ABSTRACT
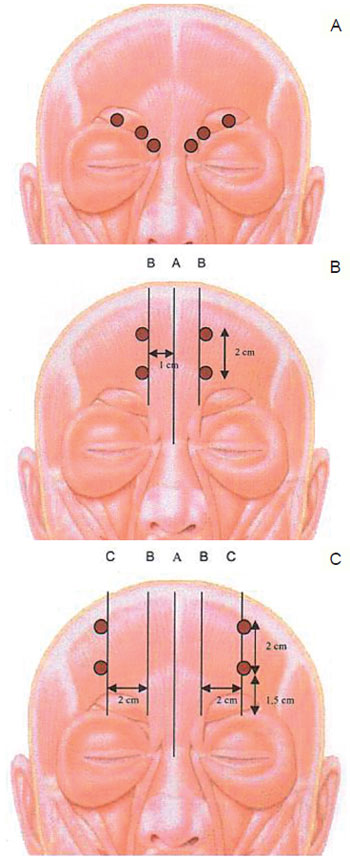
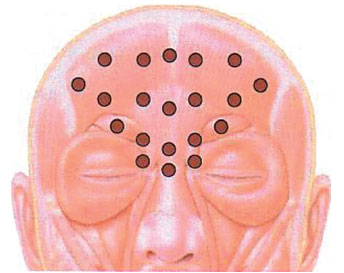
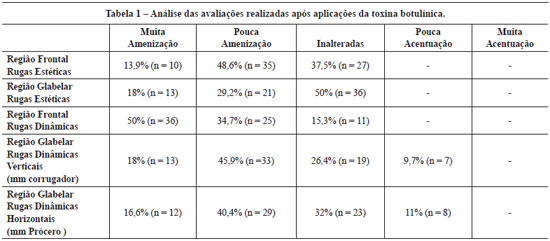
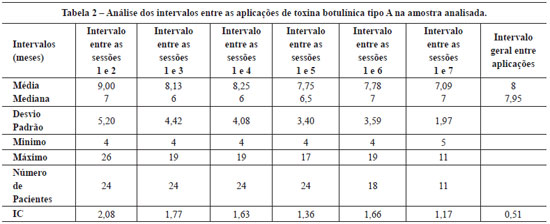
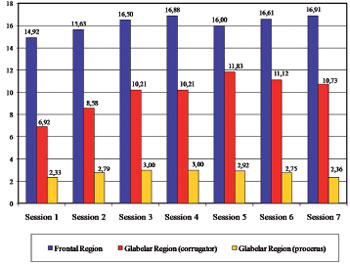
Methods: Wrinkles in the frontal and glabellar regions of the face were evaluated in patients submitted to a series of cosmetic botulinum toxin applications, with analysis of the intervals between applications and doses used. Twenty-four female patients who received 5 to 7 botulinum toxin applications to the upper third of the face were evaluated. Mean follow-up time was 42.2 ± 4 months and the mean interval between applications was 8 ± 0.51 months. The forehead and glabellar wrinkles were evaluated by a standardized scale comparing photos taken prior to the first application, at rest and during facial expressions. Results: Over time, static wrinkles in the frontal region were reduced in 62.5% of the patients and remained the same in 37.5%, while static wrinkles in the glabellar region were reduced in 47.2% of the patients, remained the same in 50% and were slightly accentuated in 2.8%. Dynamic wrinkles of the frontal region were reduced in 84.7% of the patients and remained the same in 15.3%, while the vertical dynamic wrinkles in the corrugator region were reduced in 63.9% of the patients, remained the same in 26.4% and were slightly accentuated in 9.7%. Horizontal dynamic wrinkles in the procerus region were reduced in 57% of the patients, remained the same 32% and were slightly accentuated in 11%. The mean total dose of toxin used per session was 43.83 ± 1.25 U, and the total cumulated dose was 272.08 ± 20.42 U.
Keywords:
Botulinum toxin type A. Face. Esthetics. Rejuvenation.
RESUMO
Método: Foram avaliadas as rugas das regiões frontal e glabelar da face em pacientes submetidas a aplicações seriadas da toxina botulínica tipo A com finalidade estética, analisando-se os intervalos entre as aplicações e as doses utilizadas. Vinte e quatro pacientes do sexo feminino receberam de 5 a 7 aplicações da toxina botulínica tipo A no terço superior da face. O tempo médio de acompanhamento foi de 42,2 ± 4 meses e o intervalo médio entre as aplicações de 8 ± 0,51 meses. As rugas frontais e glabelares foram avaliadas segundo escala padronizada, comparando-se fotografias previas à primeira e à ultima aplicação, em repouso e em movimentos da mímica facial. Resultados: No longo prazo, as rugas estáticas da região frontal foram amenizadas em 62,5% das pacientes e inalteradas em 37,5%, enquanto as rugas estáticas da região glabelar foram amenizadas em 47,2% das pacientes, inalteradas em 50% e pouco acentuadas em 2,8%. As dinâmicas da região frontal foram amenizadas em 84,7% das pacientes e inalteradas em 15,3%, enquanto as dinâmicas verticais da região glabelar (corrugadores) foram amenizadas em 63,9% das pacientes, inalteradas em 26,4% e pouco acentuadas em 9,7%. As rugas dinâmicas horizontais da região glabelar (prócero) foram amenizadas em 57% das pacientes, inalteradas em 32% e pouco acentuadas em 11%. A média da dose total de toxina botulínica utilizada por sessão foi de 43,83 ± 1,25 U, e a dose total cumulativa foi de 272,08 ± 20,42 U.
Palavras-chave:
Toxina botulínica tipo A. Face. Estética. Rejuvenescimento.