

Original Article - Year 2024 - Volume 39 -
Elevada expressão de galectina-3 em cicatrizes excessivas: Um estudo piloto
Elevated expression of galectin-3 in excessive scars: A pilot study
RESUMO
Introdução: Cicatrizes hipertróficas e queloides são tipos de cicatrizes excessivas de cicatrização anormal da pele. Galectina-3 (gal-3) é uma proteína da família das lectinas capaz de identificar carboidratos, que podem se combinar e atuar em diversas moléculas. Na literatura, a ação da gal-3 como principal agente regulador da fibrogênese já foi descrita, sendo atualmente utilizada na terapia antifibrótica de diversos órgãos como pulmão e fígado. O objetivo deste estudo piloto foi mostrar resultados preliminares encontrados na expressão de gal-3 em cicatrizes exacerbadas.
Método: Foram coletadas 20 amostras de biópsias de cicatrizes excessivas (16 queloides e 4 cicatrizes hipertróficas) e 9 amostras de cicatrizes normais de 22 mulheres e 7 homens. Essas amostras foram processadas para análise histopatológica de rotina por imuno-histoquímica para detectar gal-3. As células positivas para gal-3 foram quantificadas pelo método estereológico utilizando uma grade de 36 pontos.
Resultados: A imuno-histoquímica mostrou alta expressão de gal-3 em células endoteliais e epiteliais de todas as amostras de cicatrizes, bem como expressão em células distribuídas pela derme. Maior expressão de gal-3 foi encontrada em amostras de queloides (28% de células positivas) em comparação com cicatrizes normais (18%) e hipertróficas (22%) (p=0,0075). Os resultados foram obtidos de um pequeno número de pacientes, por se tratar de um estudo piloto.
Conclusão: Os dados sugerem que a gal-3 participa do processo de cicatrização e, devido à sua maior presença em amostras de queloides, pode ser um potencial biomarcador para formação de queloides e um alvo terapêutico promissor a ser explorado.
Palavras-chave: Imuno-histoquímica; Queloide; Cicatriz hipertrófica; Galectina 3; Cicatrização
ABSTRACT
Introduction: Hypertrophic scars and keloids are types of excessive scars from abnormal skin healing. Galectin-3 (gal-3) is a protein from the lectin family capable of identifying carbohydrates, which can combine and act on different molecules. In the literature, the action of gal-3 as the main regulatory agent of fibrogenesis has already been described and is currently used in anti-fibrotic therapy for various organs such as the lung and liver. The objective of this pilot study was to show preliminary results found in the expression of gal-3 in exacerbated scars.
Method: Twenty biopsy samples from excessive scars (16 keloids and 4 hypertrophic scars) and 9 samples from normal scars were collected from 22 women and 7 men. These samples were processed for routine histopathological analysis by immunohistochemistry to detect gal-3. Gal-3 positive cells were quantified by the stereological method using a 36-point grid.
Results: Immunohistochemistry showed high expression of gal-3 in endothelial and epithelial cells of all scar samples, as well as expression in cells distributed throughout the dermis. Higher gal-3 expression was found in keloid samples (28% positive cells) compared to normal (18%) and hypertrophic (22%) scars (p=0.0075). The results were obtained from a small number of patients, as this was a pilot study.
Conclusion: The data suggest that gal-3 participates in the healing process and, due to its greater presence in keloid samples, it may be a potential biomarker for keloid formation and a promising therapeutic target to be explored.
Keywords: Immunohistochemistry; Keloid; Cicatrix, hypertrophic; Galectin 3; Wound healing
INTRODUÇÃO
O reparo tecidual é definido como a restauração do tecido após lesão, tanto em termos de sua conformação quanto de sua função1. A cicatrização é um processo evolutivo preservado até os dias atuais e inclui processos como inflamação, proliferação celular e remodelamento da matriz extracelular2,3. A reparação tecidual incorreta ou anormal da pele causa situações patológicas, como queloides e cicatrizes hipertróficas. Queloides e cicatrizes hipertróficas são formas de cicatrizes excessivas, que podem ser causadas por lesão na pele, queimadura, trauma, irritação, cirurgia, piercing, entre outros tipos de lesões cutâneas4.
A deposição exacerbada de componentes da matriz extracelular pode ocorrer durante as fases de cicatrização e, quando o remodelamento da lesão apresenta progressão da matriz, ocorre fibrose. A fibrogênese pode ser caracterizada como dinâmica, com grau variado de plasticidade, que depende também do tecido afetado5. A remodelação do tecido fibrótico depende diretamente da inflamação crônica e do dano às células teciduais6. Nessas situações patológicas há também inflamação contínua, presença de miofibroblastos e deposição excessiva de colágeno, fibroblastos, células inflamatórias e vasos sanguíneos recém-formados7,8. Até hoje, não se sabe a causa exata dessas situações patológicas, porém diversos tratamentos são utilizados para induzir a regressão dessas cicatrizes excessivas9. Apesar dos avanços no seu tratamento, muitos pacientes ainda apresentam efeitos adversos de cicatrizes anormais9.
As galectinas são proteínas que pertencem à família das lectinas e até o momento foram identificados 15 tipos diferentes. Essas proteínas ligam-se ao β-galactosídeo e possuem um domínio reconhecedor de ligação a carboidratos (CRD) com capacidade de reconhecer carboidratos de aproximadamente 130 aminoácidos10,11. Uma forma única das galectinas, a galectina-3 (gal-3), denominada quimera, surge devido a uma sequência desordenada e intrínseca presente em seu domínio N-terminal, que permite a oligomerização e organização da gal-3 em pentâmeros. A gal-3 possui capacidade multifuncional em inúmeras condições celulares e patológicas11.
Vários estudos já demonstraram a capacidade da gal-3 em promover reepitelização, angiogênese, adesão e migração celular, tanto em modelos experimentais murinos quanto em modelos in vitro, incluindo a participação na regulação do sistema imunológico12,13,14,15,16,17,18. A capacidade de atuar na interação célula-matriz torna a gal-3 essencial para a promoção desses processos19. Portanto, a gal-3 desempenha papéis em diversos processos, como a formação de cicatrizes, mediando o recrutamento de monócitos, a plasticidade da diferenciação de macrófagos, a interação intercelular e a produção de matriz e, assim, indiretamente, na regulação da fibrose20,21,22,23.
Vários fatores podem estar envolvidos no desenvolvimento de cicatrizes excessivas. Recentemente, alguns artigos sugeriram a participação da gal-3 em diversas situações patológicas, incluindo fibrose, como fibrose cardíaca e fibrose pulmonar24,25. Além disso, trabalhos recentes sugerem que a gal-3, em conjunto com a galectina-1, auxilia na proliferação e sobrevivência dos fibroblastos, que são diretamente responsáveis pela deposição excessiva de matriz cicatricial26. Portanto, mais estudos são necessários para correlacionar a expressão e ação da gal-3 no reparo tecidual normal e anormal.
OBJETIVO
O presente estudo tem como objetivo investigar e caracterizar a expressão da gal-3 em amostras humanas de cicatrizes hipertróficas e queloides, comparando-as com cicatrizes normais.
MÉTODO
Pacientes e Amostras
O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Pedro Ernesto, conforme protocolo número 1.900.610. Todos os pacientes foram informados sobre o estudo; os participantes maiores de 18 anos que consentiram voluntariamente em participar assinaram o Termo de Consentimento Livre e Esclarecido (TCLE), enquanto os indivíduos entre 13 e 17 anos assinaram o Termo de Assentimento juntamente com um responsável. Não foram incluídos no estudo pacientes que optaram por não se submeter ao procedimento cirúrgico para retirada de cicatrizes, menores de 13 anos ou indivíduos que se recusaram a assinar o Termo de Consentimento Livre e Esclarecido.
Cicatrizes normais, queloides e cicatrizes hipertróficas foram coletadas como amostras de pacientes atendidos no Setor de Cirurgia Plástica do Hospital Universitário Pedro Ernesto, no Rio de Janeiro, RJ, no período de 2015 a 2019, que desejavam realizar o procedimento para retirada dessas cicatrizes, que não apresentavam sinais de regressão e não responderam ao tratamento. A classificação de cicatrizes normais, cicatrizes hipertróficas e queloides foi feita aplicandose critérios clínicos rigorosos (avaliação feita por médico treinado).
Para a cirurgia, a pele foi previamente preparada com antissépticos locais como gluconato de clorexidina 2%, desengordurante e álcool. Os pacientes foram submetidos a intervenção cirúrgica sob anestesia local com lidocaína a 1% e adrenalina 1:200.000. A excisão das cicatrizes hipertróficas e inestéticas foi realizada em fuso abrangendo toda a lesão, enquanto nos casos de cicatrizes queloides foi realizada ressecção intralesional devido ao risco de recidiva.
Os fragmentos foram fixados em formol a 10% por pelo menos 24 horas. Após fixação em formalina, os fragmentos foram processados em parafina e transferidos para lâminas histológicas para análise histopatológica e imuno-histoquímica. Para análise geral dos tecidos, as amostras foram coradas com hematoxilina e eosina (HE) e, para observação do sistema de fibras colágenas, as amostras foram coradas pela técnica Picrosírius Red (PS). As seções HE e PS foram visualizadas em microscópio Leica DM 500, sob campo claro ou com polarizador, respectivamente. Após a captura das imagens dos cortes histológicos, as análises foram realizadas utilizando o programa de captura Future WinJoe versão 1.6 (Future Optics Sci. & Tech. Co, Xiasha, Hangzhou, China).
Imuno-histoquímica
Para identificar miofibroblastos, células importantes na reparação e fibrose tecidual, bem como na vascularização tecidual, foi realizada a técnica de imuno-histoquímica utilizando anticorpo contra alfa-actina do músculo liso (α -SMA; Abcam-UK).
Nesta metodologia, a peroxidase endógena foi bloqueada em solução de peróxido de hidrogênio a 3% (Proquímios-BR) em metanol por 30 minutos. Isto foi seguido por lavagens de 5 minutos em água corrente e em solução salina tamponada com fosfato (PBS) 1x, após o que as amostras foram bloqueadas usando o kit de bloqueio SpringBio. Após 1 hora, o excesso de solução de bloqueio foi removido e as secções foram incubadas com o anticorpo monoclonal primário anti α-SMA de camundongo a uma concentração de 1/100 em albumina de soro bovino a 1% (BSA) em PBS a 4°C durante a noite; nesta etapa as lâminas do controle negativo foram incubadas apenas com PBS/BSA a 1%.
Na segunda etapa, o anticorpo primário foi lavado com 1x PBS, depois incubado com anticorpo secundário anti-IgG de camundongo - HighDef Complement Kit (Cell Marque-USA) por 30 minutos. A marcação foi revelada com o cromogênio diaminobenzidina (DAB; Cell Marque-USA) por 5-8 minutos. Os cortes foram lavados novamente com 1x PBS e contrastados com hematoxilina de Harris (Proquímios-BR). As lâminas foram lavadas em água corrente, depois em água destilada e, em seguida, desidratadas, clarificadas e montadas com Entellan (Merck-Ger). As fatias foram visualizadas em microscópio de campo claro (Leica DM500).
Para identificar a presença de gal-3 nas amostras de cicatrizes, foi realizada imuno-histoquímica utilizando o anticorpo monoclonal primário anti-gal-3 (Clone M3/38; American Type Culture Collection-EUA). As amostras foram desparafinizadas, reidratadas e a recuperação antigênica foi realizada com solução Trilogy® (1:100 diluída em água destilada; Sigma-USA). As lâminas foram então passadas em banho de água destilada seguido de solução de peróxido de hidrogênio a 3% para bloqueio da peroxidase endógena. As lâminas foram novamente lavadas em banho de água destilada e 3 banhos de PBS+Tween (10%), seguido de bloqueio do local específico com 16% de leite e 20% de BSA em água destilada por 1 hora.
As secções foram então incubadas com o anticorpo anti-gal-3 numa concentração de 1:100 em PBS/BSA a 1% durante 1 hora; nesta fase, as lâminas para o controle negativo foram incubadas apenas com PBS/BSA a 1%. As lâminas foram lavadas três vezes com PBS + Tween seguido de incubação com um anticorpo secundário IgG anti-camundongo não conjugado (Vector-USA). Foram realizadas três lavagens com PBS + Tween e, em seguida, para amplificar o sinal do anticorpo secundário, a estreptavidina peroxidase (Sigma-USA) foi adicionada por 20 minutos. Os cortes foram lavadas novamente com PBS+Tween e o cromógeno DAB foi adicionado por 20 segundos. O contraste foi realizado com hematoxilina de Harris (Sigma-EUA). Por fim, foi realizada desidratação e clarificação, as lâminas foram montadas com Entellan e visualizadas em microscópio (Leica DM 500).
Análise quantitativa de galectina-3 e captura de imagem
Três campos aleatórios de cada lâmina foram fotografados para a epiderme, derme e tecido subcutâneo. Após a captura das imagens dos cortes histológicos, as análises foram realizadas utilizando o programa de captura Future WinJoe.
O software Future WinJoe foi utilizado para processar as imagens digitais capturadas e a densidade de volume das células positivas para gal-3 (%Vv [gal-3]) foi avaliada utilizando um sistema estereológico composto por 36 pontos, conforme descrito anteriormente por Petito et al.27. Vv = PP/PT (%) (PP representa os pontos avaliados que chegam à estrutura e PT representa o total de pontos presentes na grade). Os resultados foram expressos como média ± desvio padrão.
RESULTADOS
Cicatrizes
Os pacientes foram subdivididos em três grupos (cicatrizes normais, cicatrizes hipertróficas e queloides) para permitir a análise estatística, conforme mostra a Tabela 1. Todos os sujeitos do grupo com cicatriz normal eram mulheres (n=9) e tinham idade entre 20 e 57 anos (média 37,3 anos). A maioria das cicatrizes normais estava localizada na região mamária (18%) e pélvica (18%), seguida de abdômen inferior (9%), umbigo (9%) e hipocôndrio (9%). No grupo queloide (n= 16) a maioria dos pacientes eram mulheres (62,5%) e com idade entre 13 e 66 anos (média 28,3 anos). E a maior parte dos queloides foi coletada nas orelhas (50,0%), seguida de abdômen (12,4%), tronco anterior (12,4%), região cervical (6,2%), couro cabeludo (6,2%), região superciliar (6,2%) e mandíbula (6,2%). Por fim, o grupo de cicatrizes hipertróficas (n=4) foi composto por 3 mulheres e 1 homem, com idade entre 21 e 61 anos (média 34,25 anos). E essas cicatrizes foram coletadas em cada área umbilical, pré-auricular, face e ombro. O tempo médio das cicatrizes típicas foi de 65 meses, enquanto os queloides tiveram em média 83 meses e as cicatrizes hipertróficas foram em média 30 meses.
| Cicatriz normal (N = 09) | Queloide (N = 16) | Cicatriz Hipertrófica (N = 04) | |
|---|---|---|---|
| Anos | 37,33± 12,76 | 28,37±15,31 | 34,25 ±18,46 |
| Sexo | 09 (100%) F | 10 (62,5%) F | 03 (75%) F |
| 00 (0%) M | 06 (37,5%) M | 01 (25%) M | |
| Cor da pele * | |||
| Branco | 07 | 01 | 01 |
| Marrom | 02 | 11 | 01 |
| Preto | 00 | 02 | 01 |
| SD | 00 | 02 | 01 |
Amostras coradas
As amostras coradas com HE de todas as cicatrizes revelaram pequena quantidade de células na derme reticular demonstrando maior deposição de matriz extracelular. Além disso, queloides e cicatrizes hipertróficas apresentavam epiderme mais retilínea e com menos papilas dérmicas em comparação às cicatrizes normais (Figura 1A, B e C).
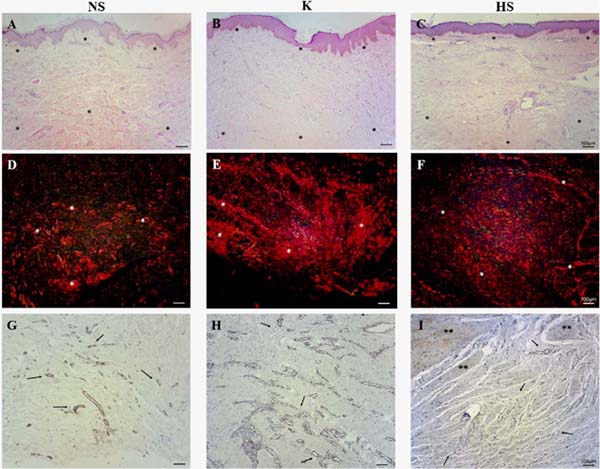
Ao microscópio de polarização, foi possível observar que todas as amostras apresentavam fibras espessas e avermelhadas, demonstrando grande deposição de colágeno na derme reticular. As fibras colágenas da cicatriz normal tendem a ser fragmentadas e entrelaçadas. Já os queloides e cicatrizes hipertróficas apresentam fibras mais longas e espessas, depositadas paralelamente à superfície, proporcionando deposição fibrosa mais exacerbada, irregular e estratificada (Figura 1D, E e F).
Expressão de α-SMA em amostras de cicatrizes excessivas
Amostras de tecido de cicatrizes normais, queloides e cicatrizes hipertróficas apresentaram coloração positiva considerável para α-SMA nas paredes dos vasos sanguíneos; entretanto, as cicatrizes normais apresentaram menor vascularização em todo o corte, comparadas aos queloides e às cicatrizes hipertróficas, principalmente na região da derme reticular (Figura 1G, H e I).
Expressão de galectina-3 em amostras de cicatrizes excessivas
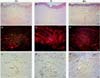
Em geral, a expressão de gal-3 foi observada na epiderme e em toda a derme papilar e áreas da derme reticular. Sua marcação foi mais intensa nas células dos vasos sanguíneos e glândulas anexas, porém a gal-3 não estava presente em regiões com deposição de fibras colágenas. Nas cicatrizes normais foi observada coloração positiva para gal-3 em todo o tecido, principalmente na derme papilar, enquanto na derme reticular não foi possível detectar coloração relevante nas regiões de deposição de fibras, apenas positividade ao redor dos vasos sanguíneos e glândulas sudoríparas (Figura 2A, B e C).
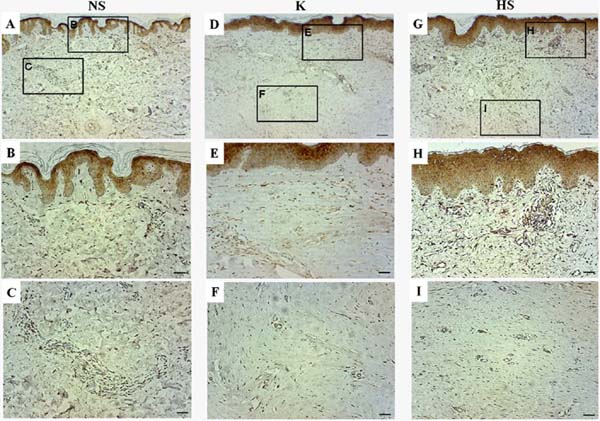
Nos queloides, foi observada marcação positiva em todo o epitélio e na derme papilar, principalmente nos vasos sanguíneos da derme papilar e reticular, além disso, o grupo queloide apresentou a maior marcação de células gal-3-positivas, porém, nenhuma marcação positiva foi observada em locais com deposição excessiva de matriz extracelular (Figura 2D, E e F). Nas cicatrizes hipertróficas também foi observada coloração positiva para gal-3 nos vasos sanguíneos da derme papilar e reticular, porém não foi observada marcação positiva na região de deposição de matriz extracelular. Em geral, o grupo com cicatriz hipertrófica apresentou padrão semelhante ao grupo queloide, mas com menor número de células positivas para gal-3 (Figura 2G, H e I).
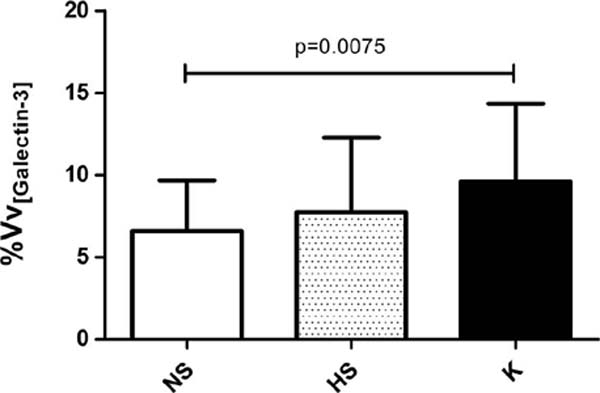
Como o padrão de distribuição da gal-3 foi semelhante entre os grupos estudados, as células positivas para gal-3 foram quantificadas em seguida por estereologia. Ao determinar e comparar a expressão de gal-3 em células distribuídas pela derme, foi possível observar diferença significativa na densidade de volume de células positivas para gal-3 em queloides em comparação com cicatrizes normais (p = 0,0075) (Figura 3). No entanto, não houve diferença estatisticamente significativa entre a densidade de volume de células positivas para gal-3 entre cicatrizes hipertróficas e normais, nem entre queloides e cicatrizes hipertróficas. As amostras do grupo queloide apresentaram 28% de células positivas para gal-3, enquanto o grupo com cicatriz normal apresentou 18% e o grupo com cicatriz hipertrófica 22% (Figura 3).
DISCUSSÃO
A galectina-3 foi descrita como tendo um papel em processos inflamatórios e angiogênicos16,28 e, portanto, está implicada em processos de cicatrização de feridas, mas seu papel ainda não foi especificamente definido. Também não se sabe ainda como surgem os queloides e as cicatrizes hipertróficas; o presente estudo teve como objetivo caracterizar a expressão da gal-3 nas cicatrizes normais e nas cicatrizes excessivas de humanos.
A cicatrização é um tipo de mecanismo de reparo que é ativado quando ocorre dano tecidual. Em algumas ocasiões, o processo de cicatrização de feridas cutâneas não acontece de forma normal, levando à formação de cicatrizes excessivas, como queloides e cicatrizes hipertróficas. Essa cicatrização excessiva é caracterizada por inflamação persistente, com recrutamento e remodelamento celular desequilibrados, o que leva à deposição excessiva de componentes da matriz, resultando em fibrose5. A fibrose tecidual é dependente de mediadores-chave e vias moleculares específicas, portanto, a fibrose pode ocorrer em órgãos completamente diferentes, apenas pela presença desses mediadores e vias moleculares6.
Galectinas são proteínas conhecidas por terem um domínio reconhecedor de ligação a carboidratos (CRD). A galectina tipo 3 é a mais diferente das 17 galectinas conhecidas e mais conhecida por possuir domínios de interação com proteínas e carboidratos, além da capacidade de pentamerizar, permitindo diferentes interações com moléculas e tecidos11. Segundo Peiró et al.6, a gal-3 está relacionada à via da fibrogênese, inclusive na fibrose cutânea, corroborando os dados encontrados em nosso estudo, no qual quantificamos mais gal-3 em tecido fibrótico, como queloides. Além disso, segundo a literatura, a gal-3 também está relacionada à angiogênese e ao recrutamento de macrófagos16,21,23. Portanto, entende-se que esta proteína está diretamente ligada ao processo de cicatrização. Também, outras galectinas já foram estudadas quanto ao seu papel no reparo tecidual, como a galectina-1, que tem sido sugerida como tendo potencial terapêutico, pois sua aplicação subcutânea em locais de feridas acelerava a cicatrização29.
Arciniegas et al.26 demonstraram a expressão de gal-3 na lâmina basal e na interface dérmica/ epidérmica, bem como em algumas células imunes, microvasos, feixes de colágeno e fibroblastos em tecidos queloides, o que concorda com nossos dados, mas não compara a expressão de gal-3 com amostras de tecido de cicatrizes normais e cicatrizes hipertróficas.
Os dados apresentados por Amadeu et al.7 e concordados por Tan et al.8 destacaram a diferença entre a vascularização das cicatrizes normais e as cicatrizes anormais, as cicatrizes hipertróficas e os queloides, em que o tecido das cicatrizes excessivas se mostrou mais vascularizado. Essa diferença na vascularização corroborou os dados encontrados em nosso estudo para a expressão do marcador de músculo liso α–SMA e gal-3 em cicatrizes normais e excessivas. Nosso trabalho também constatou que os vasos sanguíneos estavam mais presentes nas cicatrizes excessivas e que havia maior expressão de gal-3 nos vasos sanguíneos das cicatrizes excessivas, além de maior expressão de gal-3 nos queloides em geral.
Os achados de Mostacada et al.28 sugeriram que a gal-3 é vital para o recrutamento de macrófagos, influenciando sua ação eliminatória contra células apoptóticas e microrganismos. Uma diminuição na gal-3 leva, portanto, a uma resposta inflamatória menos pronunciada, devido a um menor recrutamento de células pró-inflamatórias. Além disso, Sciacchitano et al.11 demonstraram a capacidade da gal-3 de mediar a ativação de macrófagos induzidos por IL-4, conhecidos como macrófagos ativados alternativamente, para estimular a fibrose e a produção de matriz. Esses dados poderiam explicar a maior expressão de gal-3 em queloides em comparação com cicatrizes normais, mas são necessários mais estudos para compreender completamente a maior expressão de gal-3 em queloides em comparação com cicatrizes hipertróficas.
Ainda não foi possível induzir cicatrizes excessivas em modelos animais, portanto, os estudos devem basear-se em amostras humanas. O presente estudo foi limitado devido ao número escasso de amostras, principalmente das cicatrizes hipertróficas, o que provavelmente impactou a análise estatística na comparação da expressão da gal-3 entre os grupos. Além disso, devido a este pequeno número de amostras, apenas a análise tecidual foi realizada e nenhuma investigação da gal-3 na via da fibrogênese pôde ser realizada. Além disso, os cortes já apresentavam estrutura de cicatrização completa, portanto, o período de modulação celular durante a cicatrização não pôde ser avaliado. A ausência de amostras de pele normal foi nossa escolha porque este estudo pretende comparar dois tipos de cicatrizes excessivas na pele humana (cicatrizes hipertróficas e queloides) com o processo normal de cicatrização de feridas (cicatrizes normais). Apesar das limitações deste estudo, os resultados obtidos são valiosos para um estudo piloto.
CONCLUSÃO
Neste estudo, a expressão da proteína gal-3 foi detectada em cicatrizes normais e anormais, sugerindo seu envolvimento em processos típicos e atípicos de cicatrização de feridas cutâneas, particularmente na angiogênese e na reepitelização. Apesar da heterogeneidade das amostras de cicatrizes normais e anormais utilizadas neste estudo, gal-3 foi identificada e sua expressão apresentou diferenças significativas. Além disso, a sua expressão foi notavelmente maior na derme dos queloides em comparação com cicatrizes típicas, indicando um papel fundamental da gal-3 na formação de queloides. Consequentemente, são necessárias mais investigações para avaliar a deposição e função da gal-3 ao longo da cascata de cicatrização e em condições crônicas como diabetes e lesões isquêmicas. Tais estudos podem revelar o potencial da gal-3 como biomarcador para formação de queloides ou como alvo para intervenções terapêuticas no tratamento de feridas.
AGRADECIMENTOS
Os autores agradecem a Elaine N. Silva, Igor Rodrigues, Bárbara Dantas, Flavia Loureiro e Gabriel Marujo pelo suporte técnico e pela coleta de amostras dos pacientes, respectivamente.
REFERÊNCIAS
1. van Dongen JA, Harmsen MC, van der Lei B, Stevens HP Augmentation of Dermal Wound Healing by Adipose Tissue-Derived Stromal Cells (ASC). Bioengineering (Basel). 2018;5(4):91.
2. Seifert AW, Monaghan JR, Voss SR, Maden M. Skin regeneration in adult axolotls: a blueprint for scar-free healing in vertebrates. PLoS One. 2012;7(4):e32875.
3. Richardson R, Slanchev K, Kraus C, Knyphausen P, Eming S, Hammerschmidt M.Adult zebrafish as a model system for cutaneous wound-healing research. J Invest Dermatol. 2013;133(6):1655-65.
4. Ogawa R. Keloid and Hypertrophic Scars Are the Result of Chronic Inflammation in the Reticular Dermis. Int J Mol Sci. 2017;18(3):606.
5. Rockey DC, Bell PD, Hill JA. Fibrosis--a common pathway to organ injury and failure. N Engl J Med. 2015;372(12):1138-49.
6. Peiró T, Alonso-Carpio M, Ribera P, Almudéver P, Roger I, Montero P, et al. Increased Expression of Galectin-3 in Skin Fibrosis: Evidence from In Vitro and In Vivo Studies. Int J Mol Sci. 2022;23(23):15319.
7. Amadeu T, Braune A, Mandarim-de-Lacerda C, Porto LC, Desmoulière A, Costa A. Vascularization pattern in hypertrophic scars and keloids: a stereological analysis. Pathol Res Pract. 2003;199(7):469-73.
8. Tan Y, Zhang M, Kong Y, Zhang F, Wang Y, Huang Y, et al. Fibroblasts and endothelial cells interplay drives hypertrophic scar formation: Insights from in vitro and in vivo models. Bioeng Transi Med. 2023;9(2):e10630.
9. Oliveira GV, Metsavaht LD, Kadunc BV, Jedwab SKK, Bressan MS, Stolf HO, et al. Treatment of keloids and hypertrophic scars. Position statement of the Brazilian expert group GREMCIQ. J Eur Acad Dermatol Venereol. 2021;35(11):2128-42.
10. Bouffette S, Botez I, De Ceuninck F. Targeting galectin-3 in inflammatory and fibrotic diseases. Trends Pharmacol Sci. 2023;44(8):519-31.
11. Sciacchitano S, Lavra L, Morgante A, Ulivieri A, Magi F, De Francesco GP, et al. Galectin-3: One Molecule for an Alphabet of Diseases, from A to Z. Int J Mol Sci. 2018;19(2):379.
12. Ochieng J, Green B, Evans S, James O, Warfield P. Modulation of the biological functions of galectin-3 by matrix metalloproteinases. Biochim Biophys Acta. 1998;1379(1):97-106.
13. Cao Z, Said N, Amin S, Wu HK, Bruce A, Garate M, et al. Galectins-3 and -7, but not galectin-1, play a role in re-epithelialization of wounds. J Biol Chem. 2002;277(44):42299-305.
14. Paret C, Bourouba M, Beer A, Miyazaki K, Schnölzer M, Fiedler S, et al. Ly6 family member C4.4A binds laminins 1 and 5, associates with galectin-3 and supports cell migration. Int J Cancer. 2005;115(5):724-33.
15. Saravanan C, Cao Z, Head SR, Panjwani N. Detection of differentially expressed wound-healing-related glycogenes in galectin-3-deficient mice. Invest Ophthalmol Vis Sci. 2009;50(12):5690-6.
16. Funasaka T, Raz A, Nangia-Makker P. Galectin-3 in angiogenesis and metastasis. Glycobiology. 2014;24(10):886-91.
17. Walker JT, Elliott CG, Forbes TL, Hamilton DW. Genetic Deletion of Galectin-3 Does Not Impair Full-Thickness Excisional Skin Healing. J Invest Dermatol. 2016;136(5):1042-1050.
18. Oliveira FL, Bernardes ES, Brand C, dos Santos SN, Cabanel MP, Arcanjo KD, et al. Lack of galectin-3 up-regulates IgA expression by peritoneal B1 lymphocytes during B cell differentiation. Cell Tissue Res. 2016;363(2):411-26.
19. Panjwani N. Role of galectins in re-epithelialization of wounds. Ann Transi Med. 2014;2(9):89.
20. Liu T, Jin H, Ullenbruch M, Hu B, Hashimoto N, Moore B, et al. Regulation of found in inflammatory zone 1 expression in bleomycin-induced lung fibrosis: role of IL-4/IL-13 and mediation via STAT-6. J Immunol. 2004;173(5):3425-31.
21. Lemos FS, Pereira JX, Carvalho VF, Bernardes ES, Chammas R, Pereira TM, et al. Galectin-3 orchestrates the histology of mesentery and protects liver during lupus-like syndrome induced by pristane. Sci Rep. 2019;9(1):14620.
22. Wynn TA. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat Rev Immunol. 2004;4(8):583-94.
23. Fichtner-Feigl S, Strober W, Kawakami K, Puri RK, Kitani A. IL-13 signaling through the IL-13alpha2 receptor is involved in induction of TGF-beta1 production and fibrosis. Nat Med. 2006;12(1):99-106.
24. Dong R, Zhang M, Hu Q, Zheng S, Soh A, Zheng Y, et al. Galectin-3 as a novel biomarker for disease diagnosis and a target for therapy (Review). Int J Mol Med. 2018;41(2):599-614.
25. Nangia-Makker P, Hogan V, Balan V, Raz A. Chimeric galectin-3 and collagens: Biomarkers and potential therapeutic targets in fibroproliferative diseases. J Biol Chem. 2022;298(12):102622.
26. Arciniegas E, Carrillo LM, Rojas H, Ramírez R, Chopite M. Galectin-1 and Galectin-3 and Their Potential Binding Partners in the Dermal Thickening of Keloid Tissues. Am J Dermatopathol. 2019;41(3):193-204.
27. Petito RB, Amadeu TP, Pascarelli BM, Jardim MR, Vital RT, Antunes SL, et al. Transforming growth factor-β1 may be a key mediator of the fibrogenic properties of neural cells in leprosy. J Neuropathol Exp Neurol. 2013;72(4):351-66.
28. Mostacada K, Oliveira FL, Villa-Verde DM, Martinez AM. Lack of galectin-3 improves the functional outcome and tissue sparing by modulating inflammatory response after a compressive spinal cord injury. Exp Neurol. 2015;271:390-400.
29. Lin YT, Chen JS, Wu MH, Hsieh IS, Liang CH, Hsu CL, et al. Galectin-1 accelerates wound healing by regulating the neuropilin-1/Smad3/NOX4 pathway and ROS production in myofibroblasts. J Invest Dermatol. 2015;135(1):258-68.
1. Universidade do Estado do Rio de Janeiro,
Patologia Geral, Laboratório de Imunopatologia, Rio de Janeiro, RJ,
Brasil
2. Universidade Federal do Rio de Janeiro,
Instituto de Ciências Biomédicas, Rio de Janeiro, RJ, Brasil
3. Universidade do Estado do Rio de Janeiro, Setor
de Cirurgia Plástica, Rio de Janeiro, RJ, Brasil
4. Fiocruz, Laboratório de Imunofarmacologia, Rio
de Janeiro, RJ, Brasil
Autor correspondente: Thaís Porto Amadeu Av. Professor Manoel 444, 4º andar, Maracanã, Rio de Janeiro, RJ, Brasil CEP: 20550-170 E-mail: tpamadeu@gmail.com
Artigo submetido: 05/03/2024.
Artigo aceito: 30/04/2024.
Conflitos de interesse: não há.





 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter