

Original Article - Year 2021 - Volume 36 -
Infiltração de anestésicos locais na ferida cirúrgica: efeito sobre a inflamação e cicatriz fibrosa em ratos
Infiltration of local anesthetics into the surgical wound: effect on inflammation and fibrous scar in rats
RESUMO
Introdução: O alívio da dor após a cirurgia continua sendo um dos desafios médicos mais significativos, principalmente na cirurgia estética. A infiltração da incisão cirúrgica com anestésicos locais tem sido cada vez mais utilizada para reduzir a dor e o uso de analgésicos. No entanto, pouco se sabe sobre o efeito desta injeção na cicatrização. O objetivo é avaliar a interferência dos anestésicos locais na área de infiltrado inflamatório e cicatriz de fibrose em ratos.
Métodos: Duas incisões lineares foram feitas cada uma na região dorsal de 40 ratos Wistar. A incisão esquerda foi infiltrada com doses de 1,8ml de bupivacaína, levobupivacaína, ropivacaína ou solução salina 0,9%. A incisão direita não recebeu infiltração, servindo como grupo controle. Após sete dias, amostras das incisões foram coletadas para avaliação morfométrica histológica.
Resultados: Quando comparada com os grupos controle, a área de infiltrado inflamatório encontrada foi maior nos grupos bupivacaína, ropivacaína e levobupivacaína. O grupo bupivacaína apresentou um infiltrado inflamatório maior do que a levobupivacaína e a ropivacaína. A área da cicatriz fibrosa foi maior nos grupos levobupivacaína e ropivacaína. Não houve diferença entre os grupos que receberam anestésico e solução salina.
Conclusão: Como não houve diferença entre os grupos de anestésico e soro fisiológico, o volume aplicado ou o trauma podem ter sido a causa das maiores áreas de infiltração e cicatriz associadas à aplicação dos anestésicos locais.
Palavras-chave: Inflamação; Bupivacaína; Levobupivacaína; Ropivacaína; Cicatriz.
ABSTRACT
Introduction: Pain relief after surgery remains one of the most significant medical challenges, mainly in aesthetic surgery. The infiltration of the surgical incision with local anesthetics has been increasingly used to reduce pain and other analgesic use. However, little is known about the effect of this injection on healing. The objective is to evaluate the interference of local anesthetics in the area of inflammatory infiltrate and fibrosis scar in rats.
Methods: Two linear incisions each were made on the dorsal region of 40 Wistar rats. The left incision was infiltrated with doses of 1.8ml of bupivacaine, levobupivacaine, ropivacaine, or 0,9% saline solution infiltration. The right incision did not receive infiltration, serving as a control group. After seven days, samples of the incisions were collected for histological morphometric evaluation.
Results: When compared with the control groups, the area of inflammatory infiltrate was found larger in the bupivacaine, ropivacaine, and levobupivacaine groups. The bupivacaine group presented a larger inflammatory infiltrate than the levobupivacaine and ropivacaine. The fibrous scar area was larger in the levobupivacaine and ropivacaine groups. There was no difference between the groups that received anesthetic and saline solution.
Conclusion: As there was no difference between the anesthetics and saline solution groups, the volume applied, or the trauma may have been the cause of the larger areas of infiltrating and scar associated with local anesthetics application.
Keywords: Inflammation; Bupivacaine; Levobupivacaine; Ropivacaine; Cicatrix.
INTRODUÇÃO
O alívio da dor após a cirurgia continua sendo um dos desafios médicos mais significativos, e o tratamento inadequado pode atrasar a alta hospitalar e a recuperação do paciente. Além disso, a dor pós-operatória é aguda e, quando conduzida de maneira inadequada, pode levar ao desenvolvimento de dor crônica e maior uso de analgésicos, incluindo opioides, e suas consequências1,2.
A infiltração das incisões cirúrgicas com anestésicos locais (AL), principalmente os de longa duração, tem sido cada vez mais utilizada em diversos tipos de cirurgias, e os resultados descritos nos estudos são animadores1,2. Os efeitos desta aplicação foram testados em diversos modelos experimentais3-7. No entanto, o impacto da infiltração de AL na cicatrização da incisão cirúrgica ainda não foi totalmente estabelecido.
As cirurgias estéticas por vezes são significativas e, consequentemente, podem causar com dores intensas no pós-operatório. A infiltração de AL poderia melhorar esta dor; entretanto, é necessário avaliar se esta infiltração influencia na cicatrização, o que poderia prejudicar o resultado final.
OBJETIVO
Este estudo teve como objetivo avaliar a interferência da infiltração de AL de longa duração na incisão cirúrgica no infiltrado inflamatório e nas áreas de cicatriz fibrosa em ratos.
MÉTODOS
Este estudo foi realizado em um hospital público terciário (Hospital de Clínicas da Universidade Federal do Triângulo Mineiro, Uberaba, Minas Gerais, Brasil) de janeiro de 2018 a janeiro de 2020, aprovado pelo Comitê de Ética no Uso de Animais sob o protocolo número 314. Todas as os animais foram tratados seguindo as recomendações do Comitê Institucional de Cuidado Animal.
Seguimos as recomendações do Comitê sobre ética no uso de animais para cumprir o princípio dos 3R (redução, refinamento e substituição). Nenhum cálculo amostral foi realizado. Quarenta ratos Wistar, 20 machos e 20 fêmeas, foram divididos em quatro grupos de 10, com o mesmo número de fêmeas e machos em cada grupo. Os animais não apresentaram diferença no peso, com este variando entre 152 a 378 gramas, com média de 264 gramas (± 0,06).
Os ratos foram colocados em gaiolas com temperatura controlada (24 ± 1 ° C) e em ciclos de 12 horas com luz-12 horas no escuro. Foram alimentados com uma dieta padrão com água ad libitum por 12 horas antes do protocolo experimental.
O procedimento cirúrgico foi realizado sob anestesia geral, induzida por cloridrato de xilazina 2%, 5mg/kg, associado à cetamina, 70mg/kg, administrada por via intraperitoneal. Confirmada a anestesia (perda do reflexo caudal, patas e relaxamento muscular), a região dorsal do animal foi tricotomizada, limpa com iodopovidona e seca com gaze estéril após 2 minutos. Duas incisões lineares de cerca de 2cm cada foram feitas na região dorsal, simétricas em relação à linha média, atingindo o tecido subcutâneo. A incisão esquerda foi infiltrada com doses de 1,8ml de AL (Figura 1), e a incisão direita não recebeu infiltração (grupo controle). Outro grupo recebeu aplicação de 1,8ml de solução salina (SS) 0,9% na incisão esquerda e nada na direita. Foram feitos seis pontos de aplicação (0,3ml por ponto) distribuídos ao longo da incisão de 2cm.
Os grupos foram nomeados de acordo com a substância aplicada na incisão:
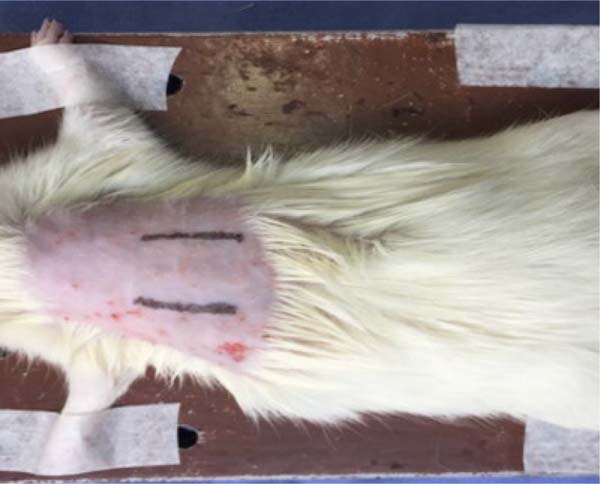
- Bupivacaína - infiltração de bupivacaína 0,25%;
- Levobupivacaína - infiltração de levobupivacaína com excesso enantiomérico 0,25%;
- Ropivacaína - infiltração de ropivacaína 0,25%;
- Solução fisiológica - infiltração de solução fisiológica 0,9%.
Não houve avaliação da equipotência anestésica. Optamos por padronizar o volume e a quantidade de pontos de aplicação nos grupos.
Dois minutos após a infiltração, as incisões foram suturadas com fio prolene 4.0. Houve um período de observação de 2 horas após a aplicação do anestésico local. Os animais receberam uma injeção intramuscular de tramadol (2mg/kg) durante o período pós-operatório a cada 12 horas por três dias. A ferida operatória foi tratada uma vez ao dia, e os animais foram sacrificados ao final do sétimo dia.
Imediatamente após o sacrifício, amostras de tecido das duas incisões com diâmetro médio de 2cm2 foram removidas e fixadas em formaldeído tamponado a 4% por aproximadamente 4 horas. Posteriormente, foram clivadas e amostras da cicatriz processadas e incluídas em parafina para confecção de cortes histológicos de cerca de 5 micrômetros (µm) de espessura. A seguir, os cortes histológicos foram corados pelas técnicas de hematoxilina-eosina (HE) para avaliação do infiltrado inflamatório e de tricrômio de Masson (MT) para avaliação da cicatriz fibrosa. As lâminas foram analisadas em microscópio de luz comum (OLYMPUS® BX40) por um único observador previamente treinado, que desconhecia o grupo ao qual cada animal pertencia (cego).
Para realização da análise morfométrica da área do infiltrado inflamatório (HE) e da cicatriz fibrosa (MT), foram selecionadas as áreas com maior infiltrado inflamatório ao redor da cicatriz cirúrgica (HE) e o foco com maior diâmetro cicatricial (MT), respectivamente. Para determinar a área do infiltrado inflamatório e da cicatriz, foi utilizado o sistema analisador de imagem semiautomático Image J® 1.32j (National Institutes of Health, US), utilizando µm como unidade de referência e o campo de aumento 100X do microscópio óptico Olympus BX41 (Olympus®, São Paulo, Brasil).
O programa Biostat®, versão 5.0, foi utilizado para a análise estatística. As comparações entre os diferentes grupos foram feitas por meio do teste ANOVA unilateral com pós-teste de Bonferroni e teste de Kruskal-Wallis com pós-teste de Student-Newman-Keuls. Os resultados foram considerados significativos quando a probabilidade de rejeição da hipótese nula foi inferior a 5% (p <0,05).
RESULTADOS
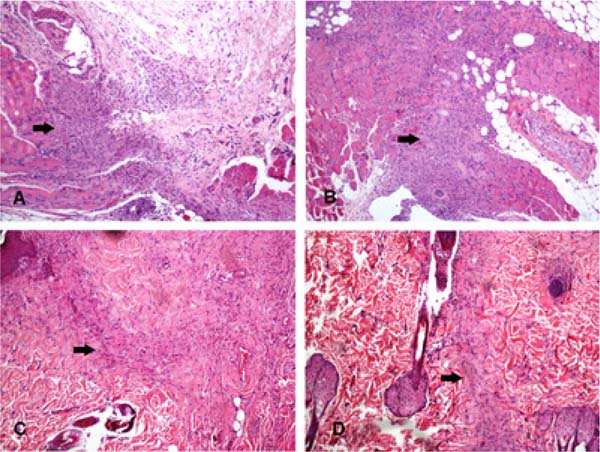
Avaliando morfologicamente, o infiltrado inflamatório era predominantemente mononuclear, permeado por ocasionais células polimorfonucleares, principalmente neutrófilos. A Tabela 1 mostra os resultados da área do infiltrado inflamatório nos diferentes grupos.
A área do infiltrado inflamatório foi significativamente maior nos grupos bupivacaína, ropivacaína e levobupivacaína em comparação com seus controles (incisões que não receberam infiltração). Ao comparar os grupos entre si, o grupo bupivacaína apresentou infiltrado inflamatório significativamente maior do que os grupos levobupivacaína e ropivacaína. Além disso, o grupo SS 0,9% apresentou área do infiltrado inflamatório substancialmente maior do que o grupo controle. No entanto, nenhuma diferença foi observada entre o grupo SS 0,9% e os grupos AL testados.
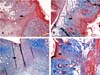
A Figura 2 ilustra a área do infiltrado inflamatório em quatro animais diferentes. A Tabela 2 mostra os dados da avaliação da área da cicatriz fibrosa.
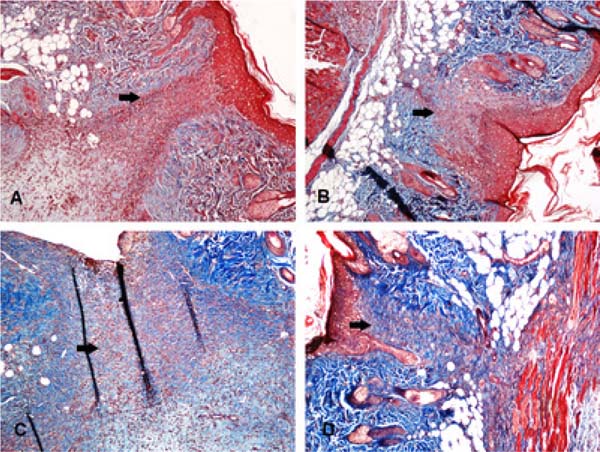
Ao avaliar a área da cicatriz fibrosa, foi observada diferença significativa entre os grupos levobupivacaína e ropivacaína e seus controles. Além disso, a área da cicatriz fibrosa era maior quando esses dois anestésicos foram aplicados. Porém, ao comparar os grupos AL com o grupo SS 0,9%, não houve diferença.
A Figura 3 mostra a cicatriz fibrosa em quatro animais diferentes.
DISCUSSÃO
A infiltração de AL na pele e tecido subcutâneo é amplamente utilizada para fins analgésicos após correção cirúrgica em diferentes tipos de cirurgia1,2. Os ALs de longa duração, como bupivacaína, ropivacaína e a levobupivacaína com excesso enantiomérico, que corresponde a 75% do isômero levogiro e 25% do isômero dextrogiro, são usados regularmente. Teoricamente, a infiltração destes anestésicos é o método mais racional de analgesia, uma vez que bloqueiam as aferências nociceptivas e, portanto, a dor e o estresse secundário8-10.
Existem controvérsias sobre a interferência do AL na cicatrização de feridas cirúrgicas. Os efeitos da injeção ou aplicação tópica de AL têm sido testados em vários modelos experimentais, utilizando tempo de cicatrização, medidas de resistência à tração, área de processo inflamatório, regeneração, tecido de granulação e angiogênese3-7. Esses estudos usaram roedores cuja pele cicatriza rapidamente, menos suscetíveis a agentes inibitórios e fatores sistêmicos que podem limitar a cicatrização3.
A cicatrização de feridas cirúrgicas ocorre quando o tecido no local da lesão é substituído por tecido conjuntivo vascularizado. A primeira etapa da cura é o início de uma reação inflamatória que reabsorverá o sangue extravasado e os produtos de degradação dos tecidos. Posteriormente, ocorre a proliferação de capilares e fibroblastos que formarão o tecido conjuntivo cicatricial. O volume final da cicatriz depende dos estímulos que regulam a atividade das células produtoras da matriz extracelular e do equilíbrio entre a síntese e a degradação da matriz11. Existem evidências de que a intensidade e o tipo do infiltrado inflamatório definirão a extensão da cicatriz12. No presente estudo, a avaliação foi realizada sete dias após a incisão. Neste momento, a cura provavelmente está no estágio de granulação/proliferação, que se caracteriza pela migração de fibroblastos e produção de colágeno em ratos13. Porém, mesmo nessa fase, infiltrado inflamatório significativo ao redor da cicatriz foi observado em todos os grupos.
| Grupo Animal | Área mediana (µm2) | Área Mínima (µm2) | Área Maxima (µm2) |
|---|---|---|---|
| Bupivacaína | 1595646,75a | 353178,5 | 3785935,5 |
| Bupivacaína controle | 10301715 | 181919 | 2865686,5 |
| Levobupivacaína | 975600b,e | 661763 | 1829388 |
| Levobupivacaína controle | 762221,8 | 97105 | 971325 |
| Ropivacaína | 1278801,3c,f | 379043,5 | 4122721,5 |
| Ropivacaína controle | 340497 | 340497 | 565769 |
| SS0,9% | 1440765,3d | 832288 | 1959811 |
| SS 0,9% controle | 749901,3 | 74383 | 1054869 |
Grupo controle: incisão que não recebeu infiltração.
a Bupivacaína x Bupivacaína controle p <0,05;
b Levobupivacaína x Levobupivacaína controle p <0,05;
c Ropivacaína x Ropivacaína controle p <0,05;
d SS x SS controle p <0,05;
e Bupivacaína x Levobupivacaína p <0,05;
f Bupivacaína x Ropivacaína p <0,05; ANOVA unilateral.
| Grupo Animal | Área mediana (µm2) | Área Mínima (µm2) | Área Maxima (µm2) |
|---|---|---|---|
| Bupivacaína | 449402 | 146280 | 2016103,5 |
| Controle de bupivacaína | 605389,5 | 47813,5 | 1251420,5 |
| Levobupivacaína | 818835,5a,c | 346804 | 4741842 |
| Levobupivacaína ao controle | 450434,0 | 116934 | 779886 |
| Ropivacaína | 885409b,d | 295817 | 2599696 |
| Controle de ropivacaína | 321682 | 207731 | 725589 |
| SS 0,9% | 530607,8 | 235281,5 | 1997949 |
| SS 0,9% de controle | 501198,5 | 140366 | 1089956 |
A levobupivacaína foi associada à menor área de infiltrado inflamatório e a uma das maiores áreas de cicatriz fibrosa. Essa observação contradiz a concepção de que a intensidade do infiltrado inflamatório define a extensão da formação da cicatriz12. É possível que o tipo de infiltrado inflamatório, mais do que sua intensidade, esteja associado a uma área de cicatriz fibrosa maior ou menor, o que não foi avaliado no presente estudo. A presença de infiltrado inflamatório interfere diretamente na formação da cicatriz; entretanto, diferentes tipos de células inflamatórias podem estar presentes, e essas células podem, ou não, estimular a produção de matriz extracelular. Outra possibilidade seria que o volume ou trauma da aplicação, e não o AL em si, interferisse no infiltrado inflamatório e na cicatriz fibrosa11, uma vez que não houve diferença entre o grupo LA e o grupo que recebeu SS, uma solução aparentemente inerte.
A aplicação de AL de longa duração na incisão para analgesia pós-operatória tem sido associada à redução das alterações induzidas por citocinas e, além disso, minimiza a hiperalgesia14. Embora alguns estudos sugiram que essas drogas também tenham propriedades antiinflamatórias15, nossos resultados demonstram que a bupivacaína e a ropivacaína, principalmente a última, estão associadas a um infiltrado inflamatório maior. Além disso, a bupivacaína foi associada a uma área de infiltração significativamente maior do que seu isômero levogiro, a levobupivacaína.
Um estudo com ratos para avaliar processos inflamatórios e cicatriciais da ferida após infiltração de AL de longa duração, avaliando histologia e resistência à tração no terceiro e décimo quarto dias, observou que, no terceiro dia, houve um aumento significativo de macrófagos no grupo que recebeu bupivacaína. Também foi observado que a concentração de colágeno estava aumentada nos animais infiltrados com bupivacaína em comparação com ropivacaína e SS. Não houve diferença na resposta inflamatória da cicatriz, presença de colágeno e resistência à tração no décimo quarto dia. Os autores concluíram que as alterações causadas pela infiltração do AL não se estendem além do terceiro dia e, portanto, não prejudicam o processo de cicatrização de feridas em ratos5. Nossos resultados contradizem essa suposição.
Outro estudo sobre os efeitos da infiltração de AL no oitavo dia de cicatrização em ratos demonstrou que tanto a bupivacaína quanto a lidocaína reduziram a produção de colágeno e a resistência à ruptura da cicatriz, causando edema, vascularização e inflamação significativos quando comparados aos controles4. Da mesma forma, no presente estudo, observamos que a bupivacaína foi associada à maior área de infiltrado inflamatório. Em relação à cicatriz fibrosa, a bupivacaína parece não interferir na cicatriz fibrosa. Por outro lado, seu isômero levogiro, a levobupivacaína e a ropivacaína foram associados a áreas maiores de cicatriz fibrosa.
Um estudo avaliando o efeito da lidocaína e da bupivacaína na cicatrização de feridas em ratos sugeriu que, embora esses anestésicos influenciassem a inflamação local e fatores proteolíticos, nenhum efeito na cicatrização de feridas foi observado16. Esses achados concordam parcialmente com os nossos.
Outro estudo, com metodologia semelhante à nossa, comparou a quantidade de colágeno e o número de mastócitos por morfometria em ratos após injeção de lidocaína com adrenalina ou tampão. Os autores concluíram que a lidocaína interfere no colágeno e reduz a quantidade inicial de mastócitos na ferida operatória17.
Dois estudos experimentais em ratos associando infiltração de levobupivacaína com ibuprofeno e norepinefrina mostraram maior regeneração da derme e epiderme, tecido de granulação e angiogênese do que no grupo controle, sugerindo um aumento no processo regenerativo/cicatrizante6 e aumento da angiogênese e resistência à tração da cicatriz7. No entanto, ao contrário do nosso estudo, a levobupivacaína foi associada a um anti-inflamatório não hormonal e um vasopressor, o que poderia interferir na cicatrização.
Em coelhos com infiltração de lidocaína e bupivacaína, outros autores não encontraram diferença histopatológica quando esses ALs foram comparados com solução salina e sugeriram que esses ALs não afetam a cicatrização18.
Os ALs atuam inibindo diretamente as fibras nociceptivas da pele. Essas fibras, juntamente com os melanócitos, neuropeptídeos e interleucinas, fazem parte do sistema neuroendócrino cutâneo que, entre outras funções, modulam a cicatrização cirúrgica, principalmente a inflamação. Os ALs bloqueiam os impulsos neurais temporariamente ao inibir a resposta neuroendócrina aos estímulos de cicatrização de feridas e às sinalizações relacionadas, interferindo negativamente na cicatrização de feridas. Um dos neuropeptídeos que desempenha papel fundamental no sistema neuroendócrino é a substância P, que controla a degranulação dos mastócitos e a liberação de proteínas inflamatórias no sítio cirúrgico. Essas células atuam na cicatrização de feridas, promovendo resposta inflamatória, angiogênese e reabsorção da matriz extracelular. Além disso, eles regulam fatores de crescimento e interleucinas, essenciais para a inflamação e para a fase proliferativa da cicatrização de feridas19,20
Entre as diferentes proteínas de cicatrização de feridas, o colágeno se correlaciona mais intimamente com a resistência do tecido cicatricial. A quantidade de colágeno no local da cicatriz depende do processo cicatricial e pode sofrer interferência do AL devido à inibição durante a fase inflamatória neurogênica21.
Como a infiltração de SS 0,9% foi associada a uma maior área de infiltrado inflamatório e cicatriz fibrosa, questionamos se, além da ação do AL ou do SS 0,9% no local da cicatriz, o efeito mecânico (distensão) provocado pela infiltração interfere na cicatrização da ferida, possibilidade já descrita11.
Ao comparar a bupivacaína com seu isômero, a levobupivacaína, a primeira foi associada à maior área de infiltrado e a última às maiores áreas de cicatriz fibrosa e menor área de infiltrado. Assim, essa modificação na molécula da bupivacaína poderia ser responsável pela menor inflamação e maior cicatriz fibrosa observada na ferida infiltrada com levobupivacaína.
CONCLUSÃO
Os resultados do presente estudo indicam que o volume aplicado ou o trauma da infiltração podem ter sido responsáveis pela maior área de infiltrado e cicatriz fibrosa, e não o próprio AL. Estudos complementares, incluindo estudos em humanos, avaliando a equipotência entre o AL e a variação do volume aplicado, são necessários para melhor compreender os mecanismos associados, principalmente na avaliação da área de infiltrado inflamatório e fibrose em diferentes estágios (dias) de cicatrização, o tipo de infiltrado inflamatório e as citocinas envolvidas.
REFERÊNCIAS
1. Lee NH, Ryu K, Song T. Postoperative analgesic efficacy of continuous wound infusion with local anesthetics after laparoscopy (PAIN): a randomized, double-blind, placebo-controlled trial. Surg Endosc. 2020 Fev;35(2):562-8.
2. Velanovich V, Rider P, Deck K, Minkowitz HS, Leiman D, Jones N, et al. Safety and efficacy of bupivacaine HCL collagen-matrix implant (INL-001) in open inguinal hernia repair: results from two randomized controlled trials. Adv Ther. 2019 Jan;36(1):200-16.
3. Brower MC, Johnson ME. Adverse effects of local anesthetic infiltration on wound healing. Reg Anesth Pain Med. 2003 Mai/Jun;28(3):233-40.
4. Hancı V, Hakimoğlu S, Özaçmak H, Bektas S, Özaçmak HS, Özadamar SO, et al. Comparison of the effects of bupivacaine, lidocaine, and tramadol infiltration on wound healing in rats. Rev Bras Anestesiol. 2012;62(6):799-810.
5. Abrão J, Fernandes CR, White PF, Shimano AC, okubo R, Lima BP, et al. Effect of local anaesthetic infiltration with bupivacaine and ropivacaine on wound healing: a placebo-controlled study. Int Wound J. 2014 Ago;11(4):379-85.
6. Zongwen G, Feng C, Xuemei C, Wang D, Li X, Li T. Local infiltration of the surgical wounds with levobupivacaine, dexibuprofen, and norepinephrine to reduce postoperative pain: a randomized, vehicle- controlled, and preclinical study. Biomed Pharmocother. 2017 Ago;92:459-67.
7. Korat PS, Kapupara PP. Local infiltration of the surgical wound with levobupivacaine, ibuprofen, and epinephrine in postoperative pain: an experimental study. Biomed Pharmacother. 2017 Dez;96:104-11.
8. Sakellaris G, Petrakis I, Makatounaki K, Arbiros I, Karkavitsas N, Charissis G. Effects of ropivacaine infiltration on cortisol and prolactin responses to postoperative pain after inguinal hernioraphy in children. J Pediatr Surg. 2004 Set;39(9):1400-3.
9. Paladini G, Di Carlo S, Musella G, Petrucci E, Scimia P, Ambrosoli A, et al. Continuous wound infiltration of local anesthetics in postoperative pain management: safety, efficacy and current perspectives. J Pain Res. 2020;31:285-94.
10. Joshi GP, Machi A. Surgical site infiltration: a neuroanatomical approach. Best Pract Res Clin Anaesthesiol. 2019 Set;33(3):317-24.
11. Pereira FEL. Reparo de lesões. In: Brasileiro Filho G, ed. Bogliolo patologia. 9ª ed. Rio de Janeiro: Guanabara Koogan; 2018. p. 181-93.
12. Werner S, Grose R. Regulation of wound healing by growth factors and cytokines. Physiol Rev. 2003 Jul;83(3):835-70.
13. Vidmar J, Chingwaru C, Chingwaru W. Mammalian cell models to advance our understanding of wound healing: a review. J Surg Res. 2017 Abr;210:269-80.
14. Gordon SM, Brahim JS, Dubner R, McCullagh LM, Sang C, Dionne RA. Attenuation of pain in a randomized trial by suppression of peripheral nociceptive activity in the immediate postoperative period. Anesth Analg. 2002 Nov;95(5):1351-7.
15. Cassuto J, Sinclair R, Bonderovic M. Anti-inflammatory properties of local anesthetics and their present and potential clinical implications. Acta Anaesthesiol Scand. 2006 Mar;50(3):265-82.
16. Waite A, Gilliver SC, Masterson GR, Hardman MJ, Ashcroft GS. Clinically relevant doses of lidocaine and bupivacaine do not impair cutaneous wound healing in mice. Br J Anaesth. 2010 Jun;104(6):768-73.
17. Rodrigues FV, Hochman B, Wood VT, Simões MJ, Juliano Y. Effects of lidocaine with epinephrine or with buffer on wound healing in rat skin. Wound Repair Regen. 2011;19(2):223-8.
18. Vasseur PB, Paul HA, Dybdal N, Crumley L. Effects of local anesthetics on healing of abdominal wounds in rabbits. Am J Vet Res. 1984 Nov;45(11):2385-8.
19. Robson MC. The role of growth factors in the healing of chronic wounds. Wound Repair Regen. 1997 Jan/Mar;5(1):12-7.
20. Myllyharju J, Kivirikko KI. Collagens and collagen-related diseases. Ann Med. 2001 Fev;33(1):7-21.
21. Steinhoff M, Ständer S, Seeliger S, Ansel JC, Shmelz M, Luger T. Modern aspects of cutaneous neurogenic inflammation. Arch Dermatol. 2003 Nov;139(11):1479-88.
1. Universidade Federal do Triângulo
Mineiro, Uberaba, MG, Brasil.
2. Universidade de Uberaba, Uberaba, MG,
Brasil.
MSC Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização.
ECSA Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Metodologia, Redação.
LAMS Conceitualização, Investigação, Metodologia, Supervisão.
GCO Análise e/ou interpretação dos dados, Metodologia, Redação - Preparação do original.
ACG Conceitualização, Metodologia, Redação - Preparação do original.
BJM Conceitualização, Metodologia, Redação - Preparação do original.
RME Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização, Concepção e desenho do estudo, Metodologia, Supervisão.
Autor correspondente: Renata Margarida Etchebehere, Rua Getúlio Guaritá 140, Bairro Abadia, Uberaba, MG, Brasil, CEP 38025-440, E-mail: renata.etchebehere@uftm.edu.br
Artigo submetido: 17/02/2021.
Artigo aceito: 19/04/2021.
Conflitos de interesse: não há.
Instituição: Hospital de Clínicas, Universidade Federal do Triângulo Mineiro, Uberaba, MG, Brasil..






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter