

Review Article - Year 2021 - Volume 36 -
Lipoenxertia para tratamento de radiodermite após tratamento de câncer de cabeça e pescoço
Fat grafting for the treatment of radiodermatitis after treatment of head and neck cancer
RESUMO
Introdução: Embora o tratamento do câncer de cabeça e pescoço tenha evoluído nos últimos anos, ainda é um desafio preservar e restaurar a simetria facial após o mesmo, comprometendo significativamente a qualidade de vida dos pacientes. Em cirurgia reconstrutiva, o enxerto de gordura autóloga vem sendo usado para tratar defeitos de volume e de contorno. O objetivo é revisar os efeitos do enxerto de gordura em pacientes com radiodermite, devido ao tratamento radioterápico de câncer de cabeça e pescoço.
Métodos: Revisão de literatura nas bases PubMed e SciELO, buscando estudos publicados nos últimos 20 anos nas línguas portuguesa, inglesa ou espanhola. Foram utilizados os descritores "adipose tissue", "transplantation", "neoplasms", "head and neck neoplasms" e "radiotherapy"; e os termos não descritores "fat grafting", "fat transplantation" e "fat graft".
Resultados: De 212 artigos encontrados, apenas 7 estavam em conformidade aos critérios de elegibilidade.
Conclusão: A revisão sugere que a lipoenxertia em reconstrução oncológica de cabeça e pescoço é um tratamento seguro e permite otimizar os resultados estéticos e funcionais. Faltam estudos prospectivos para melhor definição de técnicas e de resultados.
Palavras-chave: Tecido adiposo; Transplante; Neoplasias; Neoplasias de cabeça e pescoço; Procedimentos cirúrgicos reconstrutivos
ABSTRACT
Introduction: Although treatment of head and neck cancer has evolved in recent years, it is still a challenge to preserve and restore facial symmetry afterward; this fact significantly compromises the quality of life of patients. In reconstructive surgery, autologous fat grafting has been used to treat volume and contour defects. The objective is to review the effects of fat grafting in patients with radiodermatitis due to head and neck cancer radiotherapy treatment.
Methods: Literature review in PubMed and SciELO databases, looking for studies published in the last 20 years in Portuguese, English, or Spanish. The descriptors "adipose tissue", "transplantation", "neoplasms", "head and neck neoplasms" and "radiotherapy" and the non-descriptive terms "fat grafting", "fat transplantation" and "fat graft" were used.
Results: Of 212 articles found, only seven complied with the eligibility criteria.
Conclusion: The review suggests that fat grafting in head and neck cancer reconstruction is a safe treatment and optimizes aesthetic and functional results. Prospective studies are lacking for a better definition of techniques and results.
Keywords: Adipose tissue; Transplant; Neoplasms; Head and neck neoplasms; Reconstructive surgical procedures
INTRODUÇÃO
Os cuidados com câncer de cabeça e pescoço tem evoluído nos últimos anos em termos de diagnóstico, prognóstico e tratamento. Seu arsenal terapêutico inclui quimioterapia, radioterapia e cirurgia, cujos grandes avanços se concentram na microcirurgia reconstrutiva1,2. Apesar disto, preservar e restaurar a simetria da face após o tratamento ainda é um desafio, comprometendo significativamente a qualidade de vida dos pacientes3-5.
Nos últimos vinte anos, houve um aumento na utilização de enxerto de gordura autóloga para tratamento de defeitos de volume e de contorno em cirurgia estética reconstrutiva6-8. Sua popularização pode ser atribuída à ampla disponibilidade do material, à baixa morbidade do local de lipoaspiração na área doadora e aos benefícios intrínsecos, como procedimento minimamente invasivo9-11.
O tecido adiposo contém células estromais multipotentes, que secretam uma variedade de fatores tróficos, tais como o fator de crescimento transformante beta (TGF-β). Entre suas ações, destacam-se a supressão inflamatória e apoptótica e a promoção da angiogênese e da mitose de células parenquimatosas12-15. A sobrevivência e a longevidade dos enxertos de gordura são variáveis após o procedimento. Métodos para aumentar sua sobrevivência e de seus constituintes celulares ainda estão sob investigação16-18.
A despeito dos avanços, a literatura médica carece de estudos no que tange às complicações, à segurança e aos resultados de melhora estética e funcional em pacientes oncológicos submetidos à cirurgia reconstrutiva através do uso do enxerto de gordura para radiodermite de cabeça e pescoço.
OBJETIVOS
O presente estudo objetiva revisar a literatura médica quanto aos efeitos colaterais, benefícios e malefícios do uso terapêutico de lipoenxertia em radiodermite, após tratamento de câncer de cabeça e pescoço.
MÉTODOS
Este é um estudo observacional, analítico e secundário. A aprovação do comitê de ética em pesquisa da Universidade Federal de São Paulo foi emitida sob o número 127310/2017.
Foi realizada revisão de literatura em conformidade com a declaração PRISMA. Foram utilizados os descritores “adipose tissue”, “transplantation”, “neoplasms”, “head and neck neoplasms” e “radiotherapy”; e os termos não descritores “fat grafting”, “fat transplantation” e “fat graft”. Todos os descritores foram validados pelo sistema descritores em ciências da saúde. As bases de dados PubMed e SciELO foram acessadas em abril de 2020 para pesquisa de estudos publicados entre 01/01/2001 a 01/01/2020 nas línguas portuguesa, inglesa ou espanhola.
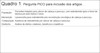
A Quadro 1 sintetiza os atributos usados para avaliação dos estudos encontrados durante a busca nas bases de dados. Foram incluídos estudos que satisfizessem os seguintes critério: (a) ensaios clínicos randomizados ou quase-randomizados, coortes prospectivas/retrospectivas e séries de casos prospectivas/retrospectivas; (b) população submetida a tratamento cirúrgico e radioterápico para câncer de cabeça e pescoço; (c) população livre de doença há pelo menos 2 anos; (d) intervenção com técnica de lipoenxertia em face e pescoço comparável a outro tipo de reconstrução ou ausência de reconstrução; (e) desfecho com análise de efeitos colaterais, benefícios e malefícios da lipoenxertia. Foram excluídos estudos que não se enquadrassem nestes critérios.
| População | Pacientes tratados para câncer de cabeça e pescoço, com radiodermite após e livres de doença por pelo menos 2 anos |
| Intervenção | Lipoencertia para radiodermite pós reconstrução oncológica de cabeça e pescoço |
| Comparação | Ausência de radiodermite por câncer de cabeça e pescoço |
| Desfecho | Análise de efeitos colaterais, beneficios e malefícios |
RESULTADOS
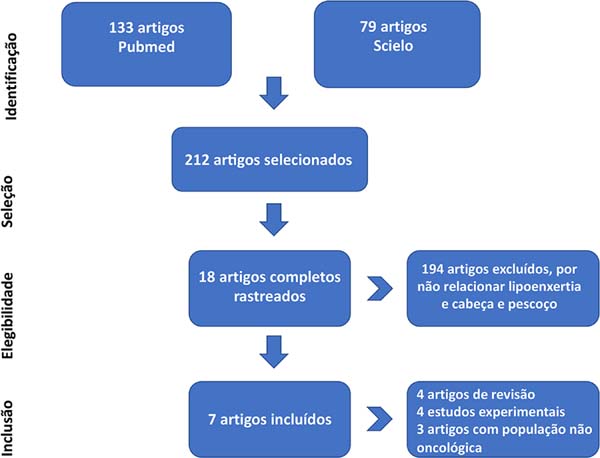
Ao todo, foram encontrados 212 artigos, sendo 133 na base de dados PubMed e 79 artigos na base SciELO. Dezoito artigos foram selecionados para avaliação minuciosa, sendo três excluídos por abordarem população não oncológica19-21, quatro revisões22-25 e quatro estudos experimentais26-29. Somente sete estudos contemplaram os critérios de inclusão, sendo esses séries de casos4,30-35. Não foram encontrados ensaios clínicos randomizados ou estudos de coorte em humanos. A Figura 1 ilustra os fluxos de inclusão e exclusão dos estudos.
Phulpin et al.31, em 2009, submeteram onze pacientes com remissão de câncer de cabeça e pescoço após tratamento com radioterapia externa na quantidade de 50Gy ou mais à lipoenxertia. O grupo contou com sete homens e a idade variou de 44 a 73 anos (mediana=54 anos). Os períodos de seguimento pós-operatório variaram de 2 a 88 meses (média=39,9 meses). Somente dois pacientes foram acompanhados por menos de 24 meses. Todos os pacientes toleraram a cirurgia e o pós-operatório imediato. Equimose, hiperemia e edema transitórios ocorreram nas primeiras 48 horas. Clinicamente, os enxertos de gordura proporcionaram melhora estrutural. No entanto, a reabsorção de gordura enxertada, estimada em aproximadamente 20 a 40%, foi observada para todos os pacientes. Devido à importância dos defeitos, foram realizadas reinjeções em seis pacientes pelo menos três meses após a primeira injeção. Nos locais de preenchimento de gordura, houve melhora da qualidade da pele irradiada. Clinicamente, o teste cutâneo mostrou maior maleabilidade, sendo a pele mais macia e permitindo alguma melhora funcional. Foi também relatada melhora na qualidade de vida de todos os pacientes.
Rigotti et al.35, em 2007, também estudaram enxerto de gordura na reconstrução de tecidos irradiados. A gordura foi colhida usando seringas de 2cc e cânulas de 2mm após infiltração tumescente. O aspirado foi purificado por centrifugação a 2700rpm e as camadas de óleo e líquido descartadas. A citometria de fluxo foi utilizada para isolar a fração vascular estromal, cultivada para obtenção de células-tronco mesenquimais para estudo adicional. Todas as células-tronco foram induzidas a se diferenciarem em adipócitos, osteoblastos ou condrócitos, dependendo do meio de cultura. Análises ultraestruturais foram realizadas no tecido irradiado antes de qualquer enxerto. Foi descoberto que este se assemelhava a tecidos afetados por isquemia crônica, caracterizando-se por adipócitos danificados, diminuição da densidade capilar e morfologia capilar anormal. Após o transplante de células-tronco adiposas, a estrutura do tecido melhorou. Com base em análises de tecidos em diferentes momentos no pós-tratamento, foi hipotetizado que as células-tronco adiposas liberam fatores angiogênicos que levam à neoangiogênese e, assim, melhoram a oxigenação dos tecidos. Também foi sugerido que a maioria dos adipócitos maduros é irreversivelmente danificada no processo de colheita. Os verdadeiros efeitos do lipofilling, pois, seriam provenientes das contribuições regenerativas das células-tronco adiposas.
Karmali et al.30, em 2015, conduziu uma análise retrospectiva de 119 pacientes submetidos a enxerto autólogo de gordura para reconstrução oncológica de cabeça e pescoço. O desfecho primário foi a recorrência oncológica. Um total de 190 procedimentos de enxerto de gordura foi realizado em 116 pacientes elegíveis. O tempo médio entre a radioterapia e a primeira lipoenxertia foi de 40,5 meses. O tempo médio da cirurgia oncológica para o primeiro tratamento de enxerto de gordura foi de 35,1±59 meses. O número médio de lipoenxertias por paciente foi de 1,6±1 (intervalo de 1 a 6) com um volume médio de injeção de 24,8±20,2mL. O tempo de seguimento foi de 24±22,3 meses. A recidiva oncológica foi observada em cinco pacientes, dos quais dois eram locais, um regional e dois evoluíram com metástase. Todas as recidivas locais e regionais ocorreram em áreas sem continuidade com a área injetada. A taxa global de complicações foi de 4% e incluiu duas infecções, dois cistos no local da injeção e uma hipercorreção.
Coleman34, em 2006, realizou lipoenxertia com abdome inferior como área doadora. A lipoenxertia foi realizada no sentido de cruz com sobreposição de planos no tecido subcutâneo profundo e superficial. A média de volume lipoenxertado foi 24ml. O tempo médio de procedimento foi 1,8 horas com 21 horas de internação subsequente. Todos os pacientes foram submetidos à anestesia geral e seguidos durante um ano. Foi observado que as injeções de gordura não apenas preenchiam os defeitos dos tecidos moles, mas também melhoravam a pele subjacente. Foi relatado um caso com excisão radical de rabdomiossarcoma facial e radioterapia adjuvante. Após o lipofilling da área irradiada, um aumento sustentado do volume facial foi observado clinicamente. Durante seu segmento, nenhuma complicação foi observada. O resultado foi avaliado através do questionário Aesthetic and Functional Evaluation System, que avalia a pele esteticamente pela dimensão de defeito e flexibilidade da pele, e funcionalmente pela quantificação de disfonia, disfagia, alteração da mobilidade da cabeça e pescoço e alteração em engolir ou mastigar. Houve melhora estética em 83% e funcional em 92% dos pacientes. Foi observada, através de registro fotográfico, uma reabsorção do enxerto de gordura de 25 a 50% em todos os pacientes.
Gutiérrez et al.4, em 2016, conduziram um estudo para avaliar duração do procedimento, técnica anestésica, duração de internação, complicações e o resultado estético e funcional do tratamento. Os critérios de inclusão foram pacientes com história de câncer oral e tratamento cirúrgico e radioterápico com pelo menos 3 anos de remissão completa; grau 3 ou 4 no Aesthetic and Functional Evaluation System, boa condição de saúde confirmada por avaliação pré-operatória e anestésica; e anuência ao termo de consentimento. Foram exclusos pacientes com lipoenxertia prévia ou os que não tinham tecido adiposo suficiente para o procedimento. Foram inclusos doze pacientes, sendo dez submetidos a tratamento cirúrgico e radioterapia e dois apenas ao cirúrgico.
Mojallal e Foyatier33, em 2004, publicaram alguns casos envolvendo enxerto de tecido adiposo em tecido irradiado. Eles relataram resultados positivos, incluindo melhor crescimento de tecidos; a melhora após o enxerto autólogo de gordura não se limitou ao subcutâneo.
Em 2018, Karmali et al.32 fizeram novo estudo com 116 pacientes (71 mulheres). A média de idade foi de 55,9 anos (variando de 30 a 79 anos) e o índice de massa corporal médio foi de 26,7±5,7kg/m2. Onze pacientes (9%) eram fumantes ativos. Oitenta e um (69%) receberam radioterapia antes da lipoenxertia e dois pacientes (1,7%) receberam radioterapia após o enxerto. Setenta e seis pacientes (66%) foram submetidos a alguma forma de reconstrução com retalho livre para defeito causado por cirurgia oncológica, enquanto 40 pacientes (34%) não foram submetidos a retalho e só receberam lipoenxertia autóloga para reconstrução. Treze pacientes (11%) foram submetidos à cirurgia do pescoço para tumores com histologia benigna, enquanto 103 (89%) tinham doença maligna. Tumores benignos foram localmente agressivos com indicação de ressecção radical. O tempo médio entre o final da radioterapia e o primeiro tratamento de lipoenxertia foi de 40,5±24,3 meses. O tempo médio entre a cirurgia de câncer de cabeça e pescoço e a primeira lipoenxertia foi de 35,1±59,0 meses. O tempo médio entre o primeiro tratamento de lipoenxertia e o último acompanhamento foi de 35,8±23,1 meses.
No total, 190 procedimentos de lipoenxertia foram realizados em 116 pacientes. O número médio de tratamentos por paciente foi de 1,6±1,0 (variação de 1 a 6), com um volume médio de injeção de 24,8±20,2mL por sessão. Todos os procedimentos foram realizados sob anestesia geral. As principais áreas doadoras foram abdome, quadril e flancos. Foram observadas três recidivas locais, uma recidiva nodal regional e duas metástases distantes. Complicações relacionadas ao procedimento foram observadas em 5,1% dos casos: dois casos de infecção, cistos de óleo e necrose de gordura. Não houve morbidade do sítio doador. Todas complicações foram resolvidas sem nova cirurgia ou hospitalização.
DISCUSSÃO
Os efeitos da radiação nos tecidos podem ser classificados como agudos, consequenciais ou tardios. Efeitos agudos são mais perceptíveis em tecidos com rápida renovação celular, como epitélio ou intestino. Observa-se aumento nas citocinas pró-inflamatórias interleucinas 1 e 8, superexpressando TGF-ß, VEGF (vascular endothelial growth factor), TNF-α (tumor necrosis factor) e interferon-γ, e morte das células funcionais. Os mecanismos de proliferação de células-tronco danificadas por radiação substituem lentamente as células perdidas. Efeitos agudos podem persistir, sendo então classificados como consequentes36.
Efeitos consequentes continuam após a conclusão da radioterapia e são mais comuns nos tecidos das vias urinárias e intestinais, pele e mucosa. Os efeitos tardios, por sua vez, se desenvolvem meses a anos após o tratamento. Embora não totalmente compreendidos, os mecanismos integram uma cascata defeituosa na cicatrização: citocinas se infiltram nos tecidos irradiados, fibrina extravasa para o interstício, colágeno é depositado e fibrose ocorre com isquemia, atrofia e danos circulatórios associados37. Os queratinócitos irradiados expressam queratinas moleculares baixas 5 e 14 em vez das queratinas moleculares altas 1 e 10, expressas em feridas normais. A radiação também desregula as metaloproteínas da matriz e as metaloproteínas inibidoras de tecidos, causando deposição de colágeno desorganizado por fibroblastos38.
Flacco et al.29, em 2018, descobriram que tecidos cronicamente danificados pela radiação apresentavam afinamento epidérmico com esclerose eosinofílica homogeneizada do colágeno dérmico, fibroblastos grandes e atípicos, e espessamento fibroso com obliteração luminal dos vasos profundos. Tais alterações são produtos da expressão de citocinas induzidas por radiação e espécies reativas de oxigênio, levando à apoptose celular. Apesar da eficácia óbvia da radioterapia para reduzir as taxas de recorrência local nos cânceres de cabeça e pescoço, os danos colaterais aos tecidos moles ao redor podem ser deformadores e debilitantes.
Garza et al., em 201426, relataram que o enxerto de gordura nos tecidos irradiados diminuía a espessura dérmica e o conteúdo de colágeno, enquanto aumentava a vascularização. Em seu estudo, a gordura humana foi obtida por lipoaspiração e isolada por gravidade. O lipoaspirado foi injetado no couro cabeludo de rato irradiado com agulhas de calibre 16 dentro de 2 horas após a coleta. A pele foi inspecionada histologicamente antes e após o enxerto de gordura. Os tecidos irradiados antes do enxerto de gordura mostraram espessamento dérmico e aumento de colágeno com baixa densidade vascular, conforme medido por marcação imunohistoquímica de CD31. A retenção de volume de enxerto de gordura foi significativamente menor nos tecidos irradiados. A sobrevida do enxerto de gordura, avaliada com tomografia computadorizada (TC), diminuiu significativamente nos tecidos irradiados.
As experiências de Luan et al.27, em 2016, também relataram melhora na microestrutura e na vascularização dos tecidos irradiados após o enxerto de gordura. Em seus estudos, camundongos irradiados foram injetados com lipoaspirado humano com células-tronco derivadas de adipócitos suplementares. A retenção do volume do enxerto de gordura foi medida usando imagens de TC 3D. Os enxertos de gordura e a pele sobreposta foram colhidos 8 semanas após a injeção e examinados histologicamente quanto à vascularidade, espessura dérmica e densidade de colágeno. Foi encontrada retenção de volume significativamente aumentada de enxertos de gordura quando foram enriquecidos com células-tronco adiposas. Curiosamente, as alterações histológicas esperadas da radiação, como aumento da espessura dérmica, hipovascularidade e aumento da densidade de colágeno, foram discretamente atenuadas com a lipoenxertia. Esses efeitos foram acentuados com a adição de células-tronco.
Similarmente, Hadad et al.28, em 2010, descobriram que, quando uma combinação de células-tronco adiposas e plasma rico em plaquetas era injetada em tecidos irradiados, a densidade microvascular aumentava e o tempo de cicatrização da ferida acelerava significativamente.
A revisão de Haubner et al.24, em 2012, investigou os possíveis mecanismos, pelos quais as células-tronco adiposas melhoram a cicatrização de feridas no tecido irradiado. Foi reportado que células-tronco derivadas do tecido adiposo sintetizam fatores de crescimento e citocinas, tais como VEGF, platelet-derived growth factor (PDGF) e TGF-β, que aceleraram a cicatrização de tecidos irradiados em alguns casos.
Especificamente na cabeça e no pescoço, a pele, a mucosa e as glândulas salivares são propensas a efeitos agudos de radiação. As células da pele são esgotadas, gerando eritema, descamação, prurido, hipersensibilidade e dor39. O dano às glândulas salivares causa xerostomia, edema e dor. A mucosite pode evoluir com disfagia e dor grave que incapacita a alimentação. Danos causados pela radiação nos músculos do pescoço agravam a disfagia e causam trismo em casos graves. Outras complicações conhecidas incluem fibrose e osteorradionecrose40.
O uso da lipoenxertia vem ganhando espaço na cirurgia plástica, com técnicas cada vez mais refinadas e com a melhor compreensão da ação das células mesenquimais, abundantes no tecido gorduroso6-8,21. De fato, o transplante autólogo de gordura vem mostrando-se eficaz e com baixo custo para a correção de deformidades da face, sendo preferível ao implante sintético, visto que apresenta textura, contorno e expressões faciais mais naturais19,24,25,30-34.
Alguns métodos alternativos ao tratamento de lipoenxertia utilizados são os agentes de preenchimento dérmico, tais como implantes de colágeno bovino, injeções e próteses de silicone ou preenchimento com ácido hialurônico. Estes, porém, levam à maior reação inflamatória local e a perda da textura da pele. Para a correção óssea, alternativas incluem autoenxertos ósseos, próteses de acrílico, hidroxiapatita e implantes aloplásticos. Todavia, esses materiais podem causar infecção ou extrusão19,30.
O enxerto autólogo de gordura pode precisar de novas intervenções, visto que toda a estrutura projetada na cirurgia cosmética se perde com o tempo por ação da gravidade ou reabsorção tecidual19,35. Embora o lipofilling tenha sido explorado e utilizado por mais de um século para melhorar as preocupações ou deformidades estéticas, a injeção de gordura na reconstrução do câncer de cabeça e pescoço é relativamente nova. Existem relatos publicados de regressão da fibrose após lipotransferência. Muitos dos estudos são limitados por pequenas populações de pacientes, evidências fragmentadas e padrões variáveis de análise.
No entanto, motivado por esses relatos esporádicos, Kumar et al.22, em 2016, realizaram uma revisão sistemática para definir o papel e o mecanismo da lipotransferência na fibrose tecidual induzida por radiação. Enfatizaram a complexa interação entre fibroblastos, citocinas fibrogênicas e miofibroblastos, a qual leva a vários padrões de formação de adesão às proteínas do citoesqueleto com consequentes cicatrizes e fibrose. Foram apontados alguns mecanismos possíveis: ativação de miofibroblastos pela transformação em cascata do fator de crescimento ß1 e de tecido conjuntivo, fibrogênese induzida por hipóxia crônica e liberação estimulada por radiação de espécies reativas de oxigênio e radicais livres com danos diretos ao DNA.
A metanálise de Krastev et al.25, em 2018, referente às injeções autólogas de gordura na reconstrução facial revelou uma taxa de complicação geral de 3,7%. As complicações mais relatadas foram assimetrias ou irregularidades após a injeção. Outras complicações incluíram infecção (0,1%), necrose gordurosa (1%) e hematoma (0,6%).
Muitos cirurgiões plásticos evitaram injetar gordura em áreas de câncer anterior por preocupações cancerígenas. No entanto, com base nas evidências atuais, acreditamos ser recomendada a utilização cautelosa do enxerto de gordura na reconstrução do câncer de cabeça e pescoço. Recomendações mais assertivas não podem ser realizadas até a publicação de estudos com maior volume de casos e tempo de seguimento. Faltam estudos prospectivos humanos para melhor compreensão do procedimento após cirurgia oncológica em cabeça e pescoço. Sendo o quinto tipo de câncer mais comum e causando significativa sequela estética e funcional após tratamento cirúrgico, estudos a respeito fazem-se necessários12,26.
Não foram encontradas análises comparativas de resultados entre lipoenxertia e outras técnicas em cirurgia de cabeça e pescoço reconstrutora oncológica. Devido ao número pequeno de artigos elegíveis, os resultados são limitados.
CONCLUSÃO
As sequelas da radiação da cabeça e do pescoço podem ser desafiadoras. O tecido adiposo pode ser um complemento útil para a melhoria dessas complicações. Dados os benefícios conhecidos e a falta de contraindicações óbvias, sugerimos que o enxerto de gordura pode ser considerado criteriosamente para reconstrução quando confrontado com complicações da radiação da cabeça e pescoço.
REFERÊNCIAS
1. Kao SS, Ooi EH. Survival outcomes following salvage surgery for oropharyngeal squamous cell carcinoma: systematic review. J Laryngol Otol. 2018 Abr;132(4):299-313.
2. Graboyes EM, Zenga J, Nussenbaum B. Head & neck reconstruction: predictors of readmission. Oral Oncol. 2017 Nov;74:159-62.
3. Aksu AE, Uzun H, Bitik O, Tunçbilek G, Şafak T. Microvascular tissue transfers for midfacial and anterior cranial base reconstruction. J Craniofac Surg. 2017 Mai;28(3):659-63.
4. Gutiérrez SJ, Gridilla JM, Romero JP, López-de-Sagredo JG, Atín MSB. Fat grafting is a feasible technique for the sequelae of head and neck cancer treatment. J Craniomaxillofac Surg. 2016 Jan;45(1):93-8.
5. Leonetti JP, Nadimi S, Marzo SJ, Anderson D, Vandevender D. Facial reanimation according to the postresection defect during lateral skull base surgery. Ear Nose Throat J. 2016;95(12):E15-E20.
6. Laloze J, Varin A, Bertheuil N, Grolleau JL, Vaysse C, Chaput B. Cell-assisted lipotransfer: current concepts. Ann Chir Plast Esthet. 2017 Abr;62(6):609-16.
7. Hivernaud V, Lefourn B, Robard M, Guicheux J, Weiss P. Autologous fat grafting: a comparative study of four current commercial protocols. J Plast Reconstr Aesthet Surg. 2017 Fev;70(2):248-56.
8. Negenborn VL, Groen JW, Smit JM, Niessen FB, Mullender MG. The use of autologous fat grafting for treatment of scar tissue and scar-related conditions: a systematic review. 2016 Jan;137(1):31e-43e.
9. Khansa I, Harrison B, Janis JE. Evidence-based scar management: how to improve results with technique and technology. Plast Reconstr Surg. 2016 Set;138(3 Suppl):165S-78S.
10. De Decker M, De Schrijver L, Thiessen F, Tondu T, Van Goethem M, Tjalma WA. Breast cancer and fat grafting: efficacy, safety and complications-a systematic review. Eur J Obstet Gynecol Reprod Biol. 2016 Dez;207:100-8.
11. Kaoutzanis C, Xin M, Ballard TN, Welch KB, Momoh AO, Kozlow JH, et al. Autologous fat grafting after breast reconstruction in postmastectomy patients: complications, biopsy rates, and locoregional cancer recurrence rates. Ann Plast Surg. 2016 Mar;76(3):270-5.
12. Spiekman M, Przybyt E, Plantinga JA, Gibbs S, Van Der Lei B, Harmsen, MC. Adipose tissue-derived stromal cells inhibit TGF-ß1-induced differentiation of human dermal fibroblasts and keloid scar-derived fibroblasts in a paracrine fashion. Plast Reconstr Surg. 2014 Out;134(4):699-712.
13. Corselli M, Chen CW, Sun B, Yap S, Rubin JP, Péault B. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev. 2012 Mai;21(8):1299-308.
14. Mizuno H, Tobita M, Uysal AC. Concise review: adipose-derived stem cells as a novel tool for future regenerative medicine. Stem Cells. 2012 Mai;30(5):804-10.
15. Philips BJ, Marra KG, Rubin JP. Adipose stem cell-based soft tissue regeneration. Expert Opin Biol Ther. 2012;12(2):155-63.
16. Tan SS, Ng ZY, Zhan W, Rozen W. Role of adipose-derived stem cells in fat grafting and reconstructive surgery. J Cutan Aesthet Surg. 2016 Jul/Set;9(3):152-6.
17. Zhou Y, Wang J, Li H, Liang X, Bae J, Huang X, et al. Efficacy and safety of cell-assisted lipotransfer: a systematic review and meta-analysis. Plast Reconstr Surg. 2016 Jan;137(1):44e-57e.
18. Ross RJ, Shayan R, Mutimer KL, Ashton MW. Autologous fat grafting: current state of the art and critical review. Ann Plast Surg. 2014 Set;73(3):352-7.
19. Alencar JCG, Andrade SHC, Pessoa SGP, Dias IS. Lipoenxertia autóloga no tratamento da atrofia hemifacial progressiva (síndrome de Parry-Romberg): relato de caso e revisão da literatura. An Bras Dermatol. 2011;86(4 Supl 1):S85-8.
20. Amarante MTJ. Análise da lipoenxertia estruturada na redefinição do contorno facial. Rev Bras Cir Plást. 2013;28(1):49-54.
21. Chia CY, Rovari DA. Lipoenxertia autóloga periorbitária no rejuvenescimento facial: análise retrospectiva da eficácia e da segurança em 31 casos. Rev Bras Cir Plást. 2012;27(3):405-10.
22. Kumar R, Griffin M, Adigbli G, Kalavrezos N, Butler PEM. Lipotransfer for radiation-induced skin fibrosis. Br J Surg. 2016 Jul;103(8):950-61.
23. Hammond SE, Samuels S, Thaller S. Filling in the details: a review of lipofilling of radiated tissues in the head and neck. J Craniofac Surg. 2019 Jun;30(3):667-71.
24. Haubner F, Ohmann E, Pohl F, Strutz J, Gassner H. Wound healing after radiation therapy: review of the literature. Radiat Oncol. 2012 Set;7:162.
25. Krastev TK, Beugels J, Hommes J, Piatkowski A, Mathijssen I, Van Der Hulst R. Efficacy and safety of autologous fat transfer in facial reconstructive surgery: a systematic review and meta-analysis. JAMA Facial Plast Surg. 2018 Set;20(5):351-60.
26. Garza RM, Paik KJ, Chung MT, Duscher D, Gurtner GC, Longaker MT, et al. Studies in fat grafting: part III. Fat grafting irradiated tissue: improved skin quality and decreased fat graft retention. Plast Reconstr Surg. 2014 Ago;134(2):249-57.
27. Luan A, Duscher D, Whittam AJ, Paik KJ, Zielins ER, Brett EA, et al. Cell-assisted lipotransfer improves volume retention in irradiated recipient sites and rescues radiation-induced skin changes. Stem Cells. 2016 Mar;34(3):668-73.
28. Hadad I, Johnstone BH, Brabham JG, Blanton MW, Rogers PI, Fellers C, et al. Development of a porcine delayed wound-healing model and its use in testing a novel cell-based therapy. Int J Radiat Oncol Biol Phys. 2010 Nov;78(3):888-96.
29. Flacco J, Chung N, Blackshear CP, Irizarry D, Momeni A, Lee GK, et al. Deferoxamine preconditioning of irradiated tissue improves perfusion and fat graft retention. Plast Reconstr Surg. 2018 Mar;141(3):655-65.
30. Karmali RJ, Nguyen AT, Skoracki RJ, Hanasono MM. Outcomes following autologous fat grafting in head and neck oncologic reconstruction. Plast Reconstr Surg. 2015 Set;136(4):49-50.
31. Phulpin B, Gangloff P, Tran N, Bravetti P, Merlin JL, Dolivet G. Rehabilitation of irradiated head and neck tissues by autologous fat transplantation. Plast Reconstr Surg. 2009 Apr;123(4):1187-97.
32. Karmali RJ, Hanson SE, Nguyen AT, Skoracki RJ, Hanasono MM. Outcomes following autologous fat grafting for oncologic head and neck reconstruction. Plast Reconstr Surg. 2018 Set;142(3):771-80.
33. Mojallal A, Foyatier JL. The effect of different factors on the survival of transplanted adipocytes. Ann Chir Plast Esthet. 2004 Out;49(5):426-36.
34. Coleman SR. Structural fat grafting: more than a permanent filler. Plast Reconstr Surg. 2006 Sep;118(3 Suppl):108S-20S.
35. Rigotti G, Marchi A, Galiè M, Baroni G, Benati D, Krampera M, et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose-derived adult stem cells. Plast Reconstr Surg. 2007 Abr;119(5):1409-22.
36. Stone HB, Coleman CN, Anscher MS, McBride WH. Effects of radiation on normal tissue: consequences and mechanisms. Lancet Oncol. 2003 Set;4(9):529-36.
37. Goessler UR, Bugert P, Kassner S, Stern-Straeter J, Bran G, Sadick H, et al. In vitro analysis of radiation induced dermal wounds. Otolaryngol Head Neck Surg. 2010 Jun;142(6):845-50.
38. Medrado AP, Soares AP, Santos ET, Reis SRA, Andrade ZA. Influence of laser photobiomodulation upon connective tissue remodeling during wound healing. J Photochem Photobiol B. 2008 Set;92(3):144-52.
39. Cooper JS, Fu K, Marks J, Silverman S. Late effects of radiation therapy in the head and neck region. Int J Radiat Oncol Biol Phys. 1995 Mar;31(5):1141-64.
40. Beetz I, Schilstra C, Van Der Schaaf A, Van Der Heuvel ER, Doornaert P, Van Luijk P, et al. NTCP models for patient rated xerostomia and sticky saliva after treatment with intensity modulated radiotherapy for head and neck cancer: the role of dosimetric and clinical factors. Radiother Oncol. 2012 Out;105(1):101-6.
1. Universidade Federal de São Paulo,
Disciplina de Cirurgia Plástica, São Paulo, SP, Brasil.
Instituição: Universidade Federal de São Paulo, Disciplina de Cirurgia Plástica, São Paulo, SP, Brasil.
RGFF Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição
RSA Análise e/ou interpretação dos dados, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição
ÉLFN Coleta de Dados, Metodologia
FCI Análise e/ou interpretação dos dados, Redação - Revisão e Edição
PGD Análise e/ou interpretação dos dados, Investigação, Redação - Preparação do original
AGF Gerenciamento do Projeto, Redação - Revisão e Edição, Supervisão
Autor correspondente: Roney Gonçalves Fechine-Feitosa, Rua Napoleão de Barros, 715, 4º andar, Vila Clementino, São Paulo, SP, Brasil. CEP: 04024-002. E-mail: roneyfechine@gmail.com
Artigo submetido: 21/06/2020.
Artigo aceito: 10/01/2021.
Conflitos de interesse: não há.



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter