

Original Article - Year 2021 - Volume 36 -
Viabilidade das células-tronco mesenquimais do tecido adiposo proveniente de lipoaspirado humano
Viability of mesenchymal stem cells of adipose tissue from human liposuction
RESUMO
Introdução: A lipoenxertia é uma alternativa com importante aplicabilidade para reconstrução de mama e/ou correções de assimetrias decorrentes do tratamento oncológico. Esta técnica consiste na transferência de gordura autóloga, cujo estroma contém células-tronco derivadas do tecido adiposo que tem capacidade de diferenciar-se em toda a linhagem mesodermal. Para o preparo do tecido adiposo, Coleman fundamentou a centrifugação, de material aspirado por seringa, em 3000 rotações por minuto (rpm) durante 3 minutos. Contudo, estudos questionam se velocidades menores de centrifugação poderiam ser menos deletérias para viabilidade celular.
Métodos: Foi realizado um estudo experimental, onde foram avaliadas as células adiposas de seis pacientes; a partir de 60mL de lipoaspirado de cada um. A amostra coletada foi fracionada em quatro tubos, e submetidos a diferentes protocolos, decantação e centrifugação nas velocidades 500, 1000 e 3000rpm por 3 minutos. Após as amostras foram processadas com colagenase IA por 30 min, submetidas ao cultivo celular por 24 horas e realizado a análise da viabilidade celular. Os resultados foram tabulados e analisados pelo teste ANOVA utilizando os programas Graphpad Prism 6.0® e SAS®.
Resultados: A viabilidade celular foi maior na amostra celular centrifugada a 3000rpm e menor na amostra decantada. A coloração com Giemsa indicou manutenção da morfologia celular entre as amostras.
Conclusão: As células centrifugadas na velocidade de 3000rpm apresentaram maior viabilidade celular. A centrifugação foi efetiva na compactação do tecido e eliminação de resíduos indesejados (sangue e óleo residual).
Palavras-chave: Células-tronco; Centrifugação; Lipectomia; Mamoplastia; Adipócitos
ABSTRACT
Introduction: Lipografting is an alternative with important applicability for breast reconstruction and/or corrections of asymmetries resulting from cancer treatment. This technique consists of autologous fat transfer, whose stroma contains stem cells derived from adipose tissue that can differentiate itself throughout the mesodermal lineage. For adipose tissue preparation, Coleman-based centrifugation of syringe-aspirated material at 3000 revolutions per minute (rpm) for 3 minutes. However, studies question whether lower centrifugation speeds could be less harmful to cell viability.
Methods: An experimental study was conducted to evaluate the adipose cells of six patients; from 60mL of liposuction of each one. The sample collected was fractionated into four tubes and submitted to different protocols, decanting and centrifugation at speeds 500, 1000, and 3000rpm for 3 minutes. Afterward, the samples were processed with collagenase IA for 30 min, submitted to cell culture for 24 hours, and a cell viability analysis. The results were tabulated and analyzed by the ANOVA test using the Graphpad Prism 6.0® and SAS®.
Results: Cell viability was higher in the cell sample centrifuged at 3000rpm and lower in the decanted sample. Giemsa staining indicated maintenance of cell morphology on the samples.
Conclusion: Centrifuged cells at a speed of 3000rpm showed higher cell viability. Centrifugation was effective in compacting tissue and eliminating unwanted waste (blood and residual oil).
Keywords: Stem cells; Centrifuge; Lipectomy; Mammoplasty; Adipocytes.
INTRODUÇÃO
A lipoenxertia, técnica cirúrgica também nomeada como lipomodelagem ou lipofilling, vem se mostrando uma alternativa importante como adjuvante a técnicas de reconstrução mamária após tratamento cirúrgico de câncer de mama1. Esse procedimento consiste na transferência de gordura autóloga para a mama, visando restituir o volume, assim como revitalizar e regenerar tecidos lesados por tratamentos adjuvantes como a radioterapia; ou mais recentemente descrito, para pequenos ajustes de volume em cirurgia conservadora para tratamento de câncer de mama1,2. Esse potencial regenerativo deve-se às células-tronco derivada do tecido adiposo (CTDA), que estão presentes no tecido celular subcutâneo1-4. Uma maneira prática de obtenção de área doadora de CTDAs, seguida do preparo para a injeção em área receptora, foi descrita na década de 90, por Coleman3,4. Nessa técnica, a obtenção do lipoaspirado é realizada utilizando agulhas de 3mm de diâmetro acopladas em seringas de 10mL. Após, o conteúdo é centrifugado a 3000rpm durante 3 minutos1,3,4. Na prática, existe uma grande variabilidade de métodos tanto para a obtenção do lipoaspirado, como na separação dos elementos que o compõem5.
As CTDAs provêm da mesma linhagem embriológica que as células-tronco da medula óssea. Tendo em vista a facilidade na obtenção cirúrgica, são consideradas uma fonte alternativa de células tronco5-8. As CTDAs podem diferenciar-se além das células de origem mesenquimal (adipócitos, miócitos, condrócitos e osteócitos) em células não mesenquimais, como hepatócitos, neurônios, células pancreáticas, células endoteliais e cardiomiócitos7,8.
A viabilidade das CTDAs pode estar relacionada a forma utilizada para a separação dos elementos do lipoaspirado4,5,7. A identificação das condições de manejo que otimizem a viabilidade do conteúdo utilizado é importante para aprimorar a utilização da lipoenxertia como adjuvante na reconstrução mamária8,9. Apesar de ser uma técnica amplamente usada, ainda existem questionamento sobre o efeito na viabilidade das CTDAs e dos adipócitos após a centrifugação; ou após a decantação do lipoaspirado10,11.
OBJETIVOS
Diante disso, o presente estudo buscou avaliar a viabilidade celular das ASCs isoladas a partir de decantação e centrifugação em diferentes velocidades (500, 1000 e 3000rpm) e métodos de coleta: Coleman, lipoaspiração convencional assistida (LCAS) e associada ao VASER (Vibration Amplification of Sound Energy at Resonance).
MÉTODOS
Estudo clínico experimental foi realizado com amostras de lipoaspirados de tecido adiposo de pacientes maiores de 18 anos, que concordaram em participar da pesquisa e assinaram o termo de consentimento livre e esclarecido, e que foram submetidos aos procedimentos de lipoaspiração associado ou não à lipofilling, realizados em hospitais na cidade de Chapecó - Santa Catarina, entre junho e julho de 2018. Os pacientes foram escolhidos aleatoriamente, durante o período proposto para a coleta do material lipoaspirado.
Para verificar a influência do processamento de lipoaspirados por decantação ou centrifugação, foram avaliados cerca de 60mL de amostras residuais de cada paciente, subdivididas em 4 tubos Falcon® de 15mL, sendo um submetido à decantação e cada um dos outros 3 tubos submetidos à centrifugação em velocidades diferentes de 500, 1000 e 3000rpm (equivalendo a 43, 173 e 1560g, respectivamente) (centrífuga com rotor: 11133 Buzzer, Sigma®). Para análise da viabilidade celular, as ASCs foram tratadas com brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT). Na amostra controle foi adicionada solução fisiológica 0,9% (SF 0,9%) na proporção 1:1, e mantida em decantação por 30 minutos12. As demais amostras foram centrifugadas nas velocidades de 500, 1000 e 3000 rpm que equivalem respectivamente a 43, 173 e 1560g (considerando que 2g equivalem a 100 rpm na centrífuga com rotor: 11133 Buzzer, Sigma®); durante 3 minutos. Em seguida, as amostras centrifugadas foram lavadas com SF 0,9% e centrifugadas novamente durante 10 minutos a 2000rpm. Adicionou-se a essas quatro amostras colagenase IA (C2674 - Sigma®) na concentração de 0,075% na proporção 1:1 e incubou-se as amostras em banho-maria a 37ºC, durante 30 minutos, com homogeneização a cada 10 minutos12,13. Para análise da viabilidade celular, as CTDAs foram tratadas com brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT).
O conteúdo do Falcon® de 15mL, foram aspirados 200µL do fundo do pellet (porção inferior do tubo) e 200µL da região intermediária e encaminhadas para cultivo na placa de 12 poços, em triplicata, com adição de 2mL do meio DMEM (Vitrocell-Embriolife®), contendo SFB 10%, anfotericina e penicilina. As amostras foram cultivadas em estufa sem CO2. Uma alíquota de cada amostra foi retirada e corada com corante Giemsa para avaliar a morfologia das células em microscopia óptica. Após 24 horas do cultivo celular, as células foram submetidas ao ensaio de viabilidade celular por brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT). As placas de foram centrifugadas em 2500rpm por 15 minutos em centrífuga thermo-shaker (Agimaxx®). Descartou-se o sobrenadante e adicionou-se 90µL de SF 0,9% a 37ºC e 10µL de reagente MTT. Incubou-se em banho-seco a 37ºC por 60 minutos. Centrifugou-se novamente em 2500rpm por 15 minutos e após descartou-se 70µL de cada amostra e adicionou-se 70µL de dimetilsufóxido (DMSO). Incubou-se por 10 minutos, repetiu-se a centrifugação nas mesmas condições e realizou-se a leitura em espectrofotometria de 560ηm12,14.
Os dados de cultivo celular de células mesenquimais realizado pela técnica MTT foram analisados estatisticamente utilizando os procedimentos MEANS e UNIVARIATE e, pela análise de variância, utilizando o procedimento do software estatístico SAS® (SAS INSTITUTE, 2002). Com a leitura das placas, os dados foram analisados utilizando o teste ANOVA, realizado pelo procedimento NPAR1WAY; e para comparação entre as médias encontradas adotou-se o teste não paramétrico de Kruskal-Wallis, calculado no software SAS®/Graphpad Prism 6.0®. Os resultados de todas as análises foram considerados significativos com p<0,05. Esse projeto foi aprovado pelo Comitê de Ética em Pesquisa da Unochapecó, sob Certificado de Apresentação para Apreciação Ética (CAAE) 73059017.4.0000.0116 e o parecer número 2.576.847.
RESULTADOS
Durante o período determinado para a coletada dos lipoaspirados, foi possível avaliar 24 amostras provenientes de seis pacientes (sendo cinco do sexo feminino e um do masculino), apresentando mediana de idade de 43 anos. A escolha de que os lipoaspirados fossem de diferentes técnicas foi para verificar se havia influência da metodologia de coleta (Coleman, lipoaspiração convencional assistida por sucção e VASER) de acordo com a maneira de separação dos componentes do lipoaspirado. A taxa de viabilidade celular foi consideravelmente maior nas amostras submetidas a centrifugações mais intensas. As amostras que passaram pela centrifugação a 3000rpm apresentaram melhores resultados quanto a viabilidade celular nas CTDAs submetidas ao ensaio com MTT (0,309±0,08A). Lipoaspirados centrifugados com 500 e 1000rpm mostraram taxas de viabilidades das CTDAs relativamente próximas (0,246±0,12B e 0,253±0,08B, respectivamente). Enquanto que a amostra lavada com SF 0,9% e decantada por 30 minutos, seguida da exposição ao MTT apresentou a menor taxa de viabilidade das CTDAs (0,219±0,18AB) (Figura 1).
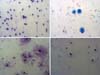
Ao término do cultivo celular, as amostras coradas com corante de Giemsa e observadas em microscopia óptica mostraram morfologias semelhantes; não foram observados cariorrexe, quantidade significativa de células binucleadas e nem indícios de fragmentação de DNA nas diferentes amostras (Figura 2).
DISCUSSÃO
A viabilidade das células adiposas pode estar relacionada a diversos fatores: características do tecido adiposo do paciente; procedimento de extração; metodologia de centrifugação; forma de injeção do lipoaspirado; uso de soluções anestésicas; topografia da área doadora; entre outros10,11,15. Não há um consenso de qual seria a maneira mais eficaz de processar a gordura (após a aspiração das áreas doadoras), para uma melhor viabilidade do enxerto; pois vários fatores podem influenciar na viabilidade das células que compõem o lipoaspirado5,16,17.
Para esta pesquisa, optou-se por incluir amostras provenientes de diferentes técnicas de lipoaspiração pois o objetivo era avaliar o impacto da velocidade de centrifugação sobre a viabilidade celular, independentemente da técnica empregada na coleta. Em estudo realizado com resíduos de lipoaspirado, provenientes de três técnicas diferentes de obtenção das células adiposas, foi verificado que a LCAS é a que fornece menor quantidade de CTDAs18. Por outro lado, um estudo in vivo, em que sítios de coleta foram tratadas com VASER, os autores concluíram que resultados semelhantes foram encontrados na LCAS considerando a qualidade de retenção de células adiposas5. Em outro estudo experimental, que comparou a técnica de coleta de tecido adiposo por LCAS e a técnica Coleman, foi verificado que a técnica da aspiração com seringa preservaria a estrutura histológica dos adipócitos melhor do que a LCAS17.
O processo da centrifugação possibilita concentrar a gordura e fornece um número de células maior por mililitro; além de separar da gordura liquefeita e dos componentes celulares sanguíneos19. Foi relatado que as CTDAs presentes no pellet (após a lavagem do centrifugado) teriam maior viabilidade por não haver contaminantes dos restos da células sanguíneas, o que seria uma constante em amostras submetidas somente à decantação10. Centrifugação com velocidades e tempo de processamento menores, podem apresentar a mesma capacidade de compactação de células quando comparadas com velocidades e tempos maiores20,21. Em nosso estudo, a amostra que foi submetida somente à decantação e as que foram centrifugadas em velocidades de 500 rpm (43g) e 1000 rpm (173g) apresentaram valores de viabilidade celular reduzida em relação à amostra de 3000 rpm. O fato de que as amostras submetidas à centrifugação em velocidades menores (500 e 1000 rpm) apresentaram resultados semelhantes, sugere que algum fator como restos celulares sanguíneos possam ter interferido na capacidade de reprodução celular. Isso foi um limitador apresentado durante a realização da pesquisa; pois, com a metodologia estabelecida, não foi possível identificar a causa específica relacionada com a menor viabilidade celular nas amostras que não foram centrifugadas em velocidade de 3000 rpm.
Considerando a variável morfologia celular, em estudo experimental não foram observadas alterações celulares em exame de microscopia óptica na centrifugação de 3600 rpm por 10 segundos9. Em outro experimento realizado com resíduos de lipoaspirado, de oito pacientes, centrifugados nas velocidades (400g, 700g, 1200g, 3000g ou 4200g) também não houve alteração da morfologia microscópica das células16. Enquanto que em outro trabalho, com metodologia semelhante, e usando as velocidades de centrifugação de 1500 e 3000rpm por 3 minutos, não foram descritas alterações em membrana celular, incluindo a amostra controle (decantação)15.
No presente estudo, após o cultivo feito por 24 horas, foi possível analisar a morfologia das amostras celulares coradas com Giemsa e não foram observadas alterações morfológicas entre as amostras decantadas e centrifugadas em diferentes velocidades, mas a viabilidade celular avaliada pelo método MTT, foi maior na amostra centrifugada a 3000rpm por 3 minutos. Esses achados sugerem que tanto a decantação, como as velocidades de centrifugação menores que 3000rpm, podem não interferir no aspecto microscópico das células, porém a velocidade maior teria uma relação com a manutenção da capacidade de multiplicação celular.
Por outro lado, em estudos experimentais que utilizaram cultivo celular em ratos, houve associação de efeitos deletérios em amostras celulares submetidas a velocidades maiores quando comparadas com as submetidas a centrifugações com velocidades menores9,16. Essa diferença de resultados pode estar relacionada com a forma de metodologia do cultivo celular onde a maioria dos trabalhos que associaram melhor viabilidade celular com maiores velocidades de centrifugação, como no presente artigo, utilizaram cultura celular em placas, enquanto que os demais pesquisadores utilizaram modelo murino.
CONCLUSÃO
A lipoenxertia é de ampla aplicabilidade, especialmente na reconstrução de mama, cujo efeito estético e terapêutico são importantes para autoestima da paciente; o que pode contribuir com a qualidade de vida durante o tratamento. Visando o aprimoramento da técnica, são realizados estudos com as ASCs, principais responsáveis pelo potencial reconstrutor. Nesse contexto, foi possível verificar no presente estudo, que centrifugações com 3000rpm por três minutos resulta em manutenção de características biológicas das células mesenquimais de tecido adiposo; necessárias para a colonização celular nas áreas receptoras de enxerto. Isso reforça a aplicabilidade da técnica de Coleman, que pode ser realizada, em serviços de tratamento cirúrgico para o câncer de mama, desde que o cirurgião esteja habituado com a metodologia.
AGRADECIMENTOS
A todos os componentes do grupo de pesquisa “Biologia Molecular e Biotecnologia em Saúde” da Universidade Comunitária da Região de Chapecó (Unochapecó) e ao grupo de pesquisa “Estudos Biológicos e Clínicos em Patologias Humanas” da Universidade Federal da Fronteira Sul (UFFS) campus Chapecó/SC.
Ao Hospital Regional do Oeste, Hospital da Criança Augusta Muller Bohner e Hospital Unimed Chapecó por consentirem com a pesquisa. Aos cirurgiões: Cassiano Furtado Beller, Fabio Portanova Barros, Gustavo Colonheze, Jorge Diego Valentini, Liana Ortiz Ruas Winkelmann, Rafael de Almeida Tirapelle e Tainara Cassol.
REFERÊNCIAS
1. Fatah F, Lee M, Martin L, O'Donoghue JM, Sassoon EM, Weiler-Mithoff M. Lipomodelling guidelines for breast surgery: joint guidelines from the association of breast surgery, the British Association of Plastic, Reconstructive and Aesthetic Surgeons, and the British Association of Aesthetic Plastic Surgeons; 2012.
2. Biazus JV, Falcão CC, Parizotto AC, Stumpf CC, Cavalheiro JAC, Schuh F, et al. Immediate reconstruction with autologous fat transfer following breast-conserving surgery. Breast J. 2015 Jun;21(3):268-75.
3. Coleman SR. Long-term survival of fat transplants: controlled demonstrations. Aesthetic Plast Surg. 1995 Out;19(5):421-5.
4. Coleman SR. Structural fat grafting. Aesthet Surg J. 1998 Set;18(5):386-8.
5. Fisher C, Grahovac TL, Schafer ME, Shippert RD, Marra KG, Rubin JP. Comparison of harvest and processing techniques for fat grafting and adipose stem cell isolation. Plast Reconstr Surg. 2013 Ago;132(2):351-61.
6. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001 Abr;7(2):211-28.
7. Kumar V, Abbas AK, Fausto N. Adaptação, lesão e morte celular. In: Kumar V, Abbas AK, Fausto N, eds. Robbins & Cotran - Patologia: bases patológicas das doenças. 7ª ed. Rio de Janeiro: Elsevier; 2005. p. 4-47.
8. Moreno M, Silva AV. Caracterização da célula-tronco derivada do tecido adiposo subcutâneo. Rev Bras Mastologia. 2012;22(4):138-43.
9. Hoareau L, Bencharif K, Girard AC, Gence L, Delarue P, Hulard O, et al. Effect of centrifugation and washing on adipose graft viability: a new method to improve graft efficiency. J Plast Reconstr Aesthet Surg. 2013 Mai;66(5):712-9.
10. Condé-Green A, Amorim NFG, Pitanguy I. Influence of decantation, washing and centrifugation on adipocyte and mesenchymal stem cell content of aspirated adipose tissue: a comparative study. J Plast Reconstr Aesthet Surg. 2010 Ago;63(8):1375-81.
11. Gabriel A, Champaneria MC, Maxwell GP. Fat grafting and breast reconstruction: tips for ensuring predictability. Gland Surg. 2015 Jun;4(3):232-43.
12. Yokomizo VMF, Benemond TMH, Bressan FF, Sangalli JR, Pieiri NCG, Casals JB, e tal. Adipose tissue derived stem cells: isolation, in vitro culture and potential uses in dermatology. Surg Cosmet Dermatol. 2011;3(1):55-9.
13. Ferreira RJ. Avaliação de diferentes métodos de detecção de alterações celulares para triagem de células-tronco mesenquimais: estudo pré-clínico (tese). Curitiba (PR): Universidade Federal do Paraná (UFPR); 2014.
14. Fukui M, Yamabe N, Zhu BT. Resveratrol attenuates the anticancer efficacy of paclitaxel in human breast cancer cells in vitro and in vivo. Eur J Cancer. 2010 Jul;46(10):1882-91.
15. Kim IH, Yang JD, Lee DG, Chung HY, Cho BC. Evaluation of centrifugation technique and effect of epinephrine on fat cell viability in autologous fat injection. Aesthet Surg J. 2009 Jan/Fev;29(1):35-9.
16. Kurita M, Matsumoto D, Shigeura T, Sato K, Gonda K, Harii K, et al. Influences of centrifugation on cells and tissues in liposuction aspirates: optimized centrifugation for lipotransfer and cell isolation. Plast Reconstr Surg. 2008 Mar;121(3):1033-41.
17. Pu LLQ, Coleman SR, Cui X, Ferguson REH, Vasconez HC. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 2008 Set;122(3):932-7.
18. Oedayrajsingh-Varma MJ, Van Ham SM, Knippenberg M, Helder MN, Klein-Nulend J, Schouten TE, et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 2006;8(2):166-77.
19. Ladeira PRS, Isaac C, Nakamura YM, Tutihashi RMC, Paggiaro AO, Ferreira MC. Cultivo de células-tronco derivadas de tecido adiposo: uma análise crítica. Rev Med (São Paulo). 2012 Dez;91(4):246.
20. Khoobehi K. Lipoenxertia na mama. In: Autor XX, ed. Contorno corporal e lipoaspiração. Rio de Janeiro: Elsevier; 2014. p. 43-53.
21. Pulsfort AK, Wolter TP, Pallua N. The effect of centrifugal forces on viability of adipocytes in centrifuged lipoaspirates. Ann Plast Surg. 2011;66(3):292-5.
1. Universidade Federal da Fronteira Sul, Chapecó,
SC, Brasil.
2. Universidade Comunitária da Região de Chapecó,
Curso de Medicina, Chapecó, SC, Brasil.
Instituições: Universidade Federal da Fronteira Sul, Chapecó, SC, Brasil e Universidade Comunitária da Região de Chapecó, Curso de Medicina, Chapecó, SC, Brasil.
MM Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Concepção e desenho do estudo, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão
JCS Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Concepção e desenho do estudo, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão
CDG Análise e/ou interpretação dos dados, Coleta de Dados, Realização das operações e/ou experimentos
LDM Análise e/ou interpretação dos dados, Coleta de Dados, Realização das operações e/ou experimentos
BSRB Análise e/ou interpretação dos dados, Análise estatística, Investigação, Realização das operações e/ou experimentos
GCK Coleta de Dados, Realização das operações e/ou experimentos
FM Análise e/ou interpretação dos dados, Análise estatística
MDB Aprovação final do manuscrito, Concepção e desenho do estudo, Metodologia, Redação - Revisão e Edição, Supervisão
Autor correspondente: Marcelo Moreno, Área Rural, Área Rural de Chapecó, Rodovia SC 484, Km 02, Sala 210, Chapecó, SC, Brasil. CEP: 89815-899. E-mail: marcelo.moreno@uffs.edu.br
Artigo submetido: 10/03/2020.
Artigo aceito: 10/01/2021.
Conflitos de interesse: não há.






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter