

Articles - Year 1998 - Volume 13 -
Vitamina A Ácida, Vitamina E e Vitamina C Injetáveis no Tratamento de Necroses de Pele
Vitamina A Ácida, Vitamina E e Vitamina C Injetáveis no Tratamento de Necroses de Pele
RESUMO
Este trabalho baseou-se em estudos realizados em laboratórios contando com a capacidade de neoformação vascular induzida pelo ACE pool isto é, vitamina A ácida "all trans retinoic acid 0,1%", com a ação antioxidante das vitaminas E "Acetato de tocoferol 0,2%" e C "ácido ascórbico revestido 0,2%" e com a capacidade das mesmas na estabilização das membranas celulares. As vitaminas foram diluídas 1:4 com vitamina A 0,002%, vitamina E 0,05% e vitamina G 0,05%. O uso de ACE pool na forma injetável intradérmica superficial por 15 dias demonstrou regerssão do quadro de necrose cutânea pós cirurgia plástica (ritidoplastia; mamoplastia redutora e abdominoplastia).
Palavras-chave:
ABSTRACT
Experimental studies veckoning vitamin A acid (all tmns retinoic acid 0.1 %) with the antioxidant action of vitamin E (tocophero1 acetate 0.2%) and vitamin C (coated ascorbic acid 0.2%) diluted 1:4 to vitamin A 0.02%, vitamin E 0.05% and vitamin C 0.05%, with efficacy in the vascular neoformation induction and in the cellular membrane stabilization, has been clinically used by us for the improvement of the skin and the skin necrosis regression after routine plastic sugeries. Patients after rhytidectomy, breast reduction and abdominoplasty with localized skin flap necrosis were submitted to daily intradermic injections for a period of 15 days, had their skin healed by these vitamin effects.
Keywords:
O objetivo deste trabalho é demonstrar que o cirurgião plástico pode atuar em casos dramáticos de necrose cutânea, pós ato cirúrgico, minimizando ou revertendo seqüelas tardias que tanto estigmatizam os pacientes. Partimos da observação clínica e de estudos microscópicos prévios em ratos e da observação clínica de pacientes que apresentaram sofrimento de retalhos pós-cirúrgicos. Utilizamos a aplicação intradérmica superficial de um composto com vitamina A, vitamina E e vitamina C (ACE pool).
Iniciam-se as aplicações 24 horas após o ato cirúrgico, quando se nota o sofrimento do retalho, e o procedimento é continuado por 15 dias, quando se observa a remissão do quadro. Baseou-se também nos estudos preliminares de PERSSONELLE et al.(l8) na melhora da textura da pele por aumento de fibras colágenas e elásticas nos tratamentos estéticos da face, em que foram realizadas aplicações intradérmicas superficiais de all trans retinoic acid 0,1% cuja biodisponibilidade após diluição foi de 0,02%.
VITAMINA A
Sabe-se que a vitamina A (all trans retinoic acid) tem como propriedade a ativação intra núcleo do ciclo dos retinóides obtendo um comportamento celular adequado e assim uma maior produção de fibras colágenas e elásticas; com poder antioxidante, imunorregulador, podendo ser usada nas mais diversas patologias. CHANDHARY(2), ESCRIBANO(6), KLIGMAN(ll,12), PERSSONELLE(l8) e TONG(21).
STTUTGEN(20) em 1962 fez a primeira avaliação clínica da vitamina A associada à doença hiperqueratótica. Em 1968, KLIGMAN(ll) fez a primeira avaliação da vitamina A em acne dando início ao uso da vitamina A em alterações da pele, principalmente na photo aged skin, nos seus estudos com retin-A nos laboratórios Ortho. Ortho R. W(l5).
Mais recentemente, ELLIS(5), em 1990, demonstrou em estudo clínico e microscópio que o uso tópico de tretinoína (all trans retinoic acid) 0,1% creme (1000 mm/ml) melhora a photo aged skin. Esta melhora foi relacionada à compactação do estrato córneo, aumento da camada granular com maior espessura da epiderme, aumento do número de mitoses nos queratinócitos, presença de glicosaminoglicanas e aumento das fibras de ancoragem da junção dermo-epidérmica. O estudo foi completado em 4 meses e foi reavaliado ao 22º mês, quando se observou clinicamente uma diminuição acentuada das rugas e vincos e uma melhora na textura e elasticidade da pele. Confirmando os achados de KLIGMAN(l2), LASNITZKI(l3) e WILSON(22), não foram relacionados efeitos colaterais.
Segundo JARDILLIER(9), o ácido retinóico é mais eficaz que o retinol, pois para a obtenção de glicosaminoglicanas (que mantêm a expressão das fibronectinas) não necessita glicolização. As fibronectinas se encontram diminuídas na photo aged skin e com crescimento descontrolado nas transformações malígnas. Com isso, fica demonstrada a possibilidade da vitamina A atuar como inibidor da carcinogênese (CONNOR(3)).
Efeito Imunorregulador da Vitamina A Ácida
De acordo com o relato de PENN et col. (17), a suplementação vitamínica A, C e E aumenta a função dos mediadores celulares imunológicos, sendo significativa a elevação do nº absoluto de linfócitos T, seguida de conseqüente aumento dos linfócitos T4 (helper) e estabilização do linfócito T8 (supressor) em resposta à fitohemaglutinina (mediador químico aumentado na presença das vitaminas A, C e E).
No presente estudo, reportaremo-nos ao all trans retinoic acid, especialmente sua função na imunorregulação e imunoestimulaçâo na imunidade celular (linhagem do linfócito T).
Sabe-se que a vitamina A perpetua a comunicação intracelular.
Sabemos que a síntese de prostaglandinas E2 pela epiderme na presença do all trans retinoic acid gera estimulação sangüínea permitindo uma resposta leucocitária rápida. Portanto, está associado à melhora na defesa primordial contra bactérias, vírus, parasitas e processos tumorais benignos e malignos.
Sabe-se também que o ácido retinóico promove o aumento de interleucina.
A presença do ácido retinóico no tegumento cutâneo ativa a rede de células de Merkel e as terminações nervosas livres situadas na junção dermo-epidérmica, são aceitas atualmente como elementos importantes na liberação das prostaglandinas D2, serotonina, leucotrienos (mediadores químicos) que estimulam a vasodilatação com conseqüente aumento de permeabilidade vascular; isto origina a chamada tecidual de elementos celulares e possivelmente de várias bioquímicas que passamos a descrever.
As plaquetas se ativam ao aderir ao subendotélio, devido à exposição ao colágeno e à trombina. Novas plaquetas se ligam a estas formas ativadas, ativando-se também e liberando o ácido araquidônico, o PAF (fator de ativação plaquetária) e o ADP.
A trombina e o colágeno tem receptores diferentes na membrana plaquetária; de sua ação ocorrem reações bioquímicas que levam à secreção dos grânulos das plaquetas, entre elas a liberação do IP3 (prostaglandina IP3) que é o segundo indutor mais importante de ativação plaquetária. O IP3 age como ionóforo de cálcio, aumentando a sua concentração. Essa concentração aumentada ativa fosfolipases (enzimas) como a A2 que liberam o ácido araquidônico.
Como é necessário inibir ou competir com o ácido araquidônico, que tem como subproduto o tromboxano A2 (potente vasoconstritor e agregante plaquetário), deveremos estimular a produção da enzima ciclo-oxigenase pelas plaquetas e produzir, então, pequenas quantidades de tromboxano A3, que é fisiologicamente inativo, reduzindo a agregação plaquetária porém, mantendo a vasodilatação.
No endotélio, temos que a produção de prostaglandina 12 (potente vasodilatador e anti agregante plaquetário) não é significativamente inibida e a atividade fisiológica de uma nova prostaglandina, a I3 é acrescentada à prostaglandina I2. O resultado é uma alteração do equilíbrio hemostático em direção a uma condição mais vasodilatadora, com menos agregação plaquetária, ABB(l) 1982.
Do ácido araquidônico também se derivam os leucotrienos, estando os do tipo B4 (LTB4) envolvidos em doenças como a artrite reumatóide e a psoríase. Quando o ácido araquidônico sofre a ação da enzima lipoxigenase, formam-se os leucotrienos do tipo B5 (LTB5) que possuem menor efeito sobre os processos inflamatórios e quimiostáticos melhorando, então, o processo.
Há relatos também, como os de ABB(l), de que o ácido retinóico em uso prolongado e em concentrações não tóxicas, inibe a atividade espontânea do linfócito T natural killer em humanos, nos advertindo mais uma vez para sermos cautelosos no seu uso prolongado.

VITAMINA C
A vitamina C (ascorbato - forma ionizada do ácido ascórbico) é essencial para a síntese do colágeno(18) por ser requerida na hidroxilação da prolina no colágeno OLZWER(l4). Assim o ascorbato resgata o íon férrico da enzima, inativado durante a hidroxilação da prolina, sendo então um antioxidante específico. A síntese do colágeno na ausência do ascorbato produz fibras anormais e contribui para as lesões na pele e fragilidade vascular.
A vitamina C regenera a vitamina E na sua forma reduzida FITZPATRICK(7). A deficiência da vitamina C mostra no início uma queratose. A vitamina C regenera a vitamina E na sua forma reduzida JARDILLIER(9). A deficiência da vitamina C mostra no início uma queratose do folículo piloso que, com o tempo, se torna hemorrágico proporcionando a queda do pêlo(9), fazendo parte de um sistema bioquímico de redox, podendo ser oxidado (reversivelmente) se transformado em aldeído-ascorbato. Este composto pode ser um doador de H2 em reações de hidroxilação enzimática. A vitamina C é a única vitamina que não é sintetizada pelo homem pois não existe em nosso organismo a enzima que converte ácido L-glucônico em ácido ascórbico OLZWER(14).
A exigência humana desta vitamina excede a das outras vitaminas por uma ou duas ordens de grandeza KARLSON(l0) .
VITAMINA E
Para que os processos intracelulares obtidos através da vitamina A e vitamina C sejam satisfatórios é necessária uma integridade de membrana celular, conseguida pela ação da vitamina E, que também proporciona a obtenção de ATP através da cadeia das quinomas, que é uma cadeia isoprenóide lateral facilmente oxidada (quinoma - hidroquinoma) (STRYER(l9)).
A vitamina E (alfa tocoferol - mais comum) inibe os lipopigmentos dos radicais livres, sendo portanto um antioxidante.
Foi demonstrado que cada molécula de vitamina E protege 220 moléculas de ácidos graxos poliinsaturados e, na presença da vitamina C em sua forma de ascorbato, sua potência anti-oxidante é aumentada(14).
Segundo PALAN(l6), DIPLOCK(4) E FITZPATRICK(7), a vitamina E é inibidora da carcinogênese.
NECROSE TECIDUAL E MEDICINA ORTOMOLECULAR
Radicais Livres
São átomos, íons ou moléculas que possuem um número ímpar de elétrons, ou seja, um elétron não pareado na órbita externa e, por serem instáveis e com elevada reatividade, tendem a acoplar o elétron não pareado em estruturas próximas, realizando processos de oxidação ou atuando como redutoras de elétrons e, portanto, os antioxidantes (vitaminas) diminuem este processo.
Segundo Efrain OLSZEWER(l4) existem duas formas de produção de radicais livres que determinam as necroses teciduais.
1º - Isquemia por reperfusão
2º - Reação de Haber-Weiss
Isquemia por Reperfusão
As alterações nos níveis de oxigênio proporcionam o aparecimento dos radicais livres, que causam lesão na membrana celular, e também de ácidos nucleicos (constituintes das proteínas).
Nos processos cirúrgicos, isto é, nas isquemias induzidas, não há formação de radicais livres, porém ao se induzir a reoxigenação (reperfusão) obtemos a sua formação.
Durante o processo isquêmico, o ATP é catalisado para hipoxantina que se acumula no interior dos tecidos. A xantina-oxidase é a mais importante neste processo catalítico e é formada pela xantino-desidrogenase que age reduzindo a nicotinamida adenosina dinucleotido (NAD), ou seja:
ácido úrico + NADH + H+
Assim, em processos isquêmicos, a xantina-desidrogenase se converte em xantina-oxidase que facilita a produção dos radicais livres.
ácido úrico + 2 O2 + 2H
Sabe-se, também, que o cálcio citosólico é importante catalisador da enzima xantino-oxidase e sua concentração aumenta durante a fase isquêmica, ou seja, no sofrimento celular, favorecendo a conversão da xantina-desidrogenase em xantina-oxidase, produzindo altos níveis de radicais livres que aumentam a permeabilidade microvascular e o processo isquêmico tecidual.
Sabe-se, por inúmeros trabalhos confirmados por OLSZEWER(l4), que drogas antioxidantes como vitamina A ácida, vitamina E, vitamina C, selênio, EDTA (ácido dietilaminotetracético) podem reverter o aumento da permeabilidade vascular e contrabalançar o processo isquêmico, ou seja a formação dos radicais livres na hora da reperfusão (Fig. 1).
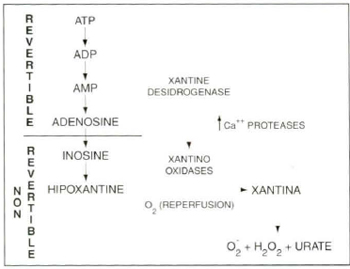
Fig. 1a - Isquemia por reperfusão.

Fig. 1 b - Reação de Haber-Weiss.
Reação de Harber-Weiss
É a reação que ocorre para a formação do radical livre super-óxido, quando na presença de ferro nos tecidos, ocasionado por hematomas que também induzem à necrose tecidual.
Segundo HEFFNER(8), fisiologicamente a quantidade de ferro extracelular é limitada no englobamento pela hemoglobina, ligação com transferrina prevenindo a formação de radicais livres, impedindo a reação de Fenton.
Assim, na célula, a maior parte do ferro não está disponível, pois está ligado à ferretina. A pequena "reserva de transição" para realizar a síntese da proteína é protegida pelo sistema antioxidante orgânico constituído por catalases, super óxido-desmutase.
Células lesadas e em áreas de inflamação tecidual liberam ferro ligado à ferritina e o da "reserva de transição". Este ferro é o que promove a reação de Haber-Weiss. Isto pode explicar porque tecidos lesados são sujeitos ao dano oxidante mais facilmente que os tecidos íntegros, independente da causa primária do dano celular. Também é sabido que, nos fumantes, as alterações alveolares incluem mais ferro ligado à ferritina nos macrófagos alveolares. Assim, nos pulmões dos fumantes, libera-se mais ferro livre e aumenta o processo oxidativo sistematicamente que, associado à liberação local do ferro (hematoma), induz a necrose teciduallocal.
AVALIAÇÃO EM RATOS
O presente estudo, objetiva a observação da melhora cicatricial, em ratos neozelandeses, após aplicação de ACE pool. Estudos realizados com a técnica estatística randomizada, fechada, demonstraram melhora da qualidade tecidual local, no grupo tratado.
Material e Método
Foram observados oito ratos (neozelandeses), adultos (90 dias), brancos, num estudo duplo cego, quatro machos e quatro fêmeas, hígidos. Todos os animais foram colocados em gaiolas individuais, em uma sala fechada acusticamente de 4 por 4 metros e mantidos em temperatura constante de 22°C, recebendo iluminação artificial com luz branca de 100 W por 12 horas diárias, alternadas com 12 horas de escuro.
Os ratos receberam ração alimentar na primeira hora de iluminação, quantitativamente e qualitativamente padronizados.
O estudo foi efetuado sempre pelo mesmo médico, nos sete dias e, durante esse período, os ratos se mantiveram hígidos, não havendo alteração de comportamento entre machos e fêmeas.
Realizaram-se três retalhos triangulares na região dorsal de cada rato, com ápice cefálico de 1 cm de base por 5 cm de altura, com relação base/altura de 1/5 e ângulo do ápice de 11,6°. Os retalhos foram denominados: A, B e C, em cada rato, sendo que A e B eram retalhos paralelos e o retalho C foi confeccionado inferiormente em direção caudal, conforme Figs. 2a e 2b.

Fig. 2a - Desenho e confecção dos retalhos realizados em ratos. Os retalhos possuem 5 cm de lado e 1 cm de base, com ápice cefálico e base caudal.

Fig. 2b Nota-se o fechamento delicado dos retalhos, com preocupação em utilizar pontos de Guilles nos ápices, menos traumáticos, e com 2 pontos simples em cada lateral. Usou-se fios monofilamentares de nylon 5-0.
Observou-se que, após 24 h da confecção dos retalhos, estes apresentavam em média 30 a 40% de necrose dermo-epidérmica no seu ápice, seguida de, aproximadamente, 10% de sofrimento dermo-epidérmico leve com epidermólise superficial, conforme Fig. 2c.

Fig. 2c - Todos os retalhos triangulares apresentaram necrose de aproximadamente 16% da área, após 24 horas.
A duração da observação foi de sete dias; todos os retalhos A foram submetidos a biópsia 24 horas após a confecção do retalho quando já instalada a necrose; todos os retalhos C pertenceram ao grupo controle, que não recebeu tratamento, e todos os retalhos B pertenceram ao grupo que recebeu a solução injetável de ACE pool (diluído 1:4 com prilocaína sem vasoconstritor).
As aplicações no retalho B foram diárias, realizadas duas horas após a alimentação dos ratos por um período de sete dias, sendo a primeira aplicação realizada após 24 h da indução da necrose. Fig. 2d.

Fig. 2d - Retalhos 7 dias após sua confecção. Observa-se que o retalho "A" (tratado) apresenta uma regressão significativa da necrose, sem seqüelas cicatriciais. O retalho "B" ainda apresenta crosta em fase de destacamento.
O estudo consistiu na aplicação de 0,5 ml de ACE pool intradérmica superficial, diariamente, no retalho B escolhido para ser do grupo tratado com assepsia prévia de álcool a 92 GL, com seringa do tipo tuberculina agulhada, sempre no mesmo local da aplicação anterior abrangendo todo o retalho e a área subjacente a este. Iniciaram-se as aplicações a 0,5 cm da área induzida a necrose, indo-se centripetamente até o ápice do retalho triangular.
Um dia após a última aplicação, retirou-se uma biópsia dos dois grupos, B e C (tratado e não tratado, respectivamente), para comparação histológica dos processos de cicatrização (Figs. 2e, 2f e 2g).

Fig. 2e - Avaliação microscópica do exame anátomopatológico do retalho do grupo C (grupo controle - biópsia 24 horas após a confecção dos retalhos) mostrando necrose dermo-epidérmica e reação inflamatória. Nota-se a rede capilar dilatada, grande quantidade de neutrófilos ao redor dos vasos, anexos necróticos.

Fig. 2f - Aspectos micrográficos do retalho "B" (não tratado), biópsia realizada após 7 dias da confecção dos retalhos. Observa-se a dissociação da camada córnea por neutrófilos e hemácias, focos de necrose na epiderme e a derme subjacente mostra presença de exsudação de neutrófilos, pele com necrose dermo-epidérmica, reação inflamatória aguda e focos de regeneração.

Fig. 2g - Avaliação microscópica do retalho "A" (tratado), biópsia realizada 7 dias após a confecção dos retalhos. Observa-se epiderme regenerada com camada córnea espessada, derme contendo vários anexos cutâneos, rede capilar ectásica, observa-se a proliferação de fibroblastos e células histióides em meio a malhas de fibrina.
Avaliação Clínica
A avaliação clínica foi determinada pela avaliação da qualidade de cicatriz e pela eliminação da necrose (regressão da necrose): em 87,5% dos retalhos tratados observou-se remissão da necrose; nos 12,5% restantes, mesmo não havendo remissão completa da necrose, houve melhoria da cicatriz em comparação ao grupo não tratado.
Avaliação Microscópia
1) Biópsia de necrose do retalho, retirado no dia subseqüente ao da indução da necrose.
2) Biópsia do grupo tratado (após 16 dias de tratamento), ao final do tratamento.
3) Biópsia do grupo não tratado após o final do período de tratamento.
DISCUSSÂO
Não foram observadas mortes no período de tratamento e não foram observadas diferenças significativas no tratamento quanto ao sexo dos animais.
Durante os sete dias de observação, pôde-se notar que o grupo que recebeu o tratamento evoluiu muito mais rapidamente que o grupo não tratado, sendo que, em apenas um rato (12,5%), não houve remissão da necrose, mesmo assim observou-se uma melhora da qualidade cicatricial quando comparada com a qualidade cicatricial do grupo não tratado.
Em 7 ratos (87,5%) houve remissão total da necrose; observou-se restauração do tegumento cutâneo e na comparação com o grupo controle que apresentava 5 ratos (62,5 %) com área cruenta, com secreção sorofibrinosa e em 2 ratos (25%) observou-se ainda a formação de crostas espessas e escuras, aderidas à derme, sendo que um rato (12,5%) teve cicatrização por segunda intenção, após retirada total do retalho.
Os aspectos clínicos foram comprovados e compatíveis com a análise microscópica do material.
ESTUDO CLÍNICO
Metodologia Clínica
Em face dos dados acima citados, encorajou-se a utilização do método em pacientes selecionados, iniciando um estudo protocolar.
Trataram-se 21 pacientes que apresentaram sofrimento de retalho de pele após cirurgia, divididos pelo tipo de cirurgia a que foram submetidos: quatro ritidoplastias, dez mamoplastias redutoras (3 bilaterais e 7 unilaterais) e sete dermolipectomias.
Métodos de Tratamento
O tratamento com pool injetável foi realizado em 21 pacientes, com idade variando entre 17 a 65 anos, sem patologias prévias (Figs. 3,.4 e 5).

Fig. 3a - Paciente com 51 anos, submetida a ritidoplastia, sem intercorrências. Observa-se o sofrimento do retalho retroauricular 24 horas após a cirurgia.

Fig. 3b - A mesma paciente após 14 dias de tratamento com ACE pool injetado diariamente. Observa-se a completa recuperação do retalho, sem a presença de seqüelas ou cicatrizes.

Fig. 4a - Paciente de 33 anos, submetida a mastoplastia redutora por técnica de incisão vertical. Observa-se o sofrimento do CAM 24 horas após a cirurgia. Visão da abertura do primeiro curativo.

Fig. 4b - Memo paciente, após 14 dias de tratamento com ACE pool. Observa-se a completa recuperação do CAM, sem deiscências de sutura nem seqüelas cicatriciais.
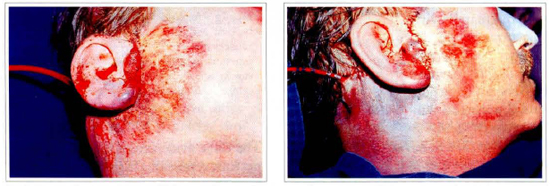
5a e 5b - Paciente com 50 anos, sexo masculino, submetido a ritidoplastia. Observa-se o grande hematoma formado 24 horas após a cirurgia com sofrimento de pele.

Fig. 5c - 4 dias após o tratamento com ACE pool.

Fig. 5d - 4 dias após o tratamento com ACE pool.
Injetamos o ACE pool (diluído 1:4 com prilocaína sem vasoconstritor) na quantidade de 1 a 3 ml, dependendo da extensão da patologia, via intradérmica superficial, sendo o limite da injeção local o nível de saturação da epiderme. Foram usadas sempre agulhas de insulina e seringas de 3 ou 5 ml, para a realização das aplicações, (todo o material descartável). Realizaram-se quinze aplicações diárias, sempre centripetamente iniciadas em área inalterada (0,5 cm fora da área necrótica) indo em direção à necrose ou sofrimento do retalho, com intervalos de 0,5 cm.
Discussão
As alterações cutâneas obtidas, após a falta de oxigenação tecidual quando se instala a necrose, são beneficiadas com o uso do ACE pool.
Na aplicação intradérmica superficial do ACE pool, notamos uma estabilização da membrana celular (diminuição da fosfolipidação da membrana celular) dada pela vitamina E, ativação intranuclear e excitação da formação do colágeno através da vitamina A. Temos também uma normalização do colágeno induzida pela hidroxilação da prolina através da vitamina C. e associada à ação das vitaminas, tem-se a potencialização da vitamina E, que também inibe a peroxidação lipídica da membrana celular.
Observa-se então que os tecidos tratados com ACE pool apresentaram na avaliação clínica (macroscopia), diminuição do tempo cicatricial quando comparado com o grupo não tratado, além de uma regeneração completa do tecido em quase todos os casos, eliminando a característica cicatricial do tecido que ocorre normalmente após a necrose.
CONCLUSÃO
Concluímos que o uso do ACE pool injetável é mais um método de tratamento que vem se somar aos mais modernos métodos disponíveis ao cirurgião plástico para a manutenção da saúde do sistema tegumentar e, com isso, oferecemos alternativas de terapêutica para os pacientes, em caso de necrose ou sofrimentos do tegumento cutâneo, que não teriam resultados satisfatórios com tratamentos clássicos.
BIBLIOGRAFIA
1. ABB J et al: Effect of Retinoic acid on the Spontaneous and Interferon-induced activity of Human Natural Killer Cells. Int. J. Cancer. 1982;30:307.
2. CHANDHARY L et al: Metabolism of All Trans (113H) Retinil acetate in young rats testo Ann. Nutr. Metab. 1986;30:1.
3. CONNOR HJ et al: Inhibition of UVB Carcino-genesis by Retinoic Acid. Câncer Research. 1983;43:272.
4. DIPLOCK AT, RICE-EVANS CA, Burdon RH. Is there a Significant Role for Lipid Perxidation in the Causation of Malignancy and for Antioxidants in Cancer Prevention. Cancer Res.1994;54:1952.
5. ELLIS CN, WEISS JS et al. Sustained Improvement with Prolongued Topical Tretinoin (Retinoic Acid) for Photoaged Skin. Journal of the American Acad. Dermat. 1990;23:1.
6. ESCRIBANO J, GRUBB A, MENDEZ E. Indentification of Retinol as one the Proteic HC Chromophores. Bioch. and Bioph. Research Communications. 1988;155:1424.
7. FITZPATRICK T. Dermatology in General Medicine. MacGrow Hill, Boston. 1993;1:247.
8. HEFFNER JE, REPINE JE. Pulmonary Strategies of Antioxidant Defence. Am. Rev. Respr. Dis. 1989;140:531.
9. JARDILLIER JC, RALLET A. Metabolisme de la Vitamine A et dês Retinoids. Bull. Cancer. 1986;73: 180.
10. KARLSON P. Bioquímica. Guanabara Koogan, Rio de Janeiro. 1970;1:470.
11. KLIGMAN AM, FULTON JE, PLEWIG G. Topical Acid Vitamin A in Acne Vulgaris. Arch. Dermatol. 1969;99:469.
12. KLIGMAN AM et al. Topical Tretinion for photo aged skin. Journal of the American Acad. Dermat. 1986;15:836.
13. LASNITZKll. The Effect of Excess Vitamin A on Mitosis in Chick Heart Fibroblast in Vitro. Esp. Cell. Res. 1955;8: 121.
14. OLSZEWER E. Radicais Livres em Medicina. Fundo Editorial BYK, São Paulo. 1992;122.
15. ORTHO RW. Johnson Pharmaceutical Research Institute.
16. PALAN PR, GOLDBERG GL et al . Lipid-soluble Antioxidants: Betacarotene and Alpha Tocopherol Leveis in Breast and Gynecologic Cancers. Gynecol. Oncol. 1994;55:72.
17. PENN ND. The Effect of Diaret Suplementation With Vitamin A and E on Cell-mediated Inunune Functionin Elderly Long Stay Patients. A Randomized Controlled Trial. Age and Aging. 1991;20:169.
18. PERSSONELLE J et al. Restauração do Tegumento Cutâneo com o uso de all trans retinoic acid Injetável "Nova forma de Tratamento". Rev. Bras. Med., 1993;50:986.
19. STRYER L: Bioquímica Koogan. Rio de Janeiro. 1988;848.
20. STTUTGEN G: Zur Loklbehandlung von Keratosen Mit Vitamin A. Saure Dermat. 1962;124:65.
21. TONG PS: Trans Retinoic Acid Enhances the Growth Response of Epidermis Keratinocytes to Epidermis Growth Factor Beta. J. lnvest. Dermatol. 1990;94:126.
22. WILSON EL, REECH E. Plasminogen Activator in Check Fibroblast: lnduction of Synthesis by Retinoic Acid: Synergism With Viral Transformation and Pherbol Ester. Cell. 1978;15:385.
AGRADECIMENTOS
- Tommus Química e Farmacêutica Ltda.
- Salomão Zoppi - Serviço de Anátomo- Patologia.
- G. Pozzan - Serviço de Anátomo-Patologia da Santa Casa de São Paulo.
- Prof. Ricardo Baroudi, MD - Por seu encorajamento científico.
I - Cirurgiã Plástica e Diretora Clínica do Hospital Saint Paul, São Paulo, SP.
II - Cirurgião Plástico e Diretor do Curso de Especialização em Cirurgia Plástica da Universidade Santa Cecília dos Bandeirantes, Santos, SP.
III - Cirurgião Plástico, Médico Assistente do Hospital Saint Paul, São Paulo, SP.
Endereço para Correspondência:
Jussara G. Perssonelle
Av. Moema 170/111 S
São Paulo - SP 04077-020


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter