

Original Article - Year 2018 - Volume 33 -
Reconstrução de parede torácica com retalhos musculocutâneos e fasciocutâneos em pacientes com câncer de mama localmente avançado e metastático
Thoracic wall reconstruction using myocutaneous and fasciocutaneous flaps in patients with locally advanced and metastatic breast cancer
RESUMO
Introdução: Câncer de mama localmente avançado é caracterizado pelos estádios clínicos
IIIb ou IV e representam de 20 a 25% de todos os casos. A reconstrução dos
defeitos é feita com retalhos musculocutâneos e fasciocutâneos, sendo os
mais utilizados o latíssimo do dorso e o reto abdominal. O objetivo é
avaliar resultados das reconstruções de parede torácica em câncer de mama
localmente avançados com retalhos musculocutâneos e fasciocutâneos.
Métodos: Estudo retrospectivo, observacional descritivo, em único centro. Variáveis
estudadas: dimensões do defeito e do retalho, tipo de retalho utilizado para
a reconstrução, metástases cutâneas e viscerais, evolução pós-operatória e
complicações.
Resultados: 11 pacientes, com média de idade de 49 anos, com o lado esquerdo mais
acometido. O tipo tumoral mais encontrado foi o carcinoma ductal invasivo.
Os retalhos realizados foram: 2 latíssimos do dorso com desenho VY (LDVY), 2
latíssimos do dorso associados a retalho toracoabdominal (LDVYTA), 4
verticais do músculo reto do abdome (VRAM) e 3 toracoabdominais (TA). A área
média dos defeitos foi 421,72cm2 e a área média dos retalhos
utilizados foi de 451cm2. A complicação mais frequente foi
deiscência parcial da ferida operatória, presente em 7 pacientes. Da
amostra, 6 pacientes atingiram êxito letal. VRAM foi o retalho que
apresentou mais complicações. A sobrevida média para VRAM foi de 25,5 meses,
para LDVY de 17 meses, TA de 17 meses e LDVYTA de 20,5 meses.
Conclusão: Os retalhos musculocutâneos e fasciocutâneos são eficazes para a reconstrução
da parede torácica após a ressecção de neoplasias mamárias localmente
avançadas.
Palavras-chave: Procedimentos cirúrgicos reconstrutivos; Parede torácica; Neoplasias da mama; Retalho miocutâneo; Metástase neoplásica; Fáscia
ABSTRACT
Introduction: Breast cancer is the most common cancer
among women worldwide. Locally advanced breast cancer is
characterized by clinical stage IIIb or IV and accounts for 20-
25% of all cases. Defects are reconstructed using myocutaneous
and fasciocutaneous flaps, primarily from the latissimus dorsi
and rectus abdominis muscles. The objective is to evaluate
the results of thoracic wall reconstructions in cases of locally
advanced breast cancer using fasciocutaneous and myocutaneous
flaps.
Methods: This was a retrospective, observational, and
descriptive single-center study. Variables studied included defect
size and flap dimensions, myocutaneous flap type, presence of
cutaneous and visceral metastasis, postoperative evolution, and
complications.
Results: We selected 11 patients with a mean
age of 49 years; the left side was the most commonly affected.
The most common tumor type was invasive ductal carcinoma.
The flaps were made of latissimus dorsi VY (LDVY) in two
patients, latissimus dorsi associated with thoracoabdominal flaps
(LDVYTA) in two, vertical rectus abdominus myocutaneous
flap (VRAM) in four, and thoracoabdominal flaps (TA) in
three. The mean defect area was 421.72 cm2, while the mean
flap area was 451 cm2. The most frequent complication was
partial dehiscence (seven patients). Six patients achieved lethal
exit. VRAM flaps presented more complications. The mean
survival for VRAM was 25.5 months, LDVY was 17 months,
TA was 17 months, LDVYTA was 20.5 months.
Conclusion:
Myocutaneous and fasciocutaneous flaps are effective for chest
wall reconstruction after locally advanced breast cancer resection.
Keywords: Reconstructive surgical procedures; Thoracic wall; Breast neoplasms; Myocutaneous flap; Neoplasm metastasis; Fascia
INTRODUÇÃO
A reconstrução de defeitos da parede torácica é desafiadora e compreende a restauração da forma e da função, bem como a cobertura e proteção de estruturas vitais1,2. Avanços nas técnicas cirúrgicas, na ventilação mecânica, no suporte de terapia intensiva, nos antibióticos com amplo espectro e na anestesia permitiram ressecções mais amplas, com morbidade e mortalidade aceitáveis, o que proporcionou melhora no prognóstico dos pacientes. Um fator que se mostrou determinante na evolução dos procedimentos foi a melhor compreensão e manejo da dinâmica ventilatória3.
As principais indicações para grandes ressecções de parede torácica incluem necroses decorrentes de radioterapia, defeitos congênitos, traumas, osteomielites, sarcomas, neoplasias pulmonares e mamárias avançadas4.
O câncer de mama é o tipo mais comum entre as mulheres no mundo e no Brasil depois do de pele não melanoma, respondendo por cerca de 28% dos casos novos a cada ano. É descrito um aumento da sua incidência tanto nos países desenvolvidos quanto nos em desenvolvimento. No Brasil a estimativa é 59.700 casos novos em 2018, segundo o INCA (Instituto Nacional do Câncer) e em 2013 ocorreram 14.388 mortes devido câncer de mama5.
Considera-se o câncer de mama localmente avançado os que se apresentam nos estádios clínicos IIIB ou IV. Sua ocorrência pode variar de 20 a 25% de todos os casos, sendo caracterizados por uma alta taxa de recorrência local e comportamento heterogêneo6,7. O estádio IIIB compreende pacientes com classificação tumoral T4, que representa tumor de qualquer tamanho com extensão direta para a parede torácica ou a pele, apresentando-se como uma ulceração ou nódulos cutâneos. Já o estádio clínico IV compreende pacientes com qualquer T, qualquer N (status linfonodal) e M1, que significa doença metastática, inclusive para a pele. Tratamento com quimioterapia adjuvante frequentemente é considerado nesta apresentação clínica antes da cirurgia, bem como radioterapia7.
Tansini é considerado o primeiro cirurgião a usar um retalho musculocutâneo para reconstrução de partes moles da parede torácica anterior. O caso relatado é o fechamento do defeito decorrente de uma mastectomia radical com um retalho de latíssimo do dorso em 19068. Existem outras descrições de transposição de retalho de latíssimo do dorso nas décadas de 409 e 5010 do século XX para reconstrução da parede torácica2. A técnica só passou a ser utilizada largamente quando o conceito de retalhos musculocutâneos foi revivido e aperfeiçoado na década de 70 do século XX, o que sedimentou sua utilização rotineira até a atualidade1,2.
Os principais músculos utilizados para a reconstrução da parede torácica são: o latíssimo do dorso (LD), peitoral maior e o reto do abdome, cada um com suas vantagens e desvantagens, porém todos robustos, confiáveis e versáteis, com uma anatomia vascular consistente e possibilidade de utilização de uma ilha de pele associada1,11.
Retalhos locais ao acaso e retalhos fasciocutâneos toracoabdominais também apresentam sua utilidade em casos selecionados12. Em alguns casos, está descrito o uso de omento maior como arcabouço para reconstrução da parede torácica como demonstrado inicialmente por Kiricuta13 e, em nosso meio, por Tavares et al.14.
Existem tentativas de elaboração de algoritmos11,15 para reconstrução das partes moles da parede torácica, mas observa-se na prática uma grande complexidade e variedade de defeitos. O cirurgião reconstrutor deve estar preparado para alterar seu planejamento devido aos achados intraoperatórios1.
A escolha da técnica depende da localização extensão do defeito, da sua localização e disponibilidade das áreas doadoras, devendo-se levar em consideração abordagens cirúrgicas anteriores na região torácica e abdominal, bem como radioterapia1,2.
OBJETIVO
Avaliar resultados das reconstruções de parede torácica com retalhos musculocutâneos e fasciocutâneos em pacientes com câncer de mama localmente avançados em hospital de referência para tratamento do câncer.
MÉTODOS
Trata-se de um estudo retrospectivo, observacional descritivo, em único centro, todos operados pelo mesmo cirurgião. A população estudada é composta de pacientes submetidos a ressecção de lesões oncológicas em parede torácica no A.C. Camargo Cancer Center, em São Paulo, SP, e reconstruídas com retalhos musculocutâneos pelo autor no período de 1 de janeiro de 2016 a 31 dezembro de 2017.
O estudo foi submetido e aprovado pelo Comitê de Ética e Pesquisa da instituição, sob o código EC 51/18. Todos os pacientes foram orientados sobre os procedimentos e assinaram termo de consentimento informado.
As variáveis estudadas foram a idade, gênero, histologia, dimensões do defeito, tipo de retalho musculocutâneo utilizado para a reconstrução, dimensões do retalho, presença de metástases cutâneas e viscerais, evolução pós-operatória e complicações imediatas e tardias.
Para a avaliação das complicações pós-operatórias, foram constituídos quatro grupos -1) Retalho vertical do músculo reto abdominal (VRAM), 2) Latíssimo do dorso em conformação VY (LDVY), 3) Retalho toracoabdominal (TA) e 4) Latíssimo do dorso associado ao retalho toracoabdominal (LDVYTA).
A técnica utilizada para a confecção dos retalhos foi a seguinte:
Retalho musculocutâneo de latíssimo do dorso com ilha de pele em VY
Inicialmente, foi realizada a mudança para decúbito lateral oposto ao defeito da mastectomia. Em seguida, foi demarcada a ilha de pele em V sobrejacente ao músculo latíssimo do dorso a partir da borda lateral do defeito resultante da mastectomia. Teste de pinçamento cutâneo foi utilizado para avaliar a tensão no fechamento da área doadora. Foi realizada então infiltração com solução de 1:250.000 de adrenalina e ropivacaína a 10mg/ml.
O retalho musculocutâneo foi confeccionado com isolamento do pedículo da artéria toracodorsal e desinserção do tendão no sulco intertubercular do úmero. Realizada transposição do retalho para a área do defeito da mastectomia seguido de confecção de 10 pontos de adesão de Baroudi com vycril 2,0. A área doadora foi fechada por planos em forma de “Y” após a drenagem com dreno de Blake n°19.
O decúbito da paciente foi então modificado para horizontal e procedida a distribuição do retalho sobre o defeito da mastectomia, instalado dreno a vácuo (Blake n° 19) e fechamento por planos. Quando necessário, foi associado retalho toracoabdominal (LDVYTA) para complementação do fechamento devido cobertura insuficiente do retalho de latíssimo do dorso.
Os curativos tanto da área doadora quanto da área reconstruída foram feitos com adaptic, gaze e opsite.
Retalho com ilha vertical de pele do músculo reto do abdome (VRAM)
Paciente em decúbito horizontal sendo realizada demarcação de ilha de pele sobre o eixo longitudinal do músculo reto do abdome contralateral e monopediculado ao defeito da mastectomia.
Em seguida, foi realizada infiltração com solução de 1:250.000 de adrenalina e ropivacaína a 10mg/ml. Realizada incisão com dissecção por planos até a bainha do músculo reto do abdome com sua abertura e isolamento do músculo. Em seguida, procedeu-se à secção no terço distal do músculo reto do abdome, na projeção da linha semilunar, após ligadura da artéria epigástrica inferior e veias correspondentes com fios de vycril 2,0. O retalho foi mobilizado para a área do defeito e procedeu-se fechamento da área doadora com reconstituição da bainha anterior do músculo reto do abdome com fio de nylon 0,0 em pontos separados.
Neste momento foi avaliada a necessidade de reforço com tela Ultrapro (Johnson & Johnson), de acordo com a tensão encontrada no fechamento. Foi então realizada drenagem a vácuo (Blake n° 19) e a área doadora fechada por planos. O retalho mobilizado foi acomodado sobre o defeito resultante da mastectomia, realizada drenagem a vácuo com dreno de Blake n° 19 e fechamento por planos.
Os curativos, tanto da área doadora quanto da área reconstruída, foram feitos com adaptic, gaze e opsite.
Retalho toracoabdominal
Após avaliação do defeito resultante da mastectomia, foram confeccionados retalhos fasciocutâneo de avanço da região torácica e abdominal. O tamanho do retalho foi proporcional ao defeito resultante e a elasticidade da pele da área doadora foi o critério utilizado para sua utilização. Após o avanço do retalho, foram feitos pontos de adesão de Baroudi com vycril 2,0, drenagem da espaço morto com dreno de Blake n° 19 e fechamento por planos.
Os curativos, tanto da área doadora quanto da área reconstruída, foram feitos com adaptic, gaze e opsite.
As análises estáticas foram realizadas com o software SPSS, versão 24.0 (Chicago, IL).
Diferenças serão consideradas estatisticamente significativas quando o valor de p for menor que 0,05. A análise descritiva foi realizada utilizando frequências e porcentagens para as características das diversas variáveis categóricas e da obtenção de medidas de tendência central (média e mediana) para as variáveis quantitativas.
O método de Kaplan Meier foi utilizado para avaliação da sobrevida.
RESULTADOS
Foram selecionadas 11 pacientes com os critérios escolhidos (Tabela 1). Considerando as variáveis descritivas, a faixa etária variou de 28 a 63 anos, com uma média de 49 anos e todas as pacientes foram do gênero feminino com câncer de mama avançado em estádio clínico IIIB ou IV. Quanto à lateralidade da doença, o lado esquerdo foi o mais acometido, sendo representado por 6 das 11 pacientes. Nenhum caso teve acometimento bilateral.
| Paciente | Idade | Retalho | Clínica | Lateralidade | Métastasés Cutâneas | Métastasés Viscerais | Dimensões do defeito (cm2) | Dimensões do retalho (cm2) | Óbito |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 38 | VRAM | Massa | Esquerda | Sim | Não | 240 | 200 | Sim |
| 2 | 53 | LDVY | Massa ulcerada | Direita | Não | Sim | 450 | 240 | Sim |
| 3 | 60 | VRAM | Massa e hiperemia | Esquerda | Não | Sim | 600 | 350 | Não |
| 4 | 51 | LDVYTA | Massa e hiperemia | Esquerda | Sim | Não | 119 | 198 | Não |
| 5 | 50 | LDVYTA | Massa ulcerada | Direita | Sim | Não | 144 | 684 | Sim |
| 6 | 42 | TA | Massa e hiperemia | Esquerda | Não | Sim | 595 | 800 | Não |
| 7 | 47 | TA | Massa | Esquerda | Sim | Sim | 63 | 800 | Sim |
| 8 | 28 | LDVY | Massa e hiperemia | Direita | Não | Sim | 625 | 171 | Não |
| 9 | 52 | VRAM | Massa ulcerada | Direita | Sim | Sim | 600 | 720 | Sim |
| 10 | 63 | TA | Massa ulcerada | Direita | Não | Sim | 336 | 425 | Não |
| 11 | 59 | VRAM | Massa ulcerada | Esquerda | Sim | Não | 300 | 375 | Sim |
O tipo tumoral mais encontrado foi o carcinoma ductal invasivo, com 9 casos, representando 81% da amostra. Os outros dois casos foram um carcinoma lobular invasivo e outro de tumor metaplásico. Das 11 pacientes 4 foram submetidas à mastectomia à Halsted e as demais à mastectomia radical modificada.
Os retalhos realizados foram em números: 2 LDVY, 2 LDVYTA (Figuras 1 e 2), 4 VRAM (Figuras 3 e 4) e 3 TA (Figura 5). A tela para reforço da parede do abdome foi utilizada em 2 pacientes em que a técnica do VRAM foi selecionada para reparar o defeito. O tamanho dos defeitos variou de 17x7 a 45x10cm, com uma área média em centímetros quadrados de 421,72cm2 e o tamanho dos retalhos utilizados para reconstrução foi de 19x9 a 40x20cm2, com uma área média de 451cm2.
A apresentação clínica inicial foi uma massa mamária volumosa em 2 das pacientes, massa com hiperemia cutânea difusa em 4 pacientes e massa com ulceração em 5 pacientes (Figura 6). Hemorragia estava presente em 4 das pacientes, sendo que uma delas necessitou de radioterapia hemostática antes da cirurgia para controle dos sintomas.
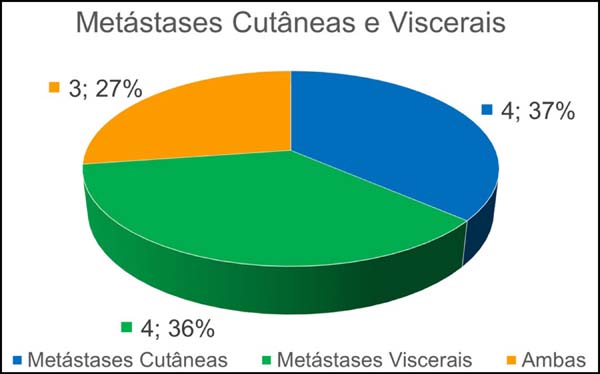
Das 11 pacientes, 4 apresentaram metástases cutâneas durante o período de acompanhamento, 4 metástases viscerais e 3 metástases viscerais e cutâneas concomitantes (Figura 7). Quatro pacientes já haviam sido submetidas a quadrantectomias previamente e retornaram com doença recidivada para tratamento de controle locorregional da neoplasia.
A média de internação após o procedimento foi de 4 dias, variando de 1 até 15 dias. Apenas 1 paciente teve necessidade de acompanhamento pós-operatório na unidade de terapia intensiva (UTI) com permanência de 1 dia.
Quatro pacientes receberam radioterapia complementar após o tratamento cirúrgico. Das 11 pacientes operadas, 10 foram tratadas por quimioterapia neoadjuvante e dez pacientes quimioterapia adjuvante. Das 11 pacientes, 3 apresentavam comorbidades, sendo 1 delas hipertensão arterial sistêmica e 2 com diabetes e hipertensão associadas.
A complicação mais frequente foi deiscência parcial da ferida operatória, estando presente em 7 pacientes, 6 destas manejadas conservadoramente e 1 necessitou de ressutura em regime ambulatorial com o intuito de habilitar a paciente o mais rápido possível para a quimioterapia adjuvante. Além disso, necrose parcial do retalho ocorreu em 2 pacientes, hemorragia em 1 paciente, abscesso em 2, epiteliólise em 3 e seroma em uma paciente (Figura 8).
Uma paciente diabética e hipertensa apresentou abscesso de ferida operatória em vigência de quimioterapia adjuvante, evoluindo para choque séptico e i n d o a óbito 32 dias após a cirurgia. Em uma paciente com câncer de mama e radioterapia prévia submetida à reconstrução com VRAM ocorreu necrose parcial do retalho e da pele da área receptora na região axilar, o que causou exposição dos vasos axilares. Optou-se por desbridamento cirúrgico amplo e reconstrução local com retalho fasciocutâneo paraescapular, que apresentou boa evolução, embora a paciente tenha apresentado recidiva locorregional da doença 3 semanas após e foi a óbito 3 depois de 3 meses da recidiva.
No momento da aquisição dos dados, seis pacientes da série haviam ido a óbito. Dos quatro grupos avaliados, a reconstrução com VRAM foi o que apresentou o maior número de complicações e a com o retalho toracoabdominal a que menos apresentou.
Quanto à sobrevida, utilizando o teste de Kaplan Meier e estratificando por retalho utilizado, obtiveram-se os seguintes resultados (Figura 9 e Tabela 2): VRAM: sobrevida em 12 meses de 75% e 37,5% em 28 meses; LDVYTA: sobrevida de 50% em 18 meses; TA: sobrevida de 66,7% em 13 meses. A sobrevida média para VRAM foi de 25,5 meses, para LDVY de 17 meses, TA de 17 meses e LDVYTA de 20,5 meses.
| Tabela de sobrevivência | |||||||
|---|---|---|---|---|---|---|---|
| Proporção Cumulativa | Número de Eventos Cumulativos | Número de Casos Remanescentes | |||||
| Survivina at the Time | |||||||
| Retalho | Tempo | Status | Estimativa | Std. Erro | |||
| VRAM | 1 | 12,000 | Sim | 0,750 | 0,217 | 1 | 3 |
| 2 | 22,000 | Não | . | . | 1 | 2 | |
| 3 | 28,000 | Sim | 0,375 | 0,286 | 2 | 1 | |
| 4 | 32,000 | Sim | 0,000 | 0,000 | 3 | 0 | |
| LDVY | 1 | 16,000 | Não | . | . | 0 | 1 |
| 2 | 17,000 | Sim | 0,000 | 0,000 | 1 | 0 | |
| TA | 1 | 13,000 | Sim | 0,667 | 0,272 | 1 | 2 |
| 2 | 14,000 | Não | . | . | 1 | 1 | |
| 3 | 19,000 | Não | . | . | 1 | 0 | |
| LDVYTA | 1 | 18,000 | Sim | 0,500 | 0,354 | 1 | 1 |
| 2 | 23,000 | Não | . | . | 1 | 0 | |
Um teste de log rank foi aplicado para verificar se existia diferenças estatísticas entre os tipos de tratamento, encontrando um valor de p de 0,87. Dessa forma, com um nível de significância de 5% não existe diferença estatisticamente significativa entre o tipo de retalho utilizado em termos de sobrevida.
DISCUSSÃO
A ressecção cirúrgica ampla com margens livres e fechamento do defeito com retalhos musculocutâneos ou fasciocutâneos é considerada a abordagem de eleição para o câncer de mama localmente avançado (estádios IIIB e IV). Este tratamento proporciona um tempo livre de progressão de doença aumentado, melhora da qualidade de vida e aumento da sobrevida global16-28.
O retalho de músculo latíssimo do dorso apresenta papel de protagonismo nas reparações torácicas e mamárias, pois possui pedículo vascular consistente e bom arco de rotação como advogado por Dutra, sendo o retalho confeccionado com a paciente em decúbito lateral, modalidade que foi adotada em todos os casos operados neste estudo29,30. Andrade et al.31, em 2015, descreveram a mobilização do retalho em decúbito dorsal, relatando redução no tempo operatório.
Devido à necessidade de grandes quantidades teciduais para cobertura dos defeitos, variações na composição da ilha de pele foram descritas, como a proposta por Micali et al.32 , em 2001, com ilha de pele do retalho de músculo latíssimo do dorso em VY. Sua utilidade na reconstrução mamária foi confirmada por Woo et al.33, em 2006, e Luz et al.34,em 2010 e por nós no presente estudo, sendo definido como retalho de primeira escolha, quando possível.
A adequada seleção de pacientes, planejamento coordenado com o mastologista e cuidados na manipulação intraoperatória dos tecidos envolvidos são essenciais para o sucesso da reconstrução com o retalho de latíssimo do dorso em VY35,36. Em nosso entendimento, a extensão de pele que se posiciona fora da topografia do músculo e, dessa forma, com vascularização ao acaso, desempenha importante fator na ocorrência de complicações com deiscência e necrose parcial. O VRAM é considerado para defeitos extensos ou quando houver contraindicação ao latíssimo23.
Silva et al.12, em um estudo semelhante ao nosso, apresentaram uma área de ressecção de 259,2 cm2, menor que a encontrada por nós, de 421,72cm2, o que pode explicar o maior uso do VRAM em nosso estudo. Neste mesmo trabalho a complicação mais frequente foi a epiteliólise bem como em nossa casuística, seguido por necrose parcial do retalho.
A utilização de retalhos musculocutâneos e fasciocutâneos não interfere no diagnóstico e tratamento de uma recidiva locorregional de câncer de mama. Na literatura, a taxa de recorrência encontrada é de 10,6%, variando de 2 semanas até 3,8 anos20. Em nosso estudo encontramos 63,3% de recorrência local. Atribui-se a isso o perfil das pacientes operadas, todas com doença localmente agressiva.
Quando apenas metástases cutâneas estão presentes, a sobrevida média é de 42,1 meses. Quando metástases viscerais também estão presentes a sobrevida mediana é de 12,08 meses37. As 7 pacientes que foram a óbito apresentavam metástases cutâneas e viscerais e apresentaram sobrevida mediana de 15 meses.
CONCLUSÃO
Os retalhos musculocutâneos e fasciocutâneos permanecem predominantes como opção de reconstrução na parede torácica e viabilizam as extensas ressecções necessárias para as margens oncologicamente adequadas, com índices aceitáveis de complicações.
COLABORAÇÕES
|
JAJ |
Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; coleta de dados; conceitualização; concepção e desenho do estudo; gerenciamento do projeto; metodologia; realização das operações e/ ou experimentos; redação - preparação do original; redação - revisão e edição; supervisão; visualização. |
|
AKD |
Supervisão. |
|
MCD |
Redação - revisão e edição. |
|
EKY |
Redação - revisão e edição. |
REFERÊNCIAS
1. Bakri K, Mardini S, Evans KK, Carlsen BT, Arnold PG. Workhorse flaps in chest wall reconstruction: the pectoralis major, latissimus dorsi, and rectus abdominis flaps. Semin Plast Surg. 2011;25(1):43-54. DOI: http://dx.doi.org/10.1055/s-0031-1275170
2. Arnold PG, Pairolero PC. Chest-wall reconstruction: an account of 500 consecutive patients. Plast Reconstr Surg. 1996;(98):804-10. DOI: http://dx.doi.org/10.1097/00006534-199610000-00008
3. Mansour KA, Thourani VH, Losken A, Reeves JG, Miller JI Jr, Carlson GW, et al. Chest wall resections and reconstruction: a 25-year experience. Ann Thorac Surg. 2002;73(6):1720-5. DOI: http://dx.doi.org/10.1016/S0003-4975(02)03527-0
4. Graeber GM, Langenfeld J. Chest wall resection and reconstruction. In: Franco KL, Putman JR, eds. Advanced therapy in thoracic surgery. London: BC Decker; 1998. p. 175-85.
5. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva - INCA. Estimativa 2018: Síntese de Resultados e Comentários. [acesso 2018 Jan 15]. Disponível em: http://www2.inca.gov.br/wps/wcm/connect/tiposdecancer/site/home/mama/cancer_mama
6. Woodward WA, Strom EA, Tucker SL, McNeese MD, Perkins GH, Schechter NR, et al. Changes in the 2003 American Joint Committee on Cancer staging for breast cancer dramatically affect stage-specific survival. J Clin Oncol. 2003;21(17):3244-8. DOI: http://dx.doi.org/10.1200/JCO.2003.03.052
7. National Comprehensive Cancer Network - NCCN. Clinical Practice Guidelines in Oncology: Breast Cancer. [acesso 2018 Jan 15]. Disponível em: http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf
8. Tansini I. Sopra il mio nuovo processo di amputazione della mammella. Gaz Med Ital. 1906;57:141.
9. Hutchins EH. A method for the prevention of elephantiasis. Surg Gynecol Obstet. 1939;69:795-804.
10. Campbell DA. Reconstruction of the anterior thoracic wall. J Thorac Surg. 1950;19(3):456-61. PMID: 15406489
11. Losken A, Thourani VH, Carlson GW, Jones GE, Culbertson JH, Miller JI, et al. A reconstructive algorithm for plastic surgery following extensive chest wall resection. Br J Plast Surg. 2004;57(4):295-302. PMID: 15145731 DOI: http://dx.doi.org/10.1016/j.bjps.2004.02.004
12. Silva MMA, Sabino Neto M, Leite AT, Guimarães PAP, Ferreira LM. Reconstrução de parede torácica em extensas ressecções oncológicas. Rev Bras Cir Plást. 2017;32(4):513-22.
13. Kiricuta I. L'emploi du grand épiploon dans la chirurgie du sein cancéreux. Press Med. 1963;71:15-7.
14. Tavares FM, Menezes CM, Moscozo MV, Xavier GR, Oliveira GM, Amorim Júnior MAP. Retalho de omento: uma alternativa em cirurgia reparadora da parede torácica. Rev Bras Cir Plást. 2011;26(2):360-5. DOI: http://dx.doi.org/10.1590/S1983-51752011000200028
15. Chang RR, Mehrara BJ, Hu QY, Disa JJ, Cordeiro PG. Reconstruction of complex oncologic chest wall defects: a 10- year experience. Ann Plast Surg. 2004;52(5):471-9. DOI: http://dx.doi.org/10.1097/01.sap.0000122653.09641.f8
16. Alvarado M, Ewing CA, Elyassnia D, Foster RD, Shelley Hwang E. Surgery for palliation and treatment of advanced breast cancer. Surg Oncol. 2007;16(4):249-57. DOI: http://dx.doi.org/10.1016/j.suronc.2007.08.007
17. Chin PL, Andersen JS, Somlo G, Chu DZ, Schwarz RE, Ellenhorn JD. Esthetic reconstruction after mastectomy for inflammatory breast cancer: is it worthwhile? J Am Coll Surg. 2000;190(3):304-9. PMID: 10703855
18. Lee MC, Newman LA. Management of patients with locally advanced breast cancer. Surg Clin North Am. 2007;87(2):379-98. DOI: http://dx.doi.org/10.1016/j.suc.2007.01.012
19. Park JS, Ahn SH, Son BH, Kim EK. Using local flaps in a chest wall reconstruction after mastectomy for locally advanced breast cancer. Arch Plast Surg. 2015;42(3):288-94. DOI: http://dx.doi.org/10.5999/aps.2015.42.3.288
20. Slavin SA, Love SM, Goldwyn RM. Recurrent breast cancer following immediate reconstruction with myocutaneous flaps. Plast Recons Surg. 1994;93(6):1191-204. DOI: http://dx.doi.org/10.1097/00006534-199405000-00013
21. Tanabe M, Iwase T, Okumura Y, Yoshida A, Masuda N, Nakatsukasa K, et al.; Collaborative Study Group of Scientific Research of the Japanese Breast Cancer Society. Local recurrence risk after previous salvage mastectomy. Eur J Surg Oncol. 2016;42(7):980-5. DOI: http://dx.doi.org/10.1016/j.ejso.2016.03.008
22. Cagli B, Barone M, Ippolito E, Cogliandro A, Silipigni S, Ramella S, et al. Ten years experience with breast reconstruction after salvage mastectomy in previously irradiated patients: analysis of outcomes, satisfaction and well-being. Eur Rev Med Pharmacol Sci. 2016;20(22):4635-41.
23. Rao R, Feng L, Kuerer HM, Singletary SE, Bedrosian I, Hunt KK, et al. Timing of surgical intervention for the intact primary in stage IV breast cancer patients. Ann Surg Oncol. 2008;15(6):1696-702. DOI: http://dx.doi.org/10.1245/s10434-008-9830-4
24. Blanchard DK, Shetty PB, Hilsenbeck SG, Elledge RM. Association of surgery with improved survival in stage IV breast cancer patients. Ann Surg. 2008;247(5):732-8. PMID: 18438108 DOI: http://dx.doi.org/10.1097/SLA.0b013e3181656d32
25. Graziosi GB, Lucas FAS, Maximiano AMC, Caiado Neto BR, Prota Júnior MLC. Reconstrução de parede torácica em tumores de mama localmente avançados. Rev Bras Cir Plást. 2013;28(3 Suppl.1):64.
26. Franco D, Tavares Filho JM, Cardoso P, Moreto Filho L, Reis MC, Boasquevisque CHR, et al. A cirurgia plástica na reconstrução da parede torácica: aspectos relevantes - série de casos. Rev Col Bras Cir. 2015;42(6):366-37. DOI: http://dx.doi.org/10.1590/0100-69912015006003
27. Batista KT, Araujo HJ, Mammare EM, Aita AA, Silva RS. Reconstrução da parede torácica após a ressecção de extensos tumores. Rev Bras Cir Plást. 2014;29(4):550-6.
28. Novoa N, Benito P, Jiménez MF, de Juan A, Luis Aranda J, Varela G. Reconstruction of chest wall defects after resection of large neoplasms: ten-year experience. Interact Cardiovasc Thorac Surg. 2005;4(3):250-5. DOI: http://dx.doi.org/10.1510/icvts.2004.103432
29. Dutra AK, Neto MS, Garcia EB, Veiga DF, Netto MM, Curado JH, et al. Patients' satisfaction with immediate breast reconstruction with a latissimus dorsi musculocutaneous flap. J Plast Surg Hand Surg. 2012;46(5):349-53. DOI: http://dx.doi.org/10.3109/2000656X.2012.704726
30. Dutra AK, Sabino Neto M, Garcia EB, Veiga DF, Domingues MC, Yoshimatsu EK, et al. The role of transverse latissimus dorsi musculocutaneous flap immediate breast reconstruction. Eur J Plast Surg. 2009;32(6):293-9. DOI: http://dx.doi.org/10.1007/s00238-009-0366-z
31. Andrade FAG, Duarte FG, Chaves LO, Bezerra RN, Salvador Filho LHA, Silva SVD. A sistematização do retalho do músculo latíssimo do dorso em decúbito dorsal. Rev Bras Cir Plást. 2015;30(2):190-6.
32. Micali E, Carramaschi FR. Extended V-Y latissimus dorsi musculocutaneous flap for anterior chest wall reconstruction. Plast Reconstr Surg. 2001;107(6):1382-90. DOI: http://dx.doi.org/10.1097/00006534-200105000-00010
33. Woo E, Tan BK, Koong HN, Yeo A, Chan MY, Song C. Use of the extended V-Y latissimus dorsi myocutaneous flap for chest wall reconstruction in locally advanced breast cancer. Ann Thorac Surg. 2006;82(2):752-5. PMID: 16863813 DOI: http://dx.doi.org/10.1016/j.athoracsur.2005.07.030
34. Luz DP, Lobo CAH, Hiraki P, Okada A, Montag E, Ferreira MC. Retalho miocutâneo de latíssimo do dorso em V-Y para reconstrução de grandes defeitos torácicos extensos. Rev Bras Cir Plást. 2010;25(3 Suppl.1):64.
35. Munhoz AM, Montag E, Arruda E, Okada A, Brasil JA, Gemperli R, et al. Immediate locally advanced breast cancer and chest wall reconstruction: surgical planning and reconstruction strategies with extended V-Y latissimus dorsi myocutaneous flap. Plast Reconstr Surg. 2011;127(6):2186-97. PMID: 21617452 DOI: http://dx.doi.org/10.1097/PRS.0b013e318213a038
36. Marcondes CA, Pessoa SGDP, Pessoa BBGD, Dias IS, Ribeiro NP Estratégias em reconstruções de tórax pós-ressecções extensas de tumores de mama localmente avançados: uma série de 11 casos. Rev Bras Cir Plást. 2015;30(3):339-44.
37. Hu SC, Chen GS, Lu YW, Wu CS, Lan CC. Cutaneous metastases from different internal malignancies: a clinical and prognostic appraisal. J Eur Acad Dermatol Venereol. 2008;22(6):735-40. DOI: http://dx.doi.org/10.1111/j.1468-3083.2008.02590.x
1. A. C. Camargo Cancer Center, Núcleo de Cirurgia
Plástica Reparadora, São Paulo, SP, Brasil.
Autor correspondente: Joel Abdala Junior, Rua Prof. Antônio Prudente, nº 211 - Liberdade, São Paulo, SP, Brasil, CEP 01509-010. E-mail: drjoelabdala@gmail.com
Artigo submetido: 31/7/2018.
Artigo aceito: 11/11/2018.
Conflitos de interesse: não há.





















 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter