

Case Report - Year 2018 - Volume 33 -
Pioderma gangrenoso: um desafio para o cirurgião plástico
Pyoderma gangrenosum: a challenge for the plastic surgeon
RESUMO
Introdução: O pioderma gangrenoso (PG) corresponde a uma dermatose autoimune crônica e
rara. Sua base etiológica ainda permanece pouco conhecida, sendo idiopático
em 25 a 50% dos casos, nos demais está associado com doenças sistêmicas de
fundo autoimune, tem uma incidência de 2 a 3 casos em 1 milhão de habitantes
por ano. No Brasil, este índice é de 0,38 casos por 10.000 atendimentos, as
mais acometidas são as mulheres entre a segunda e quinta década de vida. O
quadro clínico é variável, sendo que a forma ulcerosa, que surge sobre uma
cicatriz prévia, é a mais prevalente.
Relato de Caso: Paciente do sexo feminino, 39 anos de idade, previamente hígida, foi
submetida à mamoplastia redutora, evoluiu com úlcera necrótica em cicatriz
vertical de mama esquerda. Realizado desbridamento de tecidos
desvitalizados, prescrita antibioticoterapia, apresentando piora importante
da lesão, sendo considerada a hipótese de PG. Iniciado tratamento com
corticoterapia oral e tópica com remissão do quadro.
Conclusões: O PG representa um desafio no diagnóstico e, geralmente, demonstra a
dificuldade diagnóstica, podendo ser confundido com infecção do sítio
cirúrgico.
Palavras-chave: Pioderma gangrenoso; Mamoplastia; Corticosteroides; Procedimentos cirúrgicos reconstrutivos; Imunoterapia
ABSTRACT
Introduction: Pyoderma gangrenosum (PG) is a chronic and
rare autoimmune dermatosis. Its etiology remains poorly
understood, being idiopathic in 25 to 50% of cases; in others, it is
associated with systemic diseases with autoimmune background
and has an incidence of 2 to 3 cases per 1 million per year. In
Brazil, the rate is 0.38 cases per 10,000 clinical visits, and women
between the second and fifth decades of life are the most affected.
The clinical presentation is variable, and the ulcerous form,
which appears on a previous scar, is the most prevalent.
Case Report: A 39-year-old, previously healthy female underwent
reduction mammoplasty, and later developed a necrotic ulcer
on a vertical left breast scar. Debridement of devitalized
tissue was performed, with significant worsening despite
antibiotic therapy. The appearance suggested PG. Treatment
with oral and topical corticosteroids was then initiated
with remission.
Conclusions: PG represents a diagnostic
challenge, and can be confused with surgical site infection.
Keywords: Pyoderma gangrenosum; Mammoplasty; Corticosteroids; Reconstructive surgical procedures; Immunotherapy
INTRODUÇÃO
O pioderma gangrenoso (PG) corresponde a uma dermatose autoimune crônica e rara, descrita pela primeira vez por Brunstng e O Larry em 1930, ressaltando a ausência de caráter infeccioso. Histopatologicamente, é caracterizada por um infiltrado neutrofílico dérmico inespecífico não infeccioso, não neoplásico e sem vasculite primária1.
A base etiológica ainda permanece pouco conhecida, sendo idiopático em 25 a 50% dos casos. Nos demais está associado com doenças sistêmicas de fundo autoimune, com destaque para as doenças inflamatórias intestinais, principalmente a colite ulcerativa, mas também, artrites, gamopatias, especialmente por IgA, entre outras2,3. Pode surgir ainda como uma manifestação paraneoplásica e com o uso de certos medicamentos (propiltiouracil e isotretinoína em casos especiais) e substâncias ilícitas como a cocaína4.
O PG tem uma incidência de 2 a 3 casos em 1 milhão de habitantes por ano4,5. Dados nacionais de uma análise retrospectiva mostraram que, no Brasil, este índice é de 0,38 casos por 10.000 atendimentos5, sendo as mulheres as mais acometidas, entre a segunda e quinta década de vida4.
O quadro clínico é variável, sendo que a forma ulcerosa, única ou múltipla, que surge sobre uma cicatriz prévia, é a mais prevalente6. As ulceras são bem delimitadas, com alo violáceo, centro necro-hemorrágico, purulento e crescimento centrífugo acelerado, sendo a característica marcante da lesão, terminando com a formação acelerada de tecido de granulação7. Além da forma ulcerada, ainda classificamos didaticamente em formas pustulosa e vegetante, menos prevalentes e com menor associação a complicações pós-cirúrgicas8.
A histopatologia no PG é inespecífica, seja à microscopia óptica, seja à imuno- histoquímica, não existindo no momento marcadores sorológicos capazes de culminar a um diagnóstico laboratorial; desta forma, o diagnóstico é clínico por exclusão9,10.
Ressalta-se a importância do conhecimento do padrão cutâneo da lesão, pois o PG pós- cirúrgico tem diagnóstico, via de regra, demorado, porque é suplantado pelos diagnósticos mais comuns como deiscência e infecção de ferida, acarretando em desbridamentos desnecessários que tendem a piorar o quadro, uma vez que o padrão da lesão do PG está relacionado ao fenômeno de patergia em até 50%, dos casos, no qual, pequenos traumas podem desencadear novas lesões6,11.
Neste ponto é necessário que o cirurgião plástico tenha o diagnóstico de PG em seu arsenal de diagnósticos diferenciais, pois com o conhecimento das lesões cutâneas, dos fatores predisponentes e condições cirúrgicas de risco será possível evitar situações evolutivas extremamente graves para os pacientes.
RELATO DO CASO
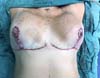
Paciente do sexo feminino, 39 anos de idade, caucasiana, previamente hígida, sem antecedentes cirúrgicos e obstétricos, foi submetida à mamoplastia redutora (Figura 1), procedimento realizado sem intercorrências, recebendo alta hospitalar após 24 horas, sem queixas e em bom estado geral.
Paciente recebeu antibioticoprofilaxia com cefezolina 1g 6/6h durante a internação, complementada com cefalexina 500 mg 6/6h, domiciliar até o 7º dia pós-operatório (DPO). Paciente reavaliada após 72 horas de procedimento cirúrgico, ainda sem queixas, ferida operatória com bom aspecto, mantida microporagem de rotina.
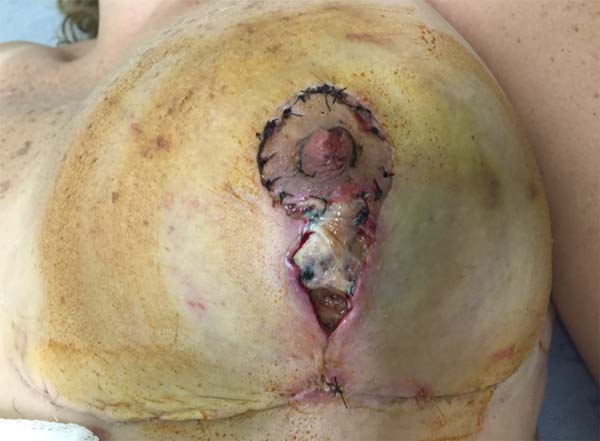
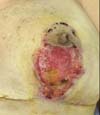
No 15 DPO, em consulta de rotina, ferida operatória apresenta úlcera necrótica em cicatriz vertical de mama esquerda, com drenagem de modera quantidade de secreção sero-purulenta (Figura 2). Realizado desbridamento de tecidos desvitalizados, prescrito antibioticoterapia com cirprofloxacino 500 mg 12/12h e curativos locais com colagenase pomada, além de microporagem em demais porções da ferida cirúrgica, com bom aspecto e boa evolução. No 17 DPO paciente é reavaliada, sendo identificada piora importante da lesão, com progressão centrípeta, acometendo segmentos da cicatriz no sulco inframamário. Paciente negava sintomas sistêmicos.
Devido à surpreendente evolução, a hipótese de PG foi considerada. Desta forma, realizamos revisão sistemática na literatura especializada no tocante ao manejo terapêutico da afecção, buscando estabelecer um protocolo de tratamento de PG (Tabela 1).
| Base de Dados | Estratégia de Busca | Resultados | Casos Clínicos |
|---|---|---|---|
| PubMed | (pyoderma grangrenosum) AND (breast) | 81 | 66 |
| Lilacs | (pyoderma grangrenosum) AND (breast) | 3 | 3 |
| SciELO | (pyoderma grangrenosum) AND (breast) | 2 | 2 |
| Total | 86 | 71 |
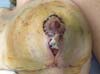
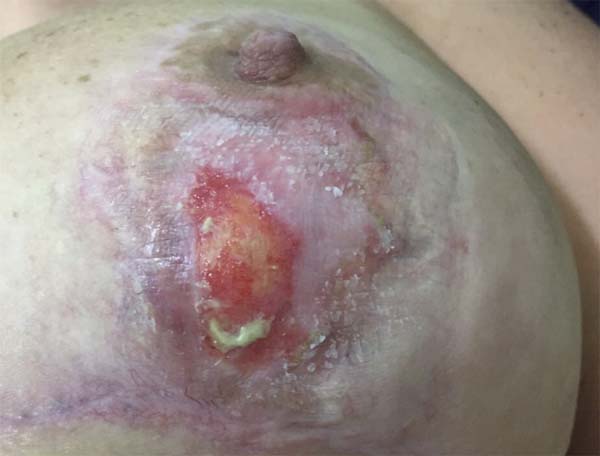
Iniciamos tratamento de primeira linha com corticoterapia oral e tópica. Iniciada prednisona 60 mg/dia por 7 dias, 40 mg/dia da mesma por mais 7 dias, seguido de 20 mg/dia por mais 7 dias, e por fim 10 mg/dia por quatro dias, terminando com 10 mg/dia em dias alternados, completando 28 dias de tratamento (Figura 3).
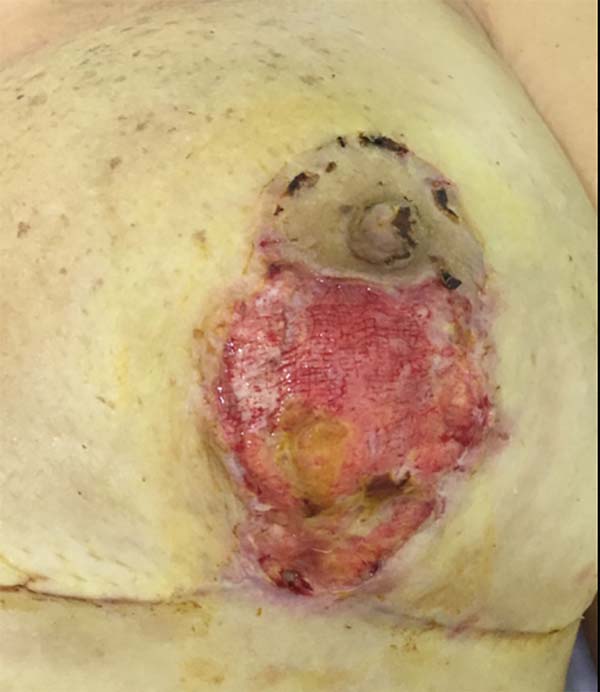
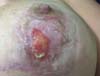
O tratamento tópico adotado compreendeu uso diário de fludroxicortida 0,125 mg/g (Drenison®), mantidos do início da terapêutica oral até a estruturação da cicatriz, que ocorreu ao fim do 2º mês PO, cerca de 20 dias após fim de corticoterapia oral (Figura 4). A paciente apresentou evolução favorável, com fechamento completo das lesões após o período de tratamento de um mês. A Figura 5 mostra o no 3º mês PO.
DISCUSSÃO
O PG se apresenta como complicação devastadora tanto para o paciente como para o cirurgião plástico, acarretando em questionamentos sobre as condições técnicas do procedimento cirúrgico realizado12. A inexistência de uma exame complementar que ratifique o diagnóstico do PG associado aos achados inespecíficos no estudo histopatológico, impõe obrigatoriedade sobre o conhecimento clínico desta afecção, para que possa se estabelecer a suspeita diagnóstica1,2,4.
Em relação ao tratamento, o objetivo é limitar a destruição tecidual, promover a cura da ferida e obter um bom resultado estético. Desbridamentos e realização de enxertos de pele são contraindicados3-5.
A terapia com corticosteroides sistêmicos é o método mais efetivo para o tratamento do PG, sendo o tratamento de primeira linha. As doses imunossupressoras são necessárias na maioria dos casos, com cerca de 100-200 mg/dia de prednisolona ou 60-80 mg/dia de prednisona4,6,7.
Alternativamente, a ciclosporina, em doses em torno de 6-10 mg/kg/dia, pode produzir melhora significativa com cicatrização das lesões em períodos entre 1 e 3 meses, sendo bem indicada para uma minoria de pacientes que não respondem a corticoterapia7,8.
Inibidores do TNF-alfa, como o infliximabe, vêm sendo utilizados com bons resultados em pacientes que se beneficiam com o uso dessa droga por suas comorbidades10,12.
A oxigenoterapia hiperbárica pode estar indicada em pacientes que não toleram ou não respondem a altas doses de corticoides sistêmicos, contudo, o resultado terapêutico mostra-se menos eficaz, como demostrados em algumas séries de casos11. A terapêutica tópica está indicada como complemento da sistêmica, e isoladamente, em casos muito selecionados e de menor gravidade, sendo os corticoesteroides as drogas de eleição6,7,11.
A antibioticoterapia não está respaldada para os casos de PG, como demonstrado em todas as séries estudadas, de forma que não há benefícios clínicos do uso de antimicrobianos nestes pacientes7,9.
Em relação a cirurgias plásticas futuras, o paciente deverá ser orientado sobre as chances de recorrência do PG, devendo este ponto ser bem explicitado no Termo de Consentimento Esclarecido a ser assinado pelo mesmo. Recomenda-se um longo follow-up com médico reumatologista, que deverá rastrear outras afecções autoimunes7,9,12.
COLABORAÇÕES
|
FFGO |
Concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo. |
|
MF |
Realização das operações e/ou experimentos. |
|
AMNG |
Realização das operações e/ou experimentos. |
|
OSF |
Realização das operações e/ou experimentos. |
|
MRM |
Realização das operações e/ou experimentos. |
|
EGC |
Aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos. |
|
OS |
Aprovação final do manuscrito. |
REFERÊNCIAS
1. Binus AM, Qureshi AA, Li VW, Winterfield LS. Pyoderma gangrenosum: a retrospective review of patient characteristics, comorbidities and therapy in 103 patients. Br J Dermatol. 2011;165(6):1244-50. PMID: 21824126 DOI: http://dx.doi.org/10.1111/j.1365-2133.2011.10565.x
2. Wollina U. Pyoderma gangrenosum--a review. Orphanet J Rare Dis. 2007;2:19. DOI: http://dx.doi.org/10.1186/1750-1172-2-19
3. Bittencourt Mde J, Soares LF, Lobato LS, Mançano AD, Leandro HS, Fonseca DM. Multiple cavitary pulmonary nodules in association with pyoderma gangrenosum: case report. An Bras Dermatol. 2012;87(2):301-4. DOI: http://dx.doi.org/10.1590/S0365-05962012000200018
4. Suárez-Pérez JA, Herrera-Acosta E, López-Navarro N, Vilchez-Márquez F, Prieto JD, Bosch RJ, et al. Pioderma gangrenoso: Presentación de 15 casos y revisión de la literatura. Actas Dermosifiliogr. 2012;103(2):120-6. DOI: http://dx.doi.org/10.1016/j.ad.2011.04.010
5. Meyer TN. Pioderma Gangrenoso: Grave e Mal Conhecida Complicação da Cicatrização. Rev Bras Cir Plást. 2006;21(2):120-4.
6. Santos M, Talhari C, Rabelo RF, Schettini APM, Chirano CA, Talhari S. Pioderma gangrenoso - apresentação clínica de difícil diagnóstico. An Bras Dermatol. 2011;86(1):153-6. DOI: http://dx.doi.org/10.1590/S0365-05962011000100025
7. Azulay RD, Azulay LA. Dermatologia. 5ª ed. Rio de Janeiro: Guanabara Koogan; 2011.
8. Fraga JCS, Souza VL, Valverde RV, Gamonal A. Pioderma gangrenoso: apresentação atípica. An Bras dermatol. 2006;81(5 Supl 3):S305-8. DOI: http://dx.doi.org/10.1590/S0365-05962006000900012
9. Souza CS, Chiossi MPV, Takada MH, Foss NT, Roselino AMF. Pioderma gangrenoso: casuística e revisão de aspectos clínico-laboratoriais e terapêuticos. An Bras Dermatol. 1999;74(5):465-72.
10. Konopha CL, Padulla GA, Ortiz MP, Beck AK, Bitencourt MR, Dalcin DC. Pioderma Gangrenoso: um Artigo de Revisão. J Vasc Bras. 2013;12(1):25-33. DOI: http://dx.doi.org/10.1590/S1677-54492013000100006
11. Coelho LF, Correia FG, Ottoni FA, Santos FPST, Pereira LB, Lanna CCD. Pioderma gangrenoso: um desafio para o reumatologista. Rev Bras Reumatol. 2009;49(3):315-20. DOI: http://dx.doi.org/10.1590/S0482-50042009000300013
12. Graças AM, Alecrim ES, Lyon S. Pioderma gangrenoso: evidências clínicas e características. Rev Med Minas Gerais. 2016;26:e-1790.
1. Hospital São Lucas, Serviço de Cirurgia
Plástica Osvaldo Saldanha, Santos, SP, Brasil.
2. Sociedade Brasileira de Cirurgia Plástica, São
Paulo, SP, Brasil.
Autor correspondente: Francisco Felipe Góis de Oliveira, Av. Ana Costa, 146 conjunto 1201 - Vila Matias - Santos, SP, Brasil. CEP 11060-000. E-mail: felipegoismd@gmail.com
Artigo submetido: 19/10/2017.
Artigo aceito: 5/9/2018.
Conflitos de interesse: não há.






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter