
Case Report - Year 2017 - Volume 32 -
Hiperplasia estromal pseudoangiomatosa: caso raro em menina de 11 anos
Pseudoangiomatous stromal hyperplasia: rare case in an 11-year-old girl
RESUMO
A Hiperplasia Estromal Pseudoangiomatosa (PASH) é uma doença benigna caracterizada pela proliferação excessiva de fibroblastos e miofibroblastos, podendo levar a um crescimento mamário importante. A apresentação é rara, em especial ocasionando necessidade de mastectomia em pacientes jovens. O estudo apresentou o relato de caso raro de uma paciente de 11 anos de idade, com hipertrofia mamária de rápida progressão, com necessidade de mastectomia e posteriormente mamoplastia de aumento para completa reinserção social.
Palavras-chave: Mama; Mamoplastia; Mastectomia; Criança.
ABSTRACT
Pseudoangiomatous stromal hyperplasia is a benign disease characterized by excessive proliferation of fibroblasts and myofibroblasts, which can lead to significant breast growth. The presentation is rare, especially among young women and cases requiring mastectomy. This report describes a rare case of an 11-year-old female patient with rapidly progressing mammary hypertrophy, who needed mastectomy and then mammoplasty for complete social integration.
Keywords: Breast; Mammoplasty; Mastectomy; Child
A Hiperplasia Estromal Pseudoangiomatosa (PASH) das mamas foi descrita inicialmente por Vuitch, em 1986, como uma doença benigna do estroma mamário, caracterizada histologicamente pela proliferação de fibroblastos e miofibroblastos maduros com formação de fendas simulando canais vasculares1. O mecanismo exato da proliferação tecidual é desconhecido, mas há evidências que sugerem estar relacionado à resposta exacerbada de miofibroblastos ao estímulo hormonal endógeno ou exógeno, em especial à progesterona1-5.
A apresentação clínica varia desde achados microscópicos incidentais focais em até 6,4% das biópsias de mama suspeitas de malignidade, podendo também ser encontrado como nódulo evidente ao exame clínico e mamográfico2,6,7. A forma tumoral, com crescimento rápido das mamas, é rara. Incide principalmente na pré-menopausa e na pós-menopausa em uso de terapia hormonal. Não há associação com câncer de mama.
Na maior parte dos casos, pacientes são curadas com a nodulectomia com margens, porém a taxa de recorrência varia de 7 a 22% dos casos4. Há poucos casos de PASH nodular descritos na literatura, com apenas quatro relatos em pacientes menores que 18 anos8,9. A paciente mais jovem a necessitar de mastectomia, após recorrência, possuía 12 anos9.
O objetivo do estudo é descrever o caso de menina de 11 anos com PASH gigante e sua abordagem terapêutica.
RELATO DE CASO
Paciente de 11 anos e 6 meses, com história de crescimento mamário excessivo nos últimos 3 meses. Anteriormente ao início da queixa, a criança apresentava evolução puberal normal, com broto mamário pouco desenvolvido. Referia dor nas mamas e na região da coluna cervical e torácica, utilizando membros superiores para auxiliar sua sustentação. Encontrava-se no período pós-menarca há 4 meses. Negava antecedentes pessoais ou histórico familiar de câncer de mama.
Ao exame, a paciente apresentava mamas de crescimento anômalo, simétrico, com presença de grandes vasos venosos, ingurgitados e placa areolopapilar de diâmetro aumentado. Observava-se cifose torácica acentuada pelo peso excessivo das mamas. À palpação, apresentava mamas de consistência aumentada, homogênea, sem nódulos palpáveis e sem linfonodomegalia axilar (Figura 1). Ultrassonografia de mamas, bioquímica e perfil hormonal revelaram-se dentro dos limites da normalidade. Paciente foi avaliada pela equipe da mastologia e liberada para cirurgia.
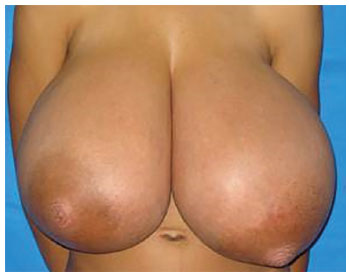
Figura 1. Paciente 11 anos com mamas de consistência aumentada, homogênea, sem nódulos palpáveis e sem linfonodomegalia axilar.
Inicialmente, a programação cirúrgica proposta para a paciente seria realizar mamoplastia redutora, porém, durante o intraoperatório observou-se que o tecido mamário apresentava aspecto anômalo, difusamente infiltrado, branco-acinzentado e fibroelástico, sem planos de clivagem. Optou-se por realizar exérese completa do parênquima mamário e sua pele adjacente, através da incisão em "T" invertido, com enxertia da placa areolopapilar. Foi locado dreno a vácuo no subcutâneo bilateralmente.
A paciente apresentou boa evolução, com retirada do curativo de Brown e dreno a vácuo no quarto dia pós-operatório e total integração do enxerto. Resultados estéticos da cicatriz foram bons e a paciente apresentou-se satisfeita. Houve melhora completa dos sintomas de dor em mamas e na região dorsal, além de melhora na qualidade de vida.
As peças foram submetidas a exame de congelação na sala de operação, sem evidência de malignidade, apresentando apenas hipertrofia com hiperplasia. O estudo anatomopatológico confirmou ausência de malignidade, com mama direita pesando 2820 g e mama esquerda 3050 g. Realizado estudo imunohistoquímico que evidenciou perfil compatível com PASH bilateral.
Após o terceiro ano de pós-operatório, e completo desenvolvimento puberal, a paciente começou a se queixar da ausência de tecido mamário, nesse momento não mais compatível com a idade, levando novamente a prejuízo à qualidade de vida, e desejo de aumento mamário (Figura 2).
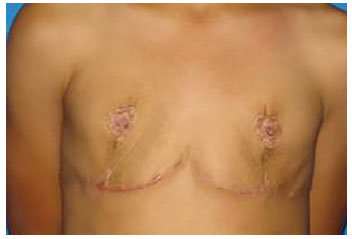
Figura 2. Pós-operatório de mastectomia.
Optou-se pela realização de mamoplastia de aumento com colocação de prótese mamária. Foi realizada incisão inframamária, com colocação do implante submuscular, 235 ml de Perfil Alto Redondo. Apresentou boa evolução no pós-operatório, não havendo intercorrências, e paciente se mostrando bastante satisfeita no pós-operatório imediato e tardio de 6 meses (Figuras 3 e 4).
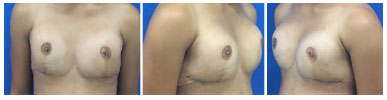
Figura 3. Pós-operatório de mamoplastia - 2 semanas.
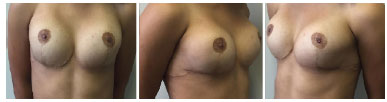
Figura 4. Pós-operatório de mamoplastia - 6 meses.
O responsável legal da paciente assinou o Termo de Consentimento Livre e Esclarecido, aceitando a participação no estudo.
DISCUSSÃO
Apesar de não haver causa definida para a PASH, a resposta proliferativa de miofibroblastos a hormônios endógenos e exógenos parece representar fator importante da patologia, pois é mais comumente diagnosticada em mulheres jovens pré-menopausa ou mulheres pós-menopausa em uso de reposição hormonal1-4. Essas pacientes costumam apresentar nódulo palpável e indolor que simula fibroadenoma10,11.
Até o momento, o diagnóstico de PASH é realizado apenas por biópsia excisional por cirurgia. A biópsia aspirativa por agulha fina costuma falhar no fornecimento de material a ser analisado e permitir o diagnóstico1,2,12.
A excisão local com margens amplas é o tratamento recomendado5. Porém, em casos com envolvimento difuso do parênquima ou recorrência da doença, pode ser necessário realizar a mastectomia3. Recorrências foram relatadas em 7-22% dos caso4. A PASH não é considerada uma lesão pré-maligna e tem prognóstico excelente9. Massas de crescimento rápido nas mamas de adolescentes devem levantar suspeita de PASH e o diagnóstico diferencial é feito com angiossarcoma de baixo grau, tumor filoides e fibroadenoma2,6. No referido caso, no momento da cirurgia não havia qualquer possibilidade de ressecção parcial, visto que qualquer tentativa de incisar o tecido mamário gerava intenso sangramento.
A apresentação com aumento difuso e rápido da mama é rara. Poucos casos foram relatados em pacientes menores de 18 anos na literatura, especialmente pacientes com PASH gigante em que foi necessária a mastectomia bilateral. Neste caso, a não reparação imediata com implantes e expansões justifica-se pela idade da criança (11 anos), evitando um desconforto psicossocial, já que as meninas da sua idade não costumam apresentar desenvolvimento mamário importante.
CONCLUSÃO
A Hiperplasia Estromal Pseudoangiomatosa gigante tumoral deve ser considerada em adolescentes que apresentam rápido crescimento da mama. A nodulectomia com margens é o tratamento de escolha na forma tumoral da lesão, porém há casos nos quais é necessário realizar mastectomia. No caso apresentado, a mastectomia e reconstrução mamária tardia com implante mostraram-se modalidades terapêuticas efetivas, respectivamente, na cura e reabilitação de paciente jovem portadora de quadro difuso de hiperplasia pseudoangiomatosa gigante das mamas num seguimento de 5 anos.
COLABORAÇÕES
RAT Redação do manuscrito ou revisão crítica de seu conteúdo.
MSN Aprovação final do manuscrito; concepção e desenho do estudo.
ALC Realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
MMAS Realização das operações e/ou experimentos.
HRP Redação do manuscrito ou revisão crítica de seu conteúdo.
LMF Aprovação final do manuscrito.
REFERÊNCIAS
1. Vuitch MF, Rosen PP, Erlandson RA. Pseudoangiomatous hyperplasia of mammary stroma. Hum Pathol. 1986;17(2):185-91. PMID: 3949338 DOI: http://dx.doi.org/10.1016/S0046-8177(86)80292-1
2. Ibrahim RE, Sciotto CG, Weidner N. Pseudoangiomatous hyperplasia of mammary stroma. Some observations regarding its clinicopathologic spectrum. Cancer. 1989;63(6):1154-60. PMID: 2917318 DOI: http://dx.doi.org/10.1002/1097-0142(19890315)63:6<1154::AID-CNCR2820630619>3.0.CO;2-Q
3. Powell CM, Cranor ML, Rosen PP. Pseudoangiomatous stromal hyperplasia (PASH). A mammary stromal tumor with myofibroblastic differentiation. Am J Surg Pathol. 1995;19(3):270-7. PMID: 7872425 DOI: http://dx.doi.org/10.1097/00000478-199503000-00004
4. Lee JS, Oh HS, Min KW. Mammary pseudoangiomatous stromal hyperplasia presenting as an axillary mass. Breast. 2005;14(1):61-4. DOI: http://dx.doi.org/10.1016/j.breast.2004.09.013
5. Rosen PP. Benign mesenchymal neoplasms. In: Rosen PP, ed. Rosen's Breast Pathology. 3rd ed. Philadelphia: Lippincott Williams & Wilkins; 2009. p. 829-901.
6. Salemis NS. Giant tumoural pseudoangiomatous stromal hyperplasia of the breast in the adolescence. ANZ J Surg. 2011;81(6):469-70. DOI: http://dx.doi.org/10.1111/j.1445-2197.2011.05774.x
7. Degnim AC, Frost MH, Radisky DC, Anderson SS, Vierkant RA, Boughey JC, et al. Pseudoangiomatous stromal hyperplasia and breast cancer risk. Ann Surg Oncol. 2010;17(12):3269-77. DOI: http://dx.doi.org/10.1245/s10434-010-1170-5
8. Gow KW, Mayfield JK, Lloyd D, Shehata BM. Pseudoangiomatous stromal hyperplasia of the breast in two adolescent females. Am Surg. 2004;70(7):605-8. PMID: 15279183
9. Singh KA, Lewis MM, Runge RL, Carlson GW. Pseudoangiomatous stromal hyperplasia. A case for bilateral mastectomy in a 12-year-old girl. Breast J. 2007;13(6):603-6. DOI: http://dx.doi.org/10.1111/j.1524-4741.2007.00499.x
10. Virk RK, Khan A. Pseudoangiomatous stromal hyperplasia: an overview. Arch Pathol Lab Med. 2010;134(7):1070-4. PMID: 20586640
11. Baker M, Chen H, Latchaw L, Memoli V, Ornvold K. Pseudoangiomatous stromal hyperplasia of the breast in a 10-year-old girl. J Pediatr Surg. 2011;46(8):e27-31. DOI: http://dx.doi.org/10.1016/j.jpedsurg.2011.04.063
12. Deniz S, Vardar E, Öztürk R, Zihni İ, Yaǧcı A, Taşlı F. Pseudo-angiomatous stromal hyperplasia of the breast detecting in mammography: case report and review of the literature. Breast Dis. 2014;34(3):117-20. DOI: http://dx.doi.org/10.3233/BD-130360
Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil
Instituição: Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil.
Autor correspondente:
Rafael Alves Tumeh
Rua Borges Lagoa, 512 - Vila Clementino
São Paulo, SP, Brasil CEP 04038-000
E-mail: rafaeltumeh@gmail.com
Artigo submetido: 12/4/2016.
Artigo aceito: 23/4/2017.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter