

Articles - Year 2003 - Volume 18 -
Úlceras Complexas por Radionecrose - Fisiopatologia, Diagnóstico e Tratamento
Complex Ulcers due to Radionecrosis - Pathophysiology, Diagnosis and Treatment
RESUMO
Os autores apresentam estudo a respeito da fisiopatologia das feridas complexas determinadas por radioterapia, descrevendo seus aspectos clínicos e anatomopatológicos.
Na seqüência, apresentam seis casos nos quais a lesão se desenvolveu e o tratamento clínico-cirúrgico es lecido.
Palavras-chave: Úlceras complexas; radionecrose
ABSTRACT
The authors present a study on the pathophysiology of complex wounds induced by radiotherapy, describing their clinical aspects and histopathological findings. They go on to present six cases in which the lesion developed, and the clinical and surgical treatment established.
Keywords: Complex ulcers; radionecrosis
A radioterapia (rxt) vem alcançando a cada dia importância maior no tratamento das neoplasias malignas. O padrão ouro do método é atuar nos tecidos neoplásicos inibindo o desenvolvimento do câncer sem comprometer as áreas vizinhas(1).
Quando ocorrem complicações, estas podem se apresentar com vários graus de gravidade sobre a pele, tecido subcutâneo, músculos, vasos e ossos com expressão clínica que varia desde o eritema cutâneo até necroses em grande profundidade e extensão, que exigem reparo apropriado.
FISIOPATOLOGIA DA RADIOLESÃO
As lesões causadas por rxt nos tecidos foram classificadas pela RTOG (Radiation Therapy Oncology Group)(2) em morbidades aguda e tardia.
A morbidade aguda sobre a pele pode ser classificada entre graus de 0 a IV, sendo as principais alterações encontradas: eritema folicular, descamação úmida e seca, edema, chegando até a hemorragia e necrose, condição encontrada nas lesões mais graves (grau IV). A resposta varia de acordo com a quantidade de raios, tempo e programação da exposição e condições clínicas do doente.
As lesões histológicas iniciam-se com redução das mitoses na camada basal e edema celular e, na fase tardia, levam a atrofia, telangectasia e ulceração(3).
As alterações são interdependentes, particularmente as vasculares, que geram lesões indiretas em todos os outros tecidos e são marcantes na fase tardia, expressando-se com espessamento e calcificação das paredes vasculares.
Nos outros tecidos, observamos fibrose da gordura subcutânea, esteatonecrose, retardo no crescimento ósseo, dor óssea, osteorradionecrose, fraturas patológicas e sarcoma osteogênico. Os músculos estriados sofrem distúrbio metabólico reversível alguns dias após a irradiação e a lesão tardia se deve a danos angiomesenquimais, levando à insuficiência vascular, proliferação do colágeno e estrangulação nervosa.
PACIENTES E MÉTODOS
Foram estudados 6 casos de radionecrose no período de julho de 1999 até julho de 2001, tratados nas Unidades I e II do Instituto Nacional de Câncer, por equipe multidisciplinar composta de cirurgiões oncológicos, plásticos, oncologistas clínicos, radioterapeutas e enfermeiros. Em todos os casos, foi excluída recidiva tumoral com exame histopatológico antes da realização da reconstrução.
CASO 1
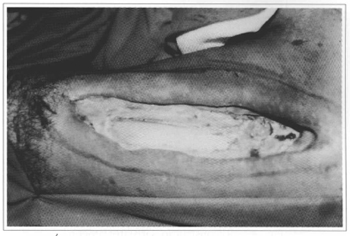
Fig. 1 - Área de radionecrose em face anterior da coxa. Marcada área do desbridamento com margem adequada.
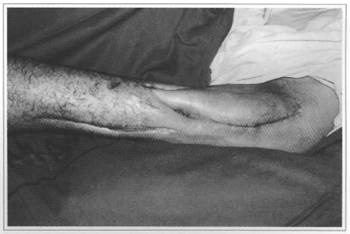
Fig. 2 - Reconstrução realizada com sucesso. Note-se a saída de secreção pelos bordos da ferida.
CASO 2
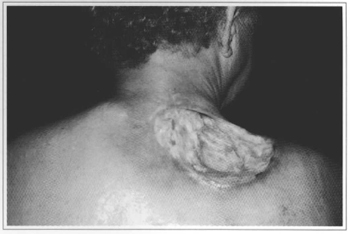
Fig. 3 - Detalhe do defeito mostrando extensa lesão tecidual e profundidade.
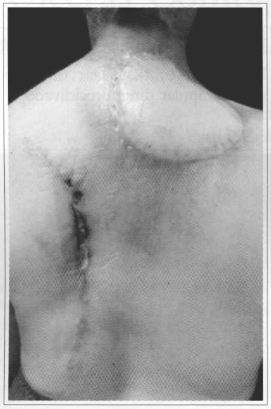
Fig. 4 - Reconstrução satisfatoriamente realizada.
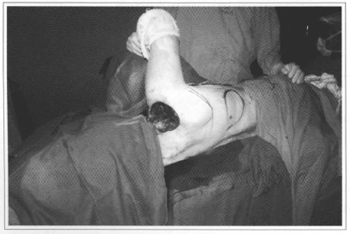
Fig. 5 - Defeito após ressecção da recidiva e marcação do retalho.
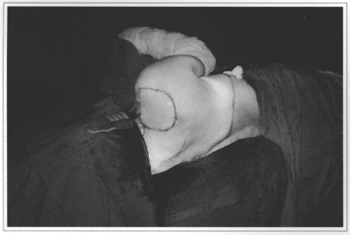
Fig. 6 - Reconstrução realizada com adequada cobertura do defeito.
CASO 3
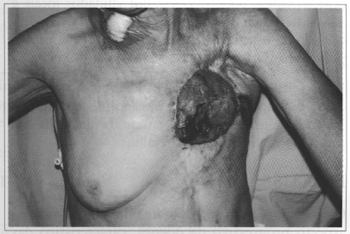
Fig. 7 - 1º dia de pós-operatório, reconstrução com retalho de músculo grande dorsal.
CASO 4
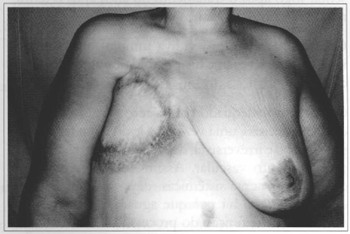
Fig. 8 - Resultado tardio da reconstrução com retalho de grande omento e enxerto de pele.
CASO 5
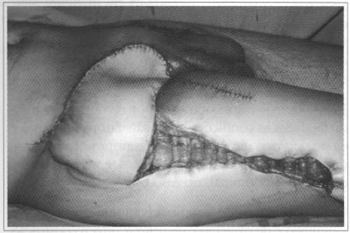
Fig. 9 - Resultado imediato - reconstrução com retalho miocutâneo de tensor da fáscia lata.
CASO 6
TRATAMENTO CIRÚRGICO DAS LESÕES DECORRENTES DA RADIOTERAPIA
A participação do cirurgião plástico é solicitada quando se estabelecem lesões de Grau IV (RTOG), com a formação de feridas complexas(4).
O tratamento inicia-se com desbridamento, biópsia e programação da reconstrução. O momento ideal para a reconstrução deve ser julgado individualmente. Quando há estrutura nobres expostas ou quando as condições locais são extremamente favoráveis (feridas limpas, não infectadas), deve ser imediato.
Na opção por reconstrução tardia, pode-se usar recursos como câmara de oxigênio hiperbárico no intuito de melhorar as condições locais das lesões, por promoção de angiogênese e fibroplasia, conforme experiência de alguns autores(5).
O desbridamento deve incluir o tecido necrosado e ósseo envolvido com margem de 3 a 5 cm(4). Este deve limitar-se às áreas clinicamente suspeitas de desvitalização. Essas margens podem ser ampliadas em casos de sugestão clínica de infecção.
É recomendada coleta de amostras para cultura e antibiograma como rotina.
O exame histopatológico da ferida é imprescindível para assegurar erradicação da neoplasia primária e para excluir neoplasia secundária à irradiação.
As lesões anatomopatológicas descritas levam a uma insuficiência vascular dos tecidos, o que se manifesta num período de até 4 a 6 meses após a irradiação, devendo a reconstrução, baseada neste fato, utilizar tecidos bem vascularizados, como retalhos musculares, miocutâneos ou microcirúrgicos. Quando não estão envolvidas estruturas nobres e não havendo exposição óssea, pode-se optar por cuidados locais e auto-enxertia de pele, considerando-se sempre a dificuldade de integração da enxertia cutânea em áreas pobremente vascularizadas.
Na escolha do retalho, a proposta deverá ser por tecidos a distância do campo irradiado. A arteriografia pode ser de grande valia no estudo da qualidade dos pedículos vasculares desses retalhos.
DISCUSSÃO
Como se observa na revisão de literatura, devido ao aspecto progressivo da doença, característico das radiolesões, suas manifestações clínicas podem se apresentar logo após o tratamento ou anos após o término deste, como vimos nos casos 3, 4 e 6.
O caso 2 apresentou recidiva tumoral, mostrando a importância do exame histopatológico antes de se iniciar a reconstrução.
O momento adequado para a reconstrução pode ser de difícil decisão, uma vez que a lesão é um fenômeno progressivo e irreversível, dependente do grau de comprometimento vascular. Assim que se estabeleçam condições locais e sistêmicas, deve-se optar pela reconstrução; não há por que aguardar "evolução da necrose" ou "definição do processo". Casos como os 1 e 2, com grande quantidade de secreção na ferida e cultura positiva, foram tratados com cuidados locais após o desbridamento, aguardando-se melhores condições para reconstrução, uma vez que não apresentavam estruturas nobres expostas. Para tal, lançou-se mão de curativos especiais com hidrocolóides (caso 2) e câmara de oxigênio hiperbárico (caso 1).
Já nos outros casos, optou-se por reconstrução imediata, dadas as condições locais satisfatórias (casos 3 e 4) ou pela exposição de estruturas nobres, como cavidades pleural e mediastino, no caso 4, e vasos femorais e cavidade abdominal, no caso 6.
Com o objetivo de promover aumento do aporte sangüíneo e de oxigênio e de realizar uma reconstrução segura, a opção foi por retalhos musculares (musculocutâneos) na maioria dos casos, exceto nos casos 4 e 6, em que se optou por retalho de grande omento, procedimento de fácil execução e que promove, igualmente, melhora da qualidade dos leitos tratados pela incorporação de tecido plenamente vascularizado.
Confirmando o curso progressivo da radiolesão, o caso 1 apresentou evolução dramática e rápida: 7 meses após a reconstrução, mantinha secreção sugestiva de necrose tecidual pelos bordos da ferida, chegando a apresentar abscesso local. Confirmada a ausência de neoplasia pelo exame histopatológico, o paciente foi submetido novamente à câmara de oxigênio hiperbárico, mas apresentou fratura patológica do membro, devido à osteorradionecrose, tendo sido este desarticulado.
Todos os pacientes encontram-se em acompanhamento no Hospital por equipe multidisciplinar.
CONCLUSÃO
As complicações causadas pela radioterapia nos tecidos adjacentes às áreas programadas podem evoluir com comprometimento de estruturas nobres, gerando feridas complexas com evolução progressiva.
A reconstrução com tecido bem vascularizado é fundamental na estabilização dessas lesões complexas com o objetivo de otimizar as condições de cicatrização.
Oncologicamente deve-se observar o controle local do tumor primário, como condição "sine qua non" para o planejamento das reconstruções.
A precocidade da reconstrução é um princípio básico, visto que a necrose, uma vez determinada, tende a evoluir.
BIBLIOGRAFIA
1. Salvajoli, JV. Radioterapia em Oncologia. 1 ed. São Paulo: Medsi; 1994. p.43-66.
2. Murad AM, Katz A. Oncologia - Bases clínica do tratamento. 1 ed. Rio de Janeiro: Guanabara Koogan; 1996. p.43-57.
3. Berjis CC. Pathology of Irradiation: 1 ed. New York; 1971. p.146-84.
4. Mathes SJ, Nahai F. Reconstructive Surgery - Principles, Anatomy e Technique. 1 ed. New York: Churchill Livingstone; 1997. Volume I. p.161-253.
5. Ashamalla HL, Thom SR, Goldwein JW. Hyperbaric Oxygen Therapy for the treatment of Radiation-Induced Cancer Sequelae in Children. Cancer. 1996;77(11):2407-12.
I. Membro Especialista da SBCP, ex-residente do Serviço de Cirurgia Plástica e Microcirurgia Reconstrutiva do Instituto Nacional de Câncer.
II. Membro Titular da SBCP, Chefe do Serviço de Cirurgia Plástica e Microcirurgia Reconstrutiva do Instituto Nacional de Câncer.
Instituto Nacional de Câncer - Serviço de Cirurgia Plástica Reparadora e Microcirurgia
Endereço para correspondência:
Patrícia Breder de Barros
Pça. Cruz Vermelha, 23 - 8º andar
Rio de Janeiro - RJ - 20230-130
Fone: (21) 2506-6087


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter