

Original Article - Year 2016 - Volume 31 -
Dermatofibrosarcoma protuberans: série de 27 casos consecutivos
Dermatofibrosarcoma protuberans: a single series of 27 consecutive cases
RESUMO
INTRODUÇÃO: A dermatofibrosarcoma protuberans (DFSP) é um tumor maligno de baixo grau de partes moles caracterizado por infiltração local agressiva e propenso a recidiva local. Este estudo retrospectivo analisou resultados clínicos, taxas de recidiva e sobrevida após tratamento cirúrgico de DFSP.
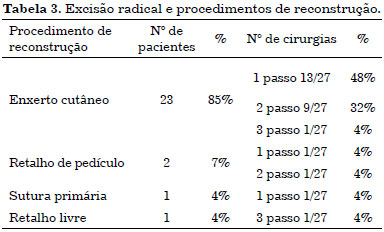
MÉTODOS: Pacientes submetidos a cirurgia para erradicação completa do tumor, e subsequente seguimento por exame clínico e vigilância ultrassonográfica de locais primários do tumor e linfonodos correspondentes para detectar recidiva local ou distante. A cirurgia, invariavelmente, incluiu grande excisão do tumor, seguida por procedimentos de reconstrução diferente como enxerto de pele em 23 casos (85%), retalho local em 2 pacientes (7.4%), retalho livre em 1 caso (4%), enquanto a principal sutura foi realizada apenas em um caso (4%).
RESULTADOS: Foi necessária segunda cirurgia em 9 casos (33%) para atingir margens livres mínimas de 2-3 cm. Outros tratamentos cirúrgicos foram utilizados, como cirurgia micrográfica de Mohs, ou terapias adjuvantes, como radioterapia e quimioterapia. Em nossa série de pacientes o intervalo livre de recidiva variou de 1 a 10 anos, com média de 6 anos. A recidiva local ocorreu em 3 pacientes (11%), e necessitou de outras excisões cirúrgicas extensas. Um total de 27 pacientes não desenvolveu metástase distante durante o seguimento.
CONCLUSÃO: A excisão extensa é efetiva para disponibilizar local confiável para controlar a doença, porém somente se limitadas por margens livres de 2-3 cm e confirmadas por patologista. A vigilância clinica e ultrassonografia durante o seguimento permite identificação precoce de eventuais recidivas locais e envolvimento de linfonodos.
Palavras-chave: Dermatofibrossarcoma; Retalhos de tecido biológico; Recidiva local de neoplasia; Seguimentos.
ABSTRACT
INTRODUCTION: Dermatofibrosarcoma protuberans (DFSP) is a rare low-grade malignant tumor of soft tissues characterized by aggressive local infiltration and propensity for local recurrence. This retrospective study analyzed clinical outcomes, recurrence and survival rates after surgical treatment of DFSP.
METHODS: Patients underwent surgery to complete eradicate tumor, and subsequently a close follow-up by clinical examination and ultrasounds surveillance of primary tumor site and corresponding lymph nodes, to detect local or distant recurrence. Surgery invariably included wide excision of tumor, followed by different reconstructive procedures as skin grafting in 23 cases (85%), local flap in 2 patients (7.4%), free flap in 1 case (4%), while primary closure was performed only in one case (4%).
RESULTS: Second surgery was needed in 9 cases (33%) to achieve minimum free-margins of 2-3cm. Other surgical treatments like Mohs Micrographic Surgery, or adjuvant therapies, like radio- or chemotherapy were not used. Free-recurrence lapse among this series of patients varied from 1 to 10 years, with a medium period of 6 years. Local recurrence occurred in 3 patients (11%), and required a further extended surgical excision. A total of 27 patients did not develop distance metastasis during the follow-up.
CONCLUSION: Extended excision is effective to provide a reliable local control of disease, but only if free margins limiting 2-3 cm is confirmed by pathologist. Clinical and ultrasound surveillance during close follow-up provide early detection of eventual local recurrence and of lymph nodes involvement.
Keywords: Dermatofibrosarcoma; Free tissue flaps; Neoplasm recurrence local; Follow-up studies.
A dermatofibrosarcoma protuberans (DFSP) foi descrita primeiramente por Taylor em 18901. Subsequentemente, Darrier e Ferrand2 relataram caso de dermatofribroma progressiva e recorrente. Hoffman3 foi o primeiro a descrever a tendência do tumor para desenvolver os nódulos protuberantes, e definir essa lesão como dermatofibrosarcoma protuberans.
Apesar de rara, a DFSP é o tumor estromal mais comum de origem cutânea4. Alguns estudos epidemiológicos têm relatado uma taxa média de incidência anual entre 0,8 e 4,5 de casos por um milhão de indivíduos5. Outros estudos demostraram que a DFSP têm uma alta taxa de incidência entre indivíduos com idade entre 20 e 50 anos6.
A DFSP é um tumor maligno de baixo grau constituindo menos de 0,1% de todas as malignidades7. Clinicamente é mascarado como tumor benigno, indolente no tronco e membros. A dermatofibrosarcoma precoce pode ser similar a uma queloide, uma placa ou nódulo endurecido assintomático, se não tratado torna-se firme, aumentado e ulcerada8.
Microscopicamente, estende-se além da avaliação das margens clínicas, espalhando-se localmente na derme, tecido subcutâneo e muscular. O tumor origina-se na derme camada da pele: progressivamente tende a envolver o panículo subcutâneo e estende-se diretamente ao longo do tecido mole local. Na presença de tumores de longa duração, tem sido observada invasão da fáscia subjacente, muscular e óssea9. Acredita-se que célula de origem na DFSP é a célula tronco da derme ou célula mesenquimal indiferenciada com características fibroblásticas, musculares e neurológicas.
Além disso, o exame físico, a ressonância magnética por imagem e a tomografia computadorizada pode ser útil na avaliação da área de extensão do tumor10. O primeiro marcador imunohistoquímico identificado para DFSP foi o antígeno CD34, que é expressado em até 90% dos casos9. Estudos anteriores têm relevado que o CD34 também é expresso por outros sarcomas e lesões fibrohistiocíticas benignas, incluindo tumores fibrosos solitários, fibroma esclerótico, fibromixoma acral superficial, dermatofibromas10.
Consequentemente, o CD34 pode ser considerado como um marcador não específico de DFSP9,10. Múltiplas teorias têm sido levantadas sobre a origem da DFSP, o principal fator etiológico em desenvolvimento da DFSP e a apresentação de diversos traumas anteriores, incluindo cicatrizes cirúrgicas, cicatrizes por trauma, queimaduras, radiodermites, pontos de aplicação de vacina, locais de linhas venosas centrais e picadas de inseto11-14. Alguns estudos relatam histórico de trauma em 13% dos casos13. A influência hereditária não foi identificada como significante.15
Uma translocação de cromossomo t (17;22) (q22;q13) foi identificada por Simon et al.16 como alteração citogenética de natureza distinta como responsável pelo desenvolvimento de DFSP. Tais anormalidades cromossômicas levam a uma superexpressão de fator de crescimento derivado de plaquetas (FCDP).
O comportamento biológico da DFSP é caracterizado por infiltração agressiva local, levando a propensão de recidiva17. De acordo com a literatura, a taxa de recidiva local para pacientes com DFSP submetidos a excisão local extensa do tronco varia de 0 a 21%17, apesar de ser mais comum na região da cabeça e pescoço, onde pode ocorrer em até 50-75%18. Estima-se que 80% das recidivas locais podem suceder dentro dos 3 primeiros anos após cirurgia primária19.
Apesar do comportamento agressivo no local, a DFSP raramente causa metástase na região dos linfonodos e viscerais. São relatadas metástase distante com taxas de 1% a 4%20, o óbito relacionado é mencionado por alguns autores21,22.
O tratamento padrão recomendado para DFSP é excisão extensa local da área acometida pelo tumor, incluindo fáscia subjacente e margens com tecido de aparência normal em todos os planos19. As recomendações atuais de margem cirúrgica é de pelo menos 2 cm, preferencialmente 3 cm de tecido sadio a partir da margem macroscópica do tumor com ressecção tridimensional que inclui pele, tecido subcutâneo, e fáscia subjacente15,17.
A cirurgia micrográfica de Mohs (CMM) ou excisão larga "Slow Mohs" (com cortes histopatológicos e reconstrução tardia para avaliação completa da circunferência periférica e margens profundas) parece ser o tratamento cirúrgico mais adequado para evitar recidiva local23.
A radioterapia administrada depois da cirurgia pode reduzir significativamente o risco de recorrência local em pacientes que apresentam ou são propensos a ter margens fechadas ou positivas24,25. Tem provado beneficio em radioterapia adjuvante no pós-operatório em tumores com excisão incompleta22.
O uso de radioterapia adjuvante é controverso, porém, alguns autores26 especulam uma associação entre o uso de radioterapia e alto grau de transformação, portanto um monitoramento cuidadoso é recomendado se realizado a radioterapia. A quimioterapia mostra benefício local em DFSP agressiva e sua eficácia é indefinida em doenças metastáticas18.
A superexpressão do FCDP, caracterizando DFSP, pode ser combatida por meio de terapia molecular direcionada. Essa terapia tem o objetivo de parar o crescimento do tumor pela oclusão da atividade do FCDP16. O mesilato imatinibe é um potente e seletivo inibidor de tirosina quinase com eficácia contra os receptores do FCDP26, além disso há relatos de induzir remissão completa ou parcial em pacientes com DFSP avançada ou recorrente26.
Esse inibidor é comumente utilizado para casos de DFSP que não podem ser removidos, recorrentes ou metastáticos.22 Apesar de não utilizado com frequência, há um numero crescente de evidencia sugerindo que a terapia adjuvante molecular direcionada pode ser benéfica25.
OBJETIVO
Este estudo investigou os resultados do tratamento cirúrgico para dermatofibrosarcoma protuberans.
MÉTODOS
Focamos em 27 casos consecutivos de DFSP tratados no Departamento de Cirurgia Plástica e Reconstrutiva na Universidade Padova de 2004 a 2014. Os dados foram coletados do Registro de Câncer de Veneto (Itália) e prontuários médicos.
Incluímos homens e mulheres admitidos em nossa instituição e também transferidos de outros serviços após excisão primária não radical.
Os critérios de exclusão foram diagnostico histológico incerto, dados de seguimento não disponível, idade quando o inicio do tumor foi registrado, porém esse dado não foi considerado uma variável limitante.
Relataram-se características dos pacientes, características histológicas, áreas anatômicas de incidência, tamanho da lesão primária, e abordagem terapêutica.
Utilizando seguimento cuidadoso, estudamos a percentagem de recidiva local e distante, sobrevida e óbito relacionado ao tumor.
Todos os pacientes realizaram monitoramento clinico e ultrassonográfico de local primário e correspondentes linfonodos.
RESULTADOS
Em nossa série, identificamos que os homens são afetados por DFSP com maior frequência do que as mulheres: 16 homens (59%) e 11 mulheres (41%) com razão de correspondência de 1,4/1. A idade variou de 5 a 70 anos, somente um caso pediátrico foi excluído, a média de idade dos pacientes foi de 48 anos, contudo dois picos de incidência são observados nas terceira e quinta décadas de vida (Tabela 1).
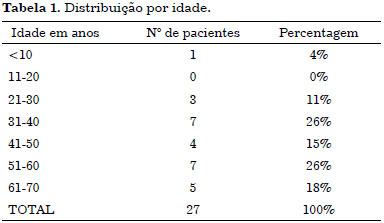
De 27 pacientes somente dois compareceram a consulta de retorno após realizar excisão primária em outro instituto.
Uma lesão multinodular elevada fixada a pele sobrejacente foi primariamente a característica clínica mais comum (96%). O tamanho inicial da lesão variou de 1 a 5 cm, cor amarelo esverdeado e consistência firme são características clinicas salientes na maioria dos casos. Cerca de metade dos pacientes, 13 (48%) apresentaram lesões confinadas ao longo do tronco anterior, o restante dos nódulos distribuíram-se no tronco posterior 6 (22%), e cabeça e pescoço 3 (11%), membros superiores 2 (7%) e membros inferiores 3 (11%) (Tabela 2).

Não foram relatadas lesões doloridas, nem outro sintoma com exceção de volume.Alguns pacientes reclamaram de questões estéticas.
No primeiro momento, todos os pacientes realizaram cirurgia. Excisão radical foi mandatória em 9 dos casos subsequentemente requerida segunda cirurgia para atingir extirpação completa do tumor. Dois pacientes necessitaram de maior ablação, mesmo após o intraoperatório a amostragem foi identificada como livre da doença pelo patologista.
Devido ao objetivo do tratamento ser excisão radical seguida de ausência recidiva no local, o esforço cirúrgico foi para ablação do tumor com margens seguras, portanto a extensão da margem removida na maioria dos instantes variou de 2-3 cm. A confirmação pelo patologista de excisão radical foi mandatória: a histopatologia dos espécimes removidas relevaram células fusiformes organizadas em padrão interligado e radiação a partir do ponto focal (Figura 1 and 2).
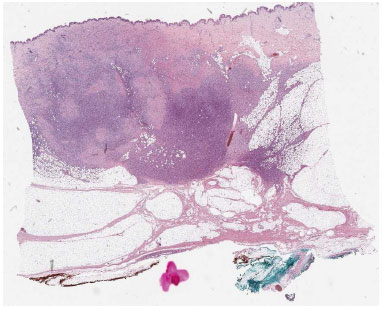
Figura 1. Visão panorâmica de dermatobibrosarcoma protuberans infiltrando a hipoderme em padrão de favo de mel.
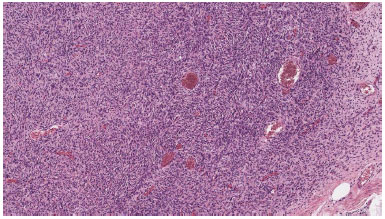
Figura 2. Em algumas áreas, a neoplasia celular são organizadas em paralelos alongados e fascículos estoriforme.
Os tumores celulares foram organizados em agrupamento compactos e nenhum dos tecidos da amostra ficou evidente cápsula perilesional (Figure 3). Figuras imunohistoquímicas, quando disponíveis, mostraram células positivas a CD34, negativa a S-100, desmina, EMA, ACML, MUC4, P53 (Figura 4).
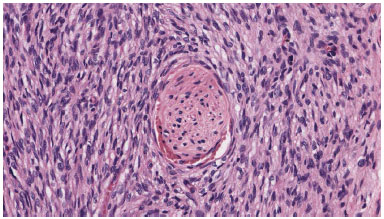
Figura 3. Neoplasmo é feito de célula fusiforme monomórfica que captura terminação nervosa.
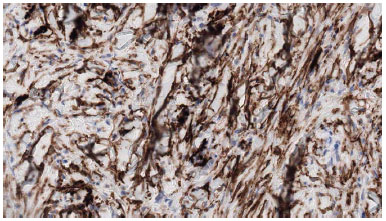
Figura 4. Células neoplásicas expressas em CD34.
A escada reconstrutiva depende diretamente do local de inicio do tumor e da extensão da excisão cirúrgica. As estratégias de reconstrução mais complexa ocorre ao longo de defeitos com maiores (Tabela 3).
Para excisão de massas bem definidas nossa escolha foi de sutura primária de pele, deixando linha de cicatriz simples e fácil de examinar causando inconveniente mínimo ao paciente. Quando as bordas neoplásicas não foram tão bem definidas ou necessitaram de segunda cirurgia para completar ressecção radical, o simples fechamento não foi uma opção viável.
As terapias oncológicas necessitaram de ressecção estendida, portanto o planejamento reconstrutivo foi considerado para solução apropriada como enxertos de pele e retalhos locais. Em particular o enxerto de pele permitiu o reparo de ressecções estendidas e ao mesmo tempo detectou eventual recidiva. Os retalhos locais foram aplicados para atingir melhor resultado estético e reparar áreas de articulação como ombro ou tornozelo.
Os procedimentos reconstrutivos incluíram: enxertos de espessura parcial 23 casos (85%), retalhos de pedículos em 2 pacientes (7,4%), retalho livre em um caso (retalho livre anterolateral da coxa) (3,7%). Em apenas um paciente (3,7%) a ferida foi suturada diretamente por aproximação primária das margens.
Todos os pacientes foram seguidos de visitas ambulatoriais com exames clínicos e ultrassonográficos no local de ocorrência do tumor. O pescoço, axila ou região inguinal (local primário, respectivamente) também foram examinadas para excluir o envolvimento de linfonodos.
Não foram detectadas metástases nos linfonodos durante o seguimento. Dos 27 pacientes estudados, 14/27 (52%) permaneceram livres de recidiva em período de 12 meses a 10 anos. A recorrência local ocorreu em 3 pacientes (11%), portanto realizaram segunda cirurgia, porém nenhum deles precisou de outra cirurgia como resultado da segunda recidiva.
De 27 pacientes, nenhum deles durante o seguimento desenvolve metástase distante, 100% dos pacientes permaneceram vivos durante o seguimento. Nenhum paciente foi submetido a radioterapia e quimioterapia adjuvante.
DISCUSSÃO
Os tumores de DFSP são caracterizados por extensão subclínica imprevisível e difundidos, portanto apresentam altas taxa de recidiva. O objetivo permanece a excisão completa das células tumorais com preservação máxima do tecido normal para manter a função e aparência estética aceitável. A necessidade de limpeza das margens na face criando defeitos potencialmente extensos de tecido são desafios na reconstrução. A patogenicidade da DFSP é independente de quatro fatores de riscos: localização primária da cabeça, recidiva após tratamento anterior, profundidade da invasão de tumor, grau atípico, mixóide ou diferenciação sarcomatosa histológica.
Tal número de variáveis pode explicar resultados tão diferentes apresentados na literatura. As taxas de 5 anos de cura de afecções que afetaram a área de cabeça e pescoço, tronco e membros tratadas com excisão longa relatada é de 25% a 50% e 80% a 100%, respectivamente. Isso poderia ser explicado pela tendência dos cirurgiões em aproximar as margens nos locais devido as questões de reconstrução.
Em nosso estudo de 10 anos, houve 59% de homens e 41% de mulheres correspondendo a distribuição relatada por outros autores1,27. O pico de idade da incidência foi observada na terceira década de vida: somente 15% eram mais jovens do que 30 anos, os restante, 85% eram mais velhos. Nossas observações concordam com a literatura1,26.
O tronco foi o local mais comum de DFSP em nossa série (68%), seguido por membros inferiores (15%), membros superiores (6%), e cabeça e pescoço (11%). Essa observação está de acordo com Taylor e Helwig1, e Burkhard et al.27. A DFSP ocorre com taxa de 2,6 casos por ano, essa taxa é maior do que relatada por Roses et al.21.
O aumento da incidência pode ser devido aos pacientes estarem atualmente melhor educados, mais conscientes em relação a saúde do que antes, e portanto eles frequentemente buscam aconselhamento medico para esse tumor mais do que no passado. Se o tumor é pequeno, a ferida pode ser geralmente fechada primariamente sem enxertia cutânea.
O enxerto cutâneo pode ser utilizado para fechar defeitos extensos após excisão radical. A taxa de recidiva é esperada a ser menor se o tumor é removido precocemente e com margens adequadas. Para providenciar resultados funcionais algumas vezes reconstruções mais complexas utilizando retalhos local e distante são necessárias quando áreas de articulação ou pressão estão envolvidas.
A confiança tanto com a técnica de ablação e cirurgia reconstrutiva de alta complexidade é necessária para atingir resultados satisfatórios, já que o reparo utilizando retalhos após excisão não radical levaria invariavelmente a recidiva difícil de detectar.
A taxa de recidiva como relatado por Parck e Tabah15 e Taylor e Helwig1 foi de 20.5% e 49%, respectivamente. Burkhardt et al.27 relataram taxa de recidiva de 33% entre os pacientes com DFSP que teve cirurgia inicial. Em uma série de 27 pacientes com DFSP realizada por McPeak et al.19, a taxa de recidiva foi 11,1%. Roses et al.21 relataram taxa de recidiva de 32% (41%) quando a margem removida foi de < 2 cm e 24% quando a margem removida excedeu 2 cm.
O tratamento em todas as instâncias consistiu com em excisão com remoção de margens de pele normal para margens macroscópicas e na biópsia para fáscia subjacente.
A taxa de recidiva em nossa série é menor quando comparado ao que relatou Taylor e Helwig1 e Roses et al.21 A razão para baixa taxa de recidiva em nosso estudo depende da ressecção de margens maiores.
Sutura de margens livres de doença leva a alta taxa de recidiva, como indicado por Roses et al21. Na literatura é relatada que 3 cm margem larga diminui significativamente de taxa de recidiva27. A cirurgia micrográfica de Mohs, que foca na ressecção com preservação precisa de tecidos normal, também mostra baixa taxa de recidiva23.
No presente estudo, nenhum dos pacientes tiveram envolvimento de linfonodo e esse achado é concordante com o que Taylor e Helwig que também não relataram qualquer metástase de linfonodo1. No estudo de McPeak et al.19 identificou-se que a metástase de linfonodo foi observada quando a dissecção inguinal e axilar foi realizada em continuidade com excisões de tumor primário: linfonodos clinicamente alongados não apresentaram evidencia de metástase em microscopia. Isso reforça o conceito que difusão linfática geralmente não ocorre nesses tumores.
Há poucas referências de padrão de radioterapia no gerenciamento da DFSP. No Ontario Cancer Institute, 19 pacientes de DFSP foram gerenciados por cirurgia e radiação como descrita por O'Sullivan et al.22: houve dois casos de recidiva local, realizando cirurgia de salvação.
Apesar da cirurgia ser o padrão ouro no tratamento, a radioterapia adjuvante em dose de 50-60 Gy é efetiva na prevenção de recrescimento local de DFSP seguido de resseção com margens positivas.
Chang et al.28 publicaram suas experiências no padrão de radioterapia em tratamento de DFSP: eles concluíram que a radioterapia pós-operatória pode reduzir a taxa de recidiva local em DFSP.
Em nosso estudo nenhum dos pacientes foram tratados com radioterapia. Isso foi possível devido a cirurgia radical, enquanto mantém as margens seguras, e a cooperação com patologistas.
O seguimento clínico cuidadoso e ultrassonográfico garante ausência de recidiva local.
CONCLUSÃO
Resultados de nossa série única confirmam que dermatofibrosarcoma protuberans comporta-se como infiltração de neoplasma. A terapia cirúrgica adequada deve ser direcionada a excisão radical extensa de lesão primária: ressecção devem ser estendida ao pelo menos 2-3 cm de margens ao redor e fáscia profunda subjacente deve ser incluída na espécime.
Em nosso estudo baixa taxa de recidiva sem qualquer caso de metástase distante confirmou eficácia de tratamento cirúrgico, mesmo sem RT pós-operatório.
Após o patologista confirmar margem cirúrgica livre de doença, um seguimento cuidadoso com visitas clínicas de 6 meses, tecidos moles e investigação de investigação de ultrassonografia de linfonodos são confiáveis para garantir vigilância oncológica efetiva.
COLABORAÇÕES
CC Redação do manuscrito ou revisão crítica de seu conteúdo.
TB Redação do manuscrito ou revisão crítica de seu conteúdo.
RS Análise e/ou interpretação dos dados.
FB Aprovação final do manuscrito.
REFERÊNCIAS
1. Taylor HB, Helwig EB. Dermatofibrosarcoma protuberans. A study of 115 cases. Cancer. 1962;15(4):717-25. DOI: http://dx.doi.org/10.1002/1097-0142(196207/08)15:4<717::AID-CNCR2820150405>3.0.CO;2-2
2. Darrier J, Ferrand M. Dermatofibromes progressifs et recidivants ou fibrosarcomes de la peau. Ann Dermatol Syphiligr (Paris). 1924;5:542-62.
3. Hoffman E. Ueber das Knollentribende fibrosarkm der haut (dermatofibrosarcoma protuberans). Dermatol Z. 1925;43:1-28.
4. Lemm D, Mügge LO, Mentzel T, Höffken K. Current treatment options in dermatofibrosarcoma protuberans. J Cancer Res Clin Oncol. 2009;135(5):653-65. PMID: 19205737
5. Chuang TY, Su WP, Muller SA. Incidence of cutaneous T cell lymphoma and other rare skin cancers in a defined population. J Am Acad Dermatol. 1990;23(2 Pt 1):254-6.
6. Sanmartín O, Llombart B, López-Guerrero JA, Serra C, Requena C, Guillén C. Dermatofibrosarcoma protuberans. Actas Dermosifiliogr. 2007;98(2):77-87.
7. Elgart GW, Hanly A, Busso M, Spencer JM. Bednar tumor (pigmented dermatofibrosarcoma protuberans) occurring in a site of prior immunization: immunochemical findings and therapy. J Am Acad Dermatol. 1999;40(2 Pt 2):315-7.
8. Lim EK, Lin VCH, Yu JT, Chang HC. Suprapubic Dermatofibrosarcoma Protuberans: Case Report and Literature Review. J Taiwan Urol Assoc. 2008;19(4):232-4.
9. Aiba S, Tabata N, Ishii H, Ootani H, Tagami H. Dermatofibrosarcoma protuberans is a unique fibrohistiocytic tumour expressing CD34. Br J Dermatol. 1992;127(2):79-84.
10. Kutzner H. Expression of the human progenitor cell antigen CD34 (HPCA-1) distinguishes dermatofibrosarcoma protuberans from fibrous histiocytoma in formalin-fixed, paraffin-embedded tissue. J Am Acad Dermatol. 1993;28(4):613-7. PMID: 7681857
11. Mbonde MP, Amir H, Kitinya JN. Dermatofibrosarcoma protuberans: a clinicopathological study in an African population. East Afr Med J. 1996;73(6):410-3.
12. Bashara ME, Jules KT, Potter GK. Dermatofibrosarcoma protuberans: 4 years after local trauma. J Foot Surg. 1992;31(2):160-5.
13. Tanaka A, Hatoko M, Tada H, Kuwahara M, Iioka H, Niitsuma K. Dermatofibrosarcoma protuberans arising from a burn scar of the axilla. Ann Plast Surg. 2004;52(4):423-5. PMID: 15084891
14. Argiris A, Dardoufas C, Aroni K. Radiotherapy induced soft tissue sarcoma: an unusual case of a dermatofibrosarcoma protuberans. Clin Oncol (R Coll Radiol). 1995;7(1):59-61.
15. Pack GT, Tabah EJ. Dermato-fibrosarcoma protuberans. A report of 39 cases. AMA Arch Surg. 1951;62(3):391-411.
16. Simon MP, Pedeutour F, Sirvent N, Grosgeorge J, Minoletti F, Coindre JM, et al. Deregulation of the platelet-derived growth factor B-chain gene via fusion with collagen gene COL1A1 in dermatofibrosarcoma protuberans and giant-cell fibroblastoma. Nat Genet. 1997;15(1):95-8. PMID: 8988177
17. Angouridakis N, Kafas P, Jerjes W, Triaridis S, Upile T, Karkavelas G, et al. Dermatofibrosarcoma protuberans with fibrosarcomatous transformation of the head and neck. Head Neck Oncol. 2011;3:5. DOI: http://dx.doi.org/10.1097/00000658-196711000-00011
18. Laskin WB. Dermatofibrosarcoma protuberans. CA Cancer J Clin. 1992;42(2):116-25.
19. McPeak CJ, Cruz T, Nicastri AD. Dermatofibrosarcoma protuberans: an analysis of 86 cases--five with metastasis. Ann Surg. 1967;166(5):803-16. PMID: 4964386
20. Rutgers EJ, Kroon BB, Albus-Lutter CE, Gortzak E. Dermatofibrosarcoma protuberans: treatment and prognosis. Eur J Surg Oncol. 1992;18(3):241-8. PMID: 1607035
21. Roses DF, Valensi Q, LaTrenta G, Harris MN. Surgical treatment of dermatofibrosarcoma protuberans. Surg Gynecol Obstet. 1986;162(5):449-52. PMID: 3704900
22. O'Sullivan B, Catton C, Bell R, Fornasier V, Cummings B, Quirt I, et al. Treatment outcome in dermatofibrosarcoma protuberans referred to a radiation oncology practice. Int J Radiat Oncol Biol Phys. 1995;32(Suppl 1):289.
23. Johnson-Jahangir H, Ratner D. Advances in management of dermatofibrosarcoma protuberans. Dermatol Clin. 2011;29(2):191-200.
24. Williams N, Morris CG, Kirwan JM, Dagan R, Mendenhall WM. Radiotherapy for dermatofibrosarcoma protuberans. Am J Clin Oncol. 2014;37(5):430-2. PMID: 23388563
25. Sun LM, Wang CJ, Huang CC, Leung SW, Chen HC, Fang FM, et al. Dermatofibrosarcoma protuberans: treatment results of 35 cases. Radiother Oncol. 2000;57(2):175-81. PMID: 11054521
26. McGregor JK. Role of surgery in the management of dermatofibrosarcoma protuberans. Ann Surg. 1961;154:255-8. PMID: 13773978
27. Burkhardt BR, Soule EH, Winkelmann RK, Ivins JC. Dermatofibrosarcoma protuberans. Study of fifty-six cases. Am J Surg. 1966;111(5):638-44.
28. Chang CK, Jacobs IA, Salti GI. Outcomes of surgery for dermatofibrosarcoma protuberans. Eur J Surg Oncol. 2004;30(3):341-5.
University of Padua, Padova, Italy
Instituição: University of Padua, Italy.
Autor correspondente:
Cesare Cappellina
Via 8 Febbraio - 2
Padova, Italy. CEP 35122
E-mail: cesarecappellina@gmail.com
Artigo submetido: 15/4/2016.
Artigo aceito: 27/4/2016.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter