

Original Article - Year 2014 - Volume 29 -
Retalho autólogo de grande omento como estrutura cirúrgica de reparo extraperitoneal. Estudo experimental comparativo, pareado e controlado de suas propriedades adaptativas
The autologous greater omental flap as a structure for extraperitoneal surgical repair: A comparative, paired, and controlled experimental study of its adaptive properties
RESUMO
INTRODUÇÃO: O grande omento vem sendo utilizado como estrutura de reparo desde o século XIX e a partir do século XX tem sido descrito, em meio extraperitoneal, para o tratamento de diversas afecções em várias especialidades cirúrgicas. Apesar de amplamente estudado a partir da década de 1960, não há descrição de estudos comparativos sobre o seu retalho em meio extra peritoneal. O objetivo do presente estudo foi analisar as características adaptativas do grande omento em meio extra peritoneal para identificar a real aplicabilidade cirúrgica desta estrutura.
MÉTODOS: Estudo experimental comparativo, pareado e controlado de 20 amostras teciduais de ratos (Rattus norvegicus) fêmeas obesas, irmãs da linhagem Sprague-Dawley. De cada animal foram analisados e comparados, macroscopicamente e microscopicamente, através das técnicas de Hematoxilina-eosina (HE) amostras de: (1) omento sem manipulação, (2) omento manipulado intraperitoneal, (3) omento manipulado extraperitoneal e (4) tecido adiposo subcutâneo.
RESULTADOS: omento extraperitoneal, macroscopicamente, apresentou uma coloração amarelado mais intenso, semelhante à gordura subcutânea adjacente, com alto grau de contração se comparado ao omento intraperitoneal de controle. Pela técnica de HE, foi identificado alto grau de fibrose e tamanho médio dos adipócitos semelhante ao omento de controle e inferior ao do subcutâneo (p<0,001).
CONCLUSÃO: O omento extraperitoneal não se mostra capaz de promover regeneração tecidual, uma vez que não foi observado metaplasia à histologia do retalho translocado. Entretanto, pode servir para a correção de pequenas deformidades, para o tratamento de áreas isquêmicas, como estrutura carreadora para a reconstrução cirúrgica e como plataforma germinadora para o desenvolvimento de novos órgãos.
Palavras-chave: Omento; Mama; Reconstrução; Epíploon; Metaplasia; Gordura.
ABSTRACT
INTRODUCTION: The greater omentum was initially used in the repair of gastrointestinal defects in the 19th century; during the 20th century, it has been used extraperitoneally in the treatment of various disorders, in several surgical specialties. Despite the fact that the greater omentum was studies in detail in the 1960s, there are no reported comparative studies concerning the use of omental flaps extraperitoneally. The present study analyzed the adaptive features of the greater omentum in the extraperitoneal space, with the aim of identifying its surgical applicability.
METHODS: A paired, controlled comparative study was conducted using 20 tissue samples from 5 obese female Sprague-Dawley rats (Rattus norvegicus). The following specimens from each animal were analyzed and compared, macroscopically and microscopically, using the hematoxylin-eosin (HE) technique: (1) omentum without manipulation; (2) intraperitoneally manipulated omentum; (3) extraperitoneally manipulated omentum; and (4) subcutaneous adipose tissue.
RESULTS: Macroscopically, the extraperitoneal omentum exhibited a more intense yellowish color and a higher degree of contraction than the control (intraperitoneal) omentum. The extraperitoneal omentum was similar in color to the adjacent subcutaneous adipose tissue. HE staining revealed a high degree of fibrosis and an average adipocyte size, similar to that in the control omentum, but lower than that in subcutaneous adipose tissue (p< 0.001).
CONCLUSION: The results of this study indicate that the extraperitoneal omentum was not able to promote tissue regeneration, as metaplasia of the translocated flap was not observed in the histological analysis. However, this structure may be used to correct small deformities, in the treatment of ischemic areas, as a carrier structure for surgical reconstruction and as a germination platform for the development of new organs.
Keywords: Omentum; Breast; Reconstruction; Epiploon; Metaplasia; Fat.
O grande omento, ou epíplon, teve sua utilização cirúrgica como estrutura de reparo, inicialmente relatada para lesões de órgãos intra-abdominais, no século XIX1,2. A primeira utilização extra cavitária bem sucedida foi descrita por Morison, em 19033, para o tratamento de ascite. Em 1937, O'Shaughnessy4 relatou o uso do grande omento pediculado para o tratamento de angina e identificou o seu poder angiogênico, a partir da observação de neovascularização em estruturas adjacentes ao retalho transposto. Entretanto, sem conhecimento dos mecanismos envolvidos na angiogênese.
O potencial cirúrgico extraperitoneal do grande omento só voltou a ser explorado durante a década de 1960, quando cirurgias bem sucedidas de transposição de epíplon foram relatadas por Kiricuta5, para a reconstrução mamária, e por Goldsmith6, para o tratamento de linfedema crônico. A partir de então, o estudo da aplicabilidade do epíplon extraperitoneal expandiu-se para as diversas especialidades cirúrgicas. Em ortopedia, para o reparo de defeitos ósseos, tratamento de osteomilite, cobertura de próteses, prevenção de aderência após tenólise; na cirurgia torácica, para reconstrução de parede torácica e defeitos esternais, cobertura de anastomoses esofágicas, tratamento de fístulas brônquicas e traqueais, de hérnia diafragmática, de infecções mediastinais; na cirurgia vascular, para o tratamento de linfedema crônico, proteção de anastomoses vasculares e próteses, revascularização de membros isquêmicos, tratamento de gangrenas; em oncologia para o tratamento e prevenção de injúrias resultantes da radioterapia; na neurocirurgia para a revascularização de áreas de isquemia cerebral, tratamento de fístulas liquóricas, epilepsia e doença de Alzheimer; na urologia e ginecologia para o tratamento de fístulas urinárias e ginecológicas; na cirurgia cardíaca, para a revascularização miocárdica; na cirurgia plástica para o tratamento e reconstrução de diversos seguimentos corporais; entre outras5-11.
Os estudos do epíplon, realizados principalmente nestes últimos 50 anos, tiveram como foco as suas características anatômicas, fisiológicas, metabólicas, angiogênicas, imunogênicas, assim como particularidades moleculares10,12-16. Vários estudos se preocuparam, inclusive, em comparar as diferenças entre o tecido adiposo do grande omento e do meio subcutâneo17-21. Entretanto, não há estudos comparativos com foco nas propriedades adaptativas teciduais do grande omento no meio extraperitoneal. Não está claro se o epíplon transposto, além de vascularizar o sítio receptor e preencher defeitos, sofre uma metaplasia capaz de regenerar, funcionalmente, estruturas danificadas, a partir de sua vasta concentração de células tronco, ou apenas um processo adaptativo mantendo o mesmo padrão tecidual e funcional presente no meio intraperitoneal22. Estas informações são de grande importância para se obter maior precisão na indicação e na forma de utilização e, ainda, melhorar a previsibilidade dos resultados tardios e evolutivos das áreas reparadas com esta estrutura. O conhecimento das propriedades adaptativas do grande omento extraperitoneal pode, ainda, servir de base para futuros estudos, em que esta estrutura poderá ser utilizada como arcabouço estrutural e meio de transporte para a regeneração tecidual e até reconstrução de novos órgãos.
Por todas estas características do epíplon extraperitoneal na atualidade e o seu grande potencial para o futuro, propôs-se um estudo experimental comparativo e pareado em ratos com foco nas transformações estruturais, anatômicas e histológicas, do retalho de epíplon translocado para o meio subcutâneo, e o seu potencial de metaplasia neste meio. O objetivo do presente estudo é, portanto, analisar as características adaptativas do grande omento em meio extraperitoneal para identificar a real aplicabilidade cirúrgica desta estrutura.
MÉTODOS
Desenho do estudo e tamanho amostral
Estudo experimental comparativo, pareado e controlado, composto de 20 amostras teciduais de ratos (Rattus norvegicus) fêmeas obesas, irmãs da linhagem Sprague-Dawley. Os ratos foram obtidos com 56 dias de vida do Centro de Reprodução Central da Universidade Estadual de Campinas (UNICAMP). Foi induzida obesidade para disponibilizar maior quantidade de tecido omental e potencializar a identificação, por imunoistomíquica, de diferentes tecidos adiposos através de macrófagos marcados com anti-CD68. A obesidade foi alcançada através da dieta de cafeteria por um período de oito semanas, que consistiu em substituir a ração padrão para roedores por alimentos calóricos, consumido pela população humana como: chocolate, amendoim, bacon, leite condensado, bolo, patê, refrigerante, conforme preconizado por Vanzela em 201023.
Esse estudo foi aprovado pela Comissão de Ética na Experimentação Animal (C.E.E.A) do Instituto de Biologia (I.B.) da UNICAMP e seguiu todas as normas referentes aos aspectos éticos estabelecidos para o uso de animais em pesquisa. Os ratos permaneceram desde o início do período de engorda até a coleta do material para análise no Biotério do I.B. da UNICAMP, isolados em caixas com cuidados diários de limpeza e iluminação de 12 horas/dia e em temperatura constante de 22 + 20Cº, submetidos a dieta de cafeteria at libitum.
Procedimento cirúrgico
Todos os procedimentos de translocação do grande omento foram realizados por dois pesquisadores. Com 112 dias de vida e pesando 323,8 + 34,2g, os animais foram submetidos à anestesia geral, com indução anestésica realizada por meio de injeção intraperitoneal de 0,5mL de Quetamina (Vetaset® Fort Dodge, 1g/10ml) e Xilesin (Rompum® Bayer, 2g/10ml) na proporção de 3:2 conforme protocolo do I.B. da UNICAMP. A dose de manutenção não foi necessária, visto que o tempo total do procedimento foi de 18 + 5 minutos.
O procedimento de translocação do omento foi realizado após tricotomia, antissepsia com Polivinil Pirrolidona Iodo (PVPI 1% de Iodo Ativo) e assepsia. Realizou-se, conforme ilustrado na figura 1: (1) incisão da pele em linha média de aproximadamente quatro centímetros; (2) dissecção de loja subcutânea de todo hemi-abdomen direito; (3) laparotomia com incisão da musculatura abdominal com quatro cm de extensão; (4) identificação e exteriorização do epíplon da cavidade abdominal; (5) divisão do grande omento em 3 partes, sendo que em uma parte foi confeccionado o retalho esquerdo pediculado nos ramos gastroepiplóicos esquerdos e mantido na cavidade abdominal com 20mm2 (controle); outra parte deu origem ao retalho direito, também de 20mm2, baseado nos ramos gastroepiplóicos direitos, que foi translocado para o meio subcutâneo no hemi-abdome direito e fixado na parede abdominal em suas extremidades (para futura identificação) com fio de nylon 5.0. O restante do epíplon foi fotografado e coletado para análise; (6) finalmente, a musculatura foi fechada com pontos contínuos de nylon 5.0, exceto os 0,3cm superior, que foi deixado aberto para a passagem do pedículo do omento translocado; (7) a pele foi fechada com pontos contínuos invertidos de nylon 5.0 e recoberta com fita microporada de papel. Após o procedimento os ratos foram colocados em decúbito lateral sob lâmpadas térmicas para recuperação anestésica.
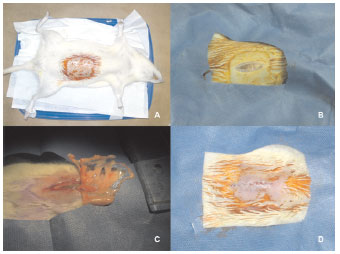
Figura (1). O procedimento de translocação. A - Rato em anestesia geral posicionado; B - Após antissepsia e posicionamento de campo estéril fenestrado é feita uma incisão na linha média da região abdominal para acesso à cavidade. C - O epíplon é exposto e são confeccionados dois retalhos de 2cm, um dos retalhos é transposto para o meio subcutâneo e o outro é usado de controle na cavidade abdominal. O tecido remanescente é ressecado e usado como amostra de "omento não manipulado". D - Após a translocação a incisão é fechada no plano muscular preservando-se aberto 1cm no seguimento superior para permitir o fluxo sanguíneo do pedículo e a pele é fechada por completa com pontos contínuos invertidos.
Preparo e análise anatômica macroscópica
Ao completar oito semanas de pós-operatório (168 dias de vida e peso médio de 351 + 26,92g) os ratos foram eutanasiados. Neste momento, outras três amostras teciduais foram identificadas, fotografadas e ressecadas: os retalhos do epíplon de controle e do epíplon translocado e um fragmento de tecido adiposo do subcutâneo da fossa ilíaca esquerda (local com tecido adiposo abundante, afastado do sítio de translocação do omento e sem influência local de processo inflamatório).
A comparação macroscópica dos tecidos, quanto ao grau de contração e coloração, foi realizada pelos dois pesquisadores que realizaram o procedimento de translocação e remoção dos retalhos. Como os retalhos (translocado e de controle) eram pediculados não foi possível a sua introdução em recipiente graduado para a aferição exata de seu volume durante o procedimento de translocação. A aferição macroscópica quantitativa da contração dos retalhos de epíplon e a perda volumétrica destas estruturas não puderam ser realizadas, embora eles tenham sido confeccionados com uma medida padrão de 20mm2.
Preparo e análise histológica
A análise microscópica dos retalhos foi realizada por um patologista cego para a origem dos tecidos, as amostras obtidas estavam apenas identificadas por números e letras. Apenas os pesquisadores que realizaram os procedimentos de confecção e extração dos retalhos sabiam a origem das peças analisadas. Cada amostra coletada foi imediatamente identificada e introduzida em um frasco com formol 10% tamponado.
No laboratório de patologia, as amostras teciduais foram processadas, sendo que cada amostra deu origem a uma lâmina identificada e corada pela técnica Hematoxilina-eosina (HE) para avaliar: (1) fibrose, (2) o diâmetro dos adipócitos e a presença de população celular diferente da, habitualmente, presente no omento, o que caracterizaria a metaplasia.
A fibrose foi analisada em microscopia óptica comum pelo patologista. Para a análise do diâmetro dos adipócitos foram capturadas imagens digitais em ampliação de 100X, usando uma câmera digital (Leica DFC360 FX, Solms, Alemanha) acoplado a um microscópio de campo claro (Leica DM5000 B). Estas imagens foram avaliadas por um software de análise de imagem (Leica QWin Padrão V3, Microsystem Imaging), para quantificar o diâmetro de 100 adipócitos aleatórios contados por um procedimento semi-automatizado no programa.
Análise estatística
Os dados de cada rata e de cada amostra tecidual coletada foram estatisticamente estudados. A evolução do peso dos ratos e o diâmetro médio dos adipócitos foram analisados por meio do teste t de Student, pareado em pares independentes. O nível de significância foi de 5% e o software utilizado para análise foi o SAS versão 9.2.
RESULTADOS
Análise anatômica macroscópica
Com oito semanas após a translocação, conforme ilustrado na figura 2, o peso médio dos ratos passou de 323,8 + 34,16 para 351,0 + 26,92 (p=0,012, IC95% de -44,68 a -9,72). Neste momento foi observado cicatrização completa da ferida operatória com crescimento completo de pêlos no local (Figura 3A).
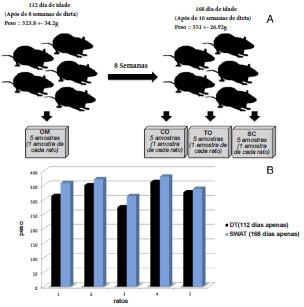
Figura 2 (A) - Após 8 semanas de dieta de cafetaria, os ratos (pesando 323,8 ± 34.2g e aos 112 dias de idade) foram submetidos a cirurgia para o transplante de omento ao ambiente subcutâneo. Neste momento, uma amostra de omento (OM) de cada rato foi identificada, fotografada e extraída. Com 8 semanas pós-transplante, os ratos foram sacrificados (168 dias de idade, peso corporal 351 ± 26,92 g). Três amostras de tecido foram identificadas, fotografadas e extraiu-se: os retalhos de controle pós-operatório do omento (CO), o omento transplantado (TO) e de um fragmento de tecido adiposo subcutâneo (SC) na fossa ilíaca esquerda. B - gráfico representando progressão do peso de cada um dos ratos a partir do transplante (DT) até 8 semanas após o transplante (8WAT). A média de peso aumentou, significativamente, de 323,8 ± 34.16g para 351,0 ± 26.92g, durante as oito semanas após o transplante do grande omento.
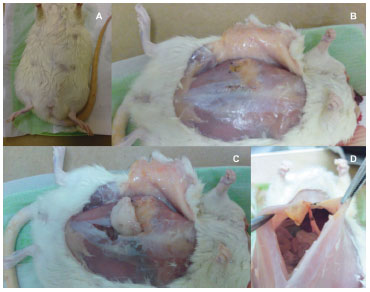
Figura 3 (A) - Ferida completamente cicatrizada após oito semanas do procedimento cirúrgico. (B) - Epíplon translocado fixado em quadrante superior direito da região abdominal. (C) - Coloração do omento translocado semelhante à da gordura subcutânea e diferente da encontrada no omento de controle. (D) - Observação da integridade do pedículo.
Macroscopicamente, o omento translocado para o meio subcutâneo apresentou uma coloração amarelado mais intenso, semelhante à gordura subcutânea adjacente (Figuras 3B e C), diferente da tonalidade mais clara observada no momento de sua translocação, e ainda presente no epíplon intra-abdominal de controle (Figura 3C).
Quanto ao grau de contração, o epíplon translocado apresentou intensa contração em relação ao omento intra-abdominal de controle, identificado como uma estrutura delgada e de consistência elástico-fibrosa (Figura 3C). Foi feita confirmação da integridade pós-operatória do pedículo (Figura 3D).
Análise histológica
À microscopia, todas amostras analisadas apresentavam retalhos viáveis (sem necrose). No omento translocado houve maior grau de fibrose em relação a todas as outras amostras. Não foi identificado nenhum outro tipo tecidual nas amostras dos retalhos de epíplon, além dos habitualmente presentes nesta estrutura anatômica (Figura 4).
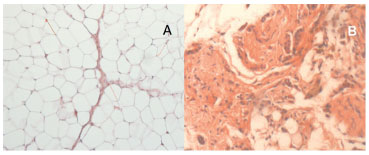
Figura 4 (A) - análise microscópica para medir o diâmetro de 100 adipócitos aleatórios e a aparência histológica do omento não manipulado (OM) (HE, 100x). (B)- aparência histológica do omento transplantado (TO) com um alto grau de fibrose (HE, 100x).
A morfologia mostrou que, o diâmetro médio dos adipócitos do omento, do subcutâneo, do omento translocado, do omento intra-abdominal e de controle foram de 0,059um, 0,071um, 0,064um e 0,065um, respectivamente (Tabela 1). Os adipócitos do omento não manipulado foram menores do que os do subcutâneo p<0,001(IC 95%: -0,016 a -0,010). Houve diferença estatisticamente significativa entre o diâmetro dos adipócitos do omento translocado com os do não manipulado p=0,0014 (IC95%: -0,008 a -0,003) e os do subcutâneo p<0,001 (IC95%: 0,004 a 0,010). Os adipócitos do retalho translocado foram estatisticamente semelhantes aos do controle p=0,27. (Figura 5).
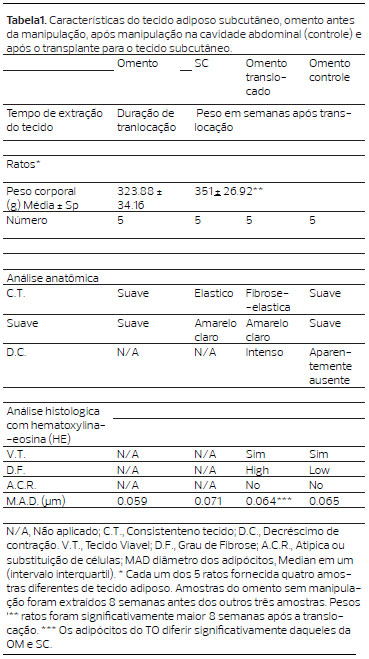
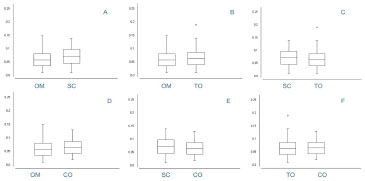
Figura 5. Análise estatística do diâmetro médio dos adipócitos por meio do teste t-Student pareado de variáveis independentes. (A) - Omento não manipulado vs. Subcutâneo, p < 0,0001.(B) - Omento Translocado vs. Ometo não manipulado p < 0.0001. C- Omento Translocado vs. Subcutâneo, p < 0,0001. (D) - Omento não Maniplado vs. Ometo de Controle, p < 0,0001. E - Omento de Controle vs. Subcutâneo, p < 0,0001. F - Omento de Controle vs. Omento Translocado, p=0,27.
DISCUSSÃO
Apesar do grande conhecimento que se tem hoje do grande omento e de sua vasta aplicabilidade clínica em diversas especialidades médicas, existe uma deficiência em estudos comparativos com foco nas propriedades adaptativas no omento extraperitoneal. Os principais estudos, que analisam o potencial cirúrgico e terapêutico dos retalhos extraperitoneais do grande omento, focam a área corporal receptora ou as estruturas anatômicas tratadas e os mecanismos envolvidos nestas respostas6-11,14,16.
Como o presente estudo teve como foco avaliar as propriedades adaptativas do tecido transplantado de omento extraperitoneal, foi possível comparar importantes alterações teciduais, até então não relatadas na literatura. Em relação ao tempo pós-operatório de coleta do material para análise, com oito semanas após a translocação do omento, a cicatriz cutânea apresentava formação completa de pêlos na região abdominal (figura 3A). Este achado revela regeneração completa neste período, que é superior ao dobro do período gestacional de três semanas dos ratos, e tempo suficiente para a remissão de respostas inflamatórias decorrentes do procedimento, (inclusive confirmada pela baixa concentração de macrófagos à imunoistoquímica) e para a completa adaptação ou metaplasia do retalho transposto.
Quanto à avalição anatômica, o omento translocado apresentou as mesmas características do tecido subcutâneo adjacente, com coloração amarelo claro, aspecto denso e de consistência elástico-fibrosa, diferenciando-se do omento de controle, que manteve o mesmo padrão do omento sem manipulação. Estes achados sugerem que a contração do grande omento, observada neste estudo, possivelmente, resultante de ausência do líquido peritoneal, pode ser uma contraindicação à utilização desta estrutura como tecido de preenchimento ou ganho volumétrico. Entretanto, o alto grau de fibrose e consistência elástico-fibrosa decorrente de sua translocação extraperitoneal pode ser útil para o tratamento de deformidades e reparos que necessitem de um suporte estrutural ou de cobertura sem volume. Esta estrutura pode, ainda, ser efetivamente utilizada como tecido carreador de células, tecidos ou órgãos em praticamente todas as regiões corporais12,16.
Em relação à análise histológica com HE, o omento translocado apresentou o mesmo padrão tecidual e a mesma morfologia celular dos adipócitos do controle, diferenciando-se pela presença de moderado grau de fibrose. A ausência de líquido peritoneal é, aparentemente, o principal fator responsável por estas características adaptativas do omento no espaço subcutâneo. A contração observada no omento translocado, e a ausência desta no epíplon de controle, podem ser justificadas por possível desidratação e maior grau de fibrose18-21,24.
Como o tecido adiposo subcutâneo é reconhecidamente diferente do epíplon17-21, era esperado que o diâmetro médio entre eles fossem diferentes, porém a influência sobre o retalho translocado ainda não tinha sido descrita. Os dados referentes à diferença tecidual entre os adipócitos do grande omento e do subcutâneo foram estatisticamente confirmados no presente estudo.
Em relação à comparação entre o retalho translocado e as demais amostras teciduais, foram identificados que o diâmetro médio dos adipócitos do omento translocado foi semelhante ao do retalho de omento de controle, estatisticamente diferente do omento sem manipulação e do tecido adiposo subcutâneo.
Estes resultados podem sugerir que o líquido peritoneal exerça influência, predominantemente, sobre a matriz extracelular do omento e sobre a sua população de células flutuantes, com pouca influência sobre os adipócitos. O fato de os dois retalhos manipulados manterem o mesmo diâmetro de adipócitos e serem estatisticamente menor do que o diâmetro de adipócito encontrado na gordura subcutânea sugere que a transformação anatômica observada seja resultante, principalmente, de alterações na matriz extracelular do tecido adiposo do omento, e que não há sinais de substituição na população celular, por adipócitos do subcutâneo. A diferença estatística entre o diâmetro dos adipócitos do omento virgem de manipulação, que é menor do que o diâmetro dos adipócitos dos retalhos de epíplon de controle e translocado, pode ser resultante da significante engorda dos animais que ocorreu no período de oito semanas entre cada procedimento (tabela 1).
O grande omento é fonte de células tronco onipotentes (células capazes de se diferenciarem em outros tipos celulares de mesma origem embrionária) e apresenta grande potencial angiogênico, restaurando tecidos isquêmicos e lesões actínicas3,6,8,10,14,16. Pelo fato de estar em um local diferente de seu sítio primário, ele estaria exposto a metaplasia, pelos mesmos princípios observados no esôfago de Barrett ou nas metaplasias dos retalhos cutâneos intraorais. Este dado justifica a importância de se investigar se há substituição do tipo celular no tecido transposto. Os resultados encontrados à histologia não evidenciaram presença de metaplasia celular no retalho de omento translocado, uma vez que não foi observado outro tipo tecidual e nem mesmo alteração no diâmetro dos adipócitos entre as amostras pareadas que foram comparadas com o omento de controle.
O tecido adiposo subcutâneo, da medula óssea e intra-abdominal nos mamíferos apresentam diferenças estruturais e funcionais com características muito distintas, embora sejam formadas principalmente de adipócitos25,26. No presente estudo, foi observado, à morfologia, que o adipócito do omento extra-peritoneal era menor do que o adipócito das demais amostras. Consequentemente, pode inferir que estes adipócitos perderam parcialmente sua capacidade funcional de reserva energética e passaram a exercer a função de tecido de preenchimento (provavelmente semelhante ao tecido adiposo das medulas ósseas), por provável adaptação tecidual. Portanto, o omento extraperitoneal, isoladamente na forma de retalho, não aparenta ser capaz de se transformar no tecido receptor, apesar de sua grande concentração de células tronco onipotentes e de seu grande potencial angiogênico.
Os achados do presente estudo demonstram que o epíplon, semelhante ao tecido adiposo subcutâneo, é uma rica fonte de material que pode ser utilizado na reconstrução de diversos órgãos e estruturas corporais como tecido de pequeno preenchimento e suporte, sem aparente capacidade de regenerar funcionalmente órgãos e tecidos27,28. Em adição, por estar relacionado à grande potencial angiogênico, capaz de permitir a revascularização de áreas isquêmicas, poderia servir como estrutura carreadora para a reconstrução cirúrgica e como plataforma germinadora para o desenvolvimento de novos órgãos16,29,30. Não sendo adequado, quando usado isoladamente, para grandes reconstruções, regeneração tecidual ou reposição volumétrica.
CONCLUSÃO
Em conclusão, no meio subcutâneo, o epiplon translocado sofre intensa contração e perda volumétrica, e embora apresente um aspecto macroscópico semelhante à gordura subcutânea, à microscopia mantém o mesmo padrão estrutural e morfológico dos adipócitos presentes no meio intra-abdominal, sem apresentar sinais de metaplasia. Portanto, o omento extraperitoneal não se mostra capaz de promover regeneração tecidual, mas pode servir para a correção de pequenas deformidades, para o tratamento de áreas isquêmicas, como estrutura carreadora para a reconstrução cirúrgica e como plataforma germinadora para o desenvolvimento de novos órgãos.
REFERÊNCIAS
1. de Lamballe AJJ Memóire sur les plaies du canal intestinal. Paris, 1826.
2. Senn N. An experimental contribution to intestinal surgery, with special reference to the treatment of intestinal obstruction. Ann Surg. 1888;7(6):421-30.
3. Morison R. A case of ascites due to liver cirrhosis treated by operation. Ann Surg. 1903;38(3):361-6.
4. O'Shaughnessy L. Surgical treatment of cardiac ischaemia. Lancet 1937;1:185-94.
5. Kiricuta I. L'emploi du grand épiploon dans la chirurgie du sein cancereux. Presse Medicale 1963;71:15-7.
6. Goldsmith HS, De los Santos R, Beattie Jr EJ. Relief of chronic lymphedema by omental transposition. Ann Surg. 1967;166(4):573-85.
7. Liebermann-Meffert DM, Siewert JR. The role of the greater omentum in intrathoracic transposition. Neth J Surg. 1991;43(5):154-60.
8. Williams RJ, White H. Transposition of the greater omentum in the prevention and treatment of radiation injury. Neth J Surg. 1991;43(5):161-9.
9. Normington EY, Papay FA, Yetman RJ. Treatment of recurrent cerebrospinal fluid rhinorrhea with a free vascularised omental flap: A case report. Plast Reconstr Surg. 1996;98(3):514-9.
10. Liebermann-Meffert D. The greater omentum. Anatomy, embryology, and surgical applications. Surg Clin North Am. 2000;80(1):275-93.
11. Hultman CS, Carlson GW, Losken A, Jones G, Culbertson J, Mackay G, et al. Utility of the omentum in the reconstruction of complex extraperitoneal wounds and defects: donor-site complications in 135 patients from 1975 to 2000. Ann Surg. 2002;235:782-95.
12. Das SK. The size of the human omentum and methods of lengthening it for transplantation. Br J Plast Surg. 1976;29(2):170-74.
13. Agca B, Paksoy M, Polat E, Aksin E, Dirican A, Durgun V, Eren D. Influence of omentectomy on peritoneal defense mechanisms in an experimental model of intra-abdominal infection. Eur Surg Res. 2003;35(1):35-40.
14. Oloumi MM, Derakhshanfar A, Molaei M, Tayyebi M. The angiogenic potential of autogenous free omental graft in experimental tibial defects in rabbit: Short-term preliminary histopathological study. J Exp Anim Sci 2006;43(3):179-87.
15. Collins D, Hogan AM, O'Shea D, Winter DC. The omentum: anatomical, metabolic, and surgical aspects. J Gastrointest Surg. 2009;13(6):1138-46.
16. de Figueiredo JC, Naufal RR, Claro Jr F, Arias V, Bueno Pereira PR, Inaco Cirino LM. Prefabricated flap composed by skin and terminal gastromental vessels. Experimental study in rabbits. J Plast Reconstr Aesthet Surg. 2010;63(6):e525-8.
17. Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante AW Jr. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest. 2003;112(12):1796-808.
18. Harman-Boehm I, Blüher M, Redel H, Sion-Vardy N, Ovadia S, Avinoach E, et al. Macrophage infiltration into omental versus subcutaneous fat across different populations: effect of regional adiposity and the comorbidities of obesity. J Clin Endocrinol Metab. 2007;92:2240-47.
19. Dicker A, Astrom G, Wahlen K, Hoffstedt J, Naslund E, Wiren M, Ryden M, et al. Primary differences in lipolysis between humanomental and subcutaneous adipose tissue observed using in vitro differentiated adipocytes. Horm Metab Res 2009;41(5):350-5.
20. Toyoda M, Matsubara Y, Lin K, Sugimachi K, Furue M. Characterization and comparison of adipose tissue-derived cells from human subcutaneous and omental adipose tissues. Cell Biochem Funct. 2009;27(7):440-7.
21. Aron-Wisnewsky J, Tordjman J, Poitou C, Darakhshan F, Hugol D, Basdevant A, et al. Human adipose tissue macrophages: m1 and m2 cell surface markers in subcutaneous and omental depots and after weight loss. J Clin Endocrinol Metab. 2009;94(11):4619-23.
22. Kamei Y, Toriyama K, Takada T, Yagi S. Tissue-engineering bone from omentum. Nagoya J Med Sci. 2010;72(3-4):111-7.
23. Vanzela EC, Ribeiro RA, de Oliveira CA, Rodrigues FB, Bonfleur ML, et al. Pregnancy restores insulin secretion from pancreatic islets in cafeteria diet-induced obese rats. Am J Physiol Regul Integr Comp Physiol. 2010;298(2):320-8.
24. Bassols J, Ortega FJ, Moreno-Navarrete JM, Peral B, Ricart W, Fernandez- Real JM. Study of the proinflammatory role of human differentiated omental adipocytes. J Cell Biochem. 2009;107(6):1107-17.
25. Baglioni S, Francalanci M, Squecco R, Lombardi A, Cantini G, Angeli R, et al. Characterization of human adult stem-cell populations isolated from visceral and subcutaneous adipose tissue. FASEB J. 2009;23(10):3494-505.
26. Dhanasekaran M, Indumathi S, Kanmani A, Poojitha R, Revathy KM, Rajkumar JS, et al. Surface antigenic profiling of stem cells from human omentum fat in comparison with subcutaneous fat and bone marrow.Cytotechnology. 2012;64:497-509.
27. Claro F Jr, Figueiredo JC, Zampar AG, Pinto-Neto AM. Applicability and safety of autologous fat for reconstruction of the breast. Br J Surg. 2012;99(6):768-80.
28. Illouz YG. Present results of fat injection. Aesthetic Plast Surg. 1988;12(3):175-81.
29. Kobayashi T, Aomatsu Y, Iwata H, Kin T, Kanehiro H, Hisanga M, et al. Survival of microencapsulated islets at 400 days posttransplantation in the omental pouch of NOD mice. Cell Transplant. 2006;15(4):359-65.
30. Baumert H, Simon P, Hekmati M, Fromont G, Levy M, Balaton A, et al. Development of a seeded scaffold in the great omentum: feasibility of an in vivo bioreactor for bladder tissue engineering. Eur Urol. 2007;52(3):884-90.
1- Mestre - Cirurgião Plástico Membro Titular da Sociedade Brasileira de Cirurgia Plástica
2- Ph.D - Patologista na UNICAMP
3- Médico Cirurgião Geral - Residente de Cirurgia Plástica do Instituto de Cirurgia Plástica Santa Cruz
4- Ph.D - Supervisora do Laboratório de Patologia Especializada - CAISM - Unicamp
5- Full Professor - Departamento de Ginecologia e Obstetrícia do CAISM - UNICAMP
Instituição: 1 - Departamento de Tocoginecologia da Faculdade de Medicina da Universidade. Estadual de Campinas (UNICAMP) 2 - Instituto de Cirurgia Plástica Santa Cruz (ICPSC).
Autor correspondente:
Francisco Claro Júnior
Avenida Indianópolis, 2244 - Indianópolis
São Paulo - SP - CEP.: 04062-002
E-mail: fclarojr@gmail.com
Artigo submetido: 25/10/2013
Artigo aceito: 08/12/2013


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter