

Experimental - Year 2011 - Volume 26 - (3 Suppl.1)
Enxerto de gordura humana em ratos: estudo comparativo de diferentes preparos da gordura
Enxerto de gordura autóloga tem sido muito utilizado em cirurgias para rejuvenescimento facial e melhora do contorno corporal, sendo motivo de várias pesquisas. A gordura aparenta ser a substância ideal para o uso em preenchimento, por apresentar biocompatibilidade, abundância, facilidade de obtenção e baixa morbidade. Entretanto, os resultados em longo prazo do enxerto de gordura são difíceis de prever, devido às baixas taxas de viabilidade, com absorção do tecido enxertado variando de 20 a 90%. Com o objetivo de diminuir esse efeito indesejado, diversas técnicas de refinamento de adipócitos têm sido testadas. A definição de um padrão de extração, refinamento e preenchimento de gordura se torna fundamental para aumentar a viabilidade dos enxertos, melhorando seus resultados. A quantificação da gordura enxertada em pacientes é difícil de ser realizada, pois esta gordura se confunde com a gordura original da região.
OBJETIVO
Avaliar a integração do enxerto de gordura humana em ratos submetidos a diferentes métodos de refinamento.
MÉTODOS
Este estudo foi realizado no Laboratório de Cirurgia Experimental do Departamento de Cirurgia e Ortopedia da Faculdade de Medicina de Botucatu -UNESP. Foram utilizados 10 ratos da raça Wistar, machos, com massa média de 260,7 g. Os animais foram submetidos à injeção de tecido adiposo obtido de lipoaspirações realizadas em 10 pacientes. Os pacientes foram informados previamente sobre este estudo e apenas aqueles que autorizaram, mediante assinatura do termo de consentimento livre e esclarecido, tiveram suas gorduras submetidas a este estudo. Os pacientes foram anestesiados com bloqueio peridural, anestesia local ou anestesia geral, conforme a indicação. As áreas aspiradas foram desenhadas e infiltradas com solução salina e adrenalina 1:250.000. O tecido aspirado foi distribuído em cinco amostras de 20 ml cada. A amostra 1 foi deixada em repouso por 30 minutos para decantação. A amostra 2 foi colocada sobre uma peneira metálica com vãos livres de 1 mm2 e lavada com 250 ml de soro fisiológico, agitando-se a peneira levemente para retirar o excesso de soro. As amostras 3, 4 e 5 foram centrifugadas por 3, 10 e 30 minutos, respectivamente, na velocidade de 3.000 rpm (805 x g) na centrífuga Centribio®. O sobrenadante de cada amostra foi retirado com swab e o tecido adiposo colhido com auxílio de espátula. Seringas de 3 ml contendo 2 ml de gordura de cada amostra foram preparadas em ambiente estéril e encaminhadas ao biotério em caixa de isopor com gelo. Foram injetados 2 ml de cada amostra no tecido subcutâneo do dorso de cada rato, depois de anestesiados com Ketamina - 80 mg/kg (Dopalen®) e Xilazina - 30mg/kg (Anasedan®) via intramuscular. As áreas submetidas ao preenchimento foram pré-determinadas e as amostras injetadas nas respectivas áreas foram distribuídas aleatoriamente. Os ratos foram mantidos em gaiolas apropriadas, com luz e temperatura controlada, recebendo ração e água ad libitum. Após 30 dias, os animais foram sacrificados e foi realizada a ressecção dos enxertos de gordura que foram analisados por meio da mensuração de massa e volume. Com os tecidos adiposos extraídos, foram confeccionadas lâminas coradas com hematoxilina-eosina, que foram avaliadas quanto às alterações degenerativas e morfológicas dos adipócitos.
RESULTADOS
Os resultados estão representados nas Figuras 1 a 5.
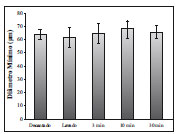
Figura 1 - Diâmetro mínimo dos adipócitos. ANOVA (P = 0,273).
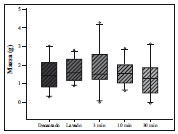
Figura 2 - Massa do enxerto entre os grupos. Kruskal-Wallis (P = 0,708).
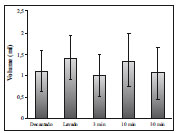
Figura 3 - Volume do enxerto entre os grupos. ANOVA (P=0,373).
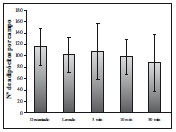
Figura 4 - Número de adipócitos por campo de 0,75 mm2. ANOVA (P=0,079).
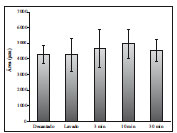
Figura 5 - Área dos adipócitos. ANOVA (P=0,416).
CONCLUSÃO
Em nosso modelo experimental, não houve diferença entre os métodos de refinamento dos adipócitos para a integração do enxerto de gordura.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter