

Special Article - Year 2011 - Volume 26 -
Substitutos cutâneos: conceitos atuais e proposta de classificação
Skin substitutes: current concepts and a new classification system
RESUMO
Feridas complexas podem resultar na perda completa do revestimento cutâneo. A solução consagrada pela cirurgia plástica é a enxertia de pele autógena, porém há casos em que ocorre escassez de área doadora cutânea, um problema ainda não totalmente solucionado. Assim, atualmente há muito interesse por materiais sintéticos ou biológicos que possam ser utilizados como substitutos cutâneos. O objetivo deste estudo foi introduzir uma forma mais didática de agrupar diferentes tipos de substitutos cutâneos. Acreditamos que esses produtos podem ser classificados de forma mais abrangente se forem divididos segundo três critérios: camada substituída da pele, subdivididos em epidérmicos (E), dérmicos (D) e compostos dermoepidérmicos (C); duração no leito da ferida, subdivididos em temporários (T) e permanentes (P); e origem do material constituinte, subdivididos em biológicos (b), biossintéticos (bs) e sintéticos (s).
Palavras-chave: Engenharia tecidual. Células cultivadas. Pele artificial.
ABSTRACT
Complex wounds are characterized by complete loss of cutaneous cover. The most common plastic surgery technique is the autogenous skin graft; however, the amount of material available from donor areas is often limited. The development of synthetic or biological products as skin substitutes is therefore an area of interest. The present study aimed to classify the different types of skin substitutes available based on three criteria: the skin layer to be replaced, which can be categorized into epidermal (E), dermal (D), and dermal-epidermal composites (C); the durability in the wound bed, which can be temporary (T) or permanent (P); and the origin of the material, subdivided into biological (b), biosynthetic (bs), and synthetic (s).
Keywords: Tissue engineering. Cells, cultured. Skin, artificial.
Diversas situações clínicas, dentre as quais queimaduras, traumatismos, infecções, doenças autoimunes e o que classificamos como feridas complexas, podem resultar na perda completa do revestimento cutâneo1. Essa solução da barreira cutânea predispõe a infecções, aumento das perdas insensíveis de água e hipotermia, gerando aumento de morbidade, internações prolongadas com alto custo, e até morte do indivíduo. Uma solução consagrada pela cirurgia plástica tem sido a enxertia de pele alógena, porém em alguns pacientes pode ocorrer escassez de áreas doadoras cutâneas, um problema ainda não totalmente solucionado. Assim, há muito interesse por materiais sintéticos ou biológicos que possam ser utilizados como substitutos cutâneos2.
Atualmente incluem-se como opções de tratamento para as grandes perdas de pele os substitutos cutâneos, sejam eles de pele humana ou de origem sintética. Exemplos disso são os aloenxertos (derivados da pele de cadáver), os xenoenxertos (derivados da pele de animais) ou os sintéticos (construídos por engenharia de tecidos). A decisão de qual substituto cutâneo empregar é determinada por fatores como tipo, tamanho e profundidade da ferida, comorbidades presentes, preferências do paciente e experiência do cirurgião.
O enxerto alógeno de pele pode ser usado para teste terapêutico do leito receptor. Se houver boa integração desse enxerto, aumentam as chances de sucesso da autoenxertia, diminuindo o risco de perda dos tecidos autógenos escassos. Isso pode ser especialmente importante nos grandes queimados ou em traumas extensos3.
A primeira tentativa de se fabricar substitutos cutâneos a partir de cultura de células epidérmicas foi descrita, em 1974, por Rheinwald e Green4, quando um pequeno fragmento de pele saudável foi cultivado até que uma lâmina suficiente de queratinócitos fosse produzida para cobrir a ferida. Apesar da inovação tecnológica que a ideia de se "construir pele" trazia, há desvantagens no uso desse procedimento, como o retardo na enxertia em aproximadamente 3 a 4 semanas (tempo necessário para desenvolvimento do epitélio), fragilidade, menor resistência à infecção e maior incidência de perda do enxerto. O sucesso do enxerto dependeria da presença de elementos dérmicos remanescentes ou transportados para o leito dessa ferida, motivando, assim, novas pesquisas sobre substitutos cutâneos2.
Dá-se o nome de substitutos cutâneos a um grupo heterogêneo de elementos biológicos e/ou sintéticos que possibilitam a oclusão temporária ou permanente das feridas. Pode-se considerar substituto dérmico desde o xeno ou aloenxerto de pele até a combinação de cultura de queratinócitos autólogos sobre matriz dérmica, em busca da maior semelhança possível com a pele do paciente5,6.
O substituto cutâneo considerado ideal deve possuir propriedades comparáveis às da pele humana, como exposto no Quadro 1.

Com o aumento da demanda, surgiram a necessidade de adequada estocagem e a preocupação com a manutenção da qualidade do tecido; assim, foram desenvolvidos métodos de preservação de pele, como a criopreservação, que busca a manutenção da viabilidade celular e da arquitetura tecidual, e a exposição ao glicerol em altas concentrações, que gera um tecido com células não viáveis, porém com estrutura proteica mantida7. A utilização de substâncias conservantes provoca também redução da carga antigênica do material. Embora esse efeito seja mais notado na conservação com glicerol em altas concentrações, na criopreservação também é possível obter-se redução da antigenicidade e, consequentemente, queda da capacidade de gerar resposta imunológica quando o tecido é transplantado ao receptor8.
Existe, no mercado mundial, uma diversidade de substitutos cutâneos com diferentes aplicações, vantagens e desvantagens, que devem ser escolhidos para cada situação clínica e conforme a disponibilidade de material.
Embora alguns trabalhos tenham procurado classificar os substitutos cutâneos9,10 e, mais recentemente, Lazic e Falanga11 tenham feito revisão do tema, a classificação mais citada na literatura é aquela proposta, em 2001, por Balasubramani et al.12 e modificada, em 2008, por Kumar13, dividida em classe I, classe II e classe III.
Classe I - Material de Curativo Temporário e Impermeável
São substitutos cutâneos com função de barreira epidérmica, que, apesar de não possuírem componentes celulares, realizam algumas das funções dessa camada da pele. Geralmente são temporários e impermeáveis, apresentando função de barreira mecânica contra bactérias e evitando a perda insensível de água. Nessa classe estão incluídos:
a) Materiais de camada única:
produtos biológicos - membrana amniótica14; produtos sintéticos - membrana ou filmes de polímeros sintéticos (Opsite®, Hydrofilm®, Tegaderme®); biossintético (Nexfill® - Fibrocel); camada de biocelulose e Veloderm®; camada de biocelulose derivada de cana-de-açúcar, espuma ou spray polimérico (Mepilex® simples ou com prata, Mepilex Ag®, indicados para tratamento de lesões parciais da pele).
b) Materiais de camada dupla, produzidos por engenharia de tecidos:
Transcyte® - substituto semipermeável composto por rede de náilon coberta por colágeno porcino com a presença de fibroblastos de neonatos. Essas células proliferam e sintetizam proteínas da matriz (fibronectina, colágeno tipo I, tenascina, proteoglicanas, e glicosaminoglicanas) e fatores de crescimento. Seu uso permite que células epiteliais do paciente migrem para a ferida15.
Classe II - Substitutos Cutâneos Duráveis de Camada Única
a) Substitutos epidérmicos:
EpiDex® - substituto epidérmico gerado por cultura de queratinócitos autólogos retirados do folículo piloso do couro cabeludo. Cerca de 50 a 100 fios de cabelo são arrancados do próprio paciente com a raiz, geralmente da região supra-auricular, e enviados ao laboratório de cultura celular. Células-tronco pluripotentes ali presentes dão origem a queratinócitos que crescem em discos de 1 cm de diâmetro, reforçados com uma membrana de silicone, sendo, então, enxertados no leito da ferida16,17.
b) Substitutos dérmicos, constituídos por substância similar à derme, com pele processada, ou fabricados como matriz de colágeno dérmico e outras proteínas de matriz:
Membranas de colágeno suíno: 1. OASIS Wound Matrix® - matriz de regeneração dérmica derivada da submucosa do jejuno de suínos18,19 processada para remoção de componentes celulares, deixando uma estrutura composta por glicosaminoglicanas, fibronectina, proteoglicanas e fatores de crescimento. É comumente utilizada no tratamento de feridas dos membros inferiores. Pode ser armazenada em temperatura ambiente20.
2. Permacol® - derivado de colágeno de derme e elastina porcina. É uma matriz acelular, não-alergênica21,22, semelhante ao conceito do aloenxerto AlloDerm®3.Matrizes dérmicas de origem bovina: 1. Matriderm® - constituída por proteínas extracelulares (colágeno e elastina), é usada em queimaduras de espessura total, associada a enxerto de pele23.
2. PriMatrix® - matriz extracelular dérmica acelular, constituída por proteínas extracelulares e colágeno tipos I e III, recomendada para cobertura de feridas complexas.Matrizes dérmicas de origem humana: 1. Alloderm® - matriz dérmica acelular com componentes biológicos naturais, derivada de pele humana de cadáver. Esses enxertos são criopreservados, liofilizados e glicerolados para o completo descelulamento do tecido, bem como remoção do material antigênico e de microrganismos patógenos24.
Classe III - Substitutos de Pele Compostos
a) Substitutos com pele humana:
Enxerto alógeno de pele - Gibson e Medawar25 demonstraram as distinções entre a integração dos autoenxertos e dos aloenxertos, definindo conceitos de rejeição imune. Os aloenxertos eram utilizados a fresco e mantidos nas lesões até a completa rejeição desse tecido. Dessa forma, os pacientes apresentavam melhora clínica inicial causada pela simples oclusão da ferida. Enquanto o organismo receptor não reconhecia o tecido como alheio, os aloenxertos se comportavam como autógenos, ocorrendo revascularização e sinalização, ao leito subjacente, da oclusão da ferida, com consequente diminuição da resposta tanto inflamatória como vascular (tecido de granulação), típica das feridas em cicatrização por segunda intenção. A melhora do aporte sanguíneo aumentaria a eficiência dos macrófagos e a digestão de eventuais patógenos presentes no local26. Porém, com o início da rejeição tinham início alterações não só locais da ferida, como edema e piora da qualidade do tecido de granulação, mas também sistêmicas, como febre, irritabilidade e anorexia. Para redução dos efeitos imunológicos deletérios, foi preconizado o uso da pele alógena apenas como curativo biológico, sendo necessárias trocas dessa pele a cada cinco dias (sempre antecipando o início do processo de rejeição)26. No enxerto alógeno de pele, preparada com glicerol em alta concentração, há desaparecimento dos componentes celulares (imunógenos), de forma que essa pele passa a se comportar como uma matriz dérmica.
b) Produzidos por engenharia de tecidos:
Integra® - substituto cutâneo sintético, acelular e bilaminar, desenvolvido por Burke et al.27, composto por análogo dérmico, formado por matriz de colágeno bovino e condroitina-6-sulfato recoberto por fina lâmina de silastic (análogo epidérmico), que controla a perda de fluidos e reduz a invasão bacteriana. A matriz dérmica permite a invasão de fibroblastos e capilares advindos do leito receptor, possibilitando a reparação de uma estrutura dermoequivalente. Gradualmente, o colágeno é reabsorvido e estrutura-se nova matriz, em um período entre 3 e 6 semanas. Depois disso, a lâmina de silastic pode ser retirada. A principal indicação do Integra® é a cobertura de feridas de espessura total ou parcial profundas em grandes queimados que não apresentam áreas doadoras suficientes para utilização. Outras indicações possíveis são: a reconstrução de tecidos posterior à excisão de contraturas cicatriciais pós-queimaduras, úlceras crônicas e feridas traumáticas27. Dentre as vantagens de seu uso, destacam-se: cobertura imediata de grandes áreas pós-escarectomias extensas, imediata disponibilidade, redução da morbidade em áreas doadoras pelo uso de enxertos mais finos, redução da formação de cicatrizes hipertróficas, já que reduz a resposta inflamatória, e melhores resultados funcionais nas articulações e extremidades. Oferece, ainda, melhores resultados pela formação de um tecido mais elástico, quando comparado ao uso exclusivo dos enxertos de pele28. As maiores desvantagens incluem: alto custo, necessidade de treinamento para seu correto emprego, e alto risco de formação de hematoma ou seroma, causando perda do componente, quando colocada imediatamente após o desbridamento5. Biobrane® - substituto cutâneo biossintético constituído por membrana bilaminada, formada por rede de náilon preenchida com colágeno porcino tipo I (análogo dérmico) e recoberta por fina lâmina de silicone (análogo epidérmico). Possui pequenos poros que permitem a drenagem do transudado, sendo considerado um substituto semipermeável. Possibilita que fibroblastos e capilares invadam a ferida e possam reparar o defeito dérmico. A reepitelização ocorre a partir da presença de queratinócitos na borda da ferida5. São suas principais indicações: tratamento de queimaduras limpas superficiais e médias de espessura parcial, não causadas por produtos químicos ou à base de petróleo; cobertura temporária de áreas doadoras de enxertos de pele parcial; e proteção de enxertos autógenos em malha29.
Dentro do conceito de engenharia de tecidos, uma alternativa para o tratamento de feridas complexas é a associação dos substitutos cutâneos com cultura de queratinócitos:
Orcel® (contém células humanas vivas) - bicamada de matriz celular, em que queratinócitos epidérmicos e fibroblastos dérmicos humanos são cultivados em duas camadas separadas de colágeno bovino tipo I. Fibroblastos dérmicos de doadores são cultivados pelo lado de dentro da matriz de colágeno bovino, enquanto queratinócitos, do mesmo doador, são cultivados no lado de fora. Orcel® serve como uma matriz biocompatível reabsorvível, que proporciona um ambiente favorável para a migração da célula hospedeira, em decorrência das citocinas e dos fatores de crescimento secretados pelos fibroblastos alogênicos. Segundo o fabricante, após 2 a 3 semanas da aplicação, não são encontrados traços de DNA alogênico na ferida5. Apligraft® - estrutura bilaminar, formada por gel de colágeno bovino tipo I povoado por fibroblastos neonatais vivos e sobre ele uma camada de células epiteliais (queratinócitos neonatais)30. É indicado para tratamento de úlceras crônicas. Segundo estudo realizado31, esse substituto foi o único que obteve diferença estatisticamente significante ao tratar úlceras venosas juntamente com sistema de compressão multicamadas em relação a outro substituto dérmico e aos enxertos de pele autógenos.
Apesar de reconhecermos a importância das classificações apresentadas, há inegavelmente dificuldade de inclusão de alguns produtos reunidos na classe I de Kumar, que deveriam ser considerados curativos. Assim, o objetivo deste trabalho foi introduzir uma forma mais didática de agrupar os diferentes tipos de substitutos cutâneos mais frequentemente citados na literatura.
MÉTODO
Proposta de classificação dos substitutos cutâneos da Disciplina de Cirurgia Plástica da FMUSP
Os substitutos cutâneos podem ser classificados de forma mais abrangente se forem subdivididos segundo três critérios: camada da pele a ser substituída, subdivididos em epidérmicos (E), dérmicos (D) e compostos dermoepidérmicos (C); durabilidade no leito da ferida, subdivididos em temporários (T) e permanentes (P); e origem do material constituinte, subdivididos em biológicos (b), biossintéticos (bs) e sintéticos (s) (Figura 1).
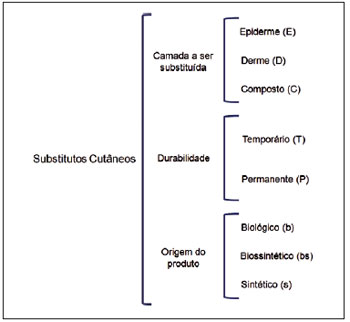
Figura 1 - Classificação dos substitutos cutâneos proposta pela Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Segundo essa classificação, temporários (T) são os produtos mantidos na ferida apenas por tempo suficiente para modular e melhorar as características da lesão, havendo a necessidade da resolução da ferida com enxerto autógeno; permanentes (P) são os que restauram parte ou a totalidade da estrutura da pele, permanecendo no leito da ferida mesmo após eventual enxertia de pele autógena para a completa cobertura da lesão; substitutos biológicos (b) são os criados a partir de algum produto de origem biológica, principalmente tecidos humanos ou animais, ou do cultivo de células humanas; sintéticos (s) são os produtos produzidos em laboratório, tentando recriar as estruturas da pele; e biossintéticos (bs) são os constituídos pela combinação de componentes sintéticos com elementos de origem biológica.
O Quadro 2 apresenta um painel geral dos substitutos cutâneos mais conhecidos e suas respectivas características.
DISCUSSÃO
Atualmente, os substitutos cutâneos têm grande importância para a cirurgia plástica, sendo principalmente utilizados no tratamento de queimaduras e outras feridas complexas, pois representam importante recurso para resolver essas soluções de continuidade cutâneas5.
Em revisão dos diversos tipos de substitutos cutâneos existentes no mercado internacional (pois, no Brasil, são poucos os representantes), percebe-se que não são muito precisas suas indicações e que a relação custo-benefício deve ser mais bem considerada, sobretudo no Brasil, onde são comercializados a custo elevado. Embora apresente benefícios, o tratamento com substitutos cutâneos ainda não é coberto pelo Sistema Único de Saúde (SUS), o que dificulta sua utilização para a população em geral. Apenas em alguns hospitais, principalmente nos universitários e em serviços particulares de referência, é empregado esse tratamento, seja como protocolo de pesquisa ou com o custo arcado pelo paciente.
Com o aumento da oferta desses produtos no mercado mundial e entendendo que esse tratamento poderia beneficiar maior número de pacientes em nosso meio, procedemos a uma revisão dos trabalhos mais representativos na literatura, em especial aqueles que procuraram sistematizar esses produtos, introduzindo alguns projetos de classificação, como a proposta por Kumar13.
Pela dificuldade em agrupar todos os produtos e de se conseguir indicações mais precisas para cada um deles, apresentadas pelas classificações mais conhecidas, introduzimos neste artigo nova classificação que consideramos mais abrangente e de aplicação mais prática para a cirurgia plástica. Incluímos, por exemplo, a cultura de queratinócitos autógenos, como substituto epidérmico, definitivo, de origem biológica, o que não havia sido contemplado na classificação de Kumar; além disso, outros novos produtos, como o Dermagraft®, puderam ser agrupados ao conjunto já existente.
Dermagraft® é um produto fabricado a partir de fibroblastos humanos obtidos do prepúcio de recém-nascidos, semeados em uma matriz de poliglactina bioabsorvível. Os fibroblastos proliferam, preenchendo espaços vazios existentes na matriz e secretando colágenos, outras proteínas de matriz, fatores de crescimento e citocinas, criando um substituto dérmico tridimensional contendo células vivas. Não há elementos epidérmicos nesse produto32.
Incluímos, em nossa classificação, o critério de durabilidade do substituto cutâneo no leito da ferida. Não está claro, na literatura, como conceituar essa durabilidade. Alguns investigadores pregam a permanência de resquícios do produto nesse leito, pois parece que muitos desses produtos não agem primariamente como repositores de tecidos ou células, mas sim como estímulo para reparação tecidual ou são agentes capazes de liberar sinalizadores na ferida12.
Ficou evidenciado, na revisão da literatura, que a utilização de materiais de origem biológica (pele de cadáver e tecidos cultivados) fora do Brasil, com finalidade comercial, é mais liberal. Em nosso meio, inexiste legislação mais específica para esses produtos, limitando seu estudo e sua aplicação.
O Laboratório de Cultura de Células da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP) vem, há alguns anos, aprimorando técnicas de cultivo celular para ampliar a segurança clínica da utilização dos substitutos dermoepidérmicos em seres humanos. Em 2001, publicamos o primeiro transplante clínico de epitélio cultivado33 e, desde então, temos dedicado muitos de nossos esforços para pesquisas nessa área.
A técnica de cultivo de queratinócitos por nós utilizada é a descrita por Rheinwald e Green34, que conseguiram criar em laboratório lâminas de epitélio humano estáveis para o transplante. Nessa técnica, a pele é digerida por enzimas proteolíticas, que degradam proteínas da adesão celular e liberam uma suspensão de queratinócitos e fibroblastos. Os queratinócitos se reproduzem em frascos de cultura sobre camada única de fibroblastos, cuja taxa de proliferação foi controlada, mas que fornecem a sinalização necessária à multiplicação coordenada dos queratinócitos. O autoenxerto de queratinócitos cultivados tem sido cada vez mais usado associado a matrizes dérmicas no tratamento de queimaduras, úlceras de membro inferior, defeitos de mucosa ou após excisão de nevus congênito gigante33. O transplante isolado de queratinócitos cultivados apresenta problemas, como baixo índice de integração das células ao leito receptor, sensibilidade à infecção e, principalmente, fragilidade da cobertura epitelial oferecida, pois a reconstrução da membrana basal é falha e falta o componente dérmico para gerar maior estabilidade estrutural ao novo tecido. O cultivo de queratinócitos sobre matrizes dérmicas, que muitos autores incluem na engenharia de tecidos, busca obter um tecido composto de melhor qualidade, menos friável e resistente a traumas6, mais próximo de uma dita "pele artificial".
Como Lazic e Falanga11, acreditamos que essa bioengenharia pode proporcionar grande avanço ao tratamento clínico e/ou cirúrgico das feridas, pois permitirá maior conhecimento sobre agentes terapêuticos que possam interferir na preparação do leito dessas feridas.
O desenvolvimento de novos materiais assim como o uso de cultura celular estão em andamento, não apenas para apurar o melhor tipo de substituto cutâneo para cada situação, mas, principalmente, para que os novos produtos sejam capazes de cobrir as feridas, reduzir a instalação de deformidades, tais como limitações funcionais, e propiciar resultados estéticos de melhor qualidade, mais rapidamente e com menor custo.
CONCLUSÕES
A proposição de classificação mais abrangente descrita neste estudo procurou incluir inovações tecnológicas e vem preencher uma necessidade para que possamos, em trabalhos futuros com séries clínicas específicas, ordenar melhor os produtos e obter dados sobre sua eficácia com maior evidência.
REFERÊNCIAS
1. Ferreira MC, Tuma P Jr, Carvalho VF, Kamamoto F. Complex wounds. Clinics (São Paulo). 2006;61(6):571-8.
2. Atiyeh BS, Costagliola M. Cultured epithelial autograft (CEA) in burn treatment: three decades later. Burns. 2007;33(4):405-13.
3. Catena F, Ansaloni L, Gazzotti F, Gagliardi S, Di Saverio S, D'Alessandro L, et al. Use of porcine dermal collagen graft (Permacol) for hernia repair in contaminated fields. Hernia. 2007;11(1):57-60.
4. Rheinwald JG, Green H. Growth of cultured mammalian cells on secondary glucose sources. Cell. 1974;2(4):287-93.
5. Shores JT, Gabriel A, Gupta S. Skin substitutes and alternatives: a review. Adv Skin Wound Care. 2007;20(9 Pt 1):493-508.
6. Paggiaro AO, Isaac C, Bariani G, Mathor M, Herson MR, Ferreira MC. Construção de equivalente dermo-epidérmico in vitro. Rev Soc Bras Cir Plást. 2007;22(3):153-7.
7. Arrunátegui G. Enxertos combinados de derme alógena residual, preservada em glicerol, sobreposta por pele autógena, como cobertura definitiva de queimaduras profundas: relatos de caso [dissertação de mestrado]. São Paulo: Faculdade de Medicina da Universidade de São Paulo; 2006.
8. Mackie DP. The Euro Skin Bank: development and application of glycerol-preserved allografts. J Burn Care Rehabil. 1997;18(1 Pt 2):S7-9.
9. Atiyeh BS, Gunn SW, Hayek SN. State of the art in burn treatment. World J Surg. 2005;29(2):131-48.
10. Horch RE, Kopp J, Kneser U, Beier J, Bach AD. Tissue engineering of cultured skin substitutes. J Cell Mol Med. 2005;9(3):592-608.
11. Lazic T, Falanga V. Bioengineered skin constructs and their use in wound healing. Plast Reconstr Surg. 2011;127(Suppl 1):75S-90S.
12. Balasubramani M, Kumar TR, Babu M. Skin substitutes: a review. Burns. 2001;27(5):534-44.
13. Kumar P. Classification of skin substitutes. Burns. 2008;34(1):148-9.
14. Paggiaro AO. Efeitos da radiação ionizante em membranas amnióticas gliceroladas empregadas como substrato ao cultivo de epitélio [tese de doutorado]. São Paulo: Faculdade de Medicina da Universidade de São Paulo; 2011.
15. Kumar RJ, Kimble RM, Boots R, Pegg SP. Treatment of partial-thickness burns: a prospective, randomized trial using Transcyte. ANZ J Surg. 2004;74(8):622-6.
16. Ortega-Zilic N, Hunziker T, Läuchli S, Mayer DO, Huber C, Baumann Conzett K, et al. EpiDex® Swiss field trial 2004-2008. Dermatology. 2010;221(4):365-72.
17. Hafner J, Kuhne A, Trueb RM. Successful grafting with EpiDex in pyoderma gangrenosum. Dermatology. 2006;212(3):258-9.
18. Brown-Estris M, Cutshall W, Hiles M. A new biomaterial derived from small intestinal submucosa and developed into a wound matrix device. Wounds. 2002;14:150-66.
19. Demling R, Niezgoda J, Haraway G, Mostow E. Small intestinal submucosa wound matrix and full thickness venous ulcers. Wounds. 2004;16;18-23.
20. Niezgoda JA, Van Gils CC, Frykberg RG, Hodde JP. Randomized clinical trial comparing OASIS wound matrix to regranex gel for diabetic ulcers. Adv Skin Wound Care. 2005;18(5 Pt 1):258-66.
21. Harper C. Permacol: clinical experience with a new biomaterial. Hosp Med. 2001;62(2):90-5.
22. Parker DM, Armstrong PJ, Frizzi JD, North JH Jr. Porcine dermal collagen (Permacol) for abdominal wall reconstruction. Curr Surg. 2006;63(4):255-8.
23. Haslik W, Kamolz LP, Nathschläger G, Andel H, Meissl G, Frey M. First experiences with the collagen-elastin matrix Matriderm as a dermal substitute in severe burn injuries of the hand. Burns. 2007;33(3):364-8.
24. Wainwright DJ. Use of an acellular allograft dermal matrix (AlloDerm) in the management of full-thickness burns. Burns. 1995;21(4):243-8.
25. Gibson T, Medawar PB. The fate of skin homografts in man. J Anat. 1943;77(Pt 4):299-310.
26. Shuck JM, Pruitt BA Jr, Moncrief JA. Homograft skin for wound coverage. A study of versatility. Arch Surg. 1969;98(4):472-9.
27. Burke JF, Yannas IV, Quinby WC Jr, Bondoc CC, Jung WK. Successful use of a physiologically acceptable artificial skin in the treatment of extensive burn injury. Ann Surg. 1981;194(4):413-28.
28. Groos N, Guillot M, Zilliox R, Braye FM. Use of an artificial dermis (Integra) for the reconstruction of extensive burn scars in children. About 22 grafts. Eur J Pediatr Surg. 2005;15(3):187-92.
29. Cassidy C, St Peter SD, Lacey S, Beery M, Ward-Smith P, Sharp RJ, et al. Biobrane versus duoderm for the treatment of intermediate thickness burns in children: a prospective, randomized trial. Burns. 2005;31(7):890-3.
30. Falanga V, Sabolinski M. A bilayered living skin construct (APLIGRAF) accelerates complete closure of hard-to-heal venous ulcers. Wound Repair Regen. 1999;7(4):201-7.
31. Jones JE, Nelson EA. Skin grafting for venous leg ulcers. Cochrane Database Syst Rev. 2005;(1):CD001737.
32. Marston WA, Hanft J, Norwood P, Pollak R; Dermagraft Diabetic Foot Ulcer Study Group. The efficacy and safety of Dermagraft in improving the healing of chronic diabetic foot ulcers: results of a prospective randomized trial. Diabetes Care. 2003;26(6):1701-5.
33. Herson MR, Mathor MB, Altran S, Capelozzi VL, Ferreira MC. In vitro construction of a potential skin substitute through direct human keratinocyte plating onto decellularized glycerol-preserved allodermis. Artif Organs. 2001;25(11):901-6.
34. Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 1975;6(3):331-43.
1. Professor titular da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.
2. Doutor, responsável pelo Banco de Tecidos do Instituto Central do HCFMUSP, São Paulo, SP, Brasil.
3. Doutor, responsável pelo Laboratório de Cultura de Células da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
4. Médico residente da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
5. Médico residente da Disciplina de Cirurgia Geral do HCFMUSP, São Paulo, SP, Brasil.
Correspondência para:
Cesar Isaac
Av. Doutor Arnaldo, 455 - sala 1.360 - Pinheiros
São Paulo, SP, Brasil - CEP 01246-903
E-mail: cesaris@plastica.fm.usp.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 25/7/2011
Artigo aceito: 13/8/2011
Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter