

Original Article - Year 2011 - Volume 26 -
Efeito da oxigenação hiperbárica e da N-acetilcisteína na viabilidade de retalhos cutâneos em ratos
Effects of hyperbaric oxygenation and N-acetylcysteine on the survival of random-pattern skin flaps in rats
RESUMO
INTRODUÇÃO: Os avanços das técnicas em cirurgia plástica permitiram a reconstrução de extensos defeitos causados por ferimentos, entre as quais destaca-se a utilização dos retalhos randômicos. No entanto, o fator limitante para a utilização desses retalhos é a imprevisibilidade de sua vascularização distal, o que poderá ocasionar danos irreversíveis à microcirculação, resultando em necrose parcial ou completa do retalho, tornando a ferida mais suscetível a infecção. Portanto, melhorar a viabilidade do retalho randômico, principalmente em sua extremidade distal, tem sido uma meta importante para o sucesso dessa técnica. O objetivo deste estudo foi investigar o papel da oxigenação hiperbárica (OHB), da N-acetilcisteína (NAC) e da associação de ambas (OHB + NAC) na área de necrose em retalhos randômicos modificados de McFarlane em pele de ratos Wistar.
MÉTODO: No total, 32 ratos Wistar machos foram divididos aleatoriamente em grupo Sham (GS, n = 8), grupo N-acetilcisteína (GNAC, n = 8), grupo oxigênio hiperbárico (GOHB, n = 8) e grupo oxigênio hiperbárico + N-acetilcisteína (GHN, n = 8). Sob anestesia geral, foi executado um retalho randômico modificado de McFarlane na região dorsal dos ratos.
RESULTADOS: A necrose média foi de 18,3%, 24,3%, 12,6% e 14,9%, respectivamente, nos grupos GS, GNAC, GOHB e GHN. Os grupos GOHB e GHN apresentaram diferença significativa quando comparados ao grupo GNAC.
CONCLUSÕES: A OHB está associada a redução da área de necrose do retalho cutâneo. A NAC foi associada a maus resultados quando usada isoladamente. A associação dos dois procedimentos, OHB e NAC, não potencializou os resultados favoráveis observados com o uso da OHB isoladamente. As descobertas sugerem que a difusão de oxigênio através do espaço intersticial foi o fator determinante de resultados mais favoráveis da OHB.
Palavras-chave: Oxigenação hiperbárica. N-acetilcisteína. Retalhos cirúrgicos.
ABSTRACT
BACKGROUND: Advances in plastic surgery techniques have enabled reconstruction of extensive wound damage, especially through the use of random flaps. However, the limiting factor for the use of these flaps is the unpredictable blood supply, which may produce irreversible damage to the microcirculation and result in partial or complete flap necrosis, making the wound more susceptible to infection. Therefore, improvement of random flaps, especially in the distal extremity, has been an essential goal for the success of this technique. The objective of this study was to investigate the effects of hyperbaric oxygenation (HBO), N-acetylcysteine (NAC), and the combination of both (HBO + NAC) on the degree of necrosis in modified McFarlane random skin flaps on Wistar rats.
METHODS: A total of 32 male Wistar rats were randomly divided into a sham treatment group (SG, n = 8), N-acetylcysteine group (NACG, n = 8), hyperbaric oxygenation group (HBOG, n = 8), and hyperbaric oxygenation plus N-acetylcysteine group (HNG, n = 8). Modified McFarlane random flaps were created in the dorsal region of the rats.
RESULTS: The average area of the flaps exhibiting necrosis was 18.3%, 24.3%, 12.6%, and 14.9%, in the SG, NACG, HBOG, and HNG, respectively. The necrotic areas in the HBOG and HNG were significantly smaller than that in the NACG.
CONCLUSIONS: HBO treatment was associated with a reduction in the area of necrosis in the skin flaps. NAC treatment alone gave poor results. The use of HBO and NAC in combination did not improve the outcome compared with the use of HBO alone. The findings suggest that oxygen diffusion through the interstitial space was the factor responsible for the favorable results of HBO.
Keywords: Hyperbaric oxygenation. N-acetylcysteine. Surgical flaps.
Os avanços das técnicas em cirurgia plástica permitiram a reconstrução de extensos defeitos causados por ferimentos, entre as quais destaca-se a utilização dos retalhos randômicos. No entanto, o fator limitante para a utilização desses retalhos é a imprevisibilidade de sua vascularização distal, o que poderá ocasionar danos irreversíveis à microcirculação, resultando em necrose parcial ou completa do retalho1, tornando a ferida mais suscetível a infecção. Portanto, melhorar a viabilidade do retalho randômico, principalmente em sua extremidade distal, tem sido uma meta importante para o sucesso dessa técnica1-3.
O dano celular que ocorre durante a reperfusão tecidual após a isquemia é resultado de uma cascata de eventos envolvendo o oxigênio, a produção de radicais livres e a liberação de mediadores inflamatórios4,5. O oxigênio molecular, dessa forma, parece desempenhar papel central no processo de cicatrização4. A hiperoxia causada pela oxigenação hiperbárica (OHB) aumenta a tolerância dos tecidos à isquemia, incrementando os mecanismos biológicos de defesa contra radicais livres6 e aumentando a capacidade dos tecidos de suportar a isquemia tecidual2,7.
A OHB tem efeito protetor na microcirculação, possivelmente por interferir na ação deletéria causada pela ativação dos neutrófilos sobre o endotélio microvascular8. Essa habilidade de interferir nos neutrófilos estimula a angiogênese e aumenta a atividade da síntese de fibroblastos e de colágeno4,9.
Os mamíferos têm um complexo sistema antioxidativo para se proteger de algum tipo de estresse. Um dos componentes mais importantes do sistema antioxidativo intracelular é a glutationa, um poderoso varredor de radicais livres ativo, que é depletado quando se estabelece o fenômeno da isquemia-reperfusão (IR)10. A N-acetilcisteína (NAC) é um pró-fármaco que fornece cisteína biodisponível para a reposição de glutationa9 na presença de espécies ativas de oxigênio (EROS), quando os níveis de glutationa diminuem nas células.
A NAC previne grande parte dos efeitos deletérios envolvidos no processo de estresse oxidativo durante a exposição à OHB11. O objetivo dos autores foi investigar o papel da OHB, da NAC isoladamente e da associação da OHB com a NAC na viabilidade de retalhos randômicos em ratos utilizando o modelo preconizado por McFarlane et al.12.
MÉTODO
Aspectos Éticos
O protocolo experimental foi aprovado pelo Comitê de Ética da Universidade Federal de São Paulo (UNIFESP), sob o número 1431-1403. Todos os procedimentos seguiram rigorosamente os regulamentos existentes sobre a experimentação animal do Colégio Brasileiro de Experimentação em Animais (COBEA).
Alojamento dos Animais e Grupos Experimentais
Trinta e dois ratos machos Wistar, pesando entre 280 g e 300 g, foram mantidos em gaiolas individuais, em salas acusticamente isoladas, a 25ºC, com iluminação artificial e com ração e água ad libitum.
Os animais foram divididos aleatoriamente em grupo Sham (GS, n = 8), grupo N-acetilcisteína (GNAC, n = 8), grupo oxigênio hiperbárico (GOHB, n = 8) e grupo oxigênio hiperbárico + NAC (GHN, n = 8).
Procedimento Anestésico
Após seis horas de jejum para dieta sólida e quatro horas para dieta líquida, os animais receberam 5 mg/kg, intramuscular, de acepromazina (Acepran® 0,2%, Vetnil Indústria e Comércio de Produtos Veterinários Ltda., São Paulo, Brasil). Dez minutos depois, receberam uma associação de 50 mg/kg, intramuscular, de quetamina (Ketalar®, Pfizer do Brasil, São Paulo, Brasil) e 10 mg/kg, intramuscular, de xilazina (Rompum®, Bayer, São Paulo, Brasil).
Procedimento Cirúrgico
Sob anestesia geral, as regiões dorsais foram epiladas e os animais, fixados em decúbito ventral. A área retangular (2 cm x 8 cm) foi marcada longitudinalmente com tinta, com base na 7ª vértebra cervical em direção à posição caudal, tendo a coluna como marco central. As marcações foram incisadas com bisturi nº 15 e a pele do retalho foi descolada da musculatura dorsal (Figura 1). Um filme de polietileno foi colocado sobre a porção muscular, que abrangeu toda a área da ferida, agindo, assim, como uma barreira entre o retalho e o tecido muscular (Figura 2). Em seguida, foi realizada sutura interrompida com náilon 3.0 (Mononylon®, Ethicon, São Paulo, Brasil) fixando o retalho cutâneo na sua posição original.
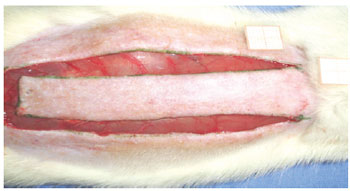
Figura 1 - Retalho cutâneo randômico (2 cm x 8 cm) padronizado de McFarlane, com base na 7a vértebra cervical.
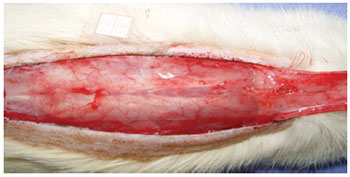
Figura 2 - Filme de polietileno colocado sobre a camada muscular, cobrindo toda a área da ferida e agindo como uma barreira entre a pele e os músculos
Procedimento de Administração da NAC e Água Destilada
A dose de 300 mg/kg de NAC (Fluimucil® acetilcisteína 300 mg/3ml, Zambon Laboratório Farmacêutico Ltda., São Paulo, Brasil) foi injetada intraperitonealmente após a elevação do retalho de pele e, consecutivamente, a cada 24 horas, durante sete dias, nos grupos GNAC e GHN. Nos grupos GS e GOHB, foi injetado intraperitonealmente 1 ml de água destilada (Isofarma, São Paulo, Brasil) após a elevação do retalho de pele e, consecutivamente, a cada 24 horas, durante sete dias.
Procedimento com OHB
A OHB foi realizada em uma câmara hiperbárica experimental para animais13 da Universidade Regional do Alto Uruguai Campus Erechim (URI) (Figura 3).

Figura 3 - Câmara hiperbárica experimental para animais, onde foi realizada a oxigenação hiperbárica.
Antes da pressurização, foi realizada lavagem da câmara por 5 minutos, utilizando-se oxigênio medicinal a 100%. A pressão de oxigênio foi então aumentada a uma taxa constante até atingir a pressão de 2,4 ATA. A concentração de oxigênio foi monitorada com um oxímetro calibrado. Os animais foram colocados na câmara hiperbárica aleatoriamente. Todos os animais dos grupos GOHB e GHN foram expostos a 100% de oxigênio em 2,4 ATA durante duas horas (uma vez por dia), iniciando 15 minutos após a fixação do retalho e a cada 24 horas, nos sete dias consecutivos.
Sequência dos Procedimentos Diários
A sequência de procedimentos em cada grupo está resumida na Figura 4. Os animais foram divididos aleatoriamente nos seguintes grupos:

Figura 4 - Fluxograma de procedimentos: GS, procedimentos no retalho e 8 injeções diárias de solução salina intraperitoneal; GNAC, procedimentos no retalho e 8 injeções diárias de N-acetilcisteína intraperitoneal; GOHB, procedimentos no retalho e 8 sessões diárias de oxigenação hiperbárica; GHN, procedimentos no retalho e 8 injeções diárias de N-acetilcisteína seguidas pela oxigenação hiperbárica. GHN = grupo oxigênio hiperbárico + N-acetilcisteína; GNAC = grupo N-acetilcisteína; GOHB = grupo oxigênio hiperbárico; GS = grupo Sham.
Sham (n = 8), que recebeu água destilada intraperitonealmente 15 minutos após a elevação do retalho e durante 7 dias consecutivos; NAC (n = 8), que recebeu 300 mg/kg1 intraperitonealmente, após elevação do retalho e durante 7 dias consecutivos; OHB (n = 8), em que todos os ratos foram expostos a oxigênio hiperbárico 100% a 2,4 ATA, 15 minutos após o procedimento e após 7 dias consecutivos, duas horas por dia cada um; GHN (n = 8), que recebeu a associação de NAC e OHB durante 7 dias consecutivos.
Acompanhamento
Todos os dias, duas vezes por dia, os animais eram examinados, sendo registrada a ocorrência de febre e de infecção da incisão. Caso fosse identificado qualquer sinal de sofrimento grave, a veterinária interromperia a investigação e os animais seriam enviados para eutanásia.
No 8º dia, os animais foram anestesiados e fixados em posição de pronação. A região dorsal foi fotografada a partir de uma distância padrão por câmera digital (SonyTP200, Sony, Japão) com 7,2 mega pixels e os arquivos foram salvos em formato JPEG.
Eutanásia
Sob anestesia, após retirada de amostras, os animais foram colocados em uma câmara com dióxido de carbono (CO2) até a parada cardiorrespiratória.
Determinação da Área de Necrose do Retalho
No 8º dia de pós-operatório, a área do retalho foi fotografada e comparada com o primeiro dia de experimento. A necrose foi definida pela coloração escura e pela formação de escaras. As imagens fotográficas foram capturadas no computador pelo software Image Pro Plus 4.5®. A média de área de necrose do retalho foi então avaliada para todos os grupos. Todos os resultados foram representados como média e desvio padrão.
Análise Estatística
As áreas de necrose foram expressas como média e desvio padrão (SPSS versão 11.0). As diferenças entre as médias das áreas de necrose foram feitas por análise de variância (ANOVA), aplicando o post hoc teste de Bonferroni. O valor P de 5% (P < 0,05) foi considerado estatisticamente significante.
RESULTADOS
Na Figura 5 é apresentada a média de necrose (%) por grupos. A área de necrose média foi de 18,3% no grupo Sham, de 24,3% no GNAC, de 12,6% no GOHB, e de 14,9% no GHN.

Figura 5 - Médias e desvio padrão da porcentagem de necrose sobre o retalho cutâneo randômico nos grupos GS, GNAC, GOHB e GHN. As médias de necrose em todos os grupos do experimento foram menores que as do grupo GS. Houve diferença significativa entre os grupos GOHB < GNAC (P < 0,01) e GHN < GNAC (P < 0,001) (teste ANOVA). GHN = grupo oxigênio hiperbárico + N-acetilcisteína; GNAC = grupo N-acetilcisteína; GOHB = grupo oxigênio hiperbárico; GS = grupo Sham.
Na Tabela 1 são descritos os resultados da avaliação macroscópica (área em mm2) para cada grupo de tratamento.

O GOHB apresentou menor área de necrose que o GS, mas não significante (P = 0,12), e uma diferença significativa com o GNAC (P < 0,01), e a viabilidade do retalho do GOHB foi o mesmo que a do GHN. O grupo GHN demonstrou diferença significativa quando comparado ao GNAC (P < 0,01).
Neste estudo, a OHB sozinha levou ao aumento da viabilidade dos retalhos de pele. A combinação de NAC e OHB, ao contrário do esperado, não demonstrou melhora da viabilidade dos retalhos quando comparada ao efeito da OHB isoladamente.
DISCUSSÃO
Existem muitas controvérsias quanto às propriedades angiogênicas da OHB. Em feridas de pele, a OHB foi utilizada para aumentar a tensão das fibras e para estimular a angiogênese2,3. As propriedades angiogênicas induzidas pela OHB são responsáveis pela elevação da tensão de oxigênio, que pode persistir por algumas horas após a OHB6,8. As repetidas exposições produzem o efeito on-off, proporcionando ambiente favorável em retalhos randômicos quando comparados aos grupos que não a utilizaram (GS e GNAC).
Neste estudo, a administração de OHB por duas horas consecutivas, durante sete dias após a cirurgia, demonstrou melhora da viabilidade dos retalhos cutâneos randômicos, em nítido contraste com hipótese original, que sugeria que a adição de oxigênio extra aumentaria a produção de radicais livres e resultaria em aumento das áreas de necrose do retalho. A hipótese atualmente mais aceita seria que a OHB provocaria vasoconstrição periférica arteriolar, o que teoricamente neutraliza a vasodilatação reflexa pós-isquemia, diminuindo o líquido intersticial e o edema, e melhorando, dessa forma, a viabilidade dos retalhos3,7.
Hong et al.14 demonstraram que tecidos hipóxicos, quando submetidos a OHB, desenvolvem aumento da pressão de oxigênio (pO2) plasmática, reduzindo a hipoxia tecidual. Esse mecanismo seria decorrente do aumento da taxa de difusão do oxigênio.
A NAC é um precursor da glutationa, potente antioxidante endógeno, que age inibindo a indução de citocinas pró-inflamatórias, a óxido nítrico sintase (iNOS), as moléculas de adesão 1 e as moléculas de adesão celular vascular 110,15-17, além de estimular a produção de óxido nítrico (NO)18.
Neste estudo, os retalhos tratados somente com OHB apresentaram aumento médio da viabilidade quando comparados àqueles tratados com a associação de OHB e NAC, sugerindo que esses agentes não se potencializam. Os grupos tratados com água destilada e NAC isoladamente apresentaram os piores resultados neste experimento.
As doses de NAC (300 mg/kg-1/dia) utilizadas no presente estudo foram determinadas pela baixa toxicidade dessa droga e por relatos de resultados favoráveis encontrados na proteção de retalhos cutâneos randômicos em ratos em outros estudos. A barreira plástica interposta entre o retalho e o leito doador impediu a revascularização do retalho a partir de seu leito19.
A utilização da OHB em associação com a NAC pode ter sido responsável por um efeito protetor sobre o efeito deletério causado pela NAC. Quando utilizada isoladamente, a NAC resulta em áreas de necrose maiores (24%); a associação, por outro lado, apresentou resultado significativamente melhor (15%) (P < 0,01).
É provável que, neste estudo, a alta concentração de NAC tenha inibido a angiogênese e a resposta cicatricial, quer pelo desequilíbrio no estado de cell redox quer por meio de um mecanismo ainda não bem determinado9.
Tem sido demonstrado que a OHB pode aumentar a tolerância dos tecidos à isquemia, além de diminuir os distúrbios metabólicos por ela causados. A OHB também melhora a microcirculação dos tecidos, reduzindo a agregação plaquetária. Essas características, combinadas com a maior capacidade do plasma em transportar oxigênio dissolvido para áreas onde as células vermelhas do sangue não podem chegar, têm se mostrado como mecanismo importante para o efeito benéfico na oxigenação de muitos tecidos hipóxicos2,20.
No presente estudo, a OHB combinada a antioxidantes não melhorou a sobrevivência dos retalhos quando comparada à OHB utilizada isoladamente, sugerindo que os potenciais efeitos tóxicos da hiperóxia, como a produção de espécies reativas de oxigênio, não foram minimizados pela terapia antioxidante com NAC.
Acredita-se que baixas concentrações de espécies reativas de oxigênio possam desempenhar papel benéfico na cicatrização dos tecidos6. Espécies oxidantes, como radicais livres e peróxido de hidrogênio, podem servir como mensageiros celulares, mediando processos como a formação da matriz extracelular, a ação de citocinas, a angiogênese e a mobilidade celular, estimulando, dessa maneira, a cicatrização9.
CONCLUSÕES
A OHB está associada a redução da área de necrose do retalho cutâneo. A NAC foi associada a maus resultados quando usada isoladamente. A associação dos dois procedimentos, OHB e NAC, não produziu potencialização dos resultados favoráveis observados com o uso da OHB isoladamente. As descobertas sugerem que a difusão de oxigênio através do espaço intersticial foi o fator determinante de resultados mais favoráveis da OHB.
REFERÊNCIAS
1. Matsumara H, Yoshizawa N, Vedder NB, Watanabe K. Preconditioning of the distal portion of a rat random-pattern skin flap. Br J Plast Surg. 2001;54(1):58-61.
2. Richards L, Lineaweaver WC, Stile F, Zhang F, Zhang F. Effect of hyperbaric oxygen therapy on the tubed pedicle flap survival in a rat model. Ann Plast Surg. 2003;50(1):51-6.
3. Ulkür E, Yüksel F, Açikel C, Celiköz B. Effect of hyperbaric oxygen on pedicle flaps with compromised circulation. Microsurgery. 2002;22(1):16-20.
4. Buras J. Basic mechanisms of hyperbaric oxygen in the treatment of ischemic-reperfusion injury. Int Anesthesiol Clin. 2000;38(1):91-109.
5. Ayhan S, Tugay C, Norton S, Araneo B, Siemionow M. Dehydroepiandrosterone protects the microcirculation of the muscle flaps from ischemia-reperfusion injury by reducing the expression of adhesion molecules. Plast Reconstr Surg. 2003;111(7):2286-94.
6. Zhang T, Gong W, Li Z, Yang S, Zhang K, Yin D, et al. Efficacy of hyperbaric oxygen on survival of random pattern skin flap in diabetic rats. Undersea Hyperb Med. 2007;34(5):335-9.
7. Ulkür E, Karagoz H, Ergun O, Celikoz B, Yildiz S, Yildirim S. The effect of hyperbaric oxygen therapy on the delay procedure. Plast Reconstr Surg. 2007;119(1):86-94.
8. Kranke P, Bennett M, Roeckl-Wiedmann I, Debus S. Hyperbaric oxygen therapy for chronic wounds. Cochrane Library. 2004;(4). Disponível em: http//www.cochrane.org/reviews/ (acesso em 26/1/2010).
9. Kunnavatana SS, Quan SY, Koch RJ. Combined effect of hyperbaric oxygen and N-acetylcysteine on fibroblast proliferation. Arch Otolaryngol Head Neck Surg. 2005;131(9):809-14.
10. Glantzounis GK, Yang W, Koti RS, Mikhailidis DP, Seifalian AM, Davidson BR. Continuous infusion of N-acetylcysteine reduces liver warm ischaemia reperfusion injury. Br J Surg. 2004;91(10):1330-9.
11. Arrais-Silva WW, Colhone MC, Ayres DC, Souza Souto PC, Giorgio S. Effects of hyperbaric oxygen on Leishmania amazonensis promastigotes and amastigotes. Parasitol Int. 2005;54(1):1-7.
12. McFarlane RM, Deyoung G, Henry RA. The design of a pedicle flap in the rat to study necrosis and its prevention. Plast Reconstr Surg. 1965;35:177-82.
13. Rech FV, Fagundes DJ, Hermanson R, Rivoire HC, Fagundes ALN. Uma proposta de câmara hiperbárica para uso em animal de experimentação e uso veterinário. Acta Cir Bras. 2008;23(4):384-90.
14. Hong JP, Kwon H, Chung YK, Jung SH. The effect of hyperbaric oxygen on ischemia-reperfusion injury: an experimental study in a rat musculocutaneous flap. Ann Plast Surg. 2003;51(5):478-87.
15. Haase M, Haase-Fielitz A, Ratnaike S, Reade MC, Bagshaw SM, Morgera S, et al. N-Acetylcysteine does not artifactually lower plasma creatinine concentration. Nephrol Dial Transplant. 2008;23(5):1581-7.
16. Adabag AS, Ishani A, Koneswaran S, Johnson DJ, Kelly RF, Ward HB, et al. Utility of N-acetylcysteine to prevent acute kidney injury after cardiac surgery: a randomized controlled trial. Am Heart J. 2008;155(6):1143-9.
17. Miner SE, Dzavik V, Nguyen-Ho P, Richardson R, Mitchell J, Atchison D, et al. N-acetylcysteine reduces contrast-associated nephropathy but not clinical events during long-term follow-up. Am Heart J. 2004;148(4):690-5.
18. Deshpande VS, Kehrer JP. Mechanisms of N-acetylcysteine-driven enhancement of MK886-induced apoptosis. Cell Biol Toxicol. 2006;22(4):303-11.
19. Abla LE, Gomes HC, Percario S, Ferreira LM. Acetylcysteine in random skin flap in rats. Acta Cir Bras. 2005;20(2):121-3.
20. Kiumehr S, Demehri S, Rabbani S, Amanpour S, Mohagheghi MA, Dehpour AR. Preconditioning of the rat random-pattern skin flap: modulation by opioids. Br J Plast Surg. 2005;58(1):58-64.
1. Doutor, membro associado da Sociedade Brasileira de Cirurgia Plástica, professor do Departamento de Cirurgia da Universidade Católica de Pelotas, Pelotas, RS, Brasil.
2. Doutor, professor associado em Técnica Operatória e Cirurgia Experimental do Departamento de Cirurgia da Universidade Federal de São Paulo, São Paulo, SP, Brasil.
3. Acadêmico de Medicina, presidente da Liga Acadêmica de Cirurgia Plástica da Universidade Federal de Pelotas, Pelotas, RS, Brasil.
4. Acadêmica de Medicina da Universidade Federal de Pelotas, Pelotas, RS, Brasil.
Correspondência para:
Fernando Passos da Rocha
Praça Piratinino de Almeida, 13 - Centro
Pelotas, RS, Brasil - CEP 96015-290
E-mail: artigosplastica@hotmail.com
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 21/6/2011
Artigo aceito: 29/7/2011
Trabalho realizado na Universidade Federal de Pelotas e na Universidade Católica de Pelotas, Pelotas, RS, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter