

Original Article - Year 2011 - Volume 26 -
Papel do queratinócito na contração da ferida: avaliação de impacto usando um modelo de matriz de colágeno povoada por fibroblastos
Role of keratinocytes in wound contraction: an impact assessment using a model of collagen matrix populated with fibroblasts
RESUMO
Introdução: A eventual participação de queratinócitos na remodelagem da ferida tem sido estudada há muito tempo. Este trabalho investigou o impacto dos queratinócitos na contração da ferida. Métodos: Foi utilizado gel de colágeno tipo I murino povoado por fibroblastos humanos com queratinócitos humanos semeado na superfície (grupo estudo), formando um equivalente dermoepidérmico. Géis de colágeno povoado apenas por fibroblastos foram utilizados como grupo controle. Os critérios de confecção e armazenagem dos géis foram iguais para ambos os grupos. Resultados: Houve aumento evidente e estatisticamente significante na contração de gel das amostras povoadas por queratinócitos, em comparação ao grupo controle. Conclusões: Esses resultados sugerem que os queratinócitos não só podem modular a proliferação de fibroblastos, mas também, por si só, desempenhar papel ativo na contração da ferida. Novas investigações sobre mecanismos envolvidos nas vias de comunicação entre células e entre célula e matriz devem ser avaliadas sob o ponto de vista de participação dos queratinócitos na cicatrização de feridas e formação de cicatrizes patológicas.
Palavras-chave: Queratinócitos. Cicatrização. Técnicas de cultura de células. Fibroblastos.
ABSTRACT
Background: The possible participation of keratinocytes in wound remodeling has been widely studied. This study investigated the impact of keratinocytes in wound contraction. Methods: Murine type I collagen gels populated by human fibroblasts and seeded with human keratinocytes on the surface to form a dermo-epidermal equivalent were used as the study group. Collagen gels populated by only fibroblasts were used as the control group. The criteria for the preparation and storage of gels were similar for both groups. Results: An evident and statistically significant increase in gel contraction was observed in samples populated by keratinocytes compared to the control group. Conclusions: These results suggest that keratinocytes not only modulate fibroblast proliferation but also play an active role in wound contraction per se. Further research on the mechanisms involved in the communication pathways between cells and between cells and the matrix shall be assessed from the perspective of keratinocyte participation in wound healing and pathologic scarring.
Keywords: Keratinocytes. Wound healing. Cell culture techniques. Fibroblasts.
Agressão ao tecido induz uma cascata de reações bioquímicas e celulares que se destinam a reparar a integridade dos tecidos. O processo de cicatrização envolve uma "orquestra" afinada de células, em que cada participante interage com outros.
Muitos aspectos dessa comunicação intercelular permanecem obscuros, apesar do fato inquestionável de que as células são responsáveis pela liberação de fatores de crescimento e outras moléculas sinalizadoras que interferem ativamente na ferida, modulando o microambiente e as respostas celulares1,2. Dentre os componentes dessa orquestra, os fibroblastos apresentam várias funções na cicatrização de feridas. Primeiramente, os fibroblastos proliferam no local da ferida e secretam colágenos na matriz extracelular, preenchendo o vazio e recriando um novo suporte estrutural para que a epiderme possa proliferar. Em segundo lugar, contraem o leito da ferida, ação que tem início 4 a 5 dias após a lesão e atinge seu pico 12 a 15 dias após a lesão. Essa característica pode persistir por períodos mais longos, especialmente se a ferida continuar aberta3-7.
A bioengenharia revolucionou as pesquisas na área de cicatrização, permitindo o estabelecimento de modelos in vitro e sistemas de cultura de células que podem mimetizar as diferentes fases de cicatrização de feridas. Em particular, as culturas de queratinócitos sobre substitutos dérmicos traduzem um melhor cenário para observação da interação dessas células com a matriz subjacente.
Em 1979, Bell et al.8 estabeleceram modelo de gel de colágeno murino povoado por fibroblastos, cuja função contrátil determinada por essas células poderia ser avaliada e modificada pela ação de moduladores. Esse modelo tornou-se um clássico para avaliação da remodelagem do colágeno e estudos de contração da ferida9,10.
A eventual participação de queratinócitos na remodelagem da ferida foi levantada por Souren et al.11, em 1989, quando relataram que géis colágeno poderiam ser rearranjados se queratinócitos fossem semeados sobre suas superfícies, efeito que não era observado se as células fossem semeadas no interior do gel.
Ralston et al.12, em pesquisas sobre substitutos dermoepidérmicos, utilizaram o gel de colágeno povoado por fibroblastos como leito para culturas de queratinócitos e relataram a participação de queratinócitos na contração da matriz extracelular.
No laboratório de pesquisa em que este estudo foi realizado, enquanto eram desenvolvidos compósitos dermoepidérmicos, observou-se que, uma vez liberada da derme, a epiderme apresentava área maior que seu substrato dérmico, quase como se a camada de queratinócitos fosse liberada de uma força de contração e adesão. Observou-se, também, que superfícies dérmicas povoadas por queratinócitos sofriam contração progressiva à medida que as células proliferavam e se reorganizavam em epitélio confluente e multiestratificado13. Essas observações intrigantes reforçaram a sugestão de que os queratinócitos podem também ter papel ativo na contração da ferida.
Este trabalho teve como objetivo avaliar e quantificar o potencial dos queratinócitos na contração da ferida, utilizando um modelo in vitro, preestabelecido, de contração de gel de colágeno povoado por fibroblastos.
MÉTODO
Cultura Primária de Queratinócitos e Fibroblastos
Queratinócitos e fibroblastos humanos foram isolados a partir de restos cirúrgicos de pele doados para fins de investigação por 5 mulheres saudáveis, com idades entre 18 anos e 42 anos.
Queratinócitos foram isolados por dissociação química (enzimática), como descrito por Rheinwald & Green14. Células obtidas entre a segunda e a quinta passagens foram contadas e ressuspendidas em meio de cultura contendo 60% Dulbecco's Modified Eagle's Medium (DMEM) (GIBCO - Life Technologies, Baltimore, Estados Unidos), 30% Ham12% (GIBCO - Life Technologies, Baltimore, Estados Unidos), 10% soro bovino fetal (GIBCO - Life Technologies, Baltimore, Estados Unidos), glutamina 4 mM (GIBCO - Life Technologies, Baltimore, Estados Unidos), adenina 0,18 mM (Sigma Chemical - St. Louis, Estados Unidos), insulina 5 µg/ml (Sigma Chemical - St. Louis, MO, EUA), hidrocortisona 0,4 µg/ml (Sigma Chemical - St. Louis, Estados Unidos), toxina colérica 0,1 mM (Sigma Chemical - St. Louis, Estados Unidos), triiodotironina 2 mM (Sigma Chemical - St. Louis, Estados Unidos), e solução de antibióticos (100 UI/ml de penicilina/estreptomicina 100 µg/ml) (Sigma Chemical - St. Louis, Estados Unidos).
As culturas primárias de queratinócitos foram estabelecidas pela semeadura de 5x106 células em suspensão de 5 ml do meio de cultura descrito anteriormente em frascos de cultura celular de 25 cm2 de área (Falcon), e mantidos em incubadora (Fisher) com atmosfera de 5% CO2 a 37ºC. Após 24 horas, foram adicionados ao meio de cultura 10 µg/ml de fator de crescimento epidérmico (Sigma Chemical - St. Louis, Estados Unidos). O meio foi trocado a cada 48 horas, até que as células apresentassem aspecto de subconfluência, quando então foram tripsinizadas e semeadas sobre géis de colágeno previamente povoados por fibroblastos.
Fibroblastos humanos foram obtidos pela técnica de explante, conforme descrição de Carrel & Burrows15, a saber: fragmentos de pele, de espessura parcial e desprovidos de tecido subcutâneo foram aderidos à superfície de placas de cultura de células de 25 cm2 de área e banhados por meio de cultura DMEM, 10% soro bovino fetal e 1% solução de antibióticos (100 UI/ml de penicilina/estreptomicina 100 µg/ml). O meio de cultura foi trocado a cada três dias, enquanto as células eram mantidas em incubadora com atmosfera de 5% CO2 a 37ºC. Após alguns dias, fibroblastos migraram para o exterior dos fragmentos, os quais foram removidos enquanto as células proliferavam na superfície dos frascos. Depois de atingir aspecto de subconfluência celular, as culturas foram amplificadas repetidamente, até que o número desejado de células fosse obtido.
Preparação da Matriz de Colágeno Povoada por Fibroblastos
A solução de colágeno foi preparada segundo protocolo proposto por Bell et al.8, em que tendões de cauda de ratos tipo Wistar-Furth foram retirados assepticamente e colocados em recipiente com ácido acético diluído na proporção de 1:1.000 (250 ml solução ácida/cauda). A mistura foi armazenada a 4ºC. Após duas semanas, foi obtida uma solução viscosa, que, após centrifugação a 500 rpm durante uma hora, se separou em duas fases: a fração sobrenadante, contendo principalmente colágeno tipo I solubilizado, que foi retirada e guardada a 4ºC (ácido solúvel); e a fração restante, representando a fração de colágeno ácido insolúvel, que foi descartada.
Para a confecção dos géis de colágeno tipo I, foi utilizado o protocolo proposto pela Collagen Biomaterials16, a saber: mistura de 100 µl de PBS (10x) com 100 µl de hidróxido de sódio (NaOH) (0,1 M), 400 µl de suspensão de fibroblastos (5x104) em PBS (1x) e 400 µl de solução de colágeno.
Dois terços dos géis confeccionados foram usados como base para a semeadura de queratinócitos (passando a ser denominados de coculturas, ou seja, queratinócitos em gel de colágeno povoado por fibroblastos) e um terço desses foi utilizado como amostras de controle (géis de colágeno contendo apenas queratinócitos).
Semeadura de Queratinócitos sobre Gel de Colágeno Contendo Fibroblastos
Após 12 horas da polimerização dos géis de colágeno contendo fibroblastos, 1,2x105 queratinócitos foram semeados na superfície de cada gel. Tanto a cocultura quanto o controle foram embebidos por meio de cultura e mantidos em incubadora a 37ºC e 5% de CO2, por mais 48 horas. Esse procedimento foi repetido em duplicata para cada um dos 5 diferentes doadores de células (queratinócitos).
Contração do Gel de Colágeno
A área do gel de colágeno povoado por fibroblastos foi fotografada nos momentos 0, 12, 24, 36 e 48 horas após o descolamento das matrizes de seus poços, com câmera fotográfica digital1 (SONY Cyber-shot, 3.2 megapixels). A medida da área do gel foi realizada utilizando-se o software UTHSCSA Image Tool for Windows versão 3.017. O cálculo foi realizado em triplicata e o valor utilizado como resultado foi a média aritmética das triplicatas, obtida em pixels e convertida para cm2.
Análise Estatística
As áreas dos géis (cocultura e controle), nos diferentes intervalos medidos, foram avaliadas usando o teste estatístico não-paramétrico de ANOVA.
RESULTADOS
Após a soltura dos géis das paredes dos poços, a contração das matrizes foi progressiva dentro do intervalo de 48 horas. Não houve contração macroscopicamente detectável após esse período (Figura 1).

Figura 1 - Contração das matrizes 48 horas após soltura dos géis das paredes dos poços. Em A, gel de colágeno povoado por fibroblastos e queratinócitos (grupo estudo). Em B, matriz de colágeno povoado apenas por fibroblastos (grupo controle).
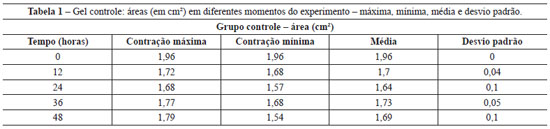
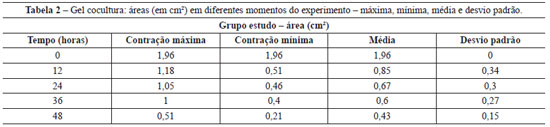
A Tabela 1 apresenta a área média dos géis controle (fibroblastos/gel de colágeno), nos diferentes intervalos (inicial - tempo 0 = área 1,96 cm2). A área média dos géis de cocultura (queratinócitos + fibroblastos/gel de colágeno), medida em diferentes intervalos, pode ser observada na Tabela 2 (inicial - tempo 0 = área 1,96 cm2).
Observa-se que a contração dos géis controle é significativamente menor (cerca de 0,27 cm2 de redução da área), comparativamente à contração dos géis de cocultura (redução média de 1,53 cm2). A Figura 2 permite a visualização das contrações dos diferentes géis de colágeno povoados apenas por fibroblastos (controles) e queratinócitos semeados em géis de colágeno povoado por fibroblastos (coculturas), em relação ao período do experimento.
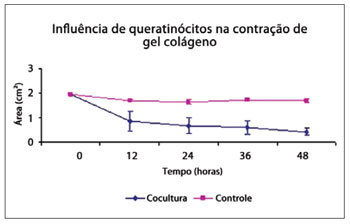
Figura 2 - Modelo de matriz de colágeno povoada por células (cm2) em relação ao tempo de experiência (P < 0,0001).
Os géis semeados com queratinócitos (coculturas) apresentaram contração significativamente maior que o grupo controle (P < 0,0001 e α = 0,05).
DISCUSSÃO
Este trabalho experimental avalia as mudanças na contração de géis de colágeno povoados por fibroblastos na presença de queratinócitos sobre esses géis.
Desde que foi desenvolvido por Bell et al.8, o modelo experimental de contração de matriz extracelular tem sido empregado em estudos de cura das feridas. Fibroblastos dispersos em matriz de colágeno apresentam comportamento mais semelhante aos fibroblastos in vivo que aqueles cultivados em monocamada. De maneira semelhante, a proliferação é mais lenta nas células dispersas em matriz extracelular.
De forma genérica, modelos tridimensionais são mais bem indicados no estudo de relações e interferências entre componentes do sistema analisado, enquanto culturas em monocamada avaliam melhor o comportamento e a atividade celular. Porém, alguns autores observaram que a confecção inicial do modelo pode modificar os resultados da medida da contração dos géis18,19.
Bell et al.8 demonstraram que, após 48 horas do início da contração, a matriz se torna estável sem sinais significativos de contração do gel de colágeno. Essa informação foi utilizada para estabelecer o calendário proposto neste trabalho.
A literatura tem demonstrado que os géis aderidos às paredes dos poços apresentam redução em sua espessura, sem alteração de seus diâmetros. No entanto, quando os géis são mecanicamente liberados dessas paredes, ocorre contração tridimensional desses géis, com alterações tanto de espessura quanto de diâmetro, em decorrência da distribuição aleatória das fibras de colágeno e da ação dos fibroblastos sobre essas fibras.
Outro fator que pode modificar a contração do modelo é o número de fibroblastos semeados na solução de colágeno: em teoria, quanto maior o número de células maior a contração observada. No entanto, a partir de determinado número de fibroblastos por unidade de volume de solução de colágeno, parece não haver qualquer aumento significativo ou mudança mensurável na contração da matriz19. Na literatura mundial, está descrito que quantidades entre 3x105 e 5x105 fibroblastos/poço de 1,96 cm2 de área são suficientes para promover contração dos géis compatível com o que ocorre in vivo20.
Em estudo anterior realizado no mesmo laboratório em que foi efetivado este trabalho, foi determinado que menos de 5x104 fibroblastos semeados em poços de 1,96 cm2 não geram contração (dados não publicados). Portanto, optou-se por utilizar esse número de células para que houvesse menor influência dos fibroblastos na contração desses géis, permitindo, assim, a melhor caracterização da participação dos queratinócitos nesse fenômeno.
Os resultados obtidos demonstram claramente que os géis de colágeno povoados por fibroblastos que receberam queratinócitos apresentaram taxas de contração significativamente maiores quando comparados a seus controles. A área final dos géis semeados com queratinócitos foi considerada até cinco vezes menor que a área dos géis controle. Considerando-se que os sistemas foram semelhantes, variando apenas na ação de queratinócitos, fica claro que os queratinócitos têm a capacidade de interferir com a função dos fibroblastos quanto à reorganização do substrato de colágeno.
Os dados obtidos neste estudo sugerem que alguns conceitos sobre as fases proliferativa e contrátil de cicatrização da ferida precisam ser revistos. A maioria dos especialistas considera que fibroblastos são os únicos responsáveis pela contração da ferida e pelo rearranjo do colágeno. No entanto, este estudo sugere uma colaboração clara dos queratinócitos nesse sentido. Os mecanismos exatos dessa participação, porém, devem ser mais bem compreendidos.
CONCLUSÃO
Queratinócitos têm papel na reorganização da matriz extracelular. O modelo experimental de contração utilizado neste trabalho pode permitir uma investigação mais aprofundada dos caminhos de comunicação entre as células que interagem e moduladores, com uma nova visão sobre o papel dos queratinócitos na cicatrização de feridas e formação de cicatrizes patológicas.
REFERÊNCIAS
1. Peacock EE, Cohen IK. Wound healing. In: McCarthy J, ed. Plastic surgery. Philadelphia: WB Saunders; 1990. p.161-85.
2. Grinnel F. Fibroblasts, myofibroblasts, and wound contraction. J Cell Biol. 1994;124(4):401-4.
3. Finesmith TH, Broadley KN, Davidson JM. Fibroblasts from wounds of different stages of repair vary in their ability to contract a collagen gel in response to growth factors. J Cell Physiol. 1990;144(1):99-107.
4. Coulomb B, Lebreton C, Dubertret L. Influence of human dermal fibroblasts on epidermalization. J Invest Dermatol. 1989;92(1):122-5.
5. Gabbiani G, Ryan GB, Majne G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia. 1971;27(5):549-50.
6. Darby I, Skalli O, Gabbiani G. Alpha-smooth muscle actin is transiently expressed by myofibroblasts during experimental wound healing. Lab Invest. 1990;63(1):21-9.
7. Ross R. The fibroblast and wound repair. Biol Rev Camb Philos Soc. 1968;43(1):51-96.
8. Bell E, Ivarsson B, Merrill C. Production of tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proc Natl Acad Sci USA. 1979;76(3):1274-8.
9. Kamamoto F, Paggiaro AO, Rodas A, Herson MR, Mathor MB, Ferreira MC. A wound contraction experimental model for studying keloids and wound-healing modulators. Artif Organs. 2003;27(8):701-5.
10. Isaac C, Mathor MB, Bariani G, Paggiaro AO, Herson MR, Goldenstein-Schainberg C, et al. Pentoxifylline modifies three-dimensional collagen lattice model contraction and expression of collagen types I and III by human fibroblasts derived from post-burn hypertrophic scars and from normal skin. Burns. 2009;35(5):701-6.
11. Souren JM, Ponec M, van Wijk R. Contraction of collagen by human fibroblasts and keratinocytes. In Vitro Cell Dev Biol. 1989;25(11):1039-45.
12. Ralston DR, Layton C, Dalley AJ, Boyce SG, Freedlander E, MacNeil S. Keratinocytes contract human dermal extracellular matrix and reduce soluble fibronectin production by fibroblasts in a skin composite model. Br J Plast Surg. 1997;50(6):408-15.
13. Herson MR, Mathor MB, Altran S, Capellozzi VL, Ferreira MC. In vitro construction of a potential skin substitute through direct human keratinocyte plating onto decellularized glycerol-preserved allodermis. Artif Organs. 2001;25(11):901-6.
14. Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 1975;6(3):331-43.
15. Carrel A, Burrows MT. Cultivation of adult tissues and organs outside the body. JAMA. 1910;55:1379-81.
16. Collagen biomaterials. Disponível em: http://www.vasoseal.com/cb/cbbiomaterials.html. Acesso em: 2/5/2011.
17. Wilcox CD, Dove SB, McDavid WD, Greer DB. UTHSCSA ImageTool, Version 3.0 Final. Disponível em: http://ddsdx.uthscsa.edu/dig/itdesc.html
18. Rompré P, Auger FA, Germain L, Bouvard V, López Valle CA, Thibault J, et al. Influence of initial collagen and cellular concentrations on the final surface area of dermal and skin equivalents: a Box-Behnken analysis. In Vitro Cell Dev Biol. 1990;26(10):983-90.
19. Zhu YK, Umino T, Liu XD, Wang HJ, Romberger DJ, Spurzem JR, et al. Contraction of fibroblast-containing gels: initial collagen concentration regulates the degree of contraction and cell survival. In Vitro Cell Dev Biol Anim. 2001;37(1):10-6.
20. Dallon JC, Ehrlich HP. A review of fibroblast-populated collagen lattices. Wound Repair Regen. 2008;16(4):472-9.
1. Doutor, responsável pelo Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.
2. Doutor, responsável pelo Banco de Tecidos do Instituto Central do HCFMUSP, São Paulo, SP, Brasil.
3. Médico residente da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
4. Doutora, professora assistente da Monash University, Austrália.
5. Mestre, pesquisadora do Laboratório de Cultura Celular da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
6. Pós-doutora, pesquisadora do Instituto de Pesquisas Energéticas e Nucleares (IPEN), São Paulo, SP, Brasil.
7. Professor titular da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
Correspondência para:
César Isaac
Av. Doutor Arnaldo, 455 - sala 1.360 - Pinheiros
São Paulo, SP, Brasil - CEP 01246-903
E-mail: cesaris@uol.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 7/6/2011
Artigo aceito: 12/7/2011
Trabalho realizado no Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do Hospital
das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter