

Original Article - Year 2011 - Volume 26 -
Nevo melanocítico congênito: estudo retrospectivo dos aspectos epidemiológicos e terapêuticos em uma série de 45 pacientes
Congenital melanocytic nevi: a retrospective study of epidemiological and therapeutic aspects in a series of 45 patients
RESUMO
Introdução: Os nevos melanocíticos congênitos, apesar de apresentarem uma incidência relativamente rara, são lesões que necessitam acompanhamento por longo período, a fim de se evitar sequelas psicológicas e complicações inerentes a essa patologia, como estresse psicológico, melanose neurocutânea e degeneração maligna. Método: O presente estudo demonstra os dados epidemiológicos e terapêuticos em uma série de 45 casos atendidos na Divisão de Cirurgia Plástica e Queimaduras do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Palavras-chave: Nevos e Melanomas. Nevo. Melanoma. Melanose.
ABSTRACT
Introduction: Although relatively rare, congenital melanocytic nevi are lesions that require monitoring for a long period in order to prevent psychological sequelae and complications inherent to this pathology such as psychological stress, neurocutaneous melanosis, and malignant degeneration. Methods: This study presents epidemiological therapeutic data from a series of 45 cases treated at the Divisão de Cirurgia Plástica e Queimaduras, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo.
Keywords: Nevi and Melanomas. Nevus. Melanoma. Melanosis.
Os nevos melanocíticos congênitos (NMC) são lesões pigmentadas presentes ao nascimento, decorrentes do acúmulo de melanócitos de origem neuroectodérmica em localização ectópica1. Algumas características histológicas peculiares são capazes de definir a etiologia congênita do nevo, tais como a presença de células névicas agrupadas em cachos e a presença destes elementos celulares em estruturas glandulares, vasos sanguíneos e tecido subcutâneo2.
A incidência de NMC na população geral é de 1:100 nascidos vivos e, quando se consideram apenas os nevos gigantes, a incidência se reduz para 1:20.000 nascidos vivos3. Sua distribuição corporal é ampla, sendo localizados com maior frequência no tronco e na face4,5.
NMC são classificados quanto as suas dimensões de diversas maneiras. As três classificações mais citadas levam em conta o maior diâmetro do nevo, sua área ou a porcentagem corporal que ocupam. São considerados nevos gigantes quando, respectivamente para cada classificação, apresentam mais que 20 cm de diâmetro ou compreendem área corpórea superior a 100 cm2 ou maior que 2% da superfície corporal6-8.
A presença de melanose neurocutânea, a degeneração maligna para melanoma e o estresse psicológico para familiares e para a criança são as principais motivações para o tratamento do NMC9.
A incidência real de melanoma em NMC permanece controversa na literatura e casuísticas mais recentes apresentam dados que variam entre 2,8 e 8,5% dos portadores de nevos congênitos4. Tamanho do nevo acima de 20 cm2, número de lesões e faixa etária menor que três anos são as características clínicas mais associadas ao risco de transformação maligna7,10-14.
O tratamento cirúrgico é a opção preferencial, quando indicado. Entre as modalidades cirúrgicas merecem destaque a ressecção seguida de enxertia de pele, ressecções parceladas e o uso dos expansores teciduais nas áreas sãs adjacentes, seguido de ressecção das lesões e avanço ou rotação dos retalhos expandidos.
O objetivo do presente trabalho é demonstrar a experiência de um serviço de referência para o tratamento de NMC do ponto de vista epidemiológico, apresentação clínica, modalidade cirúrgica empregada, relatórios histopatológicos e o índice de malignização em uma série de 45 pacientes.
MÉTODO
Foi realizado estudo retrospectivo por meio de revisão de prontuário de pacientes atendidos na Divisão de Cirurgia Plástica e Queimaduras do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, no período compreendido entre 1998 e 2010. Foi definido o diagnóstico de nevo melanocítico congênito, considerando-se os códigos do CID-10 relacionados D-28, I-78.1 e Q-82.5. Foram localizadas e analisadas as informações de 45 prontuários de pacientes.
Foram avaliados dados epidemiológicos, clínicos e anatomopatológicos. Dados epidemiológicos incluíram idade, gênero, etnia e histórico familiar. Clinicamente foi analisada a localização das lesões, bem como suas dimensões e a presença de lesões satélites. Avaliada a modalidade cirúrgica empregada, o número de abordagens cirúrgicas necessárias, além de suas complicações.
Foi realizada, também, revisão dos estudos anatomopatológico das peças ressecadas, observando-se os tipos histológicos, o tamanho macroscópico da peça cirúrgica e incidência de focos neoplásicos.
RESULTADOS
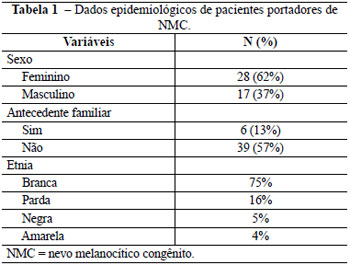
Dos 45 pacientes que foram avaliados, 62% eram do sexo feminino e apenas 13% apresentavam antecedente familiar de nevo congênito. Quanto à distribuição étnica, 75% dos pacientes eram da raça branca, 16% pardos, 5% negros e 4% amarelos (Tabela 1).
A localização mais frequente dos NMC foi a região de cabeça e pescoço, em 35% dos casos, seguida de tronco com 27% e membros com 9%. O acometimento simultâneo em dois segmentos corporais ocorreu em 20% dos pacientes e, em 9% deles, três ou mais segmentos estavam acometidos (Figura 1).
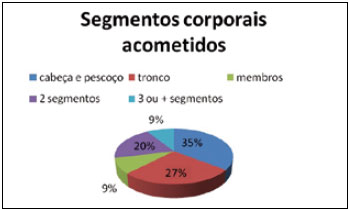
Figura 1 - Distribuição dos pacientes portadores de NMC segundo segmentos corporais acometidos.
Com relação à dimensão dos nevos, 69% dos casos apresentaram superfície corporal maior ou igual a 2%, caracterizando, portanto, nevo congênito gigante. Excluindo-se os nevos menores que 1% de superfície corporal, a média aritmética do acometimento das lesões foi de 9,65% (2-50%).
Lesões satélites estavam presentes em 30% dos casos estudados.
Na presente casuística, 29 (64%) pacientes foram submetidos a algum tipo de tratamento cirúrgico. Os 16 casos restantes encontram-se sob observação clínica, recusaram o tratamento cirúrgico ou ainda aguardam programação cirúrgica.
Em números absolutos, nesses 29 pacientes cirúrgicos, foram realizadas 66 ressecções parceladas, 13 ressecções seguidas de enxertia de pele e 18 expansões teciduais seguidas de rotação de retalhos expandidos (Tabela 2). Cada criança recebeu, em média, 2,57 abordagens cirúrgicas (mínimo de 1 e máximo de 9), sendo que apenas 7 casos receberam alta médica com tratamento concluído. Os demais pacientes aguardam pequenas ressecções, recusaram a continuidade do tratamento devido à grande exposição dos pacientes aos procedimentos cirúrgicos ou ainda devido a perda de seguimento.
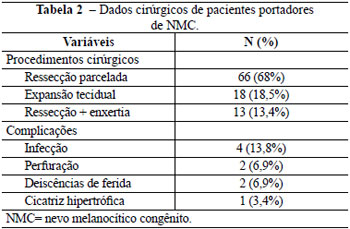
Foram consideradas complicações do tratamento, infecções de ferida operatória ou expansor, pequenas deiscências, distúrbios de cicatrização, dentre outros. Tivemos registro de 31% de complicações, sendo a maior parte delas infecciosas (4/29). Outras complicações foram pequenas deiscências de ferida operatória (2/29), perfuração de expansores (2/29) e cicatriz hipertrófica (1/29) (Tabela 2).
A análise dos resultados anatomopatológicos revelou que, em 20 casos, havia relato de nevos compostos,12 de nevos intradérmicos e 2 nevos juncionais. Desse montante, 16 dos relatórios mencionaram características patognomônicas de padrão congênito nos mesmos. Foram evidenciados, ainda, pacientes com diagnóstico de nevo azul, nevo sebáceo de Jadassohn e hamartoma de cisto neural, além de casos isolados de nódulo proliferativo em nevo congênito, hiperplasia típica e melanoma / padrão Spitzoide.
No presente estudo, apenas um (2,2%) dos pacientes teve o diagnóstico de melanoma. Apesar do laudo revisado ter aventado o diagnóstico diferencial de padrão Spitzoide, foi considerado diagnóstico de melanoma para fins de tratamento e acompanhamento do caso. Tratava-se de paciente do sexo feminino, branca, lesão localizada em tronco e ocupando 24% da superfície corporal, sem lesões satélites ou melanose neurocutânea. Para seu tratamento, já foram realizadas 7 abordagens cirúrgicas, sendo 5 ressecções parceladas e 2 expansões teciduais.
A melanose neurocutânea foi afecção presente em 3 (6,67%) casos, em localização meníngea, subcutânea e ungueal. Todos os pacientes eram pacientes brancos, com nevos de localização corporal multisegmentar e somente um deles apresentava lesões satélites.
Ainda em relação aos espécimes ressecados, foi observado que, em média, cada paciente teve 147,4 cm2 de pele ressecada, sendo o caso de maior ressecção totalizado em 560 cm2.
As Figuras 2 a 5 ilustram alguns casos dessa casuística.
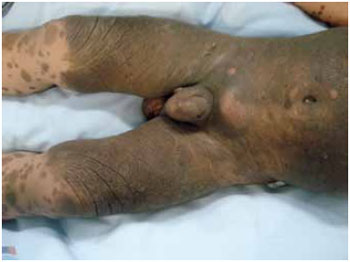
Figura 2 - Paciente portador de NMC e melanose neurocutânea demonstrando nevo ocupando 50% da superfície corporal.
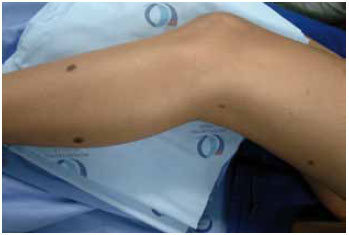
Figura 3 - Foto ilustrativa de lesões satélites em NMC.

Figura 4 - Exemplo de paciente com nevo congênito em face submetida a ressecções parceladas.
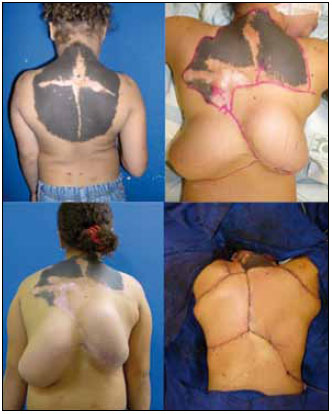
Figura 5 - Exemplo de expansão tecidual e rotação de retalho em nevo congênito gigante em dorso.
DISCUSSÃO
Os nevos congênitos, apesar de apresentarem incidência relativamente rara, são lesões que necessitam acompanhamento multidisciplinar por longo período, a fim de se evitar sequelas psicológicas e complicações inerentes a essa patologia.
Na casuística apresentada, predominaram os pacientes pediátricos do sexo feminino, não sendo encontrado na literatura consenso com relação ao gênero mais frequente. Com relação à etnia, os dados corroboram com prevalência maior na raça branca.
Os dados encontrados apontam a região da cabeça e pescoço como mais frequente para NMC, corroborando com os resultados publicados por Turkmen et al.5, porém outros estudos acusam o tronco como sítio mais frequente15. Cabe ressaltar que, no presente estudo, grande parcela dos nevos atingiam dimensões que ultrapassam os limites dos segmentos corporais, perfazendo um total de 29% dos casos com mais de 2 segmentos acometidos.
Arneja e Gosain2 publicaram dados que demonstram a prevalência de 80% de lesões satélites aos NMC, o que contraria os resultados aqui apresentados, que apontam apenas 30% dos casos.
É consenso que o tratamento cirúrgico seja o mais eficaz quando pertinente sua indicação, porém a tática cirúrgica depende das características da lesão, da complexidade do serviço e da experiência pessoal do cirurgião plástico. A conduta utilizada neste estudo vai de encontro à proposta da literatura internacional, com predominância de ressecção parcelada, seguida de expansão tecidual5. A razão que explica essa prevalência talvez seja a facilidade de execução do primeiro método, com menores custos e taxas de morbidade, porém exigindo maior número de abordagens para resolução adequada do caso, quando comparado à expansão tecidual.
As complicações infecciosas são maiores em pacientes pediátricos e, especificamente com expansores, a infecção permanece como o principal tipo de complicação. A incidência varia em torno de 4,4 a 9,3% dos casos16-21. Nossa casuística revelou incidência de 13% e, conforme já proposto na literatura, a infecção não indica a suspensão do programa de expansão, bem como o insucesso do mesmo. Em contrapartida, a extrusão é outra complicação importante e requer a retirada precoce do expansor21.
A degeneração maligna para melanoma é considerada complicação importante dos NMC, em decorrência da elevada morbi-mortalidade dessa patologia. Trabalhos iniciais publicados demonstravam variada incidência de melanomas, com estudos demonstrando incidências de zero a 42%22- 24. Estudos recentes têm demonstrado que a incidência é menor do que se acreditava, em torno de 2,8 a 8,5% dos NMC7,9. Os resultados obtidos estão de acordo com a literatura atual, visto que obtivemos incidência de apenas 2,2%. Apesar da identificação de somente um caso de degeneração maligna em nossa casuística, podemos observar que o caso em questão apresentava os fatores de risco propostos na literatura: tamanho elevado (no caso 24% de superfície corporal) e idade menor que três anos4,25.
Obedecendo aos critérios diagnósticos mais recentes para a melanose neurocutânea, 3 pacientes apresentaram melanose neurocutânea em nossa casuística. Apesar de ambos nevos volumosos, apenas 1 apresentava nevos satélites, considerado importante fator de risco para melanose neurocutânea, principalmente quando apresenta mais de 20 lesões satélites26. Localização na linha média e em cabeça e pescoço também têm sido considerados fatores de risco para a melanose neurocutânea27, o que não foi observado em nossa casuística. Em ambos os casos, a lesão era substancialmente volumosa para as considerarmos como restrita a algum segmento corporal ou em linha média do corpo.
A melanose neurocutânea, a depender da idade de incidência, pode cursar com manifestações clínicas, como graus variados de retardo do desenvolvimento neuropsicomotor, crises convulsivas, restrição de crescimento pondero-estatural, dentre outras.
Neste estudo retrospectivo, pudemos observar preferência pelo tratamento de pacientes portadores de nevos de grandes dimensões, que requerem grande número de abordagens cirúrgicas e seguimento. O seguimento clínico é peça fundamental nesse tipo de paciente, a fim de diagnosticar precocemente malignidades e outras complicações.
Os pacientes portadores de NMC gigante merecem especial atenção por equipe multiprofissional, incluindo terapeutas ocupacionais, psicoterapeutas e cirurgiões plásticos, que geralmente conduzem os casos. A sequela psicológica a esses pacientes ocorrem tanto pelo estigma das lesões pigmentadas quanto pelas inúmeras internações e procedimentos que se tornam necessários até a excisão total da lesão. Para evitar sequelas psicológicas e degenerações malignas, tem se optado por iniciar o mais precocemente o tratamento cirúrgico dessas crianças, com o objetivo de terminar o tratamento em idade pré-escolar, se possível.
REFERÊNCIAS
1. Heffek DF, Thaller S. Congenital melanosis: an update. J Craniofac Surg. 2005;16(5):940-4.
2. Bentz ML, Bauer BS, Zuker RM. Principles and practice of pediatric plastic surgery. St Louis:Quality Medical Publishing;2007.
3. Castilla EE, Dutra MG, Oriolo-Parreiras IM. Epidemiology of congenital pigmented naevi: incidence rates relative frequencies. Br J Dermatol. 1981;104(3):307-15.
4. Arneja JS, Gosain AK. Giant congenital melanocytic nevi. Plast Reconstr Surg. 2007;120(2):26e-40e.
5. Turkmen A, Isik D, Bekerecioglu M. Comparison of classification systems for congenital melanocytic nevi. Dermatol Surg. 2010;36(10):1554-62.
6. Kaplan E, Nickoloff BJ. Clinical and histologic features of nevi with emphasis on treatment approaches. Clin Plast Surg. 1987;14(2):277-300.
7. Quaba AA, Wallace AF. The incidence of malignant melanoma (0 to 15 years of age) arising in "large" congenital nevocellular nevi. Plast Reconstr Surg 1986;78(2):174-81.
8. Bauer BS, Corcoran J. Treatment of large and giant nevi. Clin Plast Surg. 2005;32(1):11-8.
9. Chung C, Forte AJ, Narayan D, Persing J. Giant nevi: a review. J Craniofac Surg. 2006;17(6):1210-5.
10. Solomon LM. The management of congenital melanocytic nevi. Arch Dermatol. 1980;116(9):1017.
11. Kaplan EN. The risk of malignancy in large congenital nevi. Plast Reconstr Surg. 1974;53(4):421-8.
12. Watt AJ, Kotsis SV, Chung KC. Risk of melanoma arising in large congenital melanocytic nevi: a systematic review. Plast Reconstr Surg. 2004;113(7):1968-74.
13. Rhodes AR, Wood WC, Sober AJ, Mihm MC Jr. Nonepidermal origin of malignant melanoma associated with a giant congenital nevocellular nevus. Plast Reconstr Surg. 1981;67(6):782-90.
14. Trozak DJ, Rowland WR, Hu F. Metastatic malignant melanoma in prepubertal children. Pediatrics. 1975;55(2):191-204.
15. Arneja JS, Gosain AK. Giant congenital melanocytic nevi of the trunk and an algorithm for treatment. J Craniofac Surg. 2005;16(5):886-93.
16. Elias DL, Baird WL, Zubowicz VN. Applications and complications of tissue expansion in pediatric patients. J Pediatr Surg. 1991;26(1):15-21.
17. Iconomou TG, Michelow BJ, Zuker RM. Tissue expansion in the pediatric patient. Ann Plast Surg. 1993;31(2):134-40.
18. Gibstein LA, Abramson DL, Bartlett RA, Orgill DP, Upton J, Mulliken JB. Tissue expansion in children: a retrospective study of complications. Ann Plast Surg. 1997;38(4):358-64.
19. Neale HW, High RM, Billmire DA, Carey JP, Smith D, Warden G. Complications of controlled tissue expansion in the pediatric burn patient. Plast Reconstr Surg. 1998;82(5):840-8.
20. Hurvitz KA, Rosen H, Meara JG. Pediatric cervicofacial tissue expansion. Int J Pediatr Otorhinolaryngol. 2005;69(11):1509-13.
21. Adler N, Dorafshar AH, Bauer BS, Hoadley S, Tournell M. Tissue expander infections in pediatric patients: management and outcomes. Plast Reconstr Surg. 2009;124(2):484-9.
22. Danarti R, Konig A, Happle R. Large congenital melanocytic nevi may reflect paradominant inheritance implying allelic loss. Eur J Dermatol. 2003;13(5):430-2.
23. Keipert JA. Giant pigmented naevus: the frequency of malignant change and indications for treatment in prepubertal children. Australas J Dermatol. 1985;26(2):81-5.
24. Bergfeld W, Helwig WB. Risk of developing melanoma in congenital nevi. Presented at the Annual Meeting of the American Academy of Dermatology, Miami, FL, December 27, 1972.
25. Shah KN. The risk of melanoma and neurocutaneous melanosis associated with congenital melanocytic nevi. Semin Cutan Med Surg. 2010;29(3):159-64.
26. Marghoob AA, Dusza S, Oliveria S, Halpern AC. Number of satellite nevi as a correlate for neurocutaneous melanocytosis in patients with large congenital melanocytic nevi. Arch Dermatol. 2004;140(2):171-5.
27. Kadonaga JN, Frieden IJ. Neurocutaneous melanosis: definition and review of literature. J Am Acad Dermatol. 1991;24(5 Pt 1):747-55.
1. Pós-graduação em Cirurgia Plástica em andamento na Faculdade de Medicina da Universidade de São Paulo (FMUSP); Médico residente em Cirurgia Plástica pela Divisão de Cirurgia Plástica e Queimaduras do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.
2. Professor livre docente do Departamento de Cirurgia da FMUSP; Médico assistente da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
3. Mestre em Cirurgia Plástica; Médica colaboradora da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
4. Especialista em Cirurgia Plástica; Médica colaboradora da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
5. Residência em Cirurgia Geral pelo HCFMUSP, São Paulo, SP, Brasil.
6. Aluno de graduação em Medicina pela FMUSP, São Paulo, SP, Brasil.
7. Professor titular da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
Correspondência para:
Dov Charles Goldenberg
Rua Pedro de Toledo, 980 Cj. 124
São Paulo, SP, Brasil - CEP 04039-002
E-mail: drdov@terra.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP
Artigo recebido: 24/1/2011
Artigo aceito: 23/3/2011
Trabalho realizado na Divisão de Cirurgia Plástica e Queimaduras do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter