

Original Article - Year 2010 - Volume 25 -
Reconstrução vaginal pelo retalho neurovascular pudendo crural na síndrome de Rokitansky
Vaginal reconstruction by neurovascular pudendal thigh flap in Rokitansky's syndrome
RESUMO
Introdução: Agenesia vaginal relacionada à síndrome de Mayer-Rokitansky-Kuster- Hauser (MRKH) ocorre na proporção de 1 para cada 4000 ou 5000 nascimentos femininos, causando grande limitação à vida afetiva da paciente. O manejo da agenesia vaginal inclui acompanhamento psicológico e reconstrução vaginal. Objetivo: Mostrar a experiência do Serviço com a técnica do retalho neurovascular pudendo crural para reconstrução vaginal no tratamento de 8 pacientes com síndrome de Rokitansky. Método: Apresentam-se oito casos de síndrome de Rokitansky em que a reconstrução vaginal foi realizada pelo retalho neurovascular pudendo crural, chamado retalho de Cingapura. O período de acompanhamento pós-operatório variou de 6 meses e 3 anos. Resultados: Uma neovagina funcional de, no mínimo, 10 cm de profundidade e 5 cm de diâmetro foi criada em todos os casos. Apesar da queixa de dor local de moderada intensidade no pós-operatório imediato, as pacientes apresentaram-se satisfeitas com os resultados. As relações sexuais foram liberadas no 40º dia de pós-operatório, sem relatos de sangramento ou dor. Três pacientes apresentaram crescimento de pêlo no intróito vaginal. Conclusão: A técnica do retalho de Cingapura permitiu a reconstrução vaginal sem a necessidade de dilatação pós-operatória, mantendo a inervação do períneo e com cicatrizes pouco perceptíveis.
Palavras-chave: Vagina/anormalidades. Vagina/cirurgia. Retalhos cirúrgicos.
ABSTRACT
Background: Congenital vaginal agenesis, with a prevalence of 1 in 4000 or 5000 females, occurs mainly as a feature of the Mayer-Rokitansky-Kuster-Hauser (MRKH) syndrome. The management of this patient includes psychological support and the creation of a neovagina. Objective: To present and evaluate the pudendal thigh flap for the creation of a neovagina in eight young women with MRKH syndrome. Methods: Eight young women with MRKH syndrome had a neovagina created by using the bilateral pudendal thigh fasciocutaneous flap procedure, Singapore flap. The patients' follow-up ranged between 6 months and 3 years. Results: A functional vagina of at least 10cm in depth and 5cm in width was created in al cases. Although the patients reported moderated local pain after the procedure, they were satisfied with the results. In addition, normal sexual life was possible after 40 days and none of them reported bleeding or pain during sexual relation. Three patients presented hair in the vaginal lining. Conclusion: Bilateral fasciocutaneous pudendal thigh flap permits vaginal reconstruction with some advantages such as postoperative dilatation is not necessary, sensation is maintained and the resulting scars are inconspicuous.
Keywords: Vagina/abnormalities. Vagina/surgery. Surgical flaps.
A incidência de atresia ou agenesia vaginal ocorre em 1 para 4000 ou 5000 nascimentos femininos1,2, sendo a causa mais comum desta anormalidade a síndrome de Mayer- Rokitansky-Kuster-Hauser3. Tais pacientes encontram-se incapacitadas para a procriação e para satisfação sexual própria e do parceiro.
A síndrome de Mayer-Rokitansky-kuster-Hauser caracteriza- se por útero e tubas uterinas rudimentares, ausência total ou parcial da vagina, anomalias no trato urinário e alterações na coluna cervical. A vulva, derivada do seio urogenital, e os ovários apresentam-se usualmente sem alterações4-6. Ocorre falha no sistema de tubos Mullerianos devido à resposta insuficiente aos hormônios secretados pelos ovários; não existe anomalia genética7,8. Podemos encontrar três tipos9:
A agenesia vaginal foi primeiro descrita, em 1572, por Realdus Colombus7,10,11 e o primeiro ensaio para revestir a neocavidade com enxerto fino de pele veio a ser realizado, em 1898, por Abbé, mais tarde popularizado por McIndoe12.
Um grande número de técnicas, desde o uso de cólon e reto11,13, peritônio14, autoenxerto cutâneo12,15 até retalhos musculares6,16,17 e fasciocutâneos7,18-20 foi descrito na literatura para correção desta anomalia.
Dentre as técnicas mais difundidas, podemos citar: Sneguireff (1892), que utilizou reto e cólon13; Baldwin (1904), que utilizou ílio; Willis e Kantar (1938), que popularizaram o método de reepitelização espontânea do trato vaginal por meio de um cateter colocado no septo retovesical; Frank (1938), que difundiu a técnica não operatória de pressão intermitente; Willian (1964), que utilizou retalho cutâneo do períneo21-23 e Hirshowitz e Pretz (1982), que utilizaram retalhos fasciocutâneos súpero-mediais da face interna da coxa para reconstrução vaginal.
A partir do melhor entendimento anatômico vascular da região perineal, abdome e terço proximal dos membros inferiores, novos retalhos foram sendo utilizados com finalidade de reparar a vagina. Dentre eles mencionamos o retalho miocutâneo do músculo gracilis24, o miocutâneo de reto abdominal de base distal6,16,17,24-26, o miocutâneo do glúteo27, o fasciocutâneo medial da coxa28, os retalhos axiais subcutâneos da parede inferior do abdome29 e retalhos axiais da artéria perineal, descritos por Hagerty30,31.
Neste trabalho, apresentamos nossa experiência em oito casos de reconstrução vaginal com retalho neurovascular pudendo, detalhando a técnica utilizada.
MÉTODO
Foram submetidas a cirurgia oito pacientes, com idade variando entre 18 e 28 anos, sendo sete brancas e uma negra. Em todos os casos, o diagnóstico de agenesia vaginal já estava previamente firmado, de 2 a 6 anos. Todas as pacientes tiveram o diagnóstico por volta dos 18 anos de idade, exceto a 4ª paciente, cujo diagnóstico se deu por ocasião do seu casamento, aos 22 anos de idade.
Para fins deste estudo, incluímos apenas as pacientes com genótipo feminino e que apresentavam vagina e/ou útero rudimentar ou ausente. Logo, os casos de pseudohermafroditismo masculino e as pacientes com síndrome de Rokitansky tipos II e III foram excluídas.
A técnica utilizada foi o retalho neurovascular pudendo de coxa descrita por Wee & Joseph32 e batizado por Woods et al.33 como retalho de Cingapura.
O conhecimento da vascularização da região é fundamental para se compreender a técnica. A artéria pudenda interna supre o períneo e emite seu primeiro ramo, a artéria retal inferior, que se dirige para a região anal. Prossegue como artéria perineal, que, após a emissão da artéria transversa do períneo, continuase como artéria labial posterior, nutrindo a pele adjacente aos grandes lábios, e se anastomosa com ramos das artérias pudenda externa profunda (sua principal anastomose), com ramos da circunflexa femoral medial e com o ramo anterior da artéria obturatória34. A afirmação de Wee & Joseph32, de que "a sobrevivência dos retalhos depende antes da robusta natureza de sua vascularização que da perícia técnica do cirurgião" equivale a dizer que mesmo lesando-se o pedículo vascular o retalho possa sobreviver como retalho randomizado (Figura 1).
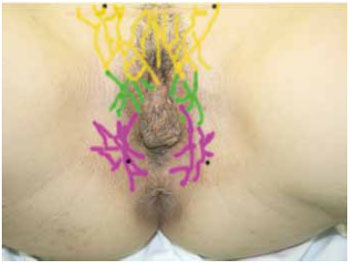
Figura 1 - Vascularização de região perineal. Amarelo: artéria pudenda externa; Verde: artéria obturadora; Roxo: artéria pudenda interna; Preto: local onde as artérias perfuram a pele.
Utilizou-se anestesia geral em 5 pacientes e peridural em 3. A técnica empregada obedeceu aos itens que se segue:
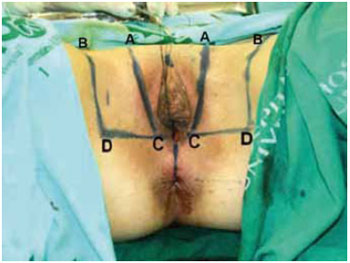
Figura 2 - Marcação dos retalhos medindo 12x6 cm. Base situada a nível posterior do intróito vaginal e ápice próximo ao triângulo femoral, metade situado na vulva e metade na raiz de coxa. Linha DC: base do retalho; Linha AB: extremidade do retalho.
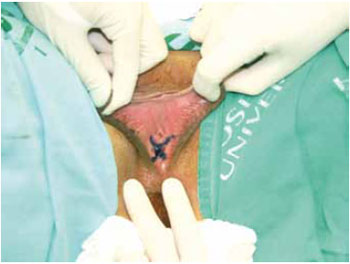
Figura 3 - Marcação em duplo Y no intróito vaginal.
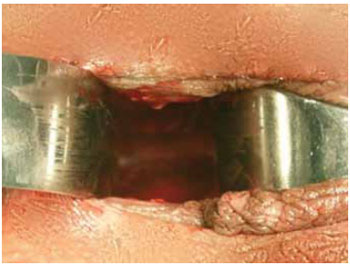
Figura 4 - Formação do neotúnel.
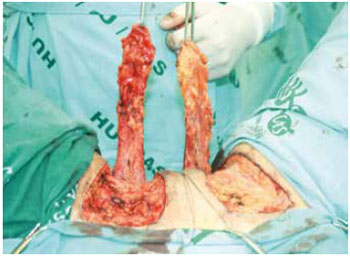
Figura 5 - Retalhos já iniciados mostrando a fáscia profunda dos músculos adutores.
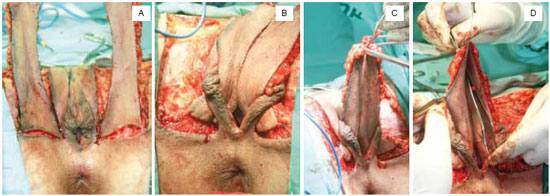
Figura 6 - A: Dissecção no subcutâneo por distância de aproximadamente 4cm na base dos retalhos. B: Retalhos transpostos por debaixo dos grandes lábios. C: Retalhos parcialmente suturados formando o fundo de saco. D: Pinça no fundo de saco da neovagina preparada para ser fixada no fundo da cavidade dissecada.
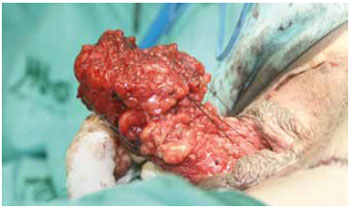
Figura 7 - Fundo de saco é ancorado no final da cavidade dissecada para prevenção de prolapso.
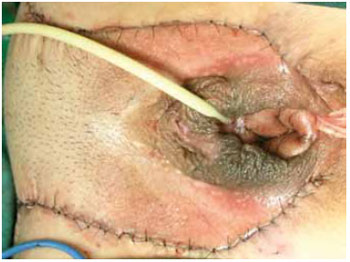
Figura 8 - Área doadora totalmente fechada por sutura em 2 planos.
RESULTADOS
Todas as pacientes operadas evoluíram bem, a neovagina apresentou no mínimo 10 cm de profundidade e 5 cm de diâmetro. Não houve casos de hematoma, infecção ou deiscência de sutura. A principal queixa no pós-operatório imediato foi de dor local de moderada intensidade, que respondeu bem aos analgésicos comuns. As pacientes deambularam no segundo dia de pós-operatório.
O curativo foi retirado a partir do 2º dia de pós-operatório, utilizando-se Neomicina e Bacitracina tópicas nas áreas suturadas e externamente. As pacientes permaneceram hospitalizadas por período curto, variando entre 2 e 3 dias. O exame especular e o toque bidigital puderam ser realizados sem grande desconforto para as pacientes com 40 dias de pós-operatório (Figura 9).
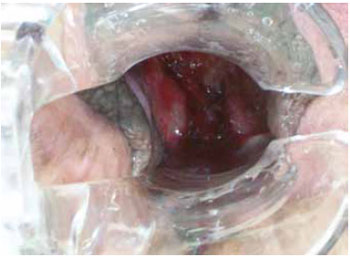
Figura 9 - Aspecto da neovagina ao exame especular no 40º dia de pós-operatório, evidenciando a permeabilidade.
As cicatrizes nas regiões doadoras se apresentaram estéticas, sem hipertrofia ou alongamento, exceto por uma paciente que apresentou alongamento do 1/3 médio da cicatriz bilateralmente (Figura 10).
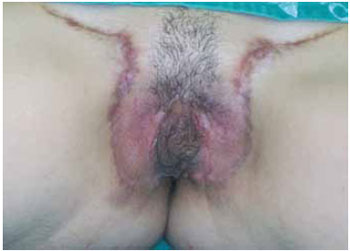
Figura 10 - Paciente no 40º dia de pós-operatório, apresentando alargamento do terço médio da cicatriz bilateralmente.
O acompanhamento pós-operatório variou entre 6 meses e 3 anos, não sendo observadas alterações significativas na neovagina, exceto crescimento de pêlos no intróito vaginal de 3 pacientes. As relações sexuais foram liberadas com 40 dias de pós-operatório, não havendo relatos de dor ou sangramento.
DISCUSSÃO
Counseller, em 1948, atribuiu a Mayer (1829), a Rokitansky (1838) e a Kuster (1910) a autoria da descrição pormenorizada de uma síndrome caracterizada pela presença de útero rudimentar, com vagina curta. Hauser e Schreiner, em 1959, estudaram 21 casos e propuseram chamar a malformação de Rokitansky-Kuster-Hauser, apesar de não obedecerem à cronologia dos fatos. Outros autores, porém, preferem denominar síndrome de Mayer-Roktansky-Kuster.
A síndrome de Rokitansky é de longe a entidade mais comumente associada à agenesia vaginal, total ou parcial5,8, o que está de acordo com o encontrado em nosso meio.
A técnica do retalho de Cingapura mostrou-se eficaz nos 8 casos avaliados, pois permitiu a reconstrução de uma vagina estável, sem contrações, com bom diâmetro, elástica e extensível, cuja manutenção das dimensões dispensa o uso de moldes e dilatadores. A sutura do intróito vaginal em Y evita a estenose, que ocorre com maior frequência na sutura circular35.
A técnica de McIndoe, uma das mais populares para o tratamento da agenesia da vagina, carrega o inconveniente do uso de moldes diários e da necessidade de vida sexual ativa para manter a funcionalidade da vagina reconstruída. Nestes casos, a ausência do molde por um dia dificulta sua reposição e o seu uso diário pode levar à ocorrência de fístulas vesicais ou retais36.
O retalho musculocutâneo de gracillis nos parece mais indicado nos casos de reconstrução após extirpação da vagina, devido ao grande volume que traz consigo e ao fato de estar sujeito à necrose parcial ou total da parte cutânea, o que também pode ocorrer nos retalhos do músculo reto abdominal37,38. Além disso, existem relatos na literatura associando a autoenxertia ao desenvolvimento de carcinoma epidermóide na neovagina39,40. Outros retalhos fasciocutâneos vulvoperineais de exíguas dimensões são descritos por Giraldo1, mas seu pequeno tamanho não permite um coito satisfatório sem dispareunia, mesmo levando em conta a elasticidade da pele.
Woods et al.33 reportam 8 casos de vaginectomia por neoplasia seguida de reconstrução pelo retalho neurovascular pudendo crural de Cingapura, porém, por questões de segurança, os retalhos não foram transformados em ilhas pela incisão de pele da base. Apesar destas pacientes serem irradiadas, todos os retalhos sobreviveram completamente. Segundo os autores, em dois de seus casos, o pedículo vascular estava lesado, demonstrando a capacidade de sobrevivência deste como retalho randomizado, reforçando a excelência desta técnica.
As principais vantagens do retalho neurovascular pudendo crural são a simplicidade e a facilidade na execução da técnica devido ao suprimento sanguíneo confiável; o ângulo de inclinação da neovagina é fisiológico e natural, as cicatrizes lineares das áreas doadoras são discretas, em parte, por se situarem na prega da virilha e períneo; nenhum retalho de coxa ou enxerto é necessário para fechar a área doadora; a vagina mantém a inervação das áreas erógenas do períneo e parte superior da coxa, em razão da manutenção de inervação a partir dos ramos labiais posteriores do nervo pudendo, e também de ramos perineais de nervo cutâneo da coxa; dispensa o uso de moldes, dilatadores e obturadores; não tem sua permeabilidade condicionada à frequência de relações sexuais; e não apresenta desordens ligadas à incontinência urinária e fecal.
A desvantagem apresentada foi o crescimento de pêlos no intróito vaginal, em 3 dos 8 casos operados, o que acreditamos poder contornar com a eletrólise prévia das partes pilosas dos retalhos no período que antecede a cirurgia.
Apesar de termos obtido profundidade satisfatória nos 8 casos apresentados, entre 10 e 12 cm, na neovagina, vale ressaltar que alguns autores citam a perda da profundidade vaginal nos pacientes que não possuíam útero para fixação do retalho, em comparação àqueles cujo retalho fora ancorado ao útero41.
CONCLUSÃO
O retalho neurovascular pudendo da coxa ou retalho de Cingapura é indicado como método seguro na reconstrução vaginal. Trata-se de técnica simples, de fácil execução e que apresenta baixo índice de complicações. Permite a obtenção de uma vagina de características anatomofuncionais adequadas, compatíveis com o desempenho da função sexual, dispensando o uso de moldes e dilatadores, levando à satisfação das pacientes. Porém, a opção pela cirurgia e o momento de realizá-la deve ser discutido com a paciente, o parceiro, o ginecologista e o psicólogo da equipe.
REFERÊNCIAS
1. Giraldo F, Solano A, Mora MJ, Abehsera M, González C, Rus JA. The Málaga flap for vaginoplasty in the Mayer-Rokitansky-Kuster-Hauser syndrome: experience and early-term results. Plast Reconst Surg. 1996;98(2):305-12.
2. Khanna S, Khanna NN. Congenital absence of vagina: an analysis of 18 cases corrected by the McIndoe operation using a condom mold. Int Surg. 1982;67(4):345-6.
3. Creatsas G, Deligeoroglou E. Vaginal aplastia and reconstruction. Best Pract Res Clin Obstet Gynaecol. 2009;24(2):185-91.
4. Baird PA, Lowry RB. Absent vagina and the Klippel-Feil anomaly. Am J Obstet Gynecol. 1974;118(2):290-1.
5. Garcia J, Jones HW Jr. The split thickness graft technique for vaginal agenesis. Obstet Gynecol. 1977;49(3):328-32.
6. Tobin GR, Day TG. Vaginal and pelvic reconstruction with distally based rectus abdominis myocutaneous flaps. Plast Reconstr Surg. 1988;81(1):62-73.
7. Capraro VJ, Gallego MB. Vaginal agenesis. Am J Obstet Gynecol. 1976;124(1):98-107.
8. Van Campenhout J, Leduc B. Unusual features in Rokitansky-Kuster- Hauser syndrome. Lancet. 1971;2(7730):928.
9. Paschoal MS. Agenesia da vagina e do útero: análise de 54 casos [Tese Concurso de Provimento do Cargo de Professor Titular da Disciplina de Ginecologia]. Rio de Janeiro: Faculdade de Medicina da Universidade Federal do Rio de Janeiro; 1979.
10. David A, Carmil D, Bar-David E, Serr DM. Congenital absence of the vagina. Clinical and psychologic aspects. Obstet Gynecol. 1975;46(4):407-9.
11. Ferreira LM, Garcia EB, Neto MS, Andrews JM. Técnica de McIndoe modificada para tratamento cirúrgico de agenesia de vagina. Rev Bras Cir. 1994;84(3):103-6.
12. McIndoe AH, Banister JB. An operation for the cure of congenital absence of the vagina. J Obstet Gynaecol Br Emp. 1938;45:490-4.
13. Junqueira A, Tostes W. Três casos de ausência congênita de vagina. Vaginoplastia pelo processo de Kirschner-Wagner. Rev Bras Cir. 1938;7:309.
14. Rothman D. The use of peritoneum in the construction of a vagina. Obstet Gynecol. 1972;40(6):835-8.
15. O'Brien BM, Mellow CG, MacIsaac IA, Maher PJ, Barbaro C. Treatment of vaginal agenesis with a new vulvovaginoplasty. Plast Recontr Surg. 1990;85(6):942-8.
16. Lilford RJ, Johnson N, Batchelor A. A new operation for vaginal agenesis: construction of a neo-vagina from rectus abdominus musculocutaneous flap. Br J Obstet Gynaecol. 1989;96(9):1089-94.
17. Tobin GR, Pursell SH, Day TG Jr. Refinements in vaginal reconstruction using rectus abdominis flaps. 1990;17(4):705-12.
18. Barros P, Costa VF, Marques H, Salimena RW. Dois casos de síndrome de Rokitansky-Kuster-Hauser. Rev Med HSE. 1972;24:2.
19. Neto BRC, Kogut J. Reconstruções vulvovaginais com retalho fasciocutaneo da região posterior da coxa baseado na artéria glútea inferior. Rev Bras Cir Plast Estet Reconst. 1996;11(3):33-40.
20. Pontén B. The fasciocutaneous flap: its use a soft tissue defects of the lower leg. Br J Plast Surg. 1981;34(2):215-20.
21. Costa DP, Piazza M, Teixeira AC, Stadler G. Nova técnica para confecção de neovagina. Vulvovaginoplastia a Williams. J Bras Ginecol. 1974;77:179.
22. Williams EA. Congenital absence of the vagina. J Obst & Ginec Brit Culth. 1964;71:511.
23. Williams EA. The surgery of developmental and congenital disorders in gynecology. Clin Obstet Gynaecol. 1978;5(3):505-23.
24. McCraw JB, Massey FM, Shanklin KD, Horton CE. Vaginal reconstruction with gracilis myocutaneous flaps. Plast Reconst Surg. 1976;58(2):176-83.
25. Butler CE, Gundeslioglu AO, Rodriguez-Bigas MA. Outcomes of immediate vertical rectus abdominis myocutaneous flap reconstruction for irradiated abdominoperineal resection defects. J Am Coll Surg. 2008;206(4):694-703.
26. Soper JT, Secord AA, Havrilesky LJ, Berchuck A, Clarke-Pearson DL. Rectus abdominis myocutaneous and myoperitoneal flaps for neovaginal reconstruction after radical pelvic surgery: comparison of flap-related morbidity. Gynecol Oncol. 2005;97(2):596-601.
27. Wagstaff MJ, Rozen WM, Whitaker IS, Enajat M, Audolfsson T, Acosta R. Perineal and posterior vaginal wall reconstruction with superior and inferior gluteal artery perforator flaps. Microsurgery. 2009;29(8):626-9.
28. Wang TN, Whetzel T, Mathes SJ, Vasconez LO. A fasciocutaneous flap for vaginal and perineal reconstruction. Plast Reconstr Surg. 1987;80(1):95-103.
29. Chen ZJ, Chen MY, Chen C, Wu N. Vaginal reconstruction with an axial subcutaneous pedicle flap from the inferior abdominal wall: a new method. Plast Reconst Surg. 1989;83(6):1005-12.
30. Hagerty RC, Vaughn TR, Lutz MH. The perineal artery axial flap in reconstruction of the vagina. Plast Reconstr Surg. 1988;82(2):344-5.
31. Joseph VT. Pudendal-thigh flap vaginoplasty in the reconstruction of genital anomalies. J Pediatr Surg. 2007;32(1):62-5.
32. Wee JT, Joseph VT. A new of technique of vaginal reconstruction using neurovascular pudendal-thigh flaps: a preliminary report. Plast Reconstr Surg. 1989;83(4):701-9.
33. Woods JE, Alter G, Meland B, Podratz K. Experience with vaginal reconstruction utilizing the modified Singapore flap. Plast Reconstr Surg. 1992;90(2):270-4.
34. Tham NL, Pan W, Rozen WM, Caren MP, Taylor GI, Corlett RJ, et al. The pudendal thigh flap for vaginal reconstruction: optimising flap survival. J Plast Reconstr Aesthet. 2010;63(5):826-31.
35. Ortiz-Monasterio F, Serrano A, Barrera G, Araico J. Congenital absence of the vagina. Long-term follow-up in 21 patients treated with skin grafts. Plast Reconstr Surg. 1972;49(2):165-70.
36. Cali RW, Pratt JH. Congenital absence of the vagina. Long-term results of vaginal reconstruction in 175 cases. Am J Obstet Gynecol. 1968;100(6):752-63.
37. Wang TN, Whetzel T, Mathes SJ, Vasconez LO. A fasciocutaneous flap for vaginal and perineal reconstruction. Plast Reconstr Surg. 1987;80(1):95-103.
38. Heath PM, Woods JE, Podratz KC, Arnold PG, Irons GB Jr. Gracilis myocutaneous vaginal reconstruction. Mayo Clin Proc. 1984;59(1):21-4.
39. Duckler L. Squamous cell carcinoma developing in an artificial vagina. Obstet Gynecol. 1972;40(1):35-8.
40. Giraldo F, Gaspar D, Gonzalez C, Bengoechea M, Ferrón M. Treatment of vaginal agenesis with vulvoperineal fasciocutaneous flaps. Plast Reconstr Surg. 1994;93(1):131-8.
41. Selvaggi G, Monstrey S, Depypere H, Blondeel P, Van Landuyt K, Hamdi M, Dhont M. Creation of a neovagina with use of a pudendal thigh fasciocutaneous flap and restoration of uterovaginal continuity. Fertil Steril. 2003;80(3):607-11.
1. Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP); Mestre em Saúde pela Universidade Federal de Juiz de Fora; Chefe do Serviço de Cirurgia Plástica da Santa Casa de Misericórdia de Juiz de Fora.
2. Residente do serviço de cirurgia Plástica da Santa casa da Misericórdia de Juiz de Fora.
3. Acadêmico da Faculdade de Medicina da Universidade Federal de Juiz de Fora.
4. Membro Titular da Sociedade Brasileira de Cirurgia Plástica; Chefe do Serviço de Cirurgia Plástica do Hospital Universitário da Universidade Federal de Juiz de Fora.
5. Membro especialista da Sociedade Brasileira de Cirurgia Plástica
Correspondência para:
Marilho Tadeu Dornelas
Rua Dom Viçoso, 20 - Alto dos Passos
Juiz de Fora, MG, Brasil - CEP: 36026-390
E-mail: marilho.dornelas@ufjf.edu.br
Artigo recebido: 22/6/ 2010
Artigo aceito: 30/8/ 2010
Trabalho realizado no Hospital Universitário da Universidade Federal de Juiz de Fora (HUUFJF) e na Clínica Plastic Center, Juiz de Fora, MG, Brasil
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP


 Read in Portuguese
Read in Portuguese
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter