

Original Article - Year 2009 - Volume 24 -
Uso de curativo com prata nanocristalina sobre enxerto em malha em queimaduras colonizadas por cepas multirresistentes
Use of nanocrystalline silver dressing on graft mesh burns colonized by multi-drug-resistant strains
RESUMO
Introdução: Pacientes vítimas de queimaduras apresentam reação inflamatória sistêmica que modifica o metabolismo, podendo cursar com infecção da área queimada. A enxertia de pele é uma ferramenta no tratamento dos queimados, no entanto, a infecção diminui ou impossibilita a integração dos enxertos. O uso de curativos com prata tem eficácia na prevenção e no tratamento de áreas contaminadas. A prata nanocristalina apresenta liberação homogênea e manutenção do ambiente próprio para reepitelização. O objetivo desse trabalho é descrever a eficiência do curativo com prata nanocristalina sobre enxerto em malha em queimaduras com colonização por cepas multirresistentes. Método: Foram avaliados quatro pacientes com queimaduras colonizadas, realizados enxerto e cobertura com curativo de prata nanocristalina. Resultados: Todos os pacientes apresentaram melhora na integração do enxerto.
Palavras-chave: Queimaduras. Nanoestruturas. Prata/uso terapêutico.
ABSTRACT
Introduction: Burn patients have systemic inflammatory reaction that modifies the metabolism and may result with infection of the burned area. Skin grafting is a tool in the treatment of burns, however, the infection decreases or prevents the integration of the grafts. The use of dressings with silver is effective in the prevention and treatment of contaminated areas. The nanocrystalline silver has released homogeneous and maintenance of proper environment for reepithelialization. The aim of this article is to describe the efficiency of nanocrystalline silver dressings on graft in place burning with colonization by multi-drug-resistant strains. Methods: We evaluated four patients with burns colonized, performed graft and covered with nanocrystalline silver dressing. Results: All patients showed improvement of graft integration.
Keywords: Burns. Nanostructures. Silver/therapeutic use.
Pacientes com queimadura de médio e grande porte apresentam diversas alterações orgânicas que interferem e dificultam seu tratamento. Simultaneamente ao dano térmico responsável por áreas de necrose de coagulação envoltas em importante processo inflamatório, a apoptose das células aumenta as áreas já lesadas, enquanto fagócitos e células imunes possuem funções alteradas1. Essas alterações podem culminar em uma das complicações mais relevantes em pacientes queimados, a infecção na área afetada, diminuindo ou mesmo impossibilitando a integração de enxertos de pele desses pacientes que possuem áreas doadoras limitadas e restritas.
Dois fatores contribuem para o aumento da incidência de infecção: a perda de solução de continuidade e a imunossupressão resultante da própria queimadura. A antibioticoterapia sistêmica, na maioria das vezes, torna-se ineficiente pela interrupção do fluxo sanguíneo local. Casos difíceis são aqueles que cursam com cepas multirresistentes em áreas de queimadura. Sendo assim, o controle da infecção, tanto quanto a tentativa de se evitar sepsemia, é a chave do sucesso da terapia em pacientes queimados e, talvez, seu maior desafio2.
Desde os tempos remotos, a prata é utilizada para fins medicinais. Os gregos e os nativos americanos usavam moedas de prata para desinfecção3,4. No final do século 19, a prata era usada para tratar epilepsia, doença venérea e úlceras em membros inferiores3,4. No final do século 20, o nitrato de prata 1% foi introduzido como colírio nos recém-nascidos para diminuição de infecção pós-parto3,4. Em 1968, Fox5 introduziu a sulfadiazina de prata em forma de creme, revolucionando o tratamento das queimaduras e reduzindo a incidência de infecção. Um dos sucessos das formulações tópicas é que apresentam menor toxicidade e maior ação local. Nas duas últimas décadas, com advento e desenvolvimento da nanotecnologia, novas formulações de prata surgem como opção terapêutica3,4,6,7. Descrevemos a evolução favorável da terapêutica local com prata nanocristalina (PN) sobre enxerto em malha de pacientes médio e grande queimado, utilizado em queimaduras com colonização por cepas multirresistentes e sinais clínicos de infecção.
MÉTODO
Foram avaliados quatro pacientes que foram vítimas de queimadura por fogo, sendo três do sexo masculino, com idades entre 13 e 47 anos e sem comorbidades. Os pacientes apresentavam 16% a 49% de área queimada, segundo a tabela de Lund-Browder, com quase totalidade de 3º grau. O atendimento primário foi realizado em outros serviços, sendo transferidos para nossa unidade de queimados entre 1º a 2º dias pós-queimadura. Inicialmente, todos receberam terapia tópica com sulfadiazina de prata e apresentavam colonização das feridas com exsudação e odor fétido (Figura 1). Todos utilizaram antibioticoterapia sistêmica diversa (segundo protocolo da unidade), sem melhora do aspecto da ferida.
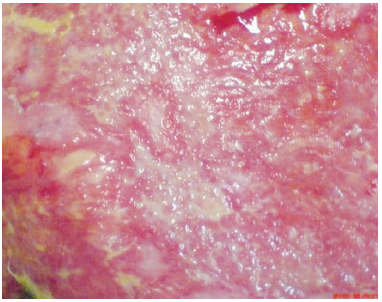
Figura 1 - Caso 1: aspecto exsudativo.
Os pacientes foram debridados e enxertados entre o 3º ao 8º dias pós-queimadura, conforme suas condições clínicas (Tabela 1). Obtiveram-se lâminas de pele parcial 0,1 mm com dermatomo de Zimmerman® e se realizou enxerto em malha 1:3, sendo coberto todo enxerto com curativo de prata nanocristalina (ActicoatTM, Smith & Nephew) e irrigado duas vezes ao dia com água destilada. Os curativos foram trocados a cada 72h até significativa epitelização, com exceção do caso 1 que foi utilizada camada dupla para o primeiro curativo e aberto após seis dias. Observaram-se cepas multirresistentes de Pseudomonas sp, Staphilococcus aureus, Acinectobacter sp e Burkoderia cepacia, isoladas em culturas de biópsia de tecido de plano profundo após o debridamento e isoladas em hemoculturas. Antibioticoterapia sistêmica foi substituída conforme orientação da comissão de controle de infecção hospitalar e sensibilidade bacteriana apresentada no antibiograma (Polimixina e Teicoplamina). Registros fotográficos foram realizados para acompanhar a evolução dos pacientes.
Caso 1
A.S.S., 13 anos, sexo masculino, 30% de superfície corporal queimada acometendo tórax-abdome e terço proximal dos membros superiores. No 2º dia de pós-operatório de debridamento (4º dia pós-queimadura), estava apresentando exsudação com odor fétido e grande quantidade de fibrina (Figuras 1 e 2). No 5º dia pós-queimadura foram realizados limpeza e enxerto em malha coberto com prata nanocristalina em camada dupla (Figura 3). No 11º dia pós-queimadura (7º dia de pós-operatório de enxerto), após abertura do curativo, foi evidenciada integração total do enxerto e área doadora com epitelização em bom estado (Figura 4). O resultado da cultura qualitativa e hemocultura apontou Pseudomonas sp somente sensível a polimixina. O paciente permaneceu com melhora clínica progressiva, apresentando pequena perda da área enxertada em parte superior do tórax e axilas. Mesmo em condições de alta após 30 dias para acompanhamento ambulatorial, a mesma só ocorreu após 93 dias por abandono familiar.
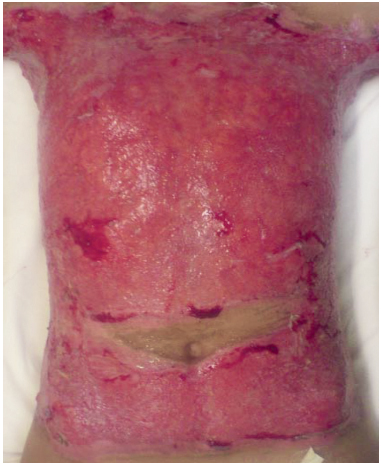
Figura 2 - Caso 1: 4º dia pós-queimadura.
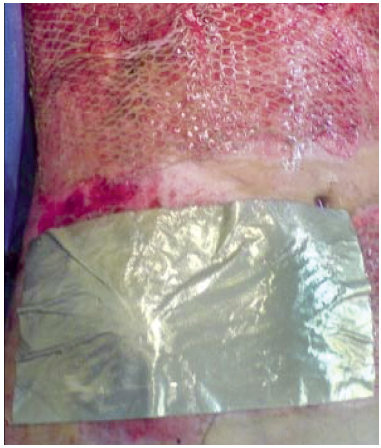
Figura 3 - Caso 1: 5º dia pós-queimadura, enxerto com prata nanocristalina.
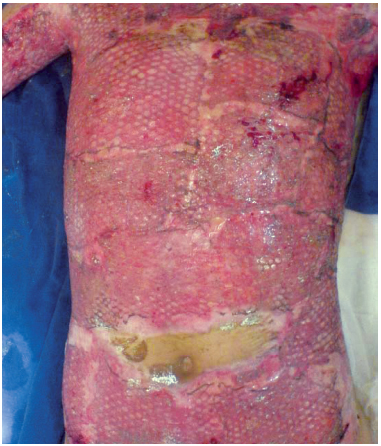
Figura 4 - Caso 1, 11º dia pós-queimadura, integração do enxerto.
Caso 2
E.A.S., 42 anos, sexo feminino, 35% de superfície corporal queimada acometendo tórax-abdome e membros superiores. Foi realizado debridamento no 3º dia pós-queimadura. No 5º dia pós-queimadura, apresentava feridas com exsudação e odor desagradável (Figura 5), sendo realizado novo debridamento no 6º dia pós-queimadura, com enxerto em malha 3:1 coberto com prata nanocristalina (Figura 6). Aberto curativo após 72h, visualizou-se integração da malha de pele parcial, com ausência de exsudação (Figura 7) e cultura qualitativa do tecido/hemocultura apresentando presença de Burkoderia cepacia sensível a polimixina. A paciente apresentou melhora clínica progressiva, com boa epitelização do enxerto em malha, apresentando pequena perda em bordas. Áreas doadoras apresentaram boa evolução. Recebeu alta hospitalar no 35º dia de internação.
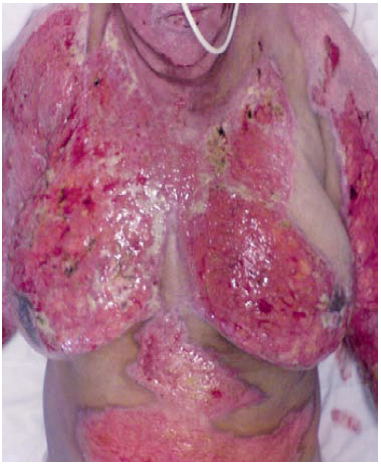
Figura 5 - Caso 2, 5º dia pós-queimadura, aspecto exsudativo.
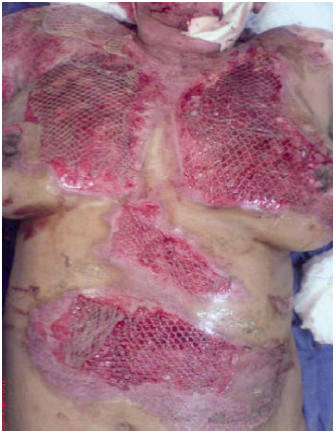
Figura 6 - Caso 2, 6º dia pós-queimadura, enxerto malha.
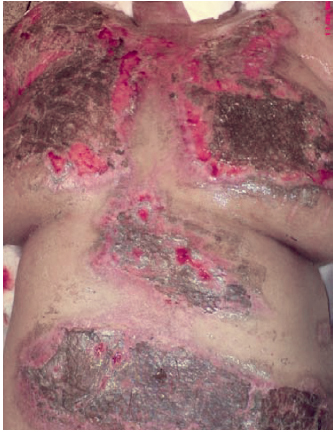
Figura 7 - Caso 2, 9º dia pós-queimadura, integração do enxerto com impregnação da prata nanocristalina no leito da ferida.
Caso 3
P.S., 29 anos, sexo masculino, 49% de superfície corpórea queimada. Foi realizado debridamento estimado de 20% das lesões no 2º dia pós-queimadura. Outros 20% sofreram debridamento no 4º dia pós-queimadura, já apresentando feridas com aspecto exsudativo, com grande quantidade de fibrina e odor desagradável. No 8º dia pós-queimadura, com feridas de mesmo aspecto, foi submetido à revisão para debridamento e limpeza com enxertia estimada de 30% das lesões, sendo coberta toda área lesada com prata nanocristalina. A cultura qualitativa do tecido e hemocultura apresentaram Pseudomonas sp somente sensível a polimixina. No 11º dia pós-queimadura, as áreas enxertadas mostraram-se integradas, com ausência de exsudação, apresentando adequada evolução e epitelização das feridas. Apesar dos cuidados de terapia intensiva, o paciente desenvolveu broncopneumonia extensa em pulmão esquerdo, com queda progressiva do estado geral, sepse e óbito no 22º dia pós-queimadura.
Caso 4
J.A.A., sexo masculino, 47 anos, 16% superfície corpórea queimada acometendo membros inferiores. Admitido 48 horas após o trauma, o paciente apresentava-se febril, com feridas exsudativas, fétidas e grande quantidade de fibrina (Figura 8). Realizado debridamento no 3º dia pós-queimadura, com enxertia no mesmo ato e cobertura com prata nanocristalina (Figura 9). A hemocultura e cultura qualitativa de tecido evidenciaram Acinetobacter sp e Staphiloccocus aureus sensíveis a teicoplamina. O curativo foi aberto após 72h e mostrou enxerto integrado (Figura 10). Recebeu alta no 21º dia pós-queimadura, apresentando epitelização completa (Figura 11) e pequena perda de enxerto em área de flexura de tornozelo direito.
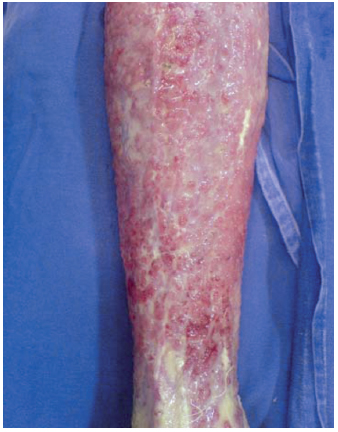
Figura 8 - Caso 4, 2º dia pós-queimadura, com exsudação.

Figura 9 - Caso 4, 3º dia pós-queimadura, enxerto com prata nanocristalina.
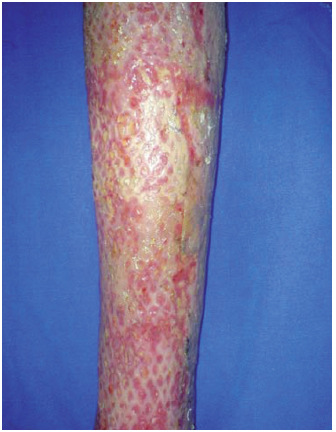
Figura 10 - Caso 4, 6º dia pós-queimadura, integração.
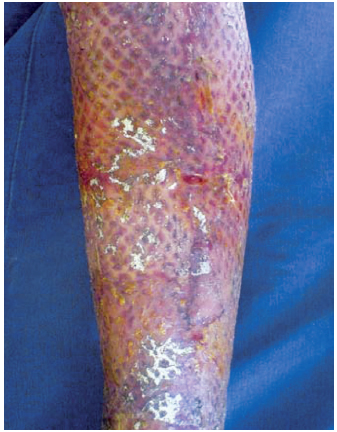
Figura 11 - Caso 4, 21º dia pós-queimadura, alta hospitalar.
RESULTADOS
Todos os pacientes apresentaram significativa integração do enxerto em poucos dias, além de diminuição da exsudação e epitelização precoce.
Os pacientes evoluíram com rápida melhora das condições clínicas, entretanto, um dos pacientes apresentou complicações pulmonares, seguidas de óbito.
A Figura 12 ilustra o período entre realização do enxerto com prata nanocristalina até sua primeira abertura e troca nos quatro pacientes.

Figura 12 - Área grifada: período entre realização do enxerto com prata nanocristalina até sua primeira abertura e troca.
DISCUSSÃO
A prata vem sendo utilizada como tratamento há mais de 200 anos em pacientes queimados3,7,8. Possui ação anti-séptica, antimicrobiana e antiinflamatória. É biologicamente ativa na sua forma solúvel, iônica ou não (Ag+ ou Ag0) e a forma Ag0 é presente nos compostos nanocristalinos. Os cátions de Ag (Ag+) apresentam potente efeito antimicrobiano por meio do bloqueio imediato da cadeia respiratória e destruição da membrana celular e parede bacteriana. Os cátions também se ligam ao DNA / RNA bacteriano, inibindo sua replicação celular3,8,9. A prata é eficaz contra um amplo espectro de bactérias aeróbias, anaeróbias, gram positivas, gram negativas; além de atividade contra fungos e vírus8,9. Sua ação antiinflamatória foi demonstrada com prata nanocristalina em modelo animal e sua eficácia comparada a esteróides de alta potência, tacrolimus e pimecrolimus10. O provável mecanismo de ação da prata nanocristalina é a supressão do TNF-alfa, interleucina-12, interleucina-8, além da indução de apoptose de células inflamatórias, sem afetar queratinócitos11-13. Nadworny et al.12, estudando dermatite de contato em modelo animal, encontraram nas feridas tratadas por sulfato de prata maior nível de apoptose de células inflamatórias, bem como em fibroblastos e queratinócitos. Já no grupo tratado com prata nanocristalina, também ocorreu maior indução da apoptose de células inflamatórias, todavia, poupando queratinócitos. Observaram que o efeito antiinflamatório da prata nanocristalina independe da atividade antimicrobiana, pois age especificamente nas citocinas inflamatórias. Provavelmente essa ação seja justificada pela apresentação Ag0 4,12.
As formulações antigas perdem os íons de prata rapidamente, sendo necessárias novas aplicações (por exemplo, a sulfadiazina de prata que necessita de 2 aplicações ao dia e o nitrato de prata mais de 12 ao dia), causando trauma e desconforto ao paciente7-9, com significativa dor, necessidade de analgesia parenteral e anestesia que interferem com alimentação, humor e nível de atividade geral.
O curativo nanocristalizado consiste em prata nanocristalina organizada em estruturas colunares, que liberam 30 vezes menos prata que outras apresentações, porém o Ag+ liberado possui uma grande superfície de exposição no leito da ferida e maior ação biológica. Outra camada com propriedade absorvente mantém a ferida úmida e com ambiente propício à contínua liberação de Ag+ 2,3,8,14 e, quando em contato com água destilada, produz liberação de maneira homogênea. Graças à nanotecnologia, quanto menor a partícula de prata liberada, maior será sua área de bioativação na ferida com aumento da atividade e solubilidade3,7,13,14. Isso fornece duas vantagens: a liberação homogênea de Ag+ suficiente para atividade antimicrobiana e a manutenção do ambiente úmido favorecendo a reepitelização3. Gravante et al.6 realizaram uma meta-análise de cinco estudos prospectivos e randomizados comparando sulfadiazina de prata e/ou nitrato de prata à prata nanocristalina e concluíram que a última é superior às demais formulações (no que tange à infecção, assim como diminui as trocas de curativo, dor e ansiedade de pacientes).
As feridas crônicas diferem das lesões agudas devido aos níveis extremos de metaloproteinases (MTP). A função da MTP é o controle da degradação da matriz extracelular, removendo tecidos danificados, permitindo a migração celular e angiogênese. Os elevados níveis dessa enzima proteolítica contribuem para a cronicidade das feridas, pois sua atividade excessiva leva à destruição da própria matriz15. Trengove et al.1 demonstraram que o processo de cura das feridas crônicas (subentende-se redução de seus diâmetros) é atingido com a diminuição dos níveis de MTP. Esse estudo levou vários autores1,12,16,17 a proporem que a diminuição da MTP seja o elo perdido entre a cura ou não de feridas crônicas. Com esse raciocínio em mente, Wright et al.15, em 2002, estudando suínos, observaram que a prata nanocristalina apresenta a capacidade de modular a atividade da MTP, diminuindo seus níveis e, embora a sulfadiazina de prata libere as mesmas quantidades de prata, esta não apresenta a mesma capacidade. A explicação mais óbvia para essa aparente discrepância é a natureza das duas formulações de prata.
O Staphilococcus aures meticilina resistente (MRSA) tornou-se um problema pandêmico. O CDC (Centers for Disease Control and Prevention) reportou aumento de 2,4 a 35% de infecções causadas por esses patógenos, sendo o agente etiológico mais preocupante em unidades intensivas para queimados8. O curativo com prata nanocristalina apresenta maior ação sobre MRSA, não elimina o patógeno da lesão, mas evita sua disseminação. Strohal et al.2, em 2005, provaram que o curativo de prata nanocristalina, além da ação antimicrobiana, oferece um efeito de barreira, impedindo a contaminação de outros pacientes.
A maior desvantagem é o custo unitário elevado8,9. Todavia, estudos têm demonstrado3,10,18 que há economia importante de material, trabalho e estadia hospitalar. Fong et al.4, em uma unidade de queimados da Austrália, compararam a prata nanocristalina com a sulfadiazina de prata e digluconato de clorexidina em creme na utilização em queimados e feridas infectadas. Pacientes tratados com prata nanocristalina tiverem redução na celulite (55% vs. 10,5%), antibioticoterapia sistêmica (57% vs. 5,2%), internação (17,3 dias vs. 12,5 dias) e custos (US$ 109.357 vs. US$ 78.907). O custo médio por paciente utilizando sulfadiazina de prata foi de US$ 27.339 e prata nanocristalina, US$19.726, economizando US$ 7613.
É descrito que a impregnação da prata nas membranas biológicas causa um discreto aumento na taxa de reepitelização em áreas doadoras comparado aos curativos convencionais, independente de sua ação antibacteriana14. O enxerto de pele em malha consiste em modelo útil para estudar a reepitelização, pelas áreas abertas entre pontes de epitélio e derme no enxerto. Demiling e DeSanti14 utilizaram este tipo de enxerto em 20 pacientes com 15 a 40% superfície corpórea queimada, demonstrando os efeitos de agentes tópicos sobre a taxa de reepitelização e concluíram que a exposição a prata nanocristalina sobre enxerto em malha aumentou a taxa de epitelização em comparação às soluções antibióticas tópicas.
Assim, a eficácia antimicrobiana da prata nanocristalina foi demonstrada em vários estudos, tanto in vivo quanto in vitro. Em contraste, há poucos relatos e nenhum estudo sobre efeitos colaterais na terapia. Trop et al.19 relatam um paciente que após uma semana com prata nanocristalina apresentou descoloração acinzentada na face que gradualmente foi aumentando, acompanhada de cansaço, perda de apetite e alterações das enzimas hepáticas, caracterizando um quadro semelhante a argiria. Esses efeitos cessaram com o término da terapia.
De modo geral, as feridas infectadas de pacientes queimados representam enorme dificuldade para realização de enxertia local. Estes pacientes, quando não infectados, apresentam colonização por diversos patógenos hospitalares resistentes a diversas drogas. Utilizamos como alternativa a terapia local com prata nanocristalina sobre enxerto em malha de áreas colonizadas e com sinais de infecção em quatro pacientes com grande superfície queimada. O tratamento local com prata nanocristalina permitiu a enxertia precoce nessas áreas, controlando os patógenos e promovendo uma melhora na epitelização (visualmente observado). Clinicamente os pacientes apresentaram rápida melhora e se pode verificar (sugestivamente) alguns pontos positivos na utilização desse curativo como: diminuição da troca de curativos, melhora na cicatrização, diminuição de complicações infecciosas, diminuição de perda do enxerto, satisfação da enfermagem e fácil utilização.
CONCLUSÃO
O curativo com prata nanocristalina mostrou-se eficaz e uma ótima opção terapêutica para o paciente médio e grande queimado (com área doadora restrita) que apresenta feridas colonizadas com sinais de infecção. No entanto, estudos com maior amostragem são necessários.
REFERÊNCIAS
1. Trengove NJ, Stacey MC, MacAuley S, Bennett N, Gibson J, Burslem F, et al. Analysis of the acute and chronic wound environments: the role of proteases and their inhibitors. Wound Repair Regen. 1999;7(6):442-52.
2. Strohal R, Schelling M, Takacs M, Jurecka W, Gruber U, Offner F. Nanocrystalline silver dressings as an efficient anti-MRSA barrier: a new solution to an increasing problem. J Hosp Infect. 2005;60(3):226-30.
3. Fong J, Wood F. Nanocrystalline silver dressings in wound management: a review. Int J Nanomedicine. 2006;1(4):441-9.
4. Fong J, Wood F, Fowler B. A silver coated dressing reduces the incidence of early burn wound cellulitis and associated costs of inpatient treatment: comparative patient care audits. Burns. 2005;31(5):562-7.
5. Fox C. Silver sulfadiazine: a new topical therapy for Pseudomonas in Burns. Therapy of Pseudomonas infection in burns. Arch Surg. 1968;96(2):184-8.
6. Gravante G, Caruso R, Sorge R, Nicoli F, Gentile P, Cervelli V. Nanocrystalline silver: a systematic review of randomized trials conducted on burned patients and an evidence-based assessment of potential advantages over older silver formulations. Ann Plast Surg. 2009;63(2):201-5.
7. Burrell RE. A scientific perspective on the use of topical silver preparations. Ostomy Wound Manage. 2003;49(5A Suppl):19-24.
8. Ulkur U, Oncul O, Karagoz H, Yeniz E, Celiköz B. Comparison of silver-coated dressing (Acticoat), chlorhexidine acetate 0.5% (Bactigrass), and fusidic acid 2% (Fucidin) for topical antibacterial effect in methicillin-resistant Staphylococci-contaminated, full-skin thickness rat burn wounds. Burns. 2005;31(7):874-7.
9. Ulkur U, Oncul O, Karagoz H, Celiköz B, Cavus,lu S. Comparison of silver-coated dressing (Acticoat), chlorhexidine acetate 0.5% (Bactigrass), and silver sulfadiazine 1% (Silverdin) for topical antibacterial effect in Pseudomonas aeruginosa-contaminated, full-skin thickness burn wounds in rats. J Burn Care Rehabil. 2005;26(5):430-3.
10. Bhol KC, Alroy J, Schechter PJ. Anti-inflammatory effect of topical nanocrystalline silver cream on allergic contact dermatitis in a guinea pig model. Clin Exp Dermatol. 2004;29(3):282-7.
11. Bhol KC, Schechter PJ. Topical nanocrystalline silver cream suppresses inflammatory cytokines and induces apoptosis of inflammatory cells in a murine model of allergic contact dermatitis. Br J Dermatol. 2005;152:1235-42.
12. Nadworny PL, Wang J, Tredget EE, Burrel RE. Anti-inflammatory activity of nanocrystalline silver in a porcine contact dermatitis model. Nanomedicine. 2008;4(3):241-51.
13. Mazurak VC, Burrell RE, Tredget EE, Clandinin MT, Field CJ. The effect of treating infected skin grafts with ActicoatM on immune cells. Burns. 2007;33(1):52-8.
14. Demling RH, DeSanti L. The rate of re-epithelialization across meshed skin grafts is increased with exposure to silver. Burns. 2002;28(3):264-6.
15. Wright JB, Lam K, Buret AG, Olson ME, Burrell RE. Early healing events in a porcine model of contaminated wounds: effects of nanocrystalline silver on matrix metalloproteinases, cell apoptosis and healing. Wound Repair Regen. 2002;10(3):141-51.
16. Yager DR, Nwomeh BC. The proteolytic environment of chronic wounds. Wound Repair Regen. 1999;7(6):433-41.
17. Barrick B, Campbell EJ, Owen CA. Leukocyte proteinases in wound healing: roles in physiologic and pathologic processes. Wound Repair Regen. 1999;7(6):410-22.
18. Peters DA, Verchere C. Healing at home: comparing cohorts of children with medium-sized burns treated as outpatients with in-hospital applied Acticoat to those children treated as inpatients with silver sulfadiazine. J Burn Care Res. 2006;27(2):198-201.
19. Trop M, Novak M, Rodl S, Hellbom B, Kroell W, Goessler W. Silver-coated dressing acticoat caused raised liver enzymes and argyria-like symptoms in burn patient. J Trauma. 2006;60(3):648-52.
1. Médico de Cirurgia Plástica do 2º ano - PUC - SP.
2. Médico de Cirurgia Plástica do 1º ano - PUC - SP.
3. Médico de Cirurgia Plástica do 3º ano - PUC - SP.
4. Cirurgião plástico, preceptor da cadeira de cirurgia plástica PUC - SP, Serviço Dr. Linneu Mattos; Membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP).
5. Cirurgião plástico, Membro Especialista da SBCP.
6. Professor Titular do Departamento de Cirurgia, área Cirurgia Plástica PUC-SP; Membro titular da SBCP.
Trabalho realizado no Conjunto Hospitalar de Sorocaba no Serviço de Cirurgia Plástica do Departamento de Cirurgia do Centro de Ciências Médicas e Biológicas da PUC-SP, Sorocaba, SP.
Trabalho Vencedor do Prêmio Raul Couto Sucena 2009.
Correspondência para:
Hamilton Aleardo Gonella
Rua Afonso Cavalline, 142
Sorocaba, SP, Brasil - CEP 18090-160
E-mail: hagonella@hotmail.com
Artigo recebido: 14/8/2009
Artigo aceito: 16/11/2009


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter