ISSN Online: 2177-1235 | ISSN Print: 1983-5175
Transplant of cultivated melanocytes for the treatment ofhypochromic burn scars
Tratamento de cicatrizes hipocrômicas pós-queimadura com transplante de melanócitos cultivados in vitro
Original Article -
Year2009 -
Volume24 -
Issue
1
Fabio KamamotoI, Marisa Roma HersonII, Marcus Castro FerreiraIII
ABSTRACT
Background: Post-burn hypochromic scars can be the subject of great personal suffering to their victims. Due to the color contrast between the normal and affected skins, they are visible lesions that embarrass the injured subjects and limit their social performance. The available treatment options in the present days are insufficient, and tend to evolve with poor results. Methods: We present in this paper the use of in vitro cultivated keratinocyte epithelium as a vehicle for the transplantation of working melanocytes to repopulate these hypochromic areas in four patients. Results: The results were evaluated with the use of color tables and skin biopsies that allowed us to clearly demonstrate the partial repigmentation of the scar areas and the integration of the transplanted melanocytes. The repigmented skin average after 3 and 6 months of the procedure was of 30.52% and 51.66%, respectively. If we consider the low-morbidity of the procedure, these results are already very encouraging, but we strongly believe that technical refinements could allow even better results.
Keywords:
Burns. Melanocytes. Cell culture techniques.
RESUMO
Introdução: As cicatrizes hipocrômicas pós-queimadura são um problema frequente, que causa aos pacientes constrangimento social e sofrimento psicológico, uma vez que podem ser bastante evidentes, graças aos contrastes de cores de pele que surgem ao seu redor (diferentes tons de pele entre a pele normal e a área vizinha à cicatriz - normalmente hipercrômica, e a cicatriz pós-queimadura, hipocrômica). As opções de tratamentos atuais para tal problema não são muito eficientes; estão hoje disponíveis: a maquiagem - que apresenta o inconveniente de sair com o passar das horas, ou a tatuagem, que muitas vezes não acompanha o tom da pele normal. Método: Neste trabalho, utilizamos epitélios de queratinócitos autólogos cultivados in vitro como veículo de transporte de melanócitos funcionantes para o tratamento dessas áreas cicatriciais hipocrômicas resultantes de queimaduras. Estes epitélios cultivados serviram como instrumento para a repopulação definitiva destas áreas com células produtoras de pigmento melânico. O método empregado incluiu o cultivo in vitro de epitélios autólogos constituídos por queratinócitos e melanócitos funcionantes, a abrasão superficial das áreas a serem tratadas, objetivando a remoção de epiderme hipocrômica, e o transplante dos enxertos autólogos cultivados. Resultados: Os resultados obtidos com a integração destes epitélios cultivados, ou seja, a restauração e a repigmentação das áreas hipocrômicas, foram avaliados por meio do uso de tabelas colorimétricas e biópsias, que demonstraram a repigmentação das cicatrizes e a persistência dos melanócitos transplantados.
Palavras-chave:
Queimaduras. Melanócitos. Técnicas de cultura de células.
INTRODUÇÃO
Sequelas de traumas, tais como queimaduras, podem ser funcionais ou estéticas, implicando em alterações importantes na auto-imagem das vítimas e criando estigmas cruéis. Dentre as sequelas frequentes em nossa população, destacam-se as áreas cicatriciais hipocrômicas, resultantes da ausência de células produtoras de pigmentos (melanócitos). Trabalhos anteriores deste grupo visando ao esclarecimento dos fatores etiológicos das hipocromias pós-queimaduras revelaram a ausência de melanócitos nas áreas cicatriciais5. Consequentemente, uma vez comprovada a ausência do principal elemento responsável pela coloração cutânea, a única terapêutica eficiente destas lesões é o implante de novas células produtoras de pigmentos nesse local.
Diante do fato de que melanócitos proliferam em co-cultura com queratinócitos, este trabalho propõe a utilização de epitélios de queratinócitos autólogos cultivados in vitro como veículo de transporte de melanócitos funcionantes para áreas hipocrômicas, resultando em instrumento para a repopulação definitiva destas áreas com células produtoras de pigmento melânico.
Várias doenças cutâneas associadas a alterações no pigmento melânico (discromias) são alvo de extensas pesquisas na área médica, pois são causa de profunda ansiedade e sofrimento aos pacientes, inclusive com repercussões sociais importantes.
As discromias cutâneas podem ser didaticamente divididas em hipermelanoses (hipercromias) ou hipomelanoses (hipocromias, leucodermias). As hipocromias caracterizam-se pelo aparecimento de manchas ou zonas de coloração mais clara que o tom de pele normal do indivíduo. Sua incidência na população mundial e em nosso meio especificamente é elevada, principalmente devido às várias etiologias possíveis. Dentre estas, destacam-se o vitiligo e áreas de cicatrizes pós-queimaduras.
A cor da pele humana é determinada pela constituição genética do indivíduo ("cor constitutiva") e por fatores ambientais, tais como a exposição à radiação ultravioleta ("cor facultativa"). A cor constitutiva resulta da interação de três elementos: a produção de melanina pelos melanócitos (cor marrom e amarelo-vermelha), a proporção entre oxihemoglobina e desoxihemoglobina circulantes no leito vascular (respectivamente, cor vermelha e azul) e a concentração de bilirrubina e beta-caroteno depositada na epiderme (cor amarela). Com papel menos importante, o brilho e a espessura da epiderme também podem influenciar na cor final1.
À melanina cabe o papel principal na coloração da pele, tendo sido descritos três tipos diferentes deste pigmento: a eumelanina (marrom-preta), a feomelanina (amarelo-vermelha) e a neuromelanina (preta)2. Os dois primeiros são produzidos a partir da metabolização da tirosina no interior dos melanócitos, que tendem a formar unidades cutâneas funcionais com os queratinócitos, guardando entre si uma proporção de 1 melanócito para 36 queratinócitos, em média3. Após a síntese, o pigmento é transferido via prolongamentos citoplasmáticos (dendritos) para os queratinócitos e, à medida que ocorre a diferenciação destes últimos, é transportado para a superfície cutânea.
A neuromelanina é sintetizada em alguns neurônios especiais do sistema nervoso central, utilizando processos enzimáticos diferentes daqueles mobilizados para a produção de eumelanina ou feomelanina4.
As hipocromias podem ser classificadas quanto à sua fisiopatologia em doenças amelanóticas, quando há comprometimento da produção de melanina nos melanócitos presentes devido a uma disfunção celular (por exemplo, albinismo, esclerose tuberosa, nevus despigmentado) ou em doenças amelanocíticas, nas quais há redução no número ou mesmo o desaparecimento de melanócitos nas lesões (por exemplo, vitiligo, cicatrizes hipocrômicas pós-queimaduras).
Trabalhos anteriores5 confirmaram a ausência de melanócitos em áreas hipocrômicas resultantes da cicatrização espontânea de queimaduras, seja consequente à migração exclusiva de queratinócitos devido a fatores inibidores circulantes após a agressão térmica, seja pela ocorrência da autodestruição in situ de melanócitos. Ainda não foram definitivamente estabelecidos os mecanismos que culminam com o desaparecimento destas células em áreas cicatriciais resultantes da reparação espontânea de áreas queimadas. Portanto, diante da ausência de células-alvo (melanócitos), pode-se concluir que, nestes quadros clínicos, terapêuticas que estimulem a produção de melanina, tais como uso de psoraleno tópico, radiação ultravioleta do tipo A e corticosteróides não apenas serão ineficientes, como ainda poderão acentuar as áreas discrômicas, pois melanócitos localizados nas bordas das lesões hipocrômicas poderão ser estimulados, criando áreas circundantes de hipercromia6.
Foram propostos tratamentos não cirúrgicos, tais como uso de maquiagem temporária ou mesmo definitiva por meio de tatuagem. No entanto, a tatuagem é pouco utilizada pela dificuldade na combinação dos pigmentos para atingir-se um resultado verdadeiramente natural, além do agravante representado pelos níveis imprevisíveis de reabsorção por macrófagos dos pigmentos, criando áreas de coloração irregular, principalmente em tronco e extremidades.
Algumas abordagens cirúrgicas foram propostas, entre elas a substituição da cicatriz hipocrômica por enxertos em lâminas de pele de espessura total ou parcial. Ainda foi proposta a realização de mini-enxertos de pele total (mini grafting), ou seja, a retirada de pequenos fragmentos (biópsias de 1 a 2 mm² de diâmetro) de pele de espessura total de áreas normocrômicas, e seu transplante a nichos previamente preparados nas áreas hipocrômicas7,8. A repigmentação da região hipopigmentada ocorre gradualmente com a dispersão de melanócitos e pigmento a partir dos mini-enxertos normocrômicos. Uma vez ocorrendo a coalescência destas pequenas ilhotas de neopigmentação, ocorre melhora da lesão hipocrômica.
Kiistala e Mustakallio9, em 1964, propuseram tática interessante para eliminar áreas doadoras de pele, ocasionando ao mesmo tempo pouco desconforto aos pacientes. Conceberam aparelho que, aplicado à pele, gerava nestas áreas pressões negativas entre 150 e 300 mmHg durante intervalos de tempo variáveis. Esta sucção provocava a separação entre a epiderme e a derme ao nível da membrana basal, resultando na formação de bolhas (suction blisters). O epitélio de revestimento destas bolhas, essencialmente composto por queratinócitos e melanócitos, podia ser removido e utilizado como enxertos "epidérmicos".
Em 1971, Falabela et al.10 foram pioneiros na utilização desta técnica para o tratamento de lesões hipocrômicas resultantes de queimaduras e de vitiligo. Esta experiência, compartilhada posteriormente por outros autores11,12, demonstrou que ocorreria a incorporação e migração dos melanócitos transportados no epitélio de revestimento das bolhas.
Melanócitos cultivados in vitro poderiam, em teoria, ser utilizados para o repovoamento das áreas hipocrômicas, uma vez que técnicas de cultura de células permitem sua cultura isolada ou associada a queratinócitos, formando epitélios transplantáveis. No entanto, melanócitos apresentam crescimento lento in vivo, fato evidenciado em cortes histológicos de pele normal, onde são vistas poucas figuras mitóticas das células pigmentares13. Löntz et al.14 observaram que a capacidade proliferativa destas células também era afetada negativamente pela idade.
Este comportamento revelou-se um problema nas culturas de melanócitos isolados. O número de células necessário para o sucesso da proposta é bastante grande, implicando em demora de até cinco semanas para atingir-se o número de células desejado, mesmo com a inclusão no meio de cultura de fatores estimulantes para a proliferação destas células, como por exemplo o 12-O-Tetradecanoil-forbol-13-acetato, a isobutilmetil xantina ou fator de crescimento de fibroblasto básico (βFGF)15.
Assim, se o transplante de melanócitos isolados teria a vantagem de permitir melhor controle sobre o número de células aplicadas à lesão hipocrômica, em contrapartida, estas células seriam apenas dispersas sobre a área cruenta, ocorrendo risco elevado de não serem incorporados de fato pelo receptor.
Na década de 70, Rheinwald e Green16-18 estabeleceram as bases do método de cultura de queratinócitos humanos a partir de células isoladas da epiderme, formando epitélios transplantáveis para uso como enxertos. A dissociação das células da cultura inicial (primária) e sua propagação em culturas filhas (secundária, terciária, etc) podia ser realizada cobrindo toda a longevidade destas células in vitro (cerca de 150 replicações) e permitindo que, a partir de 1 cm2 de pele inicial, pudessem ser obtidos aproximadamente 1000 cm2 de epitélio transplantável, no transcorrer de duas a três semanas de cultivo17.
Os epitélios cultivados in vitro são formados por camadas de queratinócitos (oito a doze camadas), que apresentam sinais de diferenciação celular detectáveis por imunofluorescência e microscopia eletrônica19,20. A presença de hemidesmossomos rudimentares representa indícios de reestruturação de membrana basal21,22.
Melanócitos funcionantes detectados por meio de coloração Dopa foram observados proliferando nestes epitélios de queratinócitos cultivados in vitro, mantendo-se a relação in vivo de um melanócito para 36 queratinócitos23,24.
Em 1981, O'Connor et al.25 descreveram a primeira utilização clínica de epitélios autólogos cultivados como enxertos em vítimas de queimaduras. A integração inicial foi de aproximadamente 50% dos enxertos e os resultados finais foram comprometidos principalmente por infecção local. Mas, transcorridos seis meses, as áreas enxertadas com epitélios cultivados possuíam aspecto e resistência mecânicas semelhantes às áreas tratadas por enxertos autógenos convencionais de espessura parcial.
Em 1984, este novo recurso terapêutico ganhou espaço importante na mídia leiga e científica, quando Gallico et al.26 divulgaram a sobrevivência de duas crianças com queimaduras de 97% e 98% de sua superfície corpórea, na maior parte de terceiro grau. A sobrevivência desses pacientes foi relacionada pelos autores à utilização de enxertos de epitélios autólogos cultivados para revestimento das áreas cruentas resultantes da remoção cirúrgica das escaras de queimaduras.
Subsequentemente, o emprego de enxertos autólogos cultivados para a oclusão de áreas cruentas em vítimas de queimaduras foi tema de outras publicações.
A experiência bem sucedida com o tratamento de queimaduras motivou também o emprego de epitélios cultivados no tratamento de outras doenças, tais como epidermólise bolhosa, fechamento de áreas cruentas resultantes da remoção de nevus gigantes congênitos ou revestimento de áreas doadoras de retalhos.
Kumagai e Uchikoshi27 utilizaram esta proposta buscando obter a repigmentação de áreas cicatriciais hipocrômicas, possivelmente dentro do conceito de que mesmo que a situação de co-cultura queratinócitos/melanócitos proporcione um número menor de melanócitos disponíveis para repigmentação, o transplante de células na forma de epitélio melhoraria as possibilidades de sua incorporação.
Em 1997, estes autores28 publicaram trabalho em que amostras de pele foram retiradas dos glúteos, da sola do pé e da região adjacente à queimadura, buscando comparar a eficiência das áreas doadoras quanto à repigmentação. As amostras foram manipuladas para a obtenção de epitélios cultivados, posteriormente aplicados em áreas hipocrômicas. Em termos de cor final, concluíram que a aplicação de epitélio cultivado segue a mesma regra geral de enxertos comuns, ou seja, que resultados estéticos melhores foram obtidos quando utilizadas como áreas doadoras de células aquelas localizadas o mais próximo possível das lesões tratadas.
Alguns autores descreveram que a pigmentação inicia-se a partir de 6 dias após o transplante e atinge seu resultado final após 3 meses. Os locais que mostram os melhores resultados são o tronco, a face e o dorso das mãos, enquanto os piores são os cotovelos e os dedos. Zachariae et al.29 compararam a repigmentação obtida por enxertia de pele e com a aplicação de epitélios cultivados, concluindo que ambas técnicas levam à repigmentação, porém o resultado com o uso de enxertos cultivados foi mais satisfatório e uniforme após seguimento de um ano. As principais complicações observadas nesta opção de tratamento com transplante de células cultivadas foram a infecção da área receptora, a resposta variável em termos de eficácia de indivíduo para indivíduo e o surgimento de áreas hipocrômicas no sítio doador em alguns pacientes29.
Baseados no conhecimento obtido nessa literatura, iniciamos em 2003 um trabalho de pigmentação dessas cicatrizes no ambulatório de sequelas de queimaduras do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
MÉTODO
Seleção de pacientes
Foram selecionadas quatro pacientes do Ambulatório de Sequelas de Queimaduras da Divisão de Cirurgia Plástica e Queimaduras do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, com idades variando de 34 a 48 anos, cujas lesões hipocrômicas foram resultantes da cicatrização espontânea de queimaduras ocorridas pelo menos 12 meses previamente à realização do estudo, independentemente do agente causal e da área de localização. Não foram incluídas neste estudo cicatrizes de áreas doadoras de enxertos de pele.
Obtenção de amostras de pele normocrômica
Sob anestesia local (xilocaína 0,5% com adrenalina 1:100.000), em condições assépticas, foi removido de cada paciente fragmento cutâneo normocrômico de espessura total de 1 cm² aproximadamente, preferencialmente de área próxima àquela a ser tratada. Após sua retirada, o fragmento de pele total foi lavado com solução salina a 0,9% e transportado ao laboratório em frasco estéril contendo meio de cultura DMEM (Meio de Dulbecco Modificado). A partir de então, toda manipulação das amostras foi realizada no Laboratório de Microcirurgia e Cirurgia Plástica da Faculdade de Medicina da Universidade de São Paulo, em setor de cultura de células especialmente designado para o cultivo de transplantes para uso clínico. O manuseio foi realizado dentro de fluxo laminar, empregando-se técnica asséptica.
Culturas de queratinócitos/melanócitos
Utilizando processos enzimáticos e meios de cultura já consagrados baseados nos trabalhos de Rheinwald e Green16, foram extraídos e cultivados os queratinócitos e em co-cultura os melanócitos das amostras obtidas previamente. Estas células foram cultivadas até a obtenção de epitélios confluentes e transplantáveis, quando foram então levadas ao centro cirúrgico a fim de serem transplantadas (Figura 1).

Figura 1 - Epitélio obtido pela co-cultura de queratinócitos e melanócitos.
Transplante dos epitélios cultivados
Preparo da área receptora: Inicialmente a área a ser tratada foi anestesiada com EMLA®. Então foi retirada da região central da lesão biópsia (punch 2 mm) e encaminhada para estudo histológico. A área receptora então foi submetida a abrasão mecânica, objetivando a remoção das camadas córnea e epidérmica. Todas estas manobras foram realizadas em centro cirúrgico, sob condições assépticas. Enxertia dos epitélios cultivados: Os epitélios cultivados foram transportados à área receptora com a utilização de lâminas de Rayon, e estes incorporados ao curativo (Figura 2). A abertura dos curativos se deu no sétimo dia pós-transplante.
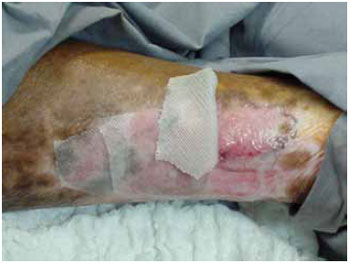
Figura 2 - Curativos de rayon contendo o epitélio cultivado.
Método de avaliação
Os resultados foram avaliados utilizando-se duas abordagens distintas: avaliação clínica baseada no painel colorimétrico de Munsell (Figura 3) e análise histológica. As medidas colorimétricas foram realizadas em um mês, 3, 6 e 12 meses após o transplante dos epitélios cultivados, permitindo a avaliação quanto ao progresso observado na repigmentação das áreas hipocrômicas. Paralelamente, foram colhidas biópsias (punch de 2 mm) das áreas pré e pós-enxertia, transcorridos 6 e 12 meses. A fim de identificar a presença ou não de melanócitos funcionantes nos preparados histológicos, empregamos a reação de Dopa.
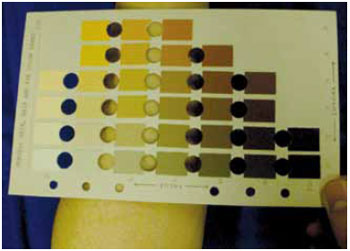
Figura 3 - Demonstração de medida de cor da pele por meio da aplicação do painel colorimétrico de Munsell.
RESULTADOS
Paciente 1: (C.M.J.) Paciente do sexo feminino, de 48 anos, com cicatriz em perna esquerda decorrente de cicatrização por segunda intenção de queimadura por escaldo com óleo há 7 anos. A área queimada apresentava região central hipocrômica com 102,3 cm² (Figura 4). A metodologia proposta foi aplicada para correção da discromia e a evolução no pós-operatório se deu sem intercorrências.
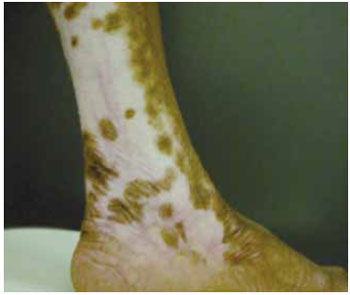
Figura 4 - Cicatriz hipocrômica pós-queimadura em perna esquerda.
A primeira medição colorimétrica no pós-operatório evidenciou área de repigmentação de 15,8 cm² dentro da área previamente hipocrômica. Essa área era discretamente mais escura do que a pele sã circunjacente. Na segunda medição, a área de repigmentação havia progredido, atingindo 43,3 cm², e já tendo adquirido uma coloração pouco mais clara, entretanto, ainda assim, mais escura do que a pele sã. Na terceira medição, a área hipocrômica havia mantido o seu tamanho, no entanto, a área repigmentada havia adquirido tom semelhante ao da pele sã (Figura 5).
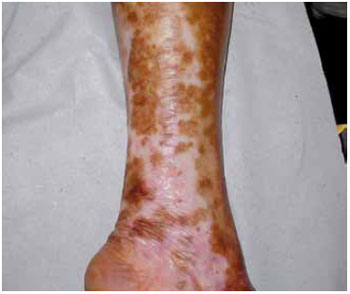
Figura 5 - Pós-operatório de 6 meses com repigmentação parcial da lesão.
Paciente 2: (I.S.A.) Paciente do sexo feminino, de 36 anos, com cicatriz decorrente de cicatrização por segunda intenção de queimadura em face posterior do antebraço esquerdo em seu terço proximal, ocasionada por escaldo por leite há 32 anos. A área queimada apresentava região de hipocromia com 210,68 cm².
Na primeira medição, três meses após o procedimento, notou-se o surgimento de pequenas ilhas de repigmentação, todas elas mais escuras do que a pele sã da mesma região do antebraço contralateral, totalizando cerca de 18,26 cm² (Figura 6). A segunda medição desta paciente foi realizada com intervalo de doze meses após a cirurgia: evidenciou-se aumento da área repigmentada, esta já apresentando coloração mais clara, aproximando-se da cor da área normal, e com uma área aproximada de 76,75 cm².
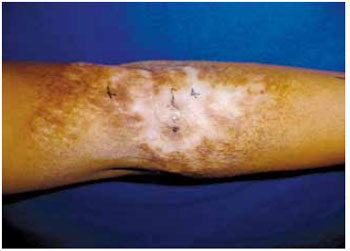
Figura 6 - Pós-operatório de 3 meses demonstrando repigmentação da área central da cicatriz.
Paciente 3: (C.T.A.) Paciente do sexo feminino, de 34 anos, com cicatriz hipocrômica de aproximadamente 117,2 cm², decorrente de cicatrização por segunda intenção de queimadura em flanco direito, provocada por incêndio em suas vestes aos 26 anos.
Na primeira medição, uma área de repigmentação de 41,1 cm² surgiu, preenchendo quase totalmente a área previamente hipocrômica. Assim como nos outros casos, esta repigmentação mostrava coloração mais escura do que a área sã de referência. Na segunda medição, três meses após a primeira, não se notou grande progressão da área repigmentada (45,2 cm²), porém sua coloração sofreu leve clareamento, aproximando a sua coloração à da área sã vizinha. Esta paciente não compareceu para a terceira medição com um ano de pós-operatório.
Paciente 4: (A.F.S.) Paciente de 40 anos, com cicatriz com área de hipocromia de cerca de 42,5 cm², decorrente de cicatrização por segunda intenção de queimadura em perna esquerda por escaldo com água há 30 anos.
À primeira medição, aos três meses de pós-operatório, havia três focos de repigmentação com coloração semelhante à das áreas sãs de referência e totalizando cerca de 26 cm². Na segunda, com 6 meses de pós-operatório, houve aumento da repigmentação, com confluência dos focos, levando a uma área de repigmentação de aproximadamente 38 cm², no total. Esta paciente não compareceu para a terceira medição com um ano de pós-operatório.
A Tabela 1 sumariza os resultados obtidos com o tratamento dos quatro pacientes e a Figura 7 apresenta a porcentagem média de repigmentação com 3 e 6 meses de tratamento.
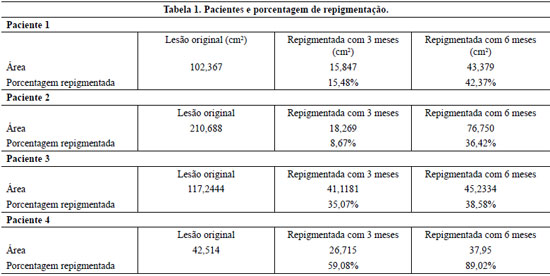
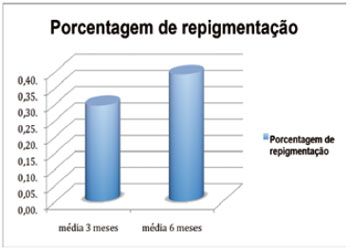
Figura 7 - Porcentagem média de repigmentação com 3 e 6 meses de tratamento.
Avaliação histológica
A avaliação histológica dos fragmentos obtidos das áreas hipocrômicas pré-tratamento demonstra total ausência de melanócitos, como é observado na Figura 8. Em contrapartida, a análise das biópsias obtidas nas áreas repigmentadas após o tratamento evidenciou repovoamento destas áreas com melanócitos funcionantes, com padrão semelhante de distribuição, densidade e localização destas células ao da pele normal (Figuras 9 e 10).
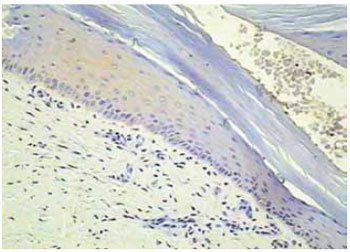
Figura 8 - Controle-biopsia pré-tratamento com ausência de melanócitos (aumento 40x).
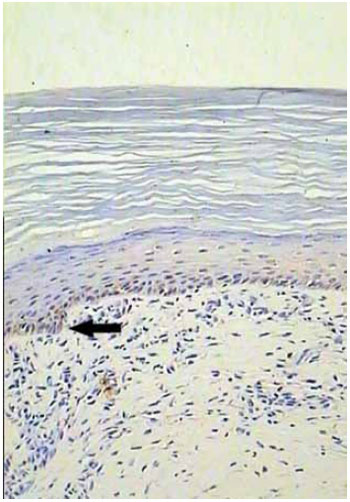
Figura 9 - Caso 1: pós-operatório de 6 meses com presença de melanócitos (seta). Aumento de 20x.
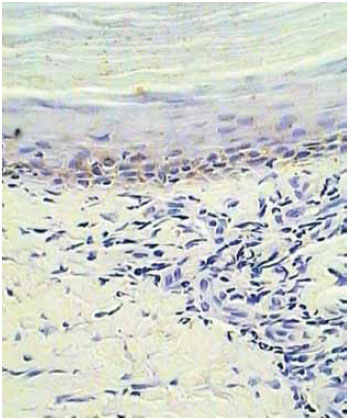
Figura 10 - Detalhe caso 1: pós-operatório de 6 meses com presença de melanócitos (em marrom). Observa-se ainda a pigmentação nas camadas mais superficiais de queratinócitos e da epiderme. Aumento de 40x.
DISCUSSÃO
Todas as pacientes apresentaram, em grau variado, diminuição nas áreas de hipocromia, sendo aquela com lesão localizada próxima ao cotovelo a que obteve menor taxa de repigmentação (Tabela 1). Esta observação é consoante com a de trabalhos prévios, que apontam o cotovelo e os dedos como sendo as áreas menos responsivas aos tratamentos para repigmentação27. Outro achado interessante foi a tendência inicial de hipercromia nas áreas que se repigmentaram após o tratamento, seguida de posterior normalização da tonalidade e aproximação desta com as das áreas sãs circunjacentes. Este fenômeno ainda carece de explicação fisiológica, no entanto, pode-se aventar a hipótese de ser provocado por maior concentração de citocinas inflamatórias e fatores de crescimento presentes nas fases mais iniciais da cicatrização e integração do enxerto, que estimulariam portanto um ritmo aumentado de melanogênese. Pode-se notar também, como mostrado nas Figuras 5 e 6, que a maior parte das áreas que recuperou pigmentação normal está presente nas regiões mais centrais das lesões, de forma que todas elas permaneceram com um "halo" de hipocromia separando as áreas repigmentadas da pele com coloração normal. Isto pode ser explicado por limitação da técnica de preparo da área receptora: é sabido que a localização normal dos melanócitos na pele é a membrana basal. Utilizamos para a preparação do leito receptor o método da dermabrasão. Assim, fica extremamente difícil garantir que o nível atingido seja a membrana basal e, portanto, os melanócitos cultivados sejam semeados com perfeição no seu "habitat" preferencial. Pode-se tentar sanar esta deficiência em trabalhos futuros com a utilização do laser para a criação de superfícies cruentas possivelmente mais uniformes em profundidade, nas áreas a serem tratadas. Este método foi utilizado com sucesso para tratamento de lesões hipocrômicas30, no entanto, por meio da obtenção de enxertos cutâneos de áreas sãs, o que evidentemente tem a desvantagem de maiores chances de criar sequelas nas áreas doadoras do que aquelas advindas das pequenas biópsias necessárias para doação de células para cultura. Apesar da pequena amostragem de pacientes neste trabalho inicial, atingimos uma média de repigmentação de 42%, e acreditamos ser possível aumentar esta taxa com o refinamento das técnicas, podendo inclusive levar à total repigmentação das áreas tratadas.
CONCLUSÃO
O transplante de melanócitos para o tratamento de cicatrizes hipocrômicas é um método factível, que permitiu a melhora do quadro clinico dos pacientes.
REFERÊNCIAS
1. Morgan JE, Gilchrest B, Goldwyn RM. Skin pigmentation. Current concepts and relevance to plastic surgery. Plast Reconstr Surg. 1975;56(6):617-28.
2. Fitzpatrick TB, Mosher DB. Pigmentações cutâneas e distúrbios do metabolismo da melanina. Ln: Harrison, ed. Medicina interna. 11ª ed. Rio de Janeiro: Guanabara Koogan; 1998. p.231-2.
3. Junqueira LC, Carneiro J. Pele e anexos. In: Junqueira LC, Carneiro J, eds. Histologia básica. 8ª ed. Rio de Janeiro: Guanabara Koogan; 1995. p.302-5.
4. Mosher DB, Fitzpatrick TB, Ortonne J, Hori Y. Disorders of pigmentation. In: Fitzpatrick TB, Eisen AZ, Wolff K, Freedberg IM, Austen KF, eds. Dermatology in general medicine. 3ª ed. New York: McGraw-Hill; 1987. p.794-830.
5. Quagliano AP, Costa MP, Germano MAN, Herson MR, Ferreira MC. Histologic analysis of postburned hypochromic lesions. Acta Anatômica. 1995;4:331.
6. Tyack ZF, Pegg S, Ziviani J. Postburn dyspigmentation: its assessment, management, and relationship to scarring. A review of the literature. J Burn Care Rehabil. 1997;18(5):435-40.
7. Falabella R. Treatment of localized vitiligo by autologous minigrafting. Arch Dermatol. 1988;124(11):1649-55.
8. Gauthier Y, Surleve-Bazeille JE. Autologous grafting with noncultured melanocytes: a simplified method for treatment of depigmented lesions. J Am Acad Dermatol. 1992;26(2 Pt 1):191-4.
9. Kiistala U, Mustakallio KK. In-vivo separation of epidermis by production of suction blisters. Lancet. 1964;1(7348):1444-5.
10. Falabella R. Epidermal grafting. An original technique and its application in achromic and granulating areas. Arch Dermatol. 1971;104(6):592-600.
11. Koga M. Epidermal grafting using the tops of suction blisters in the treatment of vitiligo. Arch Dermatol. 1988;124(11):1656-8.
12. Kim HY, Kang KY. Epidermal grafts for treatment of stable and progressive vitiligo. J Am Acad Dermatol. 1999;40(3):412-7.
13. Lerner AB, Halaban R, Klaus SN, Moellmann GE. Transplantation of human melanocytes. J Invest Dermatol. 1987;89(3):219-24.
14. Löntz W, Olsson MJ, Moellmann G, Lerner AB. Pigment cell transplantation for treatment of vitiligo: a progress report. J Am Acad Dermatol. 1994;30(4):591-7.
15. Eisinger M, Marko O. Selective proliferation of normal human melanocytes in vitro in the presence of phorbol ester and cholera toxin. Proc Natl Acad Sci USA. 1982;79(6):2018-22.
16. Rheinwald JG, Green H. Formation of a keratinizing epithelium in culture by a cloned cell line derived from a teratoma. Cell. 1975;6(3):317-30.
17. Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 1975;6(3):331-43.
18. Rheinwald JG, Green H. Epidermal growth factor and the multiplication of cultured human epidermal keratinocytes. Nature. 1977;265(5593):421-4.
19. Staiano-Coico L, Higgins PJ, Darzynkiewicz Z, Kimmel M, Gottlieb AB, Pagan-Charry, et al. Human keratinocyte culture. Identification and staging of epidermal cell subpopulations. J Clin Invest. 1986;77(2):396-404.
20. Green H, Kehinde O, Thomas J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proc Acad Sci USA. 1979;76(11):5665-8.
21. Asselineau D, Bernard BA, Bailly C, Darmon M, Pruniéras M. Human epidermis reconstructed in culture: is it "normal"? J Invest Dermatol. 1986;86(2):181-6.
22. Compton CC, Gill JM, Bradford DA, Regauer S, Gallico GG, O'Connor NE. Skin regenerated from cultured epithelial autografts on full-thickness burn wounds from 6 days to 5 years after grafting. A light, electron microscopic and immunohistochemical study. Lab Invest. 1989;60(5):600-12.
23. De Luca M, Franzi AT, D'Anna F, Zicca A, Albanese E, Bondanza S, et al. Coculture of human keratinocytes and melanocytes: differentiated melanocytes are physiologically organized in the basal layer of the cultured epithelium. Eur J Cell Biol. 1988;46(1):176-80.
24. Franzi AT, D'Anna F, Zicca A, Trabucchi E. Histological evaluation of human cultured epithelium before and after grafting. Burns. 1992;18(Suppl 1):S26-31.
25. Grafting of burns with cultured epithelium prepared from autologous epidermal cells. Lancet. 1981;1(8211):75-8.
26. Gallico GG 3rd, O'Connor NE, Compton CC, Kehinde O, Green H. Permanent coverage of large burn wounds with autologous cultured human epithelium. N Engl J Med. 1984;311(7):448-51.
27. Kumagai N, Uchikoshi T. Treatment of extensive hypomelanosis with autologous cultured epithelium. Ann Plast Surg. 1997;39(1):68-73.
28. Kumagai N, Oshima H, Tanabe M, Ishida H, Uchikoshi T. Favorable donor site for epidermal cultivation for the treatment of burn scars with autologous cultured epithelium. Ann Plast Surg. 1997;38(5):506-13.
29. Zachariae H, Zachariae C, Deleuran B, Kristensen P. Autotransplantation in vitiligo: treatment with epidermal grafts and cultured melanocytes. Acta Derm Venereol. 1993;73(1):46-8.
30. Açikel C, Ulkur E, Guler MM. Treatment of burn scar depigmentation by carbon dioxide laser-assisted dermabrasion and thin skin grafting. Plast Reconstr Surg. 2000;105(6):1973-8.
I. membro da Sociedade Brasileira de Cirurgia Plástica, Coordenador do setor de cirurgia plástica do Hospital Universitário da USP.
II. Membro da Sociedade Brasileira de Cirurgia Plástica, Chefe do Donor Tissue Bank of Victoria, Melbourne, Austrália.
III. Professor Titular da Disciplina de Cirurgia Plástica, Faculdade de Medicina da USP.
Correspondência para:
Fabio Kamamoto
Rua mato grosso, 306 conj.1402 - Consolação
São paulo - sp - CEP 01239-040
E-mail: fabio.kamamoto@terra.com.br
Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP. Trabalho vencedor do Prêmio Raul Couto Sucena/2008.
Artigo recebido: 26/11/2008
Artigo aceito: 12/1/2009
 All scientific articles published at www.rbcp.org.br are licensed under a Creative Commons license
All scientific articles published at www.rbcp.org.br are licensed under a Creative Commons license


















