

Original Article - Year 2008 - Volume 23 -
A papaína reduz a formação de cápsula fibrosa ao redor de implantes de silicone texturizados em ratos
The papain pocket delivery impairs the capsule fibrous healing around textured silicone implants in rats
RESUMO
Objetivo: Estudar o reparo tecidual ao redor dos implantes mamários texturizados sob a ação local de papaína (PA). Método: Foram avaliados 36 ratos Wistar, distribuídos aleatoriamente em dois grupos (n = 18): papaína (PA) e controle (CT). Cada grupo foi distribuído igualmente em 3 subgrupos (n = 6) e observados nos períodos de 7, 35 e 90 dias pós-operatório. Cada animal recebeu um implante texturizado na região dorso-axilar à esquerda (sham - SH), sem papaína, onde se instilou previamente 0,5 mL de solução salina 0,9%; e outro implante também texturizado à direita, onde se instilou 0,5 mL de solução hidrossolúvel contendo papaína. Os animais do grupo controle (CT) receberam apenas inclusão de um implante texturizado na região dorso-axilar esquerda com instilação prévia de 0,5 mL de solução salina 0,9%. A análise histológica, nos 3 subgrupos, foi realizada utilizando-se a coloração de picrosirius red e um sistema analisador de imagens com o programa Image Pro Plus® para verificação da espessura e da densidade de fibras colágenas da cápsula. Resultados: No grupo papaína (PA), observou-se, aos 35 e 90 dias, diminuição significativa da espessura da cápsula fibrosa ao redor do implante, da densidade de fibras colágenas e da quantidade de miofibroblastos em comparação ao grupo controle (CT). Conclusão: A papaína diminuiu a formação da cápsula fibrosa ao redor dos implantes de silicone texturizado em ratos.
Palavras-chave: Implante mamário. Inflamação. Contratura/prevenção & controle. Papaína.
ABSTRACT
Objective: To study the tissue repair around the textured mammary implants under the action of papain (PA). Methods: Thirty-six Wistar rats were evaluated and randomly distributed into two groups (n = 18): papain (PA) and control (CT). Each group was equally distributed into 3 subgroups (n = 6) and observed on 7th, 35th and 90th pos-operative days. Each animal received a textured implant in the left dorso-axillary region (sham - SH), on were instilled 0.5 mL saline solution 0.9%, and another textured implant on the right dorso-axillary region (papain - PA), on were instilled 0.5 mL of water-soluble solution of papain. The control group (CT) received only textured implant in the left dorso-axillary region with prior instillation of 0.5 mL of saline solution 0.9%. The histological analysis of the 3 subgroups was carried out using picrosirius-red stain and an image analyzing system using the Image Pro PlusTM program to evaluate the thickness and maturation and deposition of collagen fibers. Results: At 35th and 90th days, the papain group (PA) presented reduction on the fibrous capsule thickness around the implant, in the number of collagen fibers and myofibroblasts, comparing to the control group (CT). Conclusion: The papain drug decreased the fibrous capsule formation around the textured silicon implants in rats.
Keywords: Breast implantation. Inflammation. Contracture/prevention & control. Papain.
A contratura capsular após implante mamário é o efeito adverso mais comum deste procedimento cirúrgico1. A gravidade da contratura capsular tem relação direta com o grau de reação inflamatória local2 e independe da superfície do implante utilizado3. Apesar de não estar clara a patogênese da contratura capsular, este fenômeno parece ser multifatorial4.
Atualmente, não existe nenhuma medida preventiva considerada efetiva para contratura capsular4. O tratamento convencional pode ser cirúrgico, por meio de capsulotomia ou capsulectomia e substituição do implante5; ou farmacológico, por meio de esteróides, antileucotrienos, anti-TGFbeta, antibióticos ou antiinflamatórios6.
A papaína é uma endopeptidase planta thiol que tem atividade similar à enzima humana lisossomal catepsina B, com ação proteolítica e fibrinolítica sobre o mecanismo normal de cicatrização7.
Especificamente em relação à contratura capsular, alguns autores têm especulado sobre a possível ação moduladora de determinadas enzimas proteolíticas presentes ao redor dos implantes nas fases iniciais da cicatrização8,9.
Na prevenção da contratura capsular, hipotetizou-se que a papaína possa ser benéfica quando utilizada localmente ao redor do implante no momento do procedimento operatório, favorecendo um reparo tecidual com menos tecido fibrótico.
O objetivo desse estudo foi investigar os efeitos da papaína na espessura, densidade de fibras colágenas e de miofibroblastos da cápsula fibrosa ao redor de implantes texturizados em ratos.
MÉTODO
O protocolo experimental (1082-06) foi aprovado pelo Comitê de Ética da Universidade Federal de São Paulo - Escola Paulista de Medicina (UNIFESP - EPM).
Foram selecionados trinta e seis ratos Wistar machos, com peso 250-300g, mantidos em gaiola individual à temperatura ambiente com ciclo de 12 horas dia/noite (claro/escuro), recebendo água e ração livremente.
A anestesia foi via intramuscular com cloridrato de 2-(2,6- xilidino)-5,6-dihidro-4H-1,3-tiazina (Ronpun® - Bayer, Germany) e cloridrato de quetamina (Ketalar® - Parke-Davis, Belgium) na relação 1:1, empregando-se desta associação 1mL.kg-1. Uma dose única (60 mg/kg) de cefazolina (KefazolTM - Eli Lilly do Brasil Ltda - São Paulo - Brasil) foi administrada, via intramuscular, como uma profilaxia de infecção.
Utilizou-se implante de silicone de superfície texturizada (diâmetros dos poros entre 0,05 e 0,25mm) em forma de concha de dois centímetros de diâmetro e volume de 2 mL de silicone gel (Silimed® Brasil - São Paulo).
Em dezoito animais, foram realizadas duas incisões paralelas (1,5 centímetros) à direita e à esquerda da coluna vertebral, logo abaixo da região cervical. Duas lojas foram criadas a 4 centímetros da incisão sob o músculo panniculus carnosus, onde os implantes de silicone foram posicionados.
Antes da colocação do implante, foi instilado na loja esquerda 0,5 mL de solução salina (grupo sham - SH) e, na loja direita, instilou-se 30mg/kg-1 em solução de 0,5 mL de papaína (USP 27® - Papain Tablets for Topical Solution Papaverine - Vermizym, Germany - Fórmula & Ação Farmácia Ltda. Brasil) (grupo papaína - PA). Outros dezoito animais foram submetidos apenas a uma incisão à esquerda, dissecção da loja e instilação de solução salina (0,5 mL), seguida da inserção do implante (grupo controle - CT) (Figura 1).
Figura 1 - Desenho esquemático do protocolo: rato A - dois implantes texturizados - grupo sham (SH) sem droga; grupo papaína (PA) com droga; rato B - um implante texturizado - grupo controle (CT).
A eutanásia foi realizada no 7º, 35º e 90º dia, sob anestesia, por injeção intravenosa de cloreto de potássio até a parada cardíaca do animal.
A retirada da peça foi feita por uma incisão em torno do centro do implante (4cm2) (Figura 2).
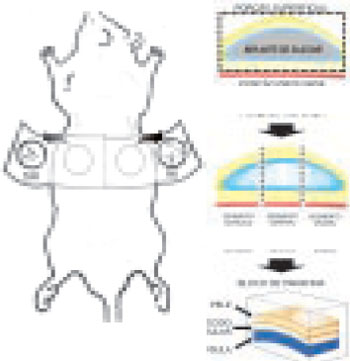
Figura 2 - Bloco único com o implante e cápsula ao seu redor coletados do rato após 24 horas. A cápsula foi dissecada a partir dos implantes de silicone e três cortes (cranial, média e caudal) foram enviados para processamento histológico.
Os espécimes foram imersos em formol 10% tamponado. Após 24 horas, a cápsula ao redor do implante foi dissecada (Figura 2), cortada em três fragmentos (cranial, medial e caudal), embebida em parafina e preparada para cortes histológicos de 5μm corados com picrosirius red, para medir a espessura da cápsula (utilizando-se aumento de 200x), e para calcular a densidade das fibras colágenas com luz polarizada (utilizando-se aumento de 400x). Em ambos os casos, utilizando-se o programa Image Pro Plus®.
Outras secções foram preparadas para imunohistoquímica para contagem de miofibroblastos (Dako CytomationTM - BiogenTM Inc - Cambrigde, MA - EUA), utilizando-se o retículo micrométrico de 100 pontos (Weiss Olympus® - Labstore®). Os músculos e vasos de cor marrom foram identificados e excluídos do porcentual da população de miofibroblastos presentes na cápsula fibrosa.
A análise estatística foi feita utilizando-se testes de variância fatorial (one-way e two-way). Estes foram executados para comparar médias dos grupos e testar se houve interação entre o tempo versus tratamento. Para a identificação da variação "two-way" dentro do mesmo grupo, foi utilizado o teste de Tukey (SPSS versão 11.0) e foi considerado valor significativo quando menor que 5% (p < 0,05).
RESULTADOS
A papaína foi eficaz para a diminuição da espessura da cápsula aos 35 e 90 dias, em comparação aos outros dois grupos (controle e sham) e estes resultados sugerem que a droga teve uma ação local no processo de cicatrização (Tabela 1 e Figuras 3 e 4).
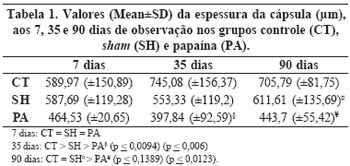
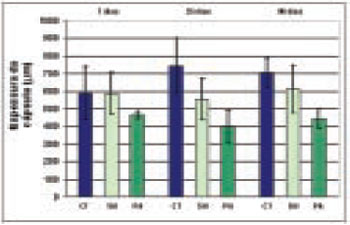
Figura 3 - Valores (Mean±SD) da espessura da capsula (μm), aos 7, 35 e 90 dias de observacao nos grupos controle (CT), sham (SH) e papaina (PA).
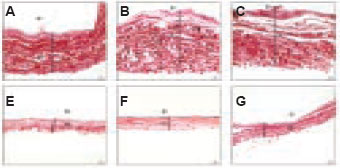
Figura 4 - Fotomicrografia da espessura da cápsula: grupo controle (CT), aos 7 dias - 739.79mm (A), 35 dias 898.62mm (B) e 90 dias 809.34mm (C); Papaína (PA), aos 7 dias 394,40mm (D), 35 dias 337,45mm (E) e 90 dias 377.14mm (F). (Picrosirius red - 200X). SI = silicone. CF = cápsula fibrosa.
A papaína mostrou-se eficaz de diminuir a densidade do colágeno aos 35 dias, mas também agiu no grupo sham (SH), o que sugere provavelmente uma ação sistêmica na formação de colágeno fibroso na cicatrização (Tabela 2 e Figuras 5 e 6).
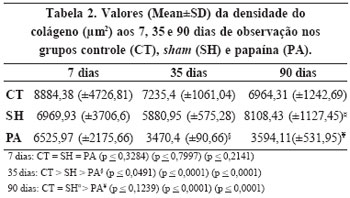
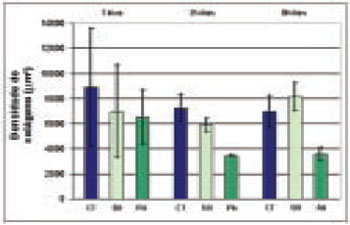
Figura 5 - Valores (Mean±SD) da densidade do colageno (μm2), aos 7, 35 e 90 dias de observacao, nos grupos controle (CT), sham (SH) e papaina (PA).
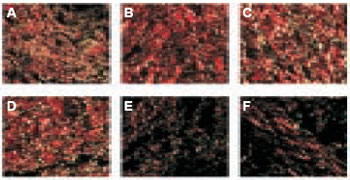
Figura 6 - Fotomicrografia da densidade do colágeno: grupo controle (CT) ao 7º (A) 7681.17μm2, 35º (B) 6318.67μm2 e 90º dia de observação (C) 7856.83μm2; no grupo papaína (PA) ao 7º (D) 7173.60μm2, 35º (E) 3301.70μm2 e 90º dia (F) 3510.30μm2. A contagem das fibras colágenas é menor aos 35 dias (B) (Picrosirius red, luz polarizada - 400X). Aspecto capturado na tela (Image Pro-PlusTM software).
A papaína aos 90 dias esteve associada a menor contagem de miofibroblastos no grupo papaína (PA) em comparação ao grupo controle (CT), o que poderia estar associado a um efeito local da droga. Por outro lado, o número de miofibroblastos foi significativamente menor no grupo sham (SH), o que indica uma ação sistêmica da droga (Tabela 3 e Figuras 7 e 8).

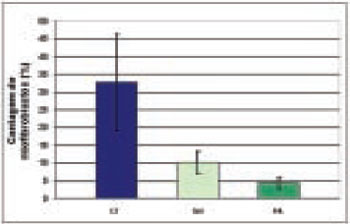
Figura 7 - Número de miofibroblastos em uma centena de campos (Mean±SD), aos 90 dias de observação, nos grupos controle (CT), sham (SH) e papaína (PA).

Figura 8 - Fotomicrografia da contagem de miofibroblastos, aos 90 dias de observação (imunohistoquímica - 200X). Grupo controle (CT) (A), sham (SH) (B) e papaína (PA) (C).
DISCUSSÃO
Modelos animais têm sido frequentemente utilizados para estudar a contratura capsular em torno de implantes4-6,8.
A prolongada e exacerbada reação tecidual tem uma correlação linear positiva com o grau de fibrose e contração ao redor do implante2.
As propriedades da papaína são conhecidas na redução do edema, ou como antiinflamatório, antitrombose e analgésico, assim como a sua ação proteolítica7.
Alguns autores mediram a atividade contrátil dos miofibroblastos e demonstraram o seu relaxamento com a utilização de papaverina (papaína)10,11.
Bastos et al.5, em estudo experimental em ratos, obtiveram redução da espessura da cápsula e de densidade do colágeno, mas não da quantidade de miofibroblastos, após injeção intraperitoneal de zafirlukast.
A droga regula a função dos mastócitos, reduzindo a capacidade de produção de citocinas e fatores de crescimento, encurtando a fase inflamatória e limitando a proliferação de miofibroblastos e deposição de colágeno. O excesso de mastócitos produz fatores de crescimento, tais como TGFbeta, que vai finalmente proporcionar contração, formação cicatricial e proliferação de miofibroblastos12. Parece que o principal mecanismo de ação da papaína é a regulação das citocinas IL-6, que têm um papel fundamental no reparo e na regeneração tecidual7,8.
Batra et al.8, em estudo experimental, demonstraram menos fibras colágenas e miofibroblastos ao redor de implantes texturizados após o terceiro mês, devido à presença de certos fatores no transudato que limitam a transformação de fibroblastos em miofibroblastos e o depósito de fibras colágenas. Wyatt et al.9, em estudo histológico de cápsulas fibrosas em humanos, descreveram uma diminuição natural na densidade de fibras colágenas ao redor de implantes texturizados com o passar do tempo e com a redução da proliferação de fibroblastos devido à presença de enzimas fibrinolíticas, as quais podem reduzir o processo inflamatório local.
Estudos prévios de Ajmal et al.13, com coelhos, com instilação local de sulfato de 2-mercaptoetano de sódio (Mesna) e Frangou & Kanellaki14 com camundongos, com mitomicina C, demonstraram redução da espessura da cápsula, da densidade de colágeno e do número de fibroblastos.
Karaçal et al.15, utilizando modelo experimental em ratos, instilaram fluido amniótico humano contendo ácido hialurônico, na loja do implante, e obtiveram redução da pressão e da espessura da cápsula após seis meses.
Acredita-se que, de forma análoga ao estudo de Karaçal et al.15, a papaína possa produzir um reparo tecidual com mais tendência à regeneração e menos formação de tecido cicatricial.
Assim como foi hipotetizado, a papaína promoveu redução significativa na espessura da cápsula fibrosa, aos trinta e cinco e noventa dias, em comparação ao grupo controle. Também reduziu a quantidade de fibras colágenas, aos trinta e cinco e noventa dias, e a quantidade de miofibroblastos, aos noventa dias de observação, em comparação ao grupo controle.
CONCLUSÃO
A instilação local de uma única dose de papaína foi efetiva para impedir a formação de cápsula fibrosa ao redor de implantes de silicone texturizados após avaliação da espessura da cápsula, da densidade de fibras colágenas e da contagem de miofibroblastos.
REFERÊNCIAS
1. Prantl L, Schreml S, Fichtner-Feigl S, Pöppl N, Eisenmann-Klein M, Schwarze H, et al. Clinical and morphological conditions in capsular contracture formed around silicone breast implants. Plast Reconstr Surg. 2007;120(1):275-84.
2. Siggelkow W, Faridi A, Spiritus K, Klinge D, Rath W, Klosterhalfen B. Histological analysis of silicone breast implant capsules and correlation with capsular contracture. Biomaterials. 2003;24(6):1101-9.
3. Poeppl N, Schreml S, Lichtenegger F, Lenich A, Eisenmann-Klein M, Prantl L. Does the surface structure of implants have an impact on the formation of a capsular contracture? Aesthetic Plast Surg. 2007;31(2):133-9.
4. Gancedo M, Ruiz-Corro L, Salazar-Montes A, Rincón AR, Armendáriz-Borunda J. Pirfenidone prevents capsular contracture after mammary implantation. Aesthetic Plast Surg. 2008;32(1):32-40.
5. Bastos EM, Neto MS, Alves MT, Garcia EB, Santos RA, Heink T, et al. Histologic analysis of zafirlukast's effect on capsule formation around silicone implants. Aesthetic Plast Surg. 2007;31(5):559-65.
6. Spano A, Palmieri B, Taidelli TP, Nava MB. Reduction of capsular thickness around silicone breast implants by zafirlukast in rats. Eur Surg Res. 2008;41(1):8-14.
7. Rose B, Herder C, Löffler H, Meierhoff G, Schloot NC, Walz M, et al. Dose-dependent induction of IL-6 by plant-derived proteases in vitro. Clin Exp Immunol. 2006;143(1):85-92.
8. Batra M, Bernard S, Picha G. Histologic comparison of breast implant shells with smooth, foam, and pillar microstructuring in a rat model from 1 day to 6 months. Plast Reconstr Surg. 1995;95(2):354-63.
9. Wyatt LE, Sinow JD, Wollman JS, Sami DA, Miller TA. The influence of time on human breast capsule histology: smooth and textured silicone-surfaced implants. Plast Reconstr Surg. 1998;102(6):1922-31.
10. Gabbiani G, Ryan GB, Majne G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia. 1971;27(5):549-50.
11. Baker JL Jr, Chandler ML, LeVier RR. Occurrence and activity of myofibroblasts in human capsular tissue surrounding mammary implants. Plast Reconstr Surg. 1981;68(6):905-12.
12. Desser L, Holomanova D, Zavadova E, Pavelka K, Mohr T, Herbacek I. Oral therapy with proteolytic enzymes decreases excessive TGF-beta levels in human blood. Cancer Chemother Pharmacol. 2001;47(supl):S10-5.
13. Ajmal N, Riordan CL, Cardwell N, Nanney LB, Shack RB. The effectiveness of sodium 2-mercaptoethane sulfonate (Mesna) in reducing capsular formation around implants in a rabbit model. Plast Reconstr Surg. 2003;112(5):1455-63.
14. Frangou J, Kanellaki M. The effect of local application of mitomycin-C on the development of capsule around silicone implants in the breast: an experimental study in mice. Aesthetic Plast Surg. 2001;25(2):118-28.
15. Karaçal N, Cobanoglu U, Ambarcioglu O, Topal U, Kutlu N. Effect of amniotic fluid on peri-implant capsular formation. Aesthetic Plast Surg. 2005;29(3):174-80.
I. MD, PhD, Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP).
II. MD, PhD, Professor Associado e Livre Docente da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Cirurgia da Universidade Federal de São Paulo / Escola Paulista de Medicina (UNIFESP-EPM).
III. MD, PhD, Professor Associado, Livre Docente e Chefe da Disciplina de Histologia e Biologia Estrutural do Departamento de Morfologia da UNIFESP-EPM.
IV. MD, Departamento de Patologia da Universidade Estadual de Maringá (UEM).
V. MD, PhD, Professora Adjunta da Disciplina de Cirurgia Plástica da Universidade Federal do Paraná (UFPR).
VI. Acadêmica do 1º ano do curso de Medicina da Universidade Oeste-Paulista de Presidente Prudente (Unoeste).
Correspondência para:
Marcio Moreira
Avenida Tiradentes, 1084
Centro - Maringá, PR
CEP 87013-260
E-mail: marciomoreiradr@brturbo.com.br
Trabalho realizado na Universidade Federal de São Paulo - Escola Paulista de Medicina (UNIFESP-EPM), São Paulo, SP; Universidade Estadual de Maringá (UEM), Maringá, PR; e Universidade Federal do Paraná (UFPR), Curitiba, PR.
Trabalho vencedor do Prêmio Evaldo D'Assumpção - 2008.
Artigo recebido: 25/08/2008 Artigo aceito: 13/11/2008


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter