

Ideas and Innovation - Year 2024 - Volume 39 -
Aplicações dos biotecidos na cirurgia plástica: Uma revisão sistemática
Applications of Biotissues in Plastic Surgery: A Systematic Review
RESUMO
Introdução Biotecidos são combinações organizadas de substâncias sintéticas e/ou biológicas que interagem com sistemas biológicos complexos para tratar, substituir ou remodelar tecidos ou órgãos. A bioengenharia de tecidos emprega diversos métodos, incluindo scaffolds biológicos e sintéticos, com interação com células-tronco e citocinas. Esta revisão examina técnicas e métodos para a síntese de biotecidos, além de sua eficácia em modelos animais e humanos.
Materiais e Métodos Foi realizada uma revisão sistematizada da literatura nas plataformas PubMed, Lilacs, Scielo e Cochrane, utilizando descritores específicos. A análise focou na identificação dos países de origem dos estudos, categorização das técnicas e recursos empregados, visando auxiliar na escolha de estratégias para o uso de biotecidos na cirurgia plástica reconstrutiva.
Resultados Dos 37 artigos selecionados, 15 abordaram experimentação in vitro, 14 in vivo, e 8 utilizaram ambas as abordagens. Os estudos foram classificados em 3 subtemas principais: adipogênese (18 artigos), angiogênese (10 artigos) e condrogênese (nove artigos), todos voltados para reconstruções teciduais.
Conclusão Os avanços no uso de biomateriais na medicina regenerativa são promissores, com experimentos satisfatórios alinhados à cirurgia plástica contemporânea. Embora a aplicação em humanos seja limitada, o potencial das células-tronco e fatores de crescimento sugerem avanços significativos que devem ser melhor desenvolvidos isoladamente em estudos futuros. Esta revisão esclarece as tecnologias e progressos no uso de biomateriais, destacando seu impacto na evolução técnica da cirurgia plástica reconstrutiva.
Palavras-chave: biomateriais; cirurgia reconstrutiva; scaffolds
ABSTRACT
Introduction Biotissues are defined as organized combinations of synthetic and/or biological substances that interact with complex biological systems to treat, replace, or remodel tissues and organs. Tissue bioengineering employs a variety of methods, including the use of biological and synthetic scaffolds, along with interactions involving stem cells and cytokines. The present review evaluates the techniques andmethods for biotissue synthesis, as well as their efficacy in both animal and human models.
Materials and Methods A systematic literature review was conducted using the PubMed, Lilacs, Scielo, and Cochrane databases, employing specific descriptors. The analysis focused on identifying the countries of origin of the studies and categorizing the techniques and resources utilized, with the aim of informing the selection of strategies for the application of biotissues in reconstructive plastic surgery.
Results Among the 37 selected articles, 15 focused on in vitro experimentation, 14 on in vivo experimentation, and 8 employed both approaches. The studies were further categorized into 3 primary subtopics: adipogenesis (18 articles), angiogenesis (10 articles), and chondrogenesis (9 articles), all relevant to tissue reconstruction.
Conclusion Advances in the use of biomaterials in regenerative medicine are promising, with experimental results aligning well with contemporary plastic surgery practices. While human application remains limited, the potential of stem cells and growth factors suggests significant future developments, warranting further focused studies. The present review elucidates the technologies and progress in the use of biomaterials, highlighting their impact on the technical evolution of reconstructive plastic surgery.
Keywords: biomaterials; reconstructive plastic surgery; scaffolds
Introdução
A cirurgia plástica teve diversos avanços no campo da cirurgia reparadora. Desde os estudos de Sir Harold Delf Gillies na Primeira Guerra Mundial até hoje, várias estratégias foram desenvolvidas com foco na escada de reconstrução. Porém, o padrão-ouro atual para tais procedimentos são retalhos autólogos cirúrgicos, os quais possuem diversas desvantagens, como locais doadores limitados, morbidade do local doador e operações complexas e prolongadas com seus próprios riscos. A fim de superar tais inconveniências, a bioengenharia promete recursos ilimitados a partir de sua potencialidade por meio de biotecidos para realizar tais reconstruções de forma mais segura, ao invés de retalhos autólogos restritos.1
Biotecidos são qualquer combinação de substâncias de origem sintética e/ou biológica que, de forma organizada e integrada, possa interagir com sistemas biológicos complexos a fim de tratar, substituir ou remodelar quaisquer tecidos ou órgãos do corpo/ser-vivo estudado.2 Desse modo, devem seguir critérios específicos, tais como: permitir proliferação celular adequada ao tecido a ser aderido; acompanhar taxas de biodegradação e evolução biológica do organismo vivo; não promoverem tipos de rejeição imunológico-inflamatória ao organismo recebedor do tecido, de modo a torná-lo viável.3
Porém, o ideal de utilização de biotecidos para formação de um tecido viável em cirurgias reconstrutivas e estéticas humanas, a fim de alcançar a proporção e a função do órgão a ser substituído, ainda possui suas limitações no conhecimento científico atual, como a nutrição ineficaz de tais tecidos desenvolvida por engenharia tecidual e materiais limitados para produção dos scaffolds.4 As unidades básicas de construção da engenharia de tecidos são a matriz extracelular (MEC) ou scaffold, células viáveis e a manutenção homeostática adequada dos tecidos.1
O objetivo desta revisão sistemática é, inicialmente, expor os princípios fundamentais subjacentes à engenharia de tecidos e, posteriormente, realizar uma análise das principais técnicas e suas inovações.
Materiais e Métodos
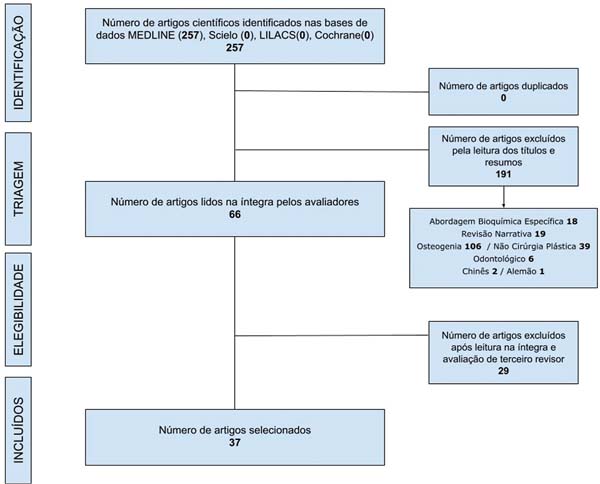
A pesquisa foi realizada nas bases de dados MEDLINE, LILACS, Scielo e Cochrane, utilizando termos descritores obtidos no DECS/MESH. Os descritores utilizados para selecionar os artigos desejados nas bases de dados foram: plastic surgery AND biomaterials AND tissue engineering AND scaffold AND stem cells. A busca restringiu-se a artigos publicados entre 2010 e 2023, em inglês, português e espanhol, e incluiu apenas revisões sistemáticas, metanálises e estudos clínicos e experimentais, englobando um total de n ¼ 257 artigos. A seleção dos artigos foi realizada por meio da plataforma Rayyan (Rayyan Systems, Cambridge, MA, EUA) para elaboração de revisões sistemáticas e sistematizadas da literatura. Dois avaliadores diferentes atuaram no estudo. Em caso de dúvidas sobre a inclusão do artigo, um terceiro avaliador foi convocado (►Fig. 1).
A avaliação do artigo iniciou-se pelo título e resumo, e, em caso de não adequação ao tema, houve exclusão primária. A exclusão secundária se deu pela leitura completa dos artigos, seguida por uma segunda filtragem de modo a obter os artigos que de fato fossem condizentes com metodologia, objetivos, aplicação prática e discussão compatíveis com os objetivos desta revisão.
Na primeira exclusão foram retirados artigos em duplicata e com enfoque em: tratamento odontológico, osteogenia, abordagem bioquímica específica, revisões narrativas e artigos sem enfoque em cirurgia plástica. Na segunda exclusão foram retirados artigos que expunham: foco apenas bioquímico, não consideravam aplicabilidade prática, protocolos de reprodução exclusiva do scaffold e artigos que não tinham aplicabilidade na cirurgia plástica reconstrutiva. Experimentos com resultados incompletos não foram considerados e os selecionados foram lidos na íntegra.
Para a elaboração dos resultados e discussão, os artigos foram categorizados em temas específicos de sua abordagem. Foram considerados in vitro artigos que não utilizaram animais para experimentação dos enxertos, e in vivo os demais que consideraram o respectivo uso. Foi considerado enfoque: adipogênico para os artigos que almejavam a reconstrução de partes moles envolvendo técnicas de coleta de tecido adiposo associadas às respectivas células-tronco teciduais como principal objetivo; angiogênico para os que propunham a neovascularização e manutenção homeostática do enxerto como objetivo; e condrogênico para os que almejavam a formação de neocartilagem. Os termos scaffold, veículo e hidrogel foram utilizados como sinônimos dado contexto específico determinado no momento de uso. Para distribuição dos artigos conforme nacionalidade, foi considerado o serviço credenciado e país de origem do primeiro autor.
Resultados
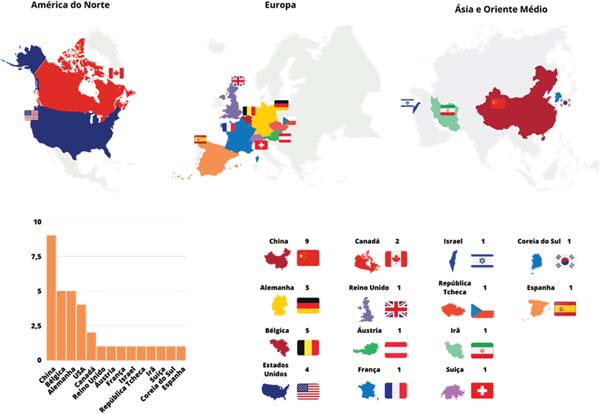
Foram selecionados 37 artigos, dentre os quais 15 realizaram abordagem experimental em modelo exclusivo in vitro; 14 realizaram abordagem experimental em modelo exclusivo in vivo; e 8 realizaram experimentação em ambas as abordagens no mesmo estudo (►Tabelas 1-3).5-41 Os países que mais publicaram sobre o assunto foram China (nove artigos), Alemanha (cinco artigos), Bélgica (cinco artigos) e Estados Unidos (quatro artigos) (►Fig. 2).
| Autor e ano | Técnica | Vantagens | Limitações |
|---|---|---|---|
| Flynn et al. (2010)5 | hASCs foram semeadas em scaffold DAT em modelo in vitro | Compatibilidade, integração e adesão celular bem favoráveis | Necessidade de mais estudos sobre scaffold DAT |
| Wu et al. (2012)6 | hASCs foram semeadas em scaffold DAT em modelo in vitro. Em seguida, o biotecido foi inserido no subcutâneo de camundongos | Compatibilidade, integração e adesão celular bem favoráveis | Necessidade de mais estudos sobre scaffold DAT |
| Alharbi et al. (2013)7 | hASCs foram semeadas em veículo Matriderm em modelo in vitro | Comparação de cânulas para lipoaspiração para sobrevivência do enxerto | Não avalia a manutenção do tecido em longo prazo |
| Garg et al. (2014)8 | rASCs foram semeadas em scaffold de hidrogel (colágeno-pululano) em modelo in vitro e, em seguida, inseridos de forma circular em feridas superficiais no dorso de camundongos | Quatro métodos de produção do enxerto analisados, produção rápida e angiogênese observada | Necessidade de estudos em humanos |
| Cheung et al. (2013)9 | hASCs foram semeadas em scaffold (DAT þ MGC ou DAT þ MCS) em modelo 3D in vitro. Em seguida, criou-se o enxerto com rASCs, e o mesmo foi inserido no subcutâneo de ratos |
Método de encapsulamento oferece uma tecnologia minimamente invasiva para defeitos irregulares em tecidos moles | Necessidade de mais estudos que analisem a manutenção da densidade celular no enxerto implantado em longo prazo |
| Gugerell et al. (2015)10 | hASCs foram semeadas em scaffolds de PLLG þ Gel-MA sob condições estáticas. Em seguida, foram inseridas em biorreator em modelo in vitro |
Condições dinâmicas e angiogênese observada | Tempo de produção |
| Pati et al. (2015)11 | hASCs foram semeadas em scaffold 3D impresso (DAT) em modelo in vitro | Compatibilidade, integração e adesão celular bem favoráveis | Necessidade de mais estudos sobre scaffold DAT |
| Zeng et al. (2015)12 | hASCs foram semeadas em microgel (PMMA) cultivados em 2D e 3D em modelo in vitro. Em seguida, os enxertos foram inseridos em feridas superficiais no dorso de camundongos | Maior vantagem da estrutura 3D e facilidade na injeção da solução de hidrogel para o enxerto e para a viabilidade celular | Necessidade de mais estudos sobre microgéis (PMMA) |
| Wahl et al. (2015)13 | hASCs foram semeadas em 4 diferentes scaffolds comerciais (BioPiel, Smart Matrix, Integra DRT, Strattice) em modelo in vitro e in vivo por membra na amniótica de ovos de galinha | Maior vantagem das matrizes de colágeno bovino e de fibrina na eficiência da cicatrização | Necessidade de mais estudos para corroborar alguma ineficiência de scaffold de quitosana ou de DAT suíno |
| Lequeux et al. (2015)14 | hASCs foram injetadas junto ao veículo Cytocare no subcutâneo de camundongos | Compatibilidade, integração e adesão celular bem favoráveis | Não avalia a manutenção do tecido a longo prazo |
| Hanken et al. (2016)15 | hASCs foram semeadas em scaffolds de seda com e sem fatores de crescimento em modelo in vitro | Manutenção do enxerto e neovascularização obtida por fatores de crescimento | Necessidade de mais estudos sobre scaffolds de seda e períodos mais longos de enxerto |
| Zhu et al. (2019)16 | rASCs foram semeadas em scaffold (ADM suína) em modelo in vitro. Em seguida, os enxertos foram inseridos na fáscia subcutânea de ratos | Compatibilidade e manutenção do tecido bem favoráveis | Necessidade de mais estudos sobre scaffold de ADM |
| Buschmann et al. (2019)17 | rASCs foram semeadas em scaffold de PLGA e injetados na parede torácica de camundongos | Compatibilidade, integração e adesão celular bem favoráveis. Neovascularização presente. | Alguma reação inflamatória observada |
| Tytgat et al. (2019a)18 | hASCs foram semeadas em scaffold (Gel-SH/Gel-NB) em modelo in vitro | Candidato alternativo ao uso de Gel-MA | Resistência mecânica do scaffold ainda a ser avaliada em estudos futuros |
| Tytgat et al. (2019b)19 | hASCs foram semeadas em scaffold 3D impresso (Gel-- MA/Car-MA) em modelo in vitro | Compatibilidade, integração e adesão celular bem favoráveis. Mecânica similar ao tecido mamário nativo. | Menor potencial de diferenciação do que quando comparado ao Gel-MA |
| Colle et al. (2020)20 | hASCs foram encapsuladas e semeadas em scaffold 3D impresso (Gel-MA) em modelo in vitro | Facilidade de replicação do scaffold por impressão em molde 3D | Necessidade de mais estudos sobre esferóides (microcápsulas) |
| Benmeridja et al. (2020)21 | Microesferas hASCs þ HUVECs foram semeadas e moldadas em 3D em modelo in vitro | Facilidade de replicação do scaffold por impressão em molde 3D. Neovascularização presente. | Necessidade de mais estudos sobre esferóides (microcápsulas) |
| Pu et al. (2021)22 | hASCs foram injetadas junto ao DAT-gel no subcutâneo de camundongos | Facilidade na injeção da solução de hidrogel para o enxerto e para a viabilidade celular | Baixo tempo de experimentação in vivo demanda novos estudos com enxerto a longo prazo |
Abreviaturas: 3D, tridimensional; ADM, matriz dérmica acellular; BioPiel, biofilme de quitosana; Car-MA, K-carragenina metacrilada; Cytocare, ácido hialurônico; DAT, tecido adiposo descelularizado; Gel-MA, gelatina metacrilamida; Gel-NB, gelatina norborneno; Gel-SH, gelatina tiolada; hASCs, células-tronco derivadas do tecido adiposo humano; HUVECs, células endoteliais da veia umbilical humana; Integra DRT, colágeno bovino; matriderm, colágeno e elastina; MCS, metacrilato sulfato de condroitina; MGC, metacrilato glicol quitosano; PGLA, ácido poli-lático-co-glicólico; PMMA, poli(metacrilato de metila); rASCs, células-tronco derivadas do tecido adiposo murino; Smart Matrix, matriz de fibrin; Strattice, derme suína descelularizada.
| Autor e ano | Técnica | Vantagens | Limitações |
|---|---|---|---|
| Wang et al. (2010)23 | SMCs foram obtidas a partir de hASCs e semeadas em malhas de PGA. Em seguida, a malha foi colocada em biorreator pulsátil em modelo in vitro | Vaso tridimensional de pequeno diâmetro formado com êxito. Biomecânica do tecido aprimorada por condições pulsáteis do biorreator | Ausência de testagem in vivo |
| Zhang et al. (2011)24 | VR-EPCs provenientes do tecido cardíaco foram semeadas em veículo Integra Matrix em modelo in vitro. Em seguida, os biotecidos foram inseridos em feridas de pele de espessura total em camundongos | Utilização de fonte alternativa de tipos de célulastronco | Necessidade de mais estudos que envolvam a utilização de VR-EPCs e facilitação de sua obtenção |
| Mestak et al. (2013)25 | rASCs foram semeadas em scaffold de ADM suína em modelo in vitro. Em seguida, realizou-se excisão de parte da parede abdominal de camundongos onde o enxerto foi suturado | Analisa utilização de telas cultivadas para reparo da parede abdominal, o que traz ressalvas no benefício do seu uso em cenário clínico | Complexidade do processo de extração, cultivo e manutenção do enxerto ainda tornam a técnica distante de aplicação em cenário clínico |
| Han et al. (2014)26 | hUCMSCs foram semeadas e diferenciadas, in vitro, em fibroblastos. Em seguida, as células foram cultivadas em | Eficiência no tratamento superficial de feridas isquêmicas e de úlceras crônicas | Necessidade de continuação dos estudos para garantia de uma aplicação clínica final favorável |
| scaffold (ADM þ colágenoquitosana) e inseridos em feridas de pele de espessura total no dorso de suínos | |||
| Zhang et al. (2015)27 | Microesferas de PLGA/PEG contendo VEGF foram impregnados em scaffolds de colágeno-quitosana semeados com hASCs em modelo in vitro. Em seguida, o biotecido foi inserido em torno do pedículo vascular de camundongos. | Neovascularização significativa, promovendo manutenção do enxerto e disponibilidade de nutrientes. | Necessidade de mais estudos pré-clínicos que analisem a manutenção do enxerto/retalho em períodos mais longos de tempo |
| Freiman et al. (2016)28 | Scaffolds PLLA/PLGA foram agregados à quatro diferentes combinações de células-tronco (hASCs, HAMECs, HUVECs e HNDFs) | Neovascularização observada melhora na integração do enxerto no hospedeiro, bem como sua manutenção | Necessidade de análise do enxerto em período superior a 14 dias, obtendo mais informações sobre sua manutenção e nutrição a longo prazo |
| Du et al. (2017)29 | BMSCs de coelhos foram semeadas em folhas e em seguida descelularizadas para formação do enxerto (BMSC-MEC). Os enxertos foram inseridos em camundongos com feridas de pele de espessura total. | Maturação dos tecidos de granulação, reepitelização rápida e angiogênese foram observados no local do enxerto | Necessidade de mais estudos que envolvam o condicionamento químico da MEC como estratégia para sua melhor adesão e manutenção in vivo |
| Steiner et al. (2018)30 | Microcápsulas de ADA-GEL (com ou sem BMSCs) foram agregadas em câmara de teflon e inseridas na virilha de ratos juntamente com uma alça arteriovenosa criada | O uso de microcápsulas junto à alça vascular promoveu vasculariizção favorável | Necessitade mais estudos envolvendo o uso de microcápsulas como veículo, bem como a utilização de alças em “loop” para angiogênese |
| Duisit et al. (2018)31 | ADM foi obtida a partir de orelha humana þ pedículo. rASCs foram semeadas no scaffold para modelo experimental in vitro. Em seguida, foram inseridas em feridas no dorso de camundongos |
Considera o uso de peças post-mortem humanas (estruturas complexas com vascularização) para obtenção de MEC | Scaffold de dificil obtenção. Necessita-se mais estudos para avanços no enxerto vascular proposto |
| Griffin et al. (2019)32 | rASCs foram semeadas (com e sem PRP) em scaffolds de poliuretano e inseridas no subcutâneo do dorso de camundongos | Adesão e vascularização foram observadas | No estudo, faltam evidências que garantam a casualidade do uso de plasma de argônio como responsável direto pela melhor adesão tecidual |
| Dash et al. (2020)33 | hiPSCs derivadas de células musculares lisas vasculares humanas foram semeadas junto ao scaffold Matrigel em modelo in vitro descrito | Descrição detalhada promove facilidade de replicação dos métodos utilizados | Impede avaliação mais aprofundada devido ao teor expositivo em protocolo |
Abreviaturas: ADA-Gel, alginato dialdeído e gelatina; ADM, matriz dérmica acelular; BMSCs, células estromais da medula óssea; HAMECs, células endoteliais microvasculares derivadas de tecido adiposo humano; hASCs, células-tronco derivadas do tecido adiposo humano; hiPSCs, células-tronco pluripotentes induzidas humanas; HNDFs, fibroblastos dérmicos neonatais humanos; hUCMSCs, células estromais mesenquimais de cordão umbilical humano; HUVECs, células endoteliais da veia umbilical humana; Integra matrix, colágeno bovino reticulado þ glicosaminoglicanos; Matrigel, proteínas þ colágeno IV; MEC, matriz extracelular descelularizada; PEG, polietileno glycol; PGA, ácido poliglicólico; PGLA, ácido poli-láticoco-glicólico; PLLA, ácido L-poli-láctico; PRP, plasma rico em plaquetas; rASCs, células-tronco derivadas do tecido adiposo murino; SMCs, células musculares lisas vasculares; VEGF, fator de crescimento endotelial; VR-EPCs, células progenitoras endoteliais residentes vasculares.
No geral, as preocupações mais frequentemente encontradas nos estudos revisados se basearam na análise da integração, compatibilidade e adesão das células-tronco ou do biomaterial/enxerto no local alvo (scaffold ou animal). Foram relatadas também análises relacionadas à manutenção dos tecidos, reações inflamatórias e reações adversas em modelos de testagem in vivo. Já em modelos de testagem in vitro, também foram observadas análises relacionadas ao modo de produção do scaffold e da cultura de células-tronco. Apenas um dos artigos revisados não fez uso de células-tronco.
Na divisão de temas e objetivos dos estudos, observou-se que 18 estudos expuseram uma aplicação focada em adipogênese, 10 estudos focaram em angiogênese e nove focaram em condrogênese.
Nos artigos de adipogênese, observou-se uso de célulastronco derivadas de tecido adiposo (ASCs) em todos os estudos selecionados - anlternando entre células de origem xenogênica ou humana. Nesse bloco também se destacaram aplicações voltadas para remodelamento de grandes feridas excisionais e para o tratamento de feridas de partes moles.
Nos artigos de angiogênese observou-se o uso majoritário de ASCs, seguido por MSCs. Nesse bloco também se destacaram aplicações voltadas para a manutenção de enxertos e tecidos por neovascularização e sinalização parácrina para promoção da angiogênese.
Nos artigos de condrogênese observou-se o uso majoritário de células-tronco mesenquimais (MSCs), geralmente retiradas da medula óssea (BMSCs) xenogênica ou humana. Um dos artigos não fez uso de células-tronco. Nesse bloco também se destacaram aplicações voltadas para remodelação/cicatrização de feridas dérmicas e sinalização parácrina para diferenciação condrogênica.
Discussão
A bioengenharia tecidual tem potencial de se tornar uma das bases da medicina regenerativa do século XXI. As técnicas descritas se aproximam da aplicabilidade prática conforme o estudo da interação do enxerto com o meio in vivo avança.24 Desse modo, o presente estudo discute nos seguintes subtemas as aplicações, vantagens e desvantagens dos artigos revisados bem como sua relação com a literatura científica.
Scaffold/Arcabouço/Veículo
Observou-se utilização de hidrogéis em 23 artigos, como uma tentativa de promover maior capacidade de integração do biomaterial acelular ao hospedeiro. Consoante ao estudo de Gierek et al., 2022, esses estudos relataram uma facilidade de implantação e manejo do biotecido proposto, assim como propriedades mecânicas capazes de simular o tecido adiposo nativo.36,42 No que cabe à aplicabilidade dos métodos, o uso de hidrogéis mostrou ser um potencial meio de garantir propriedades mecânicas sem comprometer a biodegradação natural do enxerto in vivo, visto que garante a difusão e suporte dos componentes biológicos.25,31,38
De acordo com Gierek et al., 2022, o uso de ADMs tem considerável potencial reconstrutivo em cirurgia humanas, graças à biocompatibilidade e à estrutura.42 Em concordância, o vasto uso de ADMs nos estudos revisados mostra um avanço nos estudos que remetem ao potencial desses scaffolds, com destaque para técnicas de obtenção xenógenas ou por lipoaspiração humana. A utilização de DAT se mostrou promissora graças à facilidade de obtenção e baixa morbidade da área doadora em lipoaspirados, vide uso para obtenção do arcabouço e de ASCs por meio de resíduos cirúrgicos antes descartados.5,9,13
As tecnologias de impressão e planejamento 3D já são amplamente utilizadas na cirurgia reconstrutiva para preparar intervenções e produzir implantes personalizados conforme reconhecido pelo Royal College of Surgeons na Comissão sobre o Futuro da Cirurgia.43 Isso se mostra presente nesta revisão em cinco artigos21,36-38,40 que utilizaram essa técnica para a obtenção de scaffolds estruturais “vazados” para injeção de conteúdos celulares e biológicos que pudessem compor o enxerto final. Esse tipo de método se mostrou eficiente na garantia da viabilidade do enxerto quando comparado à técnica de não impressão, com biomecânica e capacidade tecidual mimética favoráveis.37
Com base em Salehi-Nik et al., 2013, os biorreatores de perfusão podem fornecer estímulos físicos e ambientais quase in vivo para os tecidos de cultura.44 Nesse sentido, compara-se favoravelmente à experimentação pulsátil obtida na formação de vasos de pequeno calibre com biomecânica e elasticidade similares à veia safena humana. Essa abordagem pode ser usada não só no aprimoramento das técnicas reconstrutivas na cirurgia plástica, mas também na engenharia de outros tipos de condutos musculares elásticos de pequenos diâmetros, como oureter, o ducto cístico e o ducto ovariano.6
Células-tronco
O manejo de ASCs e seu uso em estudos clínicos já vem sendo praticado há muitos anos com resultados favoráveis.45-47 Consoante a isso, 23 estudos consideraram o seu uso devido à facilidade de obtenção desse tipo de célula e seu histórico na literatura. Nesse sentido, a aquisição xenogênica objetivou uma baixa morbidade da área doadora.24,35,37 Houve também a utilização de lipoaspirados como uma forma de aproveitamento de resíduos hospitalares que antes eram descartados.11 Isso reflete a facilidade de manejo e aplicabilidade das técnicas, visto que esses métodos utilizam um tecido que possui considerável proporção de células-tronco, com uma frequência variando de 0,01 a 5% do lipoaspirado, a depender do método de extração.48 A respeito desse ponto, relatou-se uma congruência com Wu et al., 2012, que destacou uma maior taxa de adesão e concentração das ASCs obtidas com métodos de micro-colheita (cânula romba de 2 mm de diâmetro) em comparação às técnicas convencionais.6
Segundo Solchaga et al., 2011, o manejo de BMSCs ainda é complexo para aplicação em técnicas de reconstrução, necessitando de maiores avanços.49 Consoante a isso, esta revisão destaca as dificuldades encontradas nos nove estudos que utilizaram esse tipo celular para controlar a resposta inflamatória e formar, com êxito, tecidos cartilaginosos sem uma taxa de fibrose considerável.7,10,17,26,27,30,31 Porém, resultados satisfatórios e alternativos foram obtidos a partir do cotransplante com células da microtia humana e do uso de citocinas para diferenciação parácrina, o que reflete os avanços na pesquisa acadêmica sobre o seu uso.7,17,27
Vale destacar também na comparação entre os tipos celulares descritos no artigo, que ASCs têm vantagens potenciais sobre BMSCs. Isso fica evidente não só em sua simplificada forma de obtenção e manejo, mas também em sua capacidade de se proliferar rapidamente e secretar altos níveis de citocinas pró-angiogênicas.50-52
Manutenção do Enxerto
Considerando o estudo de Colazo et al., 2019, sabe-se que a vascularização é considerada um grande desafio na engenharia e regeneração de tecidos, principalmente dentro do scaffold utilizado.53 Nesse contexto, para garantir a manutenção do tecido in vivo por longas durações, uma série de critérios tiveram que ser garantidos, como: a formação de redes capilares, nutrição, hidratação e biocompatibilidade do enxerto inserido.17 Nesse sentido, a presença de fatores imunorreguladores (como TGF-β, Cox-2, CD45 e CD68) e pró-angiogênicos (como VEGF, HGF, bFGF e CD31) propõese como forma de uma regeneração dinâmica adequada do tecido, com base inclusive na velocidade e eficiência da cicatrização avaliada.18,23,33-35
Adipogênese
As evidências das propriedades regenerativas do transplante autólogo de gordura incentivaram pesquisas sobre o uso clínico de ASCs.54 Nos artigos referidos com esse enfoque regenerativo, houve amplo uso de ASCs como escolha padrão para coleta e cultivo de células-tronco (►Tabela 2). Isso reflete não só a facilidade de manejo e coleta desse tipo celular, como também o crescente uso de lipoenxertia e lipoaspiração nos procedimentos estéticos e reconstrutivos na cirurgia plástica atual -- desde o período purificado (ou atraumático) que se seguiu ao trabalho de Coleman (1994 até hoje).55
| Autor e Ano | Técnica | Vantagens | Limitações |
|---|---|---|---|
| Liu et al. (2010)34 | BMSCs e condrócitos suínos foram cultivados em scaffold (PLGA). Em seguida, o biotecido foi inserido no subcutâneo de camundongos | Indução parácrina observada favoreceu condrogênese | Necessidade de mais estudos sobre condroindução parácrina e cultura mista |
| Xue et al. (2012)35 | BMSCs suínas foram cultivadas em ACSs, cultivos em scaffold (PLGA) foram considerados controle. Em seguida, os biotecidos foram inseridos no subcutâneo de camundongos | ACSs têm atividade antiangiogênica que promove estabilização da cartilagem recente | Necessidade comparativa com outros biomateriais sintéticos |
| Patel et al. (2013)36 | BMSCs humanas foram cultivadas em scaffold de POSSPCU em formato de aurícula humana em modelo experimental in vitro | A condrogênese foi verificada in vitro com a diferenciação celular induzida por fatores de crescimento adicionados | Necessitam mais estudos que envolvam scaffold POSS-PCU e testagem in vivo |
| Mendelson et al. (2014)37 | Microesferas de hidrogel carregadas com fatores de cresimento humano foram inseridas em scaffold (PLGA). O enxerto de hidrogel foi inserido sobre a cartilagem nasal nativa de camundongos | Enxerto formado sem a necessidade do uso de células-tronco | Necessidade de novos estudos sobre condroindução de tecidos nativos sobre enxertos não cultivados com células-tronco |
| Zhang et al. (2014)38 | Condrócitos humanos e BMSCs caprinas foram cultivadas em scaffold (PGLA) em modelo in vitro | Os condrócitos humanos retiveram forte capacidade inicial de formação de cartilagem, podendo promover a condrogênese ectópica de BMSCs in vitro | Ausência de testagem in vivo |
| Herrero-Mendez et al. (2015)39 | Uso de scaffold descelularizado com sGAG para reparo tecidual. Os scaffolds analisados foram uma mistura 50:50 e outra de 90:10 de HR007 enriquecido com HA. | Os scaffolds demonstraram propriedades biológicas importantes in vitro para uso clínico a fim de promover o reparo de defeitos condrais ou dérmicos | Ausência de testagem in vivo |
| Ding et al. (2016)40 | BMSCs e cartilagem auricular suínos foram obtidas e cultivados com scaffold (PGLA) em grupos isolados e em conjunto. Os biotecidos foram inseridos no subcutâneo suíno. | Demonstrou-se que a cartilagem engenheirada baseada em BMSC pode suprimir a inflamação in vivo quando cultivada sem condrócitos | Necessidade de novos estudos sobre a aplicação de enxertos cultivados de BMSCs por longas durações |
| Rajabian et al. (2017)41 | BMSCs de coelhos foram semeadas em scaffold de quitosana. Em seguida, os biotecidos inseridos em feridas superficiais no dorso desses animais | Promoção da reepitelização por fatores parácrinos | Curativos de quitosana com ou sem BMSCs, quando sem estímulos de proliferação, pioraram a cicatrização de feridas |
Abreviaturas: ACSs, folhas de cartilagem acelular; BMSCs, células estromais da medula óssea; PGLA, ácido poli-lático-co-glicólico; POSS-PCU, poli (carbonato uretano) (poliédrico oligomérico silsesquioxano modificado poli (hexanolactona/ carbonato) uretano/ureia; sGAG, glicosaminoglicanos sulfatados.
Segundo Rupnick et al., 2002, o tecido adiposo é altamente vascularizado, pois cada adipócito é circundado por uma extensa rede capilar.56 Assim, a angiogênese está intimamente relacionada com a manutenção e remodelação do tecido adiposo. Em concordância, destacam-se nos resultados obtidos esse mesmo potencial descrito na literatura: um baixo grau de fibrose dos enxertos e a capacidade próangiogênica19,28,35,40-que pode ser melhor efetivada com a co-cultura de tipos celulares provenientes de tecidos vasculares (por exemplo, HAMECs e HUVECs).26,35
Angiogênese
De acordo com Chen et al., 2017, enxertos tradicionais que não consideram a manutenção homeostática e integração do tecido final limitam a eficácia dos tratamentos.57 Dessa forma, os enxertos vasculares de engenharia de tecidos servem como a próxima melhor alternativa à aplicabilidade dos métodos.58 Consoante a isso, os artigos revisados desse bloco destacaram o grau de incorporação dos enxertos e a medição de fatores de crescimento e secreção parácrina dos tipos celulares envolvidos.26,40 Nesse contexto, foram obtidos resultados favoráveis no tratamento de feridas e úlceras isquêmicas.15
Com relação direta aos princípios da cirurgia plástica reconstrutiva e à necessidade de técnicas microvasculares para manutenção de enxertos,41 destacou-se o uso de biotecidos e técnicas que garantissem a perfusão tecidual: a formação de vasos tridimensionais de pequeno calibre6 e o uso de alças arteriovenosas para irrigação do enxerto.31
Condrogênese
Nos artigos com esse enfoque regenerativo, houve amplo uso de BMSCs como escolha de células-tronco. Neste caso, essa preferência não reflete uma facilidade de manejo e coleta, visto que a necessidade de isolamento celular da medula óssea pode ser um procedimento complexo e invasivo, embora amplamente documentado.59 Destaca-se também o seu difícil manejo devido à falta de conhecimento avançado sobre os seus mecanismos de diferenciação.60 Assim, a escolha se dá pelo conhecido potencial de diferenciação dessas células na formação de neocartilagem quando em ambiente tridimensional.61-63 Consoante a isso, avalia-se a crescente formação de tecido fibrótico irregular em torno do implante em Ding et al., 2016, o que dificultou a manutenção in vivo por longas durações, o que distancia a aplicação clínica desses métodos.27
Como forma de contornar esse descontrole da diferenciação, o uso de fatores de crescimento, como TGF-ßs, IGF-1 e BMPs, para iniciar a condrogênese elucidou resultados promissores de forma coordenada.7 Outra forma de contornar a inflamação foi o uso de folhas de cartilagem acelular (ACSs), que apresentou resultados favoráveis à manutenção do tecido cartilaginoso dada sua atividade anti-angiogênica, que estabiliza a cartilagem manipulada in vivo, fator benéfico para o manejo do enxerto final.10 Foi descrita a reconstrução satisfatória da cartilagem do dorso nasal de camundongos sem a utilização de células-tronco em Mendelson et al., 2014, que, por meio de um sistema dose-dependente de TGF-β3, evitou as reações adversas aqui comentadas.16
Limitações
Embora os resultados tenham demonstrado ser bastante promissores, pode-se ressaltar diversas limitações que foram encontradas universalmente nos estudos, as quais ainda afastam a realidade de aplicabilidade clínica, uma vez que ela deve ser reprodutível, controlável e viável. Além de um limitado acervo de pesquisas semelhantes, uma das limitações encontradas nesta revisão sistematizada foi a escassez de estudos clínicos randomizados e controlados, que são considerados o padrão-ouro para avaliação da eficácia e da segurança de qualquer intervenção médica. A maioria dos estudos encontrados consistiu em estudos em animais e pesquisas in vitro.
Conclusão
As técnicas e procedimentos descritos nesta revisão têm um elevado potencial de aplicação prática futura na cirurgia plástica reconstrutiva, à medida que mais estudos avançam nessa área. Destacam-se os avanços no uso de células-tronco e fatores de crescimento como recursos fundamentais para promover a regeneração tecidual e a biocompatibilidade dos enxertos. Dessa forma, esta revisão cumpre seu papel de esclarecer as evidências atuais sobre o tema, tornando acessíveis aos cirurgiões plásticos as principais técnicas e inovações no uso de biomateriais na cirurgia plástica reconstrutiva e seus princípios fundamentais.
Referências
1. Kouniavski E, Egozi D, Wolf Y. Techniques and Innovations in Flap Engineering: A Review. Plast Reconstr Surg Glob Open 2022;10 (09):e4523
2. Parida P, Behera A, Chandra Mishra S. Classification of Biomaterials used in Medicine. Int J Adv Appl Sci. 2012;1(03):
3. Gómez S, Vlad MD, López J, Fernández E. Design and properties of 3D scaffolds for bone tissue engineering. Acta Biomater 2016;42 (June):341-350. Doi: 10.1016/j.actbio.2016.06.032[Internet]
4. Sterodimas A, De Faria J, Correa WE, Pitanguy I. Tissue engineering in plastic surgery: an up-to-date review of the current literature. Ann Plast Surg 2009;62(01):97-103
5. Flynn LE. The use of decellularized adipose tissue to provide an inductive microenvironment for the adipogenic differentiation of human adipose-derived stem cells. Biomaterials 2010;31(17): 4715-4724. Doi: 10.1016/j.biomaterials.2010.02.046[Internet]
6. Wang C, Cen L, Yin S, et al. A small diameter elastic blood vessel wall prepared under pulsatile conditions from polyglycolic acid mesh and smooth muscle cells differentiated from adiposederived stem cells. Biomaterials 2010;31(04):621-630. Doi: 10.1016/j.biomaterials.2009.09.086[Internet]
7. Liu X, Sun H, Yan D, et al. In vivo ectopic chondrogenesis of BMSCs directed by mature chondrocytes. Biomaterials 2010;31(36): 9406-9414. Doi: 10.1016/j.biomaterials.2010.08.052[Internet]
8. Zhang Z, Ito WD, Hopfner U, et al. The role of single cell derived vascular resident endothelial progenitor cells in the enhancement of vascularization in scaffold-based skin regeneration. Biomaterials 2011;32(17):4109-4117. Doi: 10.1016/j.biomaterials.2011.02.036 [Internet]
9. Wu I, Nahas Z, Kimmerling KA, Rosson GD, Elisseeff JH. An injectable adipose matrix for soft-tissue reconstruction. Plast Reconstr Surg 2012;129(06):1247-1257
10. Xue JX, Gong YY, Zhou GD, Liu W, Cao Y, Zhang WJ. Chondrogenic differentiation of bone marrow-derived mesenchymal stem cells induced by acellular cartilage sheets. Biomaterials 2012;33(24): 5832-5840. Doi: 10.1016/j.biomaterials.2012.04.054[Internet]
11. Alharbi Z, Opländer C, Almakadi S, Fritz A, Vogt M, Pallua N. Conventional vs. micro-fat harvesting: how fat harvesting technique affects tissue-engineering approaches using adipose tissuederived stem/stromal cells. J Plast Reconstr Aesthet Surg 2013;66 (09):1271-1278
12. Patel KH, Nayyer L, Seifalian AM. Chondrogenic potential of bone marrow-derived mesenchymal stem cells on a novel, auricularshaped, nanocomposite scaffold. J Tissue Eng 2013;4(01): 2041731413516782
13. Cheung HK, Han TTY, Marecak DM, Watkins JF, Amsden BG, Flynn LE. Composite hydrogel scaffolds incorporating decellularized adipose tissue for soft tissue engineering with adipose-derived stem cells. Biomaterials 2014;35(06):1914-1923. Doi: 10.1016/j.biomaterials.2013.11.067[Internet]
14. Mestak O, Matouskova E, Spurkova Z, et al. Mesenchymal stem cells seeded on cross-linked and noncross-linked acellular porcine dermal scaffolds for long-term full-thickness hernia repair in a small animal model. Artif Organs 2014;38(07):572-579
15. Han Y, Tao R, Han Y, et al. Microencapsulated VEGF gene-modified umbilical cord mesenchymal stromal cells promote the vascularization of tissue-engineered dermis: an experimental study. Cytotherapy 2014;16(02):160-169. Doi: 10.1016/j.jcyt.2013.10.014 [Internet]
16. Mendelson A, Ahn JM, Paluch K, Embree MC, Mao JJ. Engineered nasal cartilage by cell homing: a model for augmentative and reconstructive rhinoplasty. Plast Reconstr Surg 2014;133(06): 1344-1353
17. Zhang L, He A, Yin Z, et al. Regeneration of human-ear-shaped cartilage by co-culturing human microtia chondrocytes with BMSCs. Biomaterials 2014;35(18):4878-4887. Doi: 10.1016/j.biomaterials.2014.02.043[Internet]
18. Garg RK, Rennert RC, Duscher D, et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med 2014;3(09):1079-1089
19. Gugerell A, Neumann A, Kober J, et al. Adipose-derived stem cells cultivated on electrospun l-lactide/glycolide copolymer fleece and gelatin hydrogels under flow conditions - aiming physiological reality in hypodermis tissue engineering. Burns 2015;41 (01):163-171. Doi: 10.1016/j.burns.2014.06.010[Internet]
20. Herrero-Mendez A, Palomares T, Castro B, et al. HR007: a family of biomaterials based on glycosaminoglycans for tissue repair. J Tissue Eng Regen Med 2017;11(04):989-1001. Doi: 10.1016/j.trsl.2010.06.007[Internet]
21. Pati F, Ha DH, Jang J, Han HH, Rhie JW, Cho DW. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials 2015; 62:164-175. Doi: 10.1016/j.biomaterials.2015.05.043[Internet]
22. Zeng Y, Zhu L, Han Q, et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater 2015;25:291-303. Doi: 10.1016/j.actbio.2015.07.042 [Internet]
23. Wahl EA, Fierro FA, Peavy TR, et al. In Vitro Evaluation of Scaffolds for the Delivery of Mesenchymal Stem Cells to Wounds. BioMed Res Int 2015;2015:108571
24. Lequeux C, Rodriguez J, Boucher F, et al. In vitro and in vivo biocompatibility, bioavailability and tolerance of an injectable vehicle for adipose-derived stem/stromal cells for plastic surgery indications. J Plast Reconstr Aesthet Surg 2015;68(11): 1491-1497
25. Zhang Q, Hubenak J, Iyyanki T, et al. Engineering vascularized soft tissue flaps in an animal model using human adipose-derived stem cells and VEGFþPLGA/PEG microspheres on a collagenchitosan scaffold with a flow-through vascular pedicle. Biomaterials 2015;73:198-213. Doi: 10.1016/j.biomaterials.2015.09.024 [Internet]
26. Freiman A, Shandalov Y, Rozenfeld D, et al. Adipose-derived endothelial and mesenchymal stem cells enhance vascular network formation on three-dimensional constructs in vitro. Stem Cell Res Ther 2016;7(01):5. Doi: 10.1186/s13287-015-0251-6 [Internet]
27. Ding J, Chen B, Lv T, et al. Bone Marrow Mesenchymal Stem Cell- Based Engineered Cartilage Ameliorates Polyglycolic Acid/Polylactic Acid Scaffold-Induced Inflammation Through M2 Polarization of Macrophages in a Pig Model. Stem Cells Transl Med 2016;5 (08):1079-1089
28. Hanken H, Göhler F, Smeets R, et al. Attachment, viability and adipodifferentiation of pre-adipose cells on silk scaffolds with and without co-expressed FGF-2 and VEGF. In Vivo (Brooklyn). 2016;30(05):567-72
29. Rajabian MH, Ghorabi GH, Geramizadeh B, Sameni S, Ayatollahi M. Evaluation of bone marrow derived mesenchymal stem cells for full-thickness wound healing in comparison to tissue engineered chitosan scaffold in rabbit. Tissue Cell 2017;49(01):112-121. Doi: 10.1016/j.tice.2016.11.002[Internet]
30. Du HC, Jiang L, Geng WX, et al. Evaluation of xenogeneic extracellular matrix fabricated from CuCl2-conditioned mesenchymal stem cell sheets as a bioactive wound dressing material. J Biomater Appl 2017;32(04):472-483
31. Steiner D, Lingens L, Fischer L, et al. Encapsulation of Mesenchymal Stem Cells Improves Vascularization of Alginate-Based Scaffolds. Tissue Eng Part A 2018;24(17-18):1320-1331
32. Duisit J, Amiel H, Wüthrich T, et al. Perfusion-decellularization of human ear grafts enables ECM-based scaffolds for auricular vascularized composite tissue engineering. Acta Biomater 2018; 73:339-354. Doi: 10.1016/j.actbio.2018.04.009[Internet]
33. Griffin MF, Naderi N, Kalaskar DM, Seifalian AM, Butler PE. Argon plasma surface modification promotes the therapeutic angiogenesis and tissue formation of tissue-engineered scaffolds in vivo by adipose-derived stem cells. Stem Cell Res Ther 2019;10(01):110
34. Zhu Z, Yuan ZQ, Huang C, et al. Pre-culture of adipose-derived stem cells and heterologous acellular dermal matrix: paracrine functions promote post-implantation neovascularization and attenuate inflammatory response. Biomed Mater 2019;14(03):035002
35. Buschmann J, Yamada Y, Schulz-Schönhagen K, et al. Hybrid nanocomposite as a chest wall graft with improved integration by adipose-derived stem cells. Sci Rep 2019;9(01):10910
36. Tytgat L, Van Damme L, Van Hoorick J, et al. Additive manufacturing of photo-crosslinked gelatin scaffolds for adipose tissue engineering. Acta Biomater 2019;94:340-350. Doi: 10.1016/j.actbio.2019.05.062[Internet]
37. Tytgat L, Van Damme L, Ortega Arevalo MDP, et al. Extrusion-based 3D printing of photo-crosslinkable gelatin and κ-carrageenan hydrogel blends for adipose tissue regeneration. Int J Biol Macromol 2019;140:929-938. Doi: 10.1016/j.ijbiomac.2019.08.124[Internet]
38. Colle J, Blondeel P, De Bruyne A, et al. Bioprinting predifferentiated adipose-derived mesenchymal stem cell spheroids with methacrylated gelatin ink for adipose tissue engineering. J Mater Sci Mater Med 2020;31(04):36. Doi: 10.1007/s10856-020-06374-w [Internet]
39. Dash BC, Setia O, Gorecka J, et al. A Dense Fibrillar Collagen Scaffold Differentially Modulates Secretory Function of iPSC- Derived Vascular Smooth Muscle Cells to Promote Wound Healing. Cells 2020;9(04):8-10
40. Benmeridja L, De Moor L, De Maere E, et al. High-throughput fabrication of vascularized adipose microtissues for 3D bioprinting. J Tissue Eng Regen Med 2020;14(06):840-854
41. Pu W, Han Y, Yang M. Human decellularized adipose tissue hydrogels as a culture platform for human adipose-derived stem cell delivery. J Appl Biomater Funct Mater 2021;19(33): 2280800020988141
42. Gierek M, Łabuś W, Kitala D, et al. Human Acellular Dermal Matrix in Reconstructive Surgery-A Review. Biomedicines 2022;10(11): 2870. https://pubmed.ncbi.nlm.nih.gov/36359387/[Internet]
43. Kerr R, Powis S, Black N, et al. Future of Surgery [Internet]. Royal College of Surgeons of England. 2021. Available from: https://futureofsurgery.rcseng.ac.uk/
44. Salehi-Nik N, Amoabediny G, Pouran B, et al. Engineering parameters in bioreactor’s design: a critical aspect in tissue engineering. BioMed Res Int 2013;2013(03):762132
45. Bourne DA, Thomas RD, Bliley J, et al. Amputation-site soft-tissue restoration using adipose stem cell therapy. Plast Reconstr Surg 2018;142(05):1349-1352
46. Yoshimura K, Sato K, Aoi N, Kurita M, Hirohi T, Harii K. Cellassisted lipotransfer for cosmetic breast augmentation: supportive use of adipose-derived stem/stromal cells. Aesthetic Plast Surg 2008;32(01):48-55, discussion 56-57
47. Zhu M, Zhou Z, Chen Y, et al. Supplementation of fat grafts with adipose-derived regenerative cells improves long-term graft retention. Ann Plast Surg 2010;64(02):222-228
48. Scherl A, Coute Y, Déon C, et al. Human Adipose Tissue Is a Source of Multipotent Stem Cells. Mol Biol Cell 2002;13(11):4100-4109
49. Solchaga LA, Penick KJ, Welter JF. Chondrogenic Differentiation of Bone Marrow-Derived Mesenchymal Stem Cells: Tips and Tricks. Mesenchymal Stem Cell Assays Appl 2011;698(05):469-470
50. De Ugarte DA, Morizono K, Elbarbary A, et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs 2003;174(03):101-109
51. Nakanishi C, Nagaya N, Ohnishi S, et al. Gene and protein expression analysis of mesenchymal stem cells derived from rat adipose tissue and bone marrow. Circ J 2011;75(09):2260-2268
52. Cowan CM, Shi YY, Aalami OO, et al. Adipose-derived adult stromal cells heal critical-size mouse calvarial defects. Nat Biotechnol 2004;22(05):560-567
53. Colazo JM, Evans BC, Farinas AF, Al-Kassis S, Duvall CL, Thayer WP. Applied Bioengineering in Tissue Reconstruction, Replacement, and Regeneration. Tissue Eng Part B Rev 2019;25(04):259-290
54. Simonacci F, Bertozzi N, Grieco MP, Raposio E. From liposuction to adipose-derived stem cells: indications and technique. Acta Biomed 2019;90(02):197-208
55. Mojallal A, Foyatier JL. [Historical review of the use of adipose tissue transfer in plastic and reconstructive surgery]. Ann Chir Plast Esthet 2004;49(05):419-425
56. Rupnick MA, Panigrahy D, Zhang CY, et al. Adipose tissue mass can be regulated through the vasculature. Proc Natl Acad Sci U S A 2002;99(16):10730-10735
57. Chen L, Xing Q, Zhai Q, et al. Pre-vascularization enhances therapeutic effects of human mesenchymal stem cell sheets in full thickness skin wound repair. Theranostics 2017;7(01):117-131
58. Phua QH, Han HA, Soh BS. Translational stem cell therapy: vascularized skin grafts in skin repair and regeneration. J Transl Med 2021;19(01):83
59. Hadlock TA, Vacanti JP, Cheney ML. Tissue engineering in facial plastic and reconstructive surgery. Facial Plast Surg 1998;14(03): 197-203
60. Sylvester KG, Longaker MT. Stem cells: review and update. Arch Surg 2004;139(01):93-99
61. Ma HL, Hung SC, Lin SY, Chen YL, Lo WH. Chondrogenesis of human mesenchymal stem cells encapsulated in alginate beads. J Biomed Mater Res A 2003;64(02):273-281
62. Li WJ, Tuli R, Okafor C, et al. A three-dimensional nanofibrous scaffold for cartilage tissue engineering using human mesenchymal stem cells. Biomaterials 2005;26(06):599-609
63. Ho STB, Cool SM, Hui JH, Hutmacher DW. The influence of fibrin based hydrogels on the chondrogenic differentiation of human bone marrow stromal cells. Biomaterials 2010;31(01):38-47. Doi: 10.1016/j.biomaterials.2009.09.021[Internet]
1. Departamento de Cirurgia Plástica, Universidade Federal de São Paulo, São Paulo,
SP, Brasil
2. Departamento de Medicina, Faculadade de Medicina de Sorocaba, Sorocaba, SP, Brasil
Endereço para correspondência Rafael Silva de Araújo, Departamento de Cirurgia Plástica, Universidade Federal de São Paulo, São Paulo, SP, 04021-001, Brasil (e-mail: rafael_lacipamed@hotmail.com).
Artigo submetido: 09/10/2023.
Artigo aceito: 29/09/2024.
Conflito de Interesses
Os autores não têm conflito de interesses a declarar.








 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter