
Case Report - Year 2024 - Volume 39 -
Linfoma anaplásico de grandes células T associado ao uso de implantes (BIA-ALCL): relato de caso
Implant-associated anaplastic large T-cell lymphoma (BIA-ALCL): case report
RESUMO
Reconhecido pela Organização Mundial de Saúde em 2016, o linfoma anaplásico de grandes células associado ao implante mamário (BIA-ALCL) é um subtipo incomum de linfoma não Hodgkin de células T, que se desenvolve após a inserção de próteses mamárias. A doença é uma afecção rara que afeta cerca de uma a cada 30.000 pessoas com implante mamário texturizado. As principais manifestações clínicas são o seroma tardio, assimetria mamária, massa e contratura capsular, com frequência mais elevada do primeiro. O explante da prótese com capsulectomia total pode ser suficiente para tratar o ALCL, com ressecções estendidas a locais adjacentes, quando necessário. Entretanto, em alguns casos, é realizada a radioterapia e/ou quimioterapia adjuvante. Conclui-se que, para um diagnóstico precoce e um tratamento efetivo, mulheres com seroma de aparecimento súbito e tardio deverão realizar exames complementares para a exclusão dessa afecção, mesmo com tempo inferior à média de desenvolvimento, que é de cerca de 10,6 anos.
Palavras-chave: Linfoma anaplásico de células grandes; Tomografia por emissão de pósitrons; Linfoma não Hodgkin; Seroma; Implante mamário
ABSTRACT
Recognized by the World Health Organization in 2016, breast implant-associated anaplastic large cell lymphoma (BIA-ALCL) is an uncommon subtype of T-cell non-Hodgkin lymphoma that develops after the insertion of breast implants. The disease is a rare condition that affects approximately one in every 30,000 people with textured breast implants. The main clinical manifestations are late seroma, breast asymmetry, mass, and capsular contracture, with a higher frequency of the former. Explantation of the prosthesis with total capsulectomy may be sufficient to treat ALCL, with resections extended to adjacent sites when necessary. However, in some cases, adjuvant radiotherapy and/or chemotherapy is performed. It is concluded that, for an early diagnosis and effective treatment, women with sudden and late-onset seroma should undergo additional tests to exclude this condition, even with a shorter development time than the average, which is around 10.6 years.
Keywords: Lymphoma, large-cell, anaplastic; Positron-emission tomography; Lymphoma, non-Hodgkin; Seroma; Breast implantation
INTRODUÇÃO
Em 1962, Thomas Cronin e Frank Gerow realizaram a primeira cirurgia para a inserção de prótese mamária de silicone. A partir daí, com o crescimento progressivo, mais de 1,5 milhões de mulheres se submetem a mamoplastia de aumento, anualmente, seja por motivos estéticos ou reconstrução1. No Brasil, esse procedimento teve um aumento gradual nos últimos 25 anos e, somente em 2011, cerca de 145 mil brasileiras foram submetidas a essa cirurgia2, 3. Com isso, o Brasil tornou-se o segundo maior mercado mundial de implantes mamários, atrás dos Estados Unidos2, 3, 4.
Em 1997, Keech e Creech descreveram o primeiro caso do linfoma anaplásico de grandes células associado ao implante de mama (BIA-ALCL)5, 6, 7, 8, 9. Porém, foi reconhecido pela Organização Mundial de Saúde (OMS) como uma entidade oncológica apenas em 20165, 7, 8, 9. A incidência e prevalência do BIA-ALCL é extremamente baixa, sendo que, em 2019, a U.S. Food and Drug Administration (FDA) relatou 573 casos nos Estados Unidos e no mundo, tendo 33 mortes decorrentes desse linfoma6, 10.
A patogênese do BIA-ALCL não está totalmente esclarecida, porém é descrita como um processo que envolve múltiplos fatores5, 6, 11. Uma das teorias encontradas foi de que as próteses texturizadas possuem concavidades, o que resulta em uma superfície ampla e com maior textura. Essa condição aumenta a probabilidade de ocasionar uma resposta inflamatória crônica, favorecendo o desenvolvimento do biofilme1, 5, 8, 11.
Em decorrência da formação do biofilme, observou-se um crescimento de bactérias gram negativas, Ralstonia spp, no microbioma da cápsula das próteses de pacientes diagnosticadas com BIA-ALCL5, 12. Além disso, a evolução para o linfoma ocorre como resultado da transformação maligna das células T envolvidas, associado ao período de progressão da doença, à ativação da resposta imune e à genética da paciente5.
O BIA-ALCL constitui um desafio médico que requer maior compreensão e atenção, pois o uso de implantes mamários cresce de forma exponencial em todo o mundo, inclusive no Brasil. E, por consequência, a probabilidade de novos casos tende a aumentar1. Nesse artigo, descrevemos um caso de uma paciente diagnosticada com BIA-ALCL cinco anos após a implementação da prótese mamária.
RELATO DE CASO
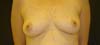
Paciente M.S.S., 54 anos, sexo feminino, leucoderma, comparece à consulta em clínica privada com queixa de flacidez abdominal pós-gestação e mamas de pequeno volume. Paciente sem histórico prévio de câncer na família. Realizou previamente esplenectomia pós-trauma, herniorrafia epigástrica, varizes e duas cesáreas. Possui artrose nos dedos e faz uso de sinvastatina e enalapril (Figura 1).
No dia 02/12/2015 foi submetida a abdominoplastia em âncora e a mamoplastia de aumento, sendo utilizadas próteses de silicone, perfil alto, texturizadas: 275cc à direita e 315cc à esquerda (Figura 2). Não houve intercorrências durante ou após a cirurgia. O seguimento pós-operatório foi realizado até 2019, quando recebeu alta ambulatorial.
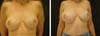
Em 22/10/2020, queixou-se de aumento progressivo de mama direita associado a dor local, com aproximadamente um mês de evolução. No exame físico, não havia sinais característicos de contratura capsular (Figura 3). Foi então realizada drenagem de 200ml, de líquido amarelo citrino, guiado por ultrassom, com melhora imediata dos sintomas;
O material foi encaminhado para citologia oncótica. No primeiro laboratório, a citologia foi negativa. Devido à alta suspeição de malignidade pelo autor sênior, a amostra foi encaminhada a um novo laboratório. Dessa vez, constatou-se citologia oncótica positiva e cultura negativa. Paciente foi imediatamente encaminhada ao oncologista.
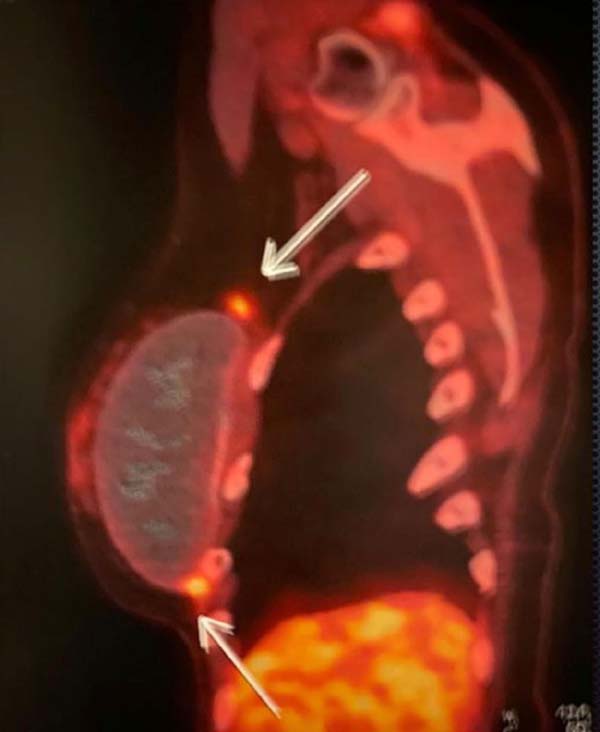
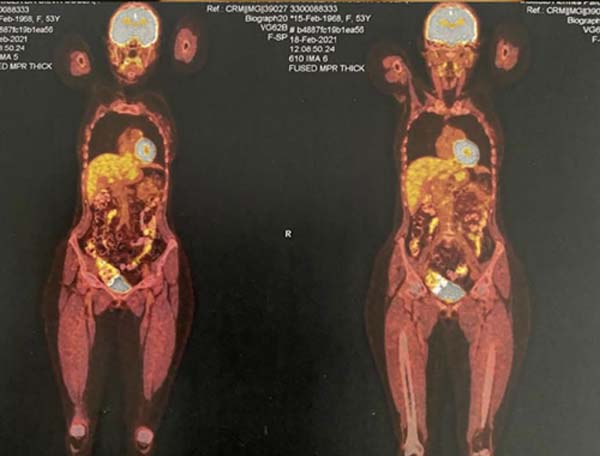
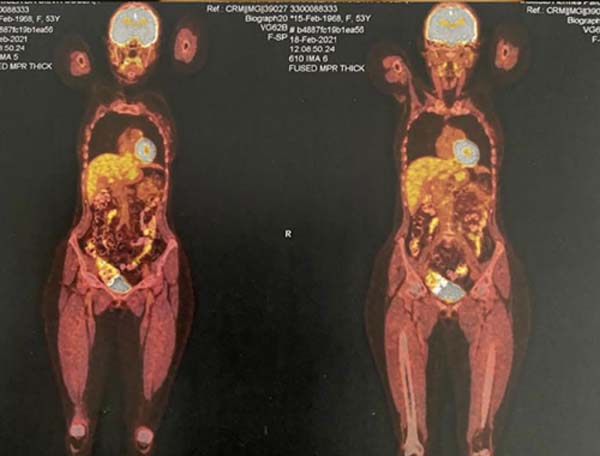
Foi realizado um PET-SCAN, que evidenciou áreas de hipercaptação em polo superior e inferior da mama direita, sem acometimento linfonodal ou de metástases a distância (Figura 4).
A paciente concordou em participar do estudo e assinou o Termo de Consentimento Livre e Esclarecido.
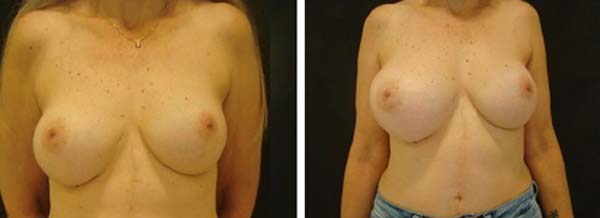
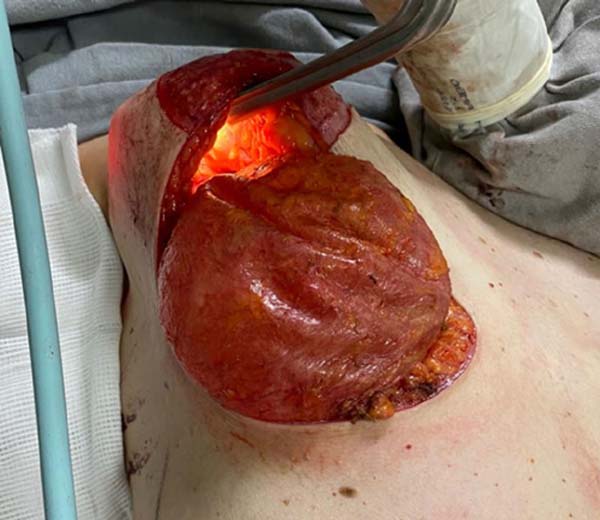
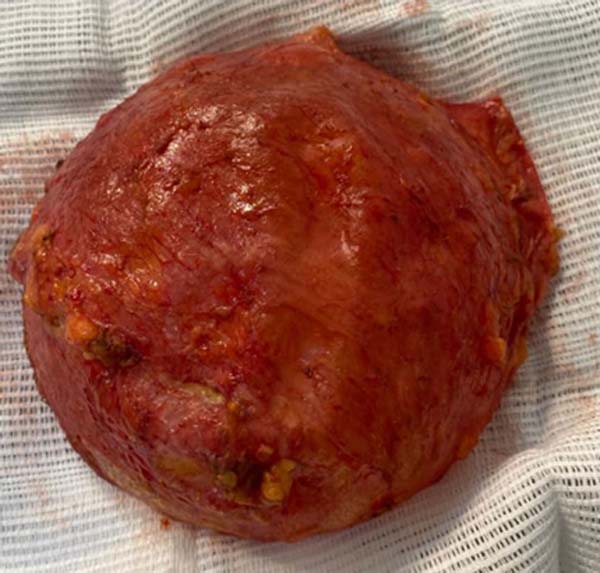
Em dezembro de 2020, foi realizada mastopexia com explante das próteses, bem como ressecção estendida de gordura e do músculo adjacente (Figura 5). Durante o procedimento cirúrgico, foi visualizada, na mama direita, uma pseudocápsula periprótese usual, sem sinais de malignidade (Figura 6).
O estudo anatomopatológico confirmou uma pseudocápsula infiltrada por células linfoides volumosas anaplásicas, sem invasão extracapsular. A imunohistoquímica evidenciou o marcador CD30, CD4, CD3 e TIA-1 positivos e os marcadores ALK-1 e CD20 negativos. Diante disso, foi confirmado se tratar de linfoma anaplásico de grandes células T associado a implante mamário à direita, restrito à pseudocápsula.
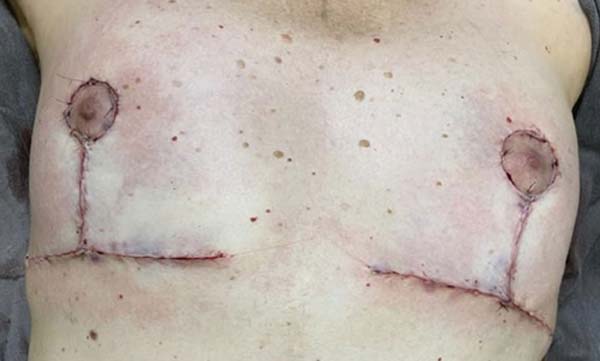
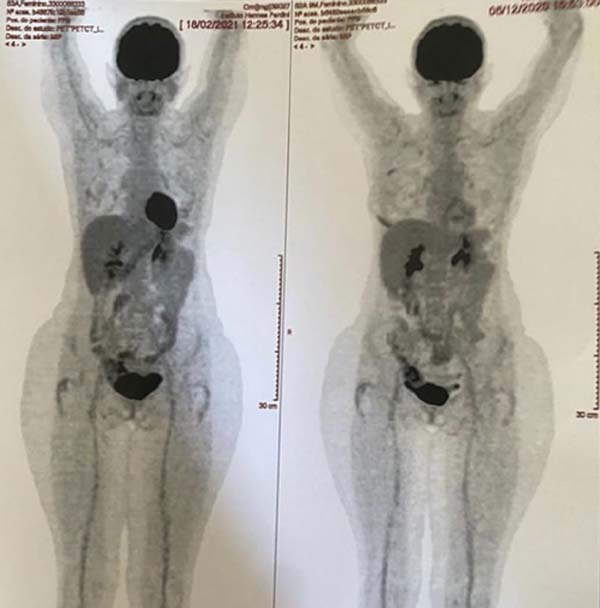
Após 3 meses da realização da mastopexia com explante de prótese mamária, foi realizado PET-SCAN de seguimento que não evidenciou mais áreas de hipermetabolismo na mama direita da paciente. Assim, paciente encontrava-se livre de doença localizada ou a distância. A paciente relatou que após a operação apresentou dores nas mamas e equimoses na região lombar, mas que depois de um determinado tempo passaram. As mamas ficaram de tamanhos diferentes e as cicatrizes pós-cirúrgicas a incomodam, e apesar disso afetar sua autoestima, ela ficou feliz com o tratamento médico e a atenção médica durante todo o processo (Figuras 7 8 9 10).
A doença tem como principais manifestações clínicas o seroma tardio, assimetria mamária, massa e contratura capsular, com frequência mais elevada do primeiro1. No caso relatado, a presença de seroma tardio e súbito foi a primeira alteração encontrada.
DISCUSSÃO
O linfoma anaplásico de grandes células associado ao implante mamário (breast implant associated anaplastic large cell lymphoma - BIA-ALCL), é um subtipo raro de linfoma não Hodgkin de células T, caracterizado como CD30 positivo e ALK negativo5.
A doença é uma afecção rara que afeta cerca de uma pessoa a cada 30.000 com implante mamário. Os implantes de poliuretano e os texturizados estão mais associados à doença devido uma maior área de superfície, o que causa uma reação inflamatória crônica mais intensa com ativação imune mediada por linfócitos Th1 e TM71.
O explante da prótese com capsulectomia total pode ser suficiente para tratar o BIA- ALCL, com ressecções estendidas a locais adjacentes, quando necessário. Entretanto, em alguns casos, é realizada a radioterapia e/ou quimioterapia adjuvante, por exemplo, se metástase regional ou a distância1.
Neste caso foi demonstrado que, para um tratamento efetivo, mulheres com seroma de aparecimento súbito e tardio deverão realizar exames complementares para o diagnóstico o mais precoce possível dessa afecção, mesmo com tempo inferior à média de desenvolvimento, de cerca de 10,6 anos, como neste caso, no qual a doença surgiu em 5 anos5. Entre os exames complementares que podem ser úteis no prognóstico da afecção, podemos destacar o PET-SCAN, que evidencia áreas de hipermetabolismo, correspondendo a células cancerígenas.
A importância de conhecer a afecção e a ter em seu leque de hipóteses diagnósticas se faz necessário, mesmo que a maioria de seromas de surgimento tardio sejam benignos. A alta suspeição como no caso retratado, por ser divisor de águas em um tratamento precoce e um tardio, é essencial para a intervenção no momento oportuno e com elevados índices de cura.
CONCLUSÃO
O linfoma anaplásico de grandes células T está associado ao implante mamário, e, apesar de ser uma doença rara, deve ser suspeitado em pacientes pós-mamoplastia de aumento que apresentem sintomas característicos associados. Depreende-se disso, portanto, que, para um diagnóstico precoce e um tratamento efetivo, mulheres com seroma de aparecimento súbito e tardio deverão realizar exames complementares para a exclusão dessa afecção, mesmo com tempo inferior à média de desenvolvimento.
REFERÊNCIAS
1. Silva ACC, Pereira APA, Bicalho BC, Avelar CC, Abreu EDFA, Camarano GCV et al. Linfoma anaplásico de grandes células associado a implante mamário: uma revisão narrativa. Rev Eletr Acervo Saúde. 2020;12(11):e4767. Disponível em: https://acervomais.com.br/index.php/saude/article/view/4767
2. Monteiro LL, Mangiavacchi W, Machado DG. A evolução das próteses mamárias e os métodos de incisão utilizados em procedimentos de mamoplastia de aumento. Rev Bras Cir Plást. 2022;37(1):125-31.
3. Batista BN, Garicochea B, Aguilar VLN, Carvalho FM, Millan LS, Fraga MFP, et al. Relato de caso de linfoma anaplásico de células grandes associado a implante mamário em paciente brasileira. Rev Bras Cir Plást. 2017;32(3):445-9.
4. Veloso CN, Abbas K, Tonin JMF. Cirurgia plástica: qual o custo da indústria da beleza? Anais do Congresso Brasileiro de Custos - ABC. Uberlândia: XX Congresso Brasileiro de Custos; 2013. Disponível em: https://anaiscbc.emnuvens.com.br/anais/article/view/20
5. Real DSS, Resendes BS. Linfoma anaplásico de grandes células relacionado ao implante mamário: revisão sistemática da literatura. Rev Bras Cir Plást. 2019;34(4):531-8.
6. Lee JH. Breast implant-associated anaplastic large-cell lymphoma (BIA-ALCL). Yeungnam Univ J Med. 2021;38(3):175-82.
7. Clemens MW Jacobsen ED, Horwitz SM. 2019 NCCN Consensus Guidelines on the Diagnosis and Treatment of Breast Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL). Aesthet Surg J. 2019;39(Suppl_1):S3-S13. DOI: 10.1093/asj/sjy331
8. Berlin E, Singh K, Mills C, Shapira I, Bakst RL, Chadha M. Breast Implant-Associated Anaplastic Large Cell Lymphoma: Case Report and Review of the Literature. Case Rep Hematol. 2018;2018:2414278. DOI: 10.1155/2018/2414278
9. Keech JA Jr, Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg. 1997;100(2):554-5.
10. Pastorello RG, D’Almeida Costa F, Osório CABT, Makdissi FBA, Bezerra SM, de Brot M, et al. Breast implant-associated anaplastic large cell lymphoma in a Li-FRAUMENI patient: a case report. Diagn Pathol. 2018;13(1):10. DOI: 10.1186/s13000-018-0688-x
11. Loch-Wilkinson A, Beath KJ, Knight RJW, Wessels WLF, Magnusson M, Papadopoulos T, et al. Breast Implant-Associated Anaplastic Large Cell Lymphoma in Australia and New Zealand: High-Surface-Area Textured Implants Are Associated with Increased Risk. Plast Reconstr Surg. 2017;140(4):645-54. DOI: 10.1097/PRS.0000000000003654
12. Johnson L, O’Donoghue JM, McLean N, Turton P, Khan AA, Turner SD, et al. Breast implant associated anaplastic large cell lymphoma: The UK experience. Recommendations on its management and implications for informed consent. Eur J Surg Oncol. 2017;43(8):1393-401.
1. João XXIII Hospital, Belo Horizonte, MG,
Brasil
2. Baleia Hospital, Belo Horizonte, MG,
Brasil
3. José do Rosário Vellano University, Belo
Horizonte, MG, Brasil
4. Semper Hospital of Belo Horizonte, Belo
Horizonte, MG, Brasil
Autor correspondente: Antônio de Pádua Peppe Neto Rodovia Papa João Paulo II, 4001, Edifício Gerais 13º and., Cidade Administrativa, Serra Verde, Belo Horizonte, MG, Brasil. CEP: 31630-901. E-mail: peppe-998@hotmail.com
Artigo submetido: 20/11/2023.
Artigo aceito: 30/04/2024.
Conflitos de interesse: não há.
Instituição: Fundação Hospitalar do Estado de Minas Gerais (FHEMIG), Belo Horizonte, MG, Brasil.








 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter