

Original Article - Year 2024 - Volume 39 -
Achados incomuns em ressonância magnética de pacientes com implantes mamários
Unusual findings on MRI of patients with breast implants
RESUMO
Introdução: O implante de prótese mamárias é uma das cirurgias mais realizadas no mundo. Ao longo do tempo, diversos materiais foram utilizados com objetivo de reconstituir o volume mamário. Apesar das melhorias técnicas, cirúrgicas e da segurança dos implantes atuais, os pacientes são confrontados com potenciais complicações "não usuais": rupturas intracapsulares e extracapsulares, hematomas tardios e deformidade de contorno, silicone intralinfonodal ou herniação da cápsula fibrosa. A ressonância magnética (RMN) é a modalidade de imagem mais útil para investigação dessas complicações.
Método: Trata-se de uma série de casos em que foram levantadas alterações ditas "não usuais", pela baixa frequência ou ausência na citação da literatura, após cirurgias de inclusão de prótese de silicone. Os dados foram coletados da experiência pessoal da clínica privada de um dos autores, na cidade de Brasília-DF, entre abril de 2015 e março de 2023.
Resultados: Foram um total de 211 pacientes avaliados, e foram encontradas alterações menos frequentes nas RMN de 12 pacientes (5,68%), das quais: 5 com volumosa quantidade de líquido pericapsular, 3 com granuloma capsular, 1 seroma tardio com conteúdo hemorrágico,1 rotura intra e extracapsular, 1 nódulo junto à cápsula fibrosa do implante, 2 linfonodopatia axilar ipsilateral, 1 silicone intralinfonodal, 1 edema do músculo peitoral, 2 tumor desmoide e 1 herniação da cápsula fibrosa.
Conclusão: Estima-se que existam 50 milhões de mulheres com próteses de mama no mundo. Com base nesse dado, o número de complicações ditas "não usuais" passa a ser um desafio diagnóstico para o cirurgião plástico e o radiologista.
Palavras-chave: Achados incidentais; Mama; Imageamento por ressonância magnética; Elastômeros de silicone; Implantes de mama.
ABSTRACT
Introduction: Breast prosthesis implantation is one of the most performed surgeries in the world. Over time, different materials were used to reconstitute breast volume. Despite technical and surgical improvements and the safety of current implants, patients are faced with potential "unusual" complications: intracapsular and extracapsular ruptures, late hematomas and contour deformity, intra-nodal silicone, or herniation of the fibrous capsule. Magnetic resonance imaging (MRI) is the most useful imaging modality for investigating these complications.
Method: This is a series of cases in which so-called "unusual" changes were reported, due to their low frequency or lack of mention in the literature, after surgeries to include a silicone prosthesis. The data were collected from the personal experience of one of the authors in his private clinic, in the city of Brasília-DF, between April 2015 and March 2023.
Results: A total of 211 patients were evaluated, and less frequent changes were found in the MRI of 12 patients (5.68%), of which: 5 with a large amount of pericapsular fluid, 3 with capsular granuloma, 1 late seroma with hemorrhagic content, 1 intra and extracapsular rupture, 1 nodule close to the implant's fibrous capsule, 2 axillary lymph node disease ipsilateral, 1 intra-nodal silicone, 1 pectoral muscle edema, 2 desmoid tumor and 1 herniation of the fibrous capsule.
Conclusion: It is estimated that there are 50 million women with breast implants in the world. Based on this data, the number of so-called "unusual" complications becomes a diagnostic challenge for the plastic surgeon and radiologist.
Keywords: Incidental findings; Breast; Magnetic resonance imaging; Silicone elastomers; Breast implants.
INTRODUÇÃO
As mamas têm uma importância fundamental no bem-estar psicossexual da paciente, uma vez que o desejo de melhorar a aparência estética faz parte do autocuidado, seja para reverter flacidez, aumentar volume, rejuvenescer, corrigir assimetria ou reconstruir as mamas1. Desse modo, o implante de próteses mamárias é uma das cirurgias mais realizadas no mundo, segundo dados divulgados pela Sociedade Internacional de Cirurgia plástica Estética (ISAPS), representando cerca de 15,8% das intervenções cirúrgicas estéticas realizadas em 2018, no mundo2.
Em 1889, Gersuny descreveu o aumento das mamas com injeção de parafina no parênquima mamário. Ao longo do tempo, diversos materiais foram utilizados com o objetivo de reconstituir o volume mamário, como próteses de marfim, esponjas de diferentes composições, enxertos dermogordurosos, silicone líquido ou gel3.
A introdução dos implantes de silicone nas mamas teve início em 1963, nos Estados Unidos da América, por meio de Cronin e Gerow, e desde então a referida intervenção cirúrgica é objeto de grandes discussões4,5. A concepção inicial visava cirurgias estéticas, mas atualmente o campo da reconstrução mamária emprega os implantes em grande escala6. Os primeiros implantes eram fabricados com elastômero espesso, em duas metades, as quais eram coladas para formar uma única peça. Ao longo do tempo, vários degraus evolutivos foram superados7,8.
Sperli descreveu 7 fases evolutivas dos implantes mamários que dependem do tipo do envoltório, com ou sem patch, revestimento e próteses infláveis9,10. Para a maioria dos tipos de implantes e estilos, houve variações ao longo dos anos, sendo mais comum em nosso meio os implantes de único lúmen com preenchimento de gel6.
Apesar das melhorias técnicas cirúrgicas e da segurança dos implantes atuais, os pacientes ainda são confrontados com potenciais complicações, sendo as mais encontradas: hematomas, seromas, infecções, assimetrias, rippling e principalmente as contraturas capsulares, que ainda são as complicações mais comumente vistas, com uma incidência global na ordem de 27%, associadas ao uso de implantes lisos e texturizados das primeiras gerações de próteses11-13.
Embora a mamografia e a ultrassonografia sejam os exames inicialmente solicitados para investigação, a ressonância magnética nuclear (RMM) é a modalidade de imagem mais útil para a caracterização de implantes mamários, devido a sua alta resolução espacial e pelo fornecimento de uma imagem de contraste entre o implante e os tecidos moles circunjacentes14. Outra vantagem é a ausência de radiação ionizante. A RMN tem maior sensibilidade (72-94%) e especificidade (85-100%) para constatar rupturas de implante, graças às suas sequências que podem suprimir ou enfatizar o sinal a partir do silicone3.
No protocolo de RMN os aparelhos de alta resolução a composição interna do silicone é melhor visualizada com detalhes em imagem sagital T2 FSE (Fast spin eco), e a imagem em T2 de alta qualidade e com supressão de água pode ser útil para diferenciar o silicone com ruptura intracapsular do líquido periimplante15. Já a imagem em dois planos é indicada para diferenciar rupturas intracapsulares precoces das dobras formadas na parte inferior e superior do implante. Além disso, a imagem no plano anteroposterior não é recomendada devido aos artefatos ocasionados pelo coração e pelo tórax15.
Complicações não usuais podem ocorrer, como rupturas intracapsulares e extracapsulares, hematomas tardios e deformidades de contorno, tendo a ressonância magnética como avaliação de imagem padrão-ouro para elucidação diagnóstica16.
Seromas são complicações tardias pouco comuns, mas que podem se manifestar sem causa definida, cujo tratamento implica a retirada ou a troca das próteses17. O aparecimento do seroma volumoso depois de um ano após a colocação de implantes é definido como tardio. Em estudos prospectivos, estimou-se que linfoma anaplásico de grandes células relacionadas ao implante mamário (BIA-ALCL) é frequente nas apresentações de seroma tardio18. Na ocorrência de seroma tardio e que não seja explicável facilmente por infecção ou trauma, deve ser considerado suspeito de doença19.
O tipo mais comum de ruptura é a do invólucro do implante (envelope de elastômero)20, cujo vazamento não se estende além da cápsula fibrosa que comumente se forma ao redor dos implantes de silicone, sendo 80 a 90% de todas as rupturas de implantes intracapsulares5. Já a ruptura extracapsular é definida como a extrusão tanto do invólucro quanto da cápsula fibrosa, com vazamento macroscópico de silicone21-23.
OBJETIVO
Realizar um levantamento das alterações encontradas nos exames de ressonância magnética de pacientes portadoras de implantes de silicone, identificar achados não usuais e suas frequências em um grande serviço de radiologia.
MÉTODO
Foi realizado um levantamento retrospectivo no cadastro de uma clínica privada de radiologia de Brasília-DF dos exames realizados em pacientes portadoras de implantes de silicone entre abril de 2015 e março de 2023.
Trata-se de uma série de casos em que foram levantadas as pacientes portadoras de alterações e selecionadas as alterações ditas “não usuais”, pela baixa frequência ou ausência de citação na literatura, após cirurgias de inclusão de prótese de silicone. Foram incluídas no estudo as pacientes que se submeteram ao aumento mamário com uso de implantes com finalidade estética ou reconstrução mamária.
O motivo da realização do exame não foi objeto do estudo. Foi realizado levantamento dos laudos e imagens da ressonância magnética nuclear (RMN) e selecionados para estudo aqueles que mostraram achados incomuns. Ademais, realizou-se revisão da literatura sobre cada um dos casos descritos e listados abaixo.
Por fim, ressalte-se que o presente estudo seguiu os princípios constantes da Declaração de Helsinque, desenvolvida pela Associação Médica Mundial. Ademais, o trabalho foi submetido e aprovado pela Comissão de Ética e Pesquisa, sob o número 75934023.7.0000.0257.
RESULTADOS
Foram submetidas à realização de RMN 211 pacientes portadoras de implantes mamários e encontraram-se alterações nas RMN de 12, o que corresponde a 5,68% do total. Utilizou-se a classificação em 3 grupos:
Grupo 1, com um total de 5 pacientes: 5 pacientes (2,3%) apresentaram volumosa quantidade de líquido pericapsular, sendo 3 desses casos de seroma pericapsular, submetidos a punções aspirativas e dosagem CD30 e ALK1, considerando-se a possibilidade de BIA-ACL, tendo 1 paciente positivo. Outros 3 pacientes (1,4%) apresentaram granuloma capsular e 1 paciente (0,4%) apresentou seroma capsular tardio com conteúdo hemorrágico.
Grupo 2, com um total de 3 pacientes: 2 pacientes (0,9%) apresentaram linfonodopatia axilar; 1 paciente (0,4%) teve rotura intra e extracapsular; 1 paciente (0,4%) nódulo junto à capsula fibrosa do implante; 1 paciente (0,4%) linfonodopatia axilar ipsilateral de provável origem inflamatória/infecciosa e 1 paciente (0,4%) silicone intralinfonodal.
Grupo 3, com um total de 4 pacientes: 1 paciente (0,4%) com edema do músculo peitoral, 2 pacientes com tumor desmoide e 1 paciente (0,4%) com herniação da cápsula fibrosa.
Caso 1
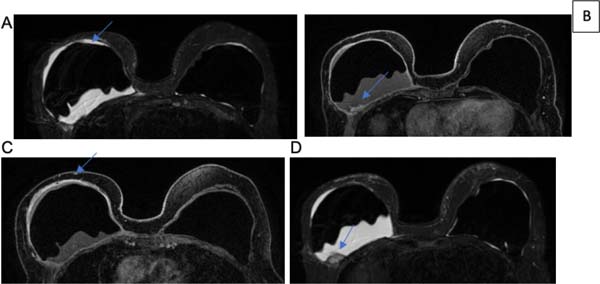
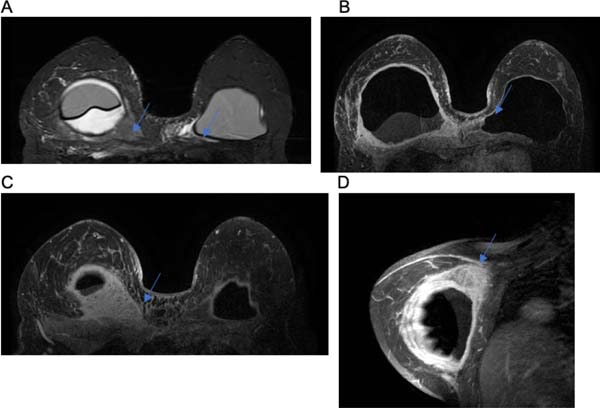
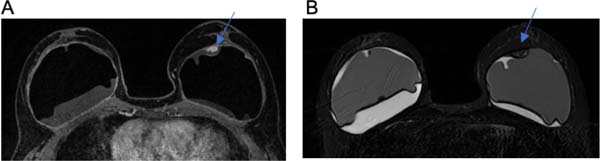
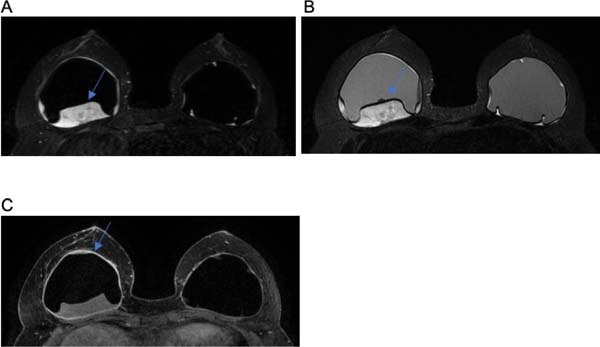
B.A.L.I., sexo feminino, 25 anos, refere que há 5 anos realizou a cirurgia para colocação de prótese com finalidade estética para aumento mamário. Submetida a cirurgia com aposição de implantes em plano retroglandular. Achado radiológico: líquido pericapsular bilateral, em maior quantidade à direita associado a realce da capsula fibrosa. Diante da possibilidade de BIA-ALCL, prosseguiu a investigação com punção aspirativa guiada por ecografia, apresentando resultado positivo.
Caso 2
D.G., sexo feminino, 69 anos, refere que foi submetida a cirurgia para reconstrução mamária após mastectomia bilateral com próteses de silicone em plano retromuscular. Foi realizado o exame de RMN com achado de volumoso seroma pericapsular à direita, com característica de suspeição para BIA-ALCL, imagem nodular capsular com realce heterogêneo, mas provavelmente correspondendo a granuloma capsular de silicone induzido. Além disso, apresentou alteração morfologia da prótese direita compatível com contratura capsular.
Caso 3
R.C.M., sexo feminino, 71 anos. Há 22 anos foi submetida a cirurgia estética mamária com implante de silicone em plano retroglandular. Em exame de rotina foi evidenciado volumoso seroma pericapsular com conteúdo hiperproteico/hemorrágico à direita, foi submetida a PAAF, considerando a possibilidade de BIA-ALCL. Essa paciente foi submetida, após esse exame de RNM, a cirurgia de capsulectomia bilateral, com retirada de coágulos à direita e reconstrução mamária há 1 ano.
Caso 4
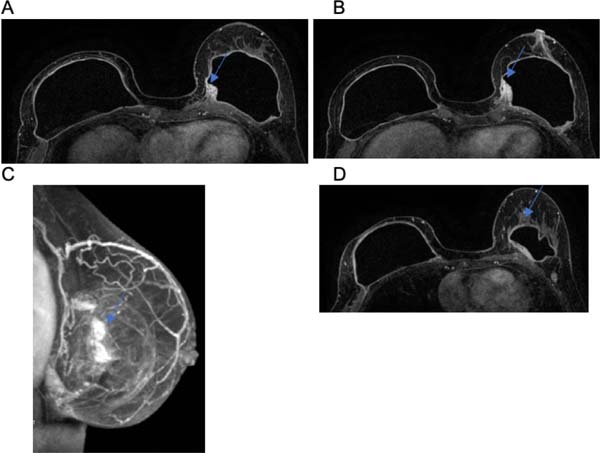
J.M., sexo feminino, 62 anos, refere que há 6 anos foi submetida a cirurgia para aumento mamário com colocação de implantes em plano retroglandular. Na RMN foi evidenciado nódulo junto à capsula fibrosa do implante esquerdo de origem inespecífica que pode corresponder a granuloma.
Caso 5
K. A., sexo feminino, 55 anos submetida a cirurgia de reconstrução devido a mastectomia direita. Realizada RMN, evidenciou-se realce do parênquima mamário e da cápsula do implante à esquerda associado à linfonodopatia axilar ipsilateral inespecífica, provavelmente inflamatório/infeccioso.
Caso 6
R.C.S., 66 anos, refere que há 11 anos realizou cirurgia estética para aumento mamário com prótese de silicone retroglandular. RNM evidenciou que o implante esquerdo apresentava sinais de contratura capsular. Ausência de sinais sugestivos de rotura intra e extracapsular dos implantes.
Caso 7
A.S., 46 anos, sexo feminino, submetida a cirurgia estética de implante mamário de silicone em posição retroglandular há 10 anos. Apresenta em mama direita silicone com moderada quantidade de líquido pericapsular, além espessamento e realce difuso da capsula fibrosa.
Caso 8
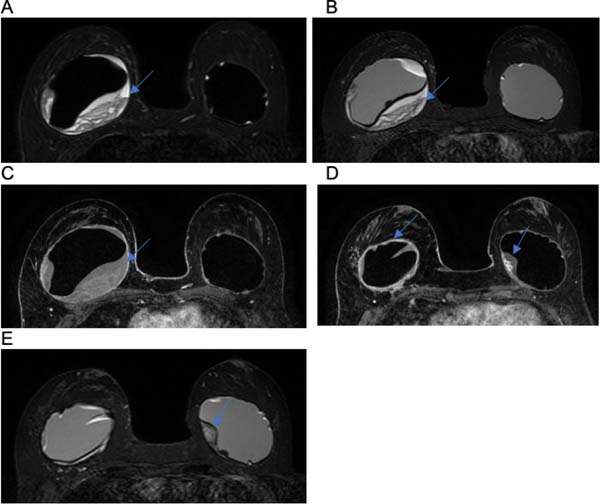
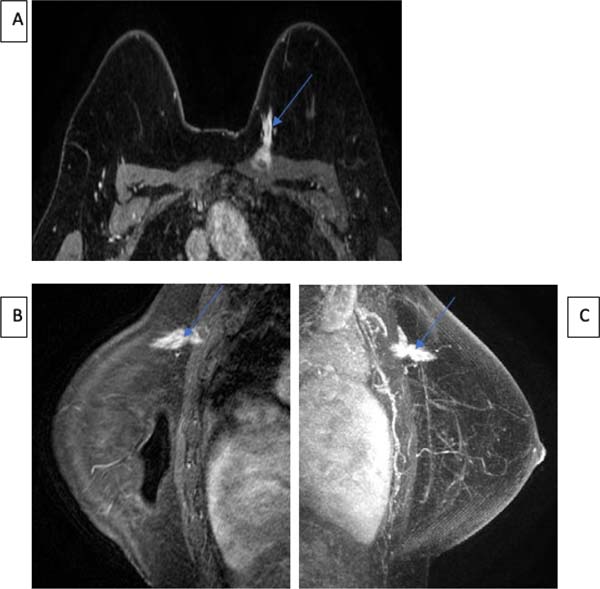
C.A.M., 52 anos, sexo feminino, foi submetida a cirurgia de reconstrução mamária devido a adenomastectomia bilateral por meio de expansores de duplo lúmen, com sinais sugestivos de rotura intracapsular à esquerda. Além disso, apresenta nos exames de imagem linfonodomegalia axilar esquerda, com sinal heterogêneo, podendo corresponder a silicone intralinfonodal, sugerindo rotura extracapsular ipsilateral.
Caso 9
E.R., 49 anos, sexo feminino, submetida a cirurgia estética há 2 anos com implante mamário em plano retroglandular. Em exames de imagem exibindo acentuado espessamento e realce pericapsular difuso, associado a alterações morfologia, volumoso seroma pericapsular e edema do músculo peitoral subjacente, com extensão pré-esternal para o aspecto medial da cápsula fibrosa e músculo peitoral contralaterais.
Caso 10
C.M., 47 anos, sexo feminino, submetida a cirurgia de reconstrução de mama com prótese em plano submuscular. Apresenta em exame de ressonância magnética das mamas expansor mamário à direita de formato habitual, sem sinais de rotura, com realce capsular difuso. No quadrante inferolateral da mama direita, nota-se herniação da cápsula fibrosa com conteúdo heterogêneo.
Caso 11
B.K.A., 30 anos, sexo feminino, submetida a mamoplastia com inclusão de implantes, com finalidade estética. Notou-se, um ano após a cirurgia, área endurecida em mama esquerda. Foi realizada ressonância magnética, com achado de nodulação heterogênea em íntimo contato com a cápsula do implante, com resultado positivo para tumor desmoide.
DISCUSSÃO
Diante de diversas complicações relacionadas a implante mamários, a ressonância magnética é o método de escolha para avaliação da integridade de implantes de silicone, pois apresenta maior acurácia do que a mamografia e a ecografia, escolhidas para acompanhamento e rastreio de câncer6. Com sensibilidade de até 94% na detecção de ruptura e especificidade entre 85% a 100%, são usadas sequências com e sem supressão de silicone, bem como sequências combinadas para avaliar parênquima e prótese24.
Na avaliação das lesões no parênquima mamário, pode-se utilizar contraste paramagnético, que possui melhor precisão em mamas no pósoperatório recente, devido à distorção arquitetural e ao edema da mama operada24. Essa alteração usual é verificada quando ocorre a contratura capsular, após o aumento das mamas com silicone. A fina cápsula fibrosa normalmente se forma ao redor da prótese e provoca desconforto e deformidade na arquitetura da mama15.
Existem diversos sinais encontrados na RMN que correspondem a complicações dos implantes de silicone, sendo descritos na literatura achados compatíveis com ruptura extracapsular (sinal de fechadura ou o sinal de noix)6. Além disso, na imagem ponderada em sagital, o sinal da linha subcapsular corresponde ao rompimento intracapsular. O referido sinal é conhecido como salad oil (focos de hipersinal em T2 no interior da prótese)24.
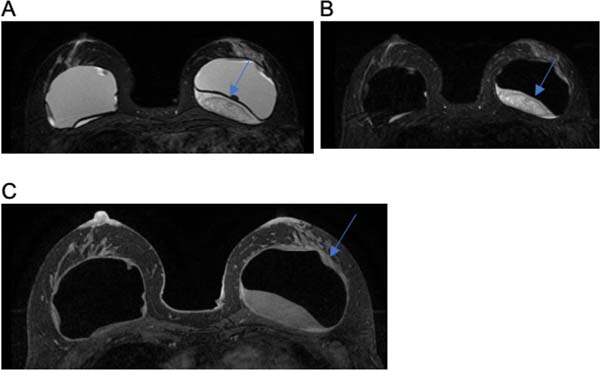
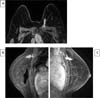
Dois pacientes apresentaram ruptura intracapsular, conforme evidenciado na Figura 8C, que retrata o sinal de linguine, presença de várias linhas curvilíneas hipointensas dentro do gel de silicone.
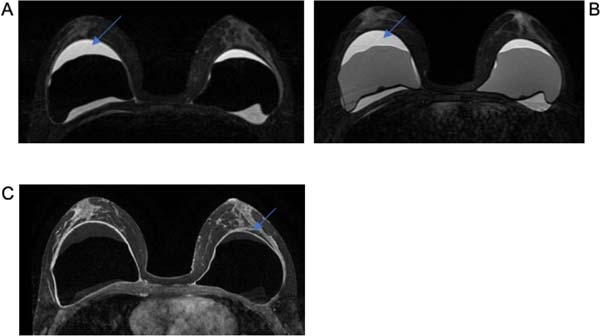
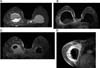
Já o sinal radiológico de contratura capsular evidenciado nas Figuras 1C e 2D pode ser analisado como o aumento do diâmetro anteroposterior do implante, associado à assimetria e à forma arredondada do mesmo8.
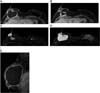
Os volumosos seromas tardios foram encontrados no grupo 1 e exemplificados nas Figuras 1A, 1B, 2A e 3C. Na literatura, as possíveis suposições etiológicas apontam para ruptura da prótese, o que não ocorreu em nenhum caso25. No entanto, em estudos prospectivos, estimou-se o BIA-ALCL ocorre em 9 a 13% das apresentações dos seromas tardios17. Mas tal fato poderia ser justificado por outras causas, como, por exemplo, o atrito entre a prótese e a loja orgânica, o processo inflamatório crônico e metaplasia da face interna da cápsula10.
Pinchuk & Tymofii26, em casuística de 569 pacientes que fizeram inclusão de próteses mamárias, relataram 6 casos de seroma tardio, ocorridos entre 2 anos e 10 anos de pós-operatórios. Na opinião dos autores, o atrito da prótese contra a superfície interna da cápsula orgânica foi um dos principais motivos para a metaplasia sinovial dessa superfície, mas também a infecção crônica e a consequente a formação do seroma.
A drenagem linfática da mama ocorre principalmente por 3 vias: supraclavicular, axilar e mamária interna, justificando o quadro de linfadenopatia local nos casos de ruptura de prótese27, semelhante ao ocorrido com o caso 8 e demonstrado na Figura 8D. A linfadenopatia por silicone é um achado não usual em ressonância magnética e tem um mecanismo mal compreendido. No entanto, acredita-se que ocorre o transporte de partículas de silicone para os linfonodos através de macrófagos no sistema reticuloendotelial. Nesses casos, o diagnóstico de câncer de mama deve ser excluído25.
Ao contrário da ruptura, o vazamento de gel de silicone é microscópico através de um envoltório do implante intacto. Esse fenômeno está relacionado com a afinidade química entra a camada externa do elastômero de silicone e gel nele contidos14. O contato com a casca exterior pode romper laços não covalentes moleculares entre as cadeias poliméricas, causando inchaço e enfraquecimento do próprio reservatório. Uma vez que se separa do seu envoltório, o silicone pode migrar, atingindo membros superiores, linfonodos inguinais e fluido pleural. Assim, pode-se explicar a possível alteração em dois pacientes do grupo 2 com linfonodopatia axilar e silicone intralinfonodal. Quando o extravasamento de gel é extenso, pode ser detectado por exame de imagem, havendo a formação do sinal da lágrima invertida6,10.
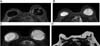
Foi evidenciado granuloma capsular em duas pacientes, conforme observado nas Figuras 2D, 4A e 4B. Ainda, atestou-se edema do músculo peitoral em uma paciente, consoante demonstrado na Figura 9A. As alterações em questão podem ser explicadas pela literatura. No caso, o silicone gel do implante pode ter o seu envoltório dissolvido com o tempo, tornando o seu revestimento mais fino, ou até mesmo dissolvido por completo, o que torna o produto viscoso dentro da cápsula fibrosa orgânica. Desse modo, em certos casos há a migração do produto viscoso para tecidos vizinhos, o que pode formar granulações, inflamação da pele com rash cutâneo, urticária, calcificações, migração para linfonodos ou mesmo infiltração em músculos do tórax, simulando tumores25.
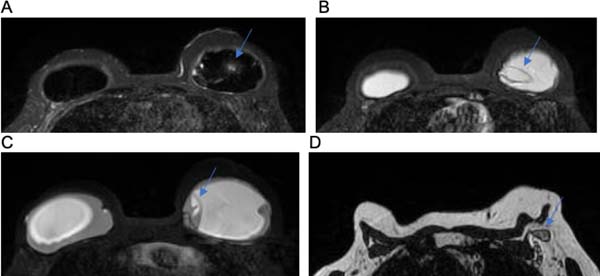
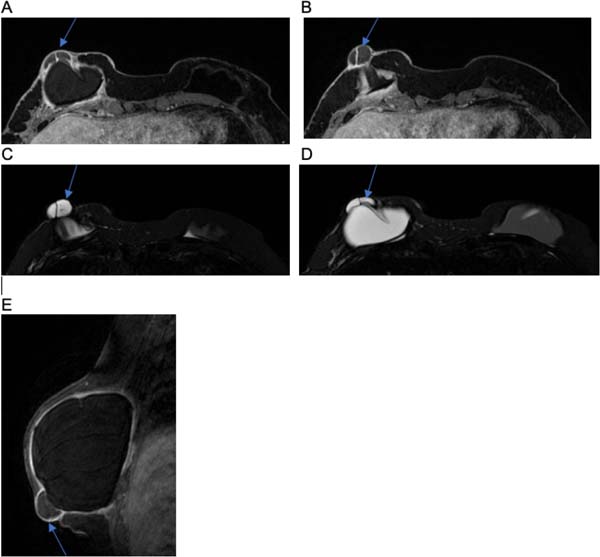
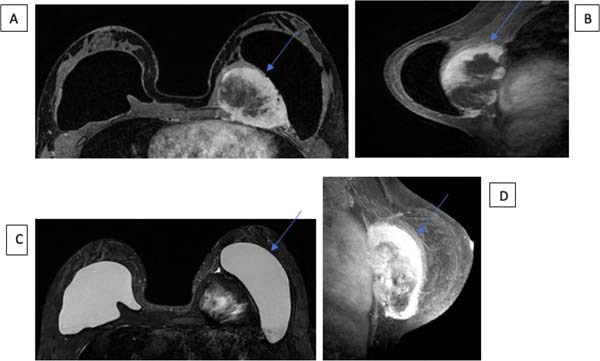
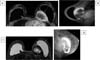
A fibromatose desmoide (DF) é tumor miofibroblástico não metastático, raro, localmente agressivo, com taxas altas de recorrência (24-77%) e curso clínico imprevisível. A incidência é de aproximadamente 0,2% de todas as neoplasias da mama28. O local mais acometido é o intra-abdominal, sendo na mama uma condição extremamente rara29. Foram encontrados 2 pacientes nos quais inicialmente foi levantada a hipótese de tumor mamário maligno, que o resultado da biópsia e imuno-histoquímica confirmou ser tumor desmoide. Na imuno-histoquímica a presença positiva de actina e vimentina, desmina raramente é positiva, enquanto S100 e CD34 são negativos, sendo úteis para o diagnóstico de tumor desmoide29.
Na ressonância magnética os tumores desmoides são tipicamente massas irregulares, de contorno mal definidos, hipointensos e isointenso em relação ao músculo em sequências ponderadas em T1 e com hiperintensidade de sinal variável em sequências ponderadas em T230. Esses achados são evidenciados nas Figuras 11A,11B, 12A e 12B.
A investigação diagnóstica por meio de exames de imagens como a ressonância magnética pode facilitar a elucidar as complicações ditas “não usuais” em cirurgias de próteses mamária. Diante dessas possíveis alterações, a paciente deve ser previamente informada sobre a inclusão de próteses mamárias, que sua decisão poderá ter implicações futuras, sendo necessárias novas intervenções cirúrgicas para tratamento caso ocorram complicações.
CONCLUSÃO
Estima-se que existam 50 milhões de mulheres com próteses de mama no mundo. O número de mulheres submetidas a aumento de mama com implantes de silicone tende a aumentar e o Brasil é um dos principais países em números estatísticos. Com base nessa tendência, o número de complicações ditas “não usuais” passa ser um desafio diagnóstico para o cirurgião plástico e o radiologista.
No presente estudo, foi encontrada baixa incidência de complicações não usuais, sendo 12 casos em 211 analisados por meio da ressonância magnética das mamas. Esse método diagnóstico permite auxiliar na detecção precoce dessas alterações e possibilita maior segurança para acompanhamento no pósoperatório, devido sua alta sensibilidade e especificidade, apresentando um papel central na orientação terapêutica.
REFERÊNCIAS
1. Baker JL Jr, Kolin IS, Bartlett ES. Psychosexual dynamics of patients undergoing mammary augmentation. Plast Reconstr Surg. 1974;53(6):652-9.
2. Pitanguy I, Barbato C, Dègand M, Lopez CET. Mamoplastia de aumento: considerações sobre a retração capsular. Rev Bras Cir. 1979;69(7/8):237-50.
3. Montandon RE. A report on complications of breast implantation: evaluation of 546 cases in 8 years. Rev Bras Cir Plást. 2014;29(3):352-60.
4. Pitanguy I, Amorim NFG, Ferreira AV, Berger R. Análise das trocas de implantes mamários nos últimos cinco anos na clínica Ivo Pitanguy. Rev Bras Cir. 2010;25(4):668-74.
5. Gorczyca DP, Gorczyca SM, Gorczyca KL. The diagnosis of silicone breast implant rupture. Plast Reconstr Surg. 2007;120(7 Suppl 1):49S-61S.
6. Dancey A, Nassimizadeh A, Levick P. Capsular contracture - What are the risk factors? A 14 year series of 1400 consecutive augmentations. J Plast Reconstr Aesthet Surg. 2012;65(2):213-8.
7. McGrath MH, Burkhardt BR. The safety and efficacy of breast implants for augmentation mammaplasty. Plast Reconstr Surg. 1984;74(4):550-60.
8. Wiedenhoefer JF, Shahid H, Dornbluth C, Otto P, Kist K. MR imaging of breast implants: useful information for the interpreting radiologist. Appl Radiol. 2015;44(10):18-24.
9. Sperli A, Bersou Jr. A, Freitas JOG, Michalany N. Complicações com Próteses Mamárias. Rev Bras Cir Plást. 2000;15(3):33-46.
10. Franco T, Franco D. Seroma tardio após implantes mamários de silicone: três formas diferentes de apresentação, evolução e conduta. Rev Bras Cir Plást. 2013;28(2):247-52.
11. Nahabedian MY, Patel K. Management of common and uncommon problems after primary breast augmentation. Clin Plast Surg. 2009;36(1):127-38.
12. Biggs TM, Cukier J, Worthing LF. Augmentation mammaplasty: a review of 18 years. Plast Reconstr Surg. 1982;69(3):445-52.
13. De Cholnoky T. Augmentation mammaplasty. Survey of complications in 10,941 patients by 265 surgeons. Plast Reconstr Surg. 1970;45(6):573-7.
14. Colombo G, Ruvolo V, Stifanese R, Perillo M, Garlaschi A. A. Prosthetic breast implant rupture: imaging--pictorial essay. Aesthetic Plast Surg. 2011;35(5):891-900.
15. Seiler SJ, Sharma PB, Hayes JC, Ganti R, Mootz AR, Eads ED, et al. Multimodality Imaging-based Evaluation of Single-Lumen Silicone Breast Implants for Rupture. Radiographics. 2017;37(2):366-82.
16. Barra RF, Barra RR, Barra Sobrinho A. Novos métodos funcionais na avaliação de lesões mamárias. Radiol Bras. 2012;45(6):340-4.
17. Cordeiro PG, Ghione P, Ni A, Hu Q, Ganesan N, Galasso N, et al. Risk of breast implant associated anaplastic large cell lymphoma (BIA-ALCL) in a cohort of 3546 women prospectively followed long term after reconstruction with textured breast implants. J Plast Reconstr Aesthet Surg. 2020;73(5):841-6.
18. Argus A, Mahoney MC. Indications for breast MRI: case-based review. AJR Am J Roentgenol. 2011;196(3 Suppl):WS1-14.
19. De-Azambuja AP, Groth AK, Jung J, Gevert F, Nabhan SK. Breast implant-associated anaplastic large cell lymphoma: a diagnostic challenge. Rev Bras Cir Plást. 2020;35(1):118-20.
20. Juanpere S, Perez E, Huc O, Motos N, Pont J, Pedraza S. Imaging of breast implants-a pictorial review. Insights Imaging. 2011;2(6):653-70.
21. Stöblen F, Rezai M, Kümmel S. Imaging in patients with breast implants-results of the First International Breast (Implant) Conference 2009. Insights Imaging. 2010;1(2):93-7.
22. Yang N, Muradali D. The augmented breast: a pictorial review of the abnormal and unusual. AJR Am J Roentgenol. 2011;196(4):W451-60.
23. Soo MS, Kornguth PJ, Walsh R, Elenberger C, Georgiade GS, DeLong D, et al. Intracapsular implant rupture: MR findings of incomplete shell collapse. J Magn Reson Imaging. 1997;7(4):724-30.
24. Schmitt W, Coelho JM, Lopes J, Marques JC. O Papel da Radiologia na Monitorização das Complicações Relacionadas com as Próteses Mamárias. Acta Radiol Port. 2018;30(1):23-34.
25. Takejima AL. Ruptura de implante mamário com disseminação linfática do silicone: relato de caso e revisão da literatura [Trabalho de Conclusão de Curso em Residência Médica]. São Paulo: Hospital do Servidor Público Municipal; 2011.
26. Pinchuk V, Tymofii O. Seroma as a late complication after breast augmentation. Aesthetic Plast Surg. 2011;35(3):303-14.
27. Moore KL, Daley AF. Anatomia orientada para a clínica. 7ª ed. Rio de Janeiro: Guanabara Koogan; 2014.
28. Benej R, Mečiarová I, Pohlodek K. Desmoid-type fibromatosis of the breast: A report of 2 cases. Oncol Lett. 2017;14(2):1433-8. DOI: 10.3892/ol.2017.6337
29. Duazo-Cassin L, Le Guellec S, Lusque A, Chantalat E, Laé M, Terrier P, et al. Breast desmoid tumor management in France: toward a new strategy. Breast Cancer Res Treat. 2019;176(2):329-35. DOI: 10.1007/s10549-019-05245-5
30. Erguvan-Dogan B, Dempsey PJ, Ayyar G, Gilcrease MZ. Primary desmoid tumor (extraabdominal fibromatosis) of the breast. AJR Am J Roentgenol. 2005;185(2):488-9.
1. Hospital Daher Lago Sul, Brasília, DF, Brasil
Autor correspondente: Igor Moura Soares Quadra SHIS QI 7, conjunto F, área especial F, Setor de Habitações Individuais Sul, Brasília, DF, Brasil, CEP: 71615-660, E-mail: igormoura739@gmail.com
Artigo submetido: 19/01/2024.
Artigo aceito: 04/02/2024.
Conflitos de interesse: não há.



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter