

Review Article - Year 2024 - Volume 39 -
Utilização da toxina botulínica para o tratamento de cicatriz queloide: revisão de escopo
Use of botulinum toxin for the treatment of keloid scars: scoping review
RESUMO
Introdução: Cicatrizes visíveis podem acarretar agravos, sejam estéticos, psicológicos, funcionais ou sociais, principalmente de grande extensão e volume, como os queloides. A descoberta de novos tratamentos de queloides não é fácil, visto a presença de alguns entraves metodológicos e éticos, sendo uma área pouco explorada. A toxina botulínica tem sido apresentada como alternativa terapêutica em estudos nacionais e internacionais, sendo necessária uma compilação e destaque dos principais estudos que possam subsidiar a prática clínica. Assim, o objetivo foi apresentar uma revisão de escopo sobre a utilização terapêutica da toxina botulínica para o tratamento de cicatrizes queloides.
Método: A revisão foi realizada através da estratégia PICO e utilizando o Preferred Reporting Items for Systematic reviews and Meta-Analyses extension for Scoping Reviews. Foi realizada nas bases de dados PubMed/ Medline, Biblioteca Virtual em Saúde e SciELO, considerando estudos do período de 2016 até setembro de 2021.
Resultados: Foram encontrados 34 artigos no geral relacionados ao tema. Após filtragem e seleção, a revisão foi construída com apoio de 5 artigos. Os estudos variaram entre coorte, relatos de caso, ensaio clínico randomizado e caso-controle. Foi possível observar como principais resultados a ação a curto prazo da toxina botulínica na redução de queloides, maior efetividade na redução dos sintomas e possibilidades de utilização clínica para diferentes populações e manifestações clínicas.
Conclusão: O mecanismo de ação da toxina botulínica pode facilitar o tratamento de queloides e redução de sintomas, sendo necessários estudos mais robustos para definição de protocolos cínicos de gestão de cicatrizes.
Palavras-chave: Queloide; Experimentação humana terapêutica; Toxinas botulínicas tipo A; Procedimentos cirúrgicos reconstrutivos; Prática clínica baseada em evidências
ABSTRACT
Introduction: Visible scars can cause problems, whether aesthetic, psychological, functional, or social, mainly of great extension and volume, such as keloids. The discovery of new treatments for keloids is not easy, given the presence of some methodological and ethical obstacles, and it is an area that is little explored. Botulinum toxin has been presented as a therapeutic alternative in national and international studies, requiring a compilation and highlighting of the main studies that can support clinical practice. Thus, the objective was to present a scoping review on the therapeutic use of botulinum toxin for the treatment of keloid scars.
Method: The review was carried out using the PICO strategy and using the Preferred Reporting Items for Systematic Reviews and Meta-Analyses extension for Scoping Reviews. It was carried out in the PubMed/ Medline, Virtual Health Library, and SciELO databases, considering studies from 2016 to September 2021.
Results: Overall, 34 articles related to the topic were found. After filtering and selection, the review was constructed with the support of 5 articles. The studies varied between cohorts, case reports, randomized clinical trials, and casecontrol. It was possible to observe as main results of the short-term action of botulinum toxin in reducing keloids, greater effectiveness in reducing symptoms, and possibilities of clinical use for different populations and clinical manifestations.
Conclusion: The mechanism of action of botulinum toxin can facilitate the treatment of keloids and reduce symptoms, requiring more robust studies to define effective scar management protocols.
Keywords: Keloid; Therapeutic Human experimentation; Botulinum toxins, type A; Reconstructive surgical procedures; Evidence-based practice
INTRODUÇÃO
Cicatrizes geralmente são um fato de preocupação para os pacientes que são submetidos a procedimentos cirúrgicos, principalmente se estas forem susceptíveis a surgir em áreas mais visíveis do corpo1. Feridas operatórias em regiões como a face tendem a apresentar maior impacto estético durante o processo de cicatrização, podendo também haver uma maior tensão na ferida operatória em algumas estruturas miofasciais, resultando em cicatrizes2.
O queloide é caracterizado como uma cicatriz de espessura considerável, elevada, resultante do crescimento anormal de tecido cicatricial, que, diferentemente das cicatrizes hipertróficas, se estende para além dos limites da ferida operatória3. Devido a sua fisiologia, os queloides não se desenvolvem em animais, o que dificulta o processo de desenvolvimento de novas terapêuticas, uma vez que o teste em animais não pode ser realizado1. Além disso, a presença de cicatrizes pode levar a repercussões biopsicossociais, sejam fisiológicas ou limitações sociais em razão da estética4. Pensando nestes aspectos, diversos tratamentos são utilizados para a redução destes agravos.
Ainda não há consenso de um tratamento único que seja considerado a melhor alternativa para as cicatrizes queloides. A Biblioteca Virtual em Saúde5, com apoio da Sociedade Brasileira de Cirurgia Dermatológica e da Sociedade Brasileira de Dermatologia, apresentam como principais tratamentos para a queloide: radioterapia local, placas de silicone, injeções de fármacos, fitas oclusivas, cirurgia, crioterapia e laserterapia. Estas opções de tratamento visam principalmente a redução dos sintomas, sendo sua regressão ou redução alternativas menos frequentes e ainda em estudo.
Visando uma melhor terapêutica, pesquisas utilizando toxina botulínica estão ganhando cada vez mais espaço. A toxina botulínica tipo A (TBA) age na redução da tensão nas bordas das feridas operatórias durante o processo de cicatrização, contribuindo assim para melhora do aspecto cicatricial, e reduzindo as possibilidades de desenvolvimento e/ou progressão de queloide6.
OBJETIVO
Pensando nisto, o presente estudo tem por objetivo apresentar uma revisão de escopo sobre a utilização terapêutica da toxina botulínica para o tratamento de cicatrizes queloides.
MÉTODO
O modelo PICO, com base em Santos et al.7, foi usado para a formulação das questões norteadoras deste estudo, sendo considerados: (P) estudos que consideraram pacientes com cicatriz queloide, (I) estudos em que o objetivo principal foi realizar ou descrever intervenções e estratégias com uso de toxina botulínica para estes pacientes, (C) estudos com ou sem grupo controle, (O) estudos que relataram o desenvolvimento e resultados das intervenções a curto, médio e longo prazo. Os estudos realizados até setembro de 2021 foram incluídos nesta revisão, se atendessem aos critérios PICO.
A revisão foi construída de acordo com o Preferred Reporting Items for Systematic reviews and Meta-Analyses extension for Scoping Reviews: PRISMA-ScR8. A pesquisa foi realizada nas bases de dados PubMed/Medline, Biblioteca Virtual em Saúde (BVS) e SciELO para identificação de artigos sobre o tratamento de cicatriz queloide com toxina botulínica. A pesquisa foi realizada combinando os termos “botulinum toxin”, “keloid”, “scar” e “treatment”. A utilização dos termos foi realizada de maneira combinada, conforme a ordem anteriormente citada. Os termos são baseados em descritores presentes no Descritores em Ciências da Saúde (DECs).
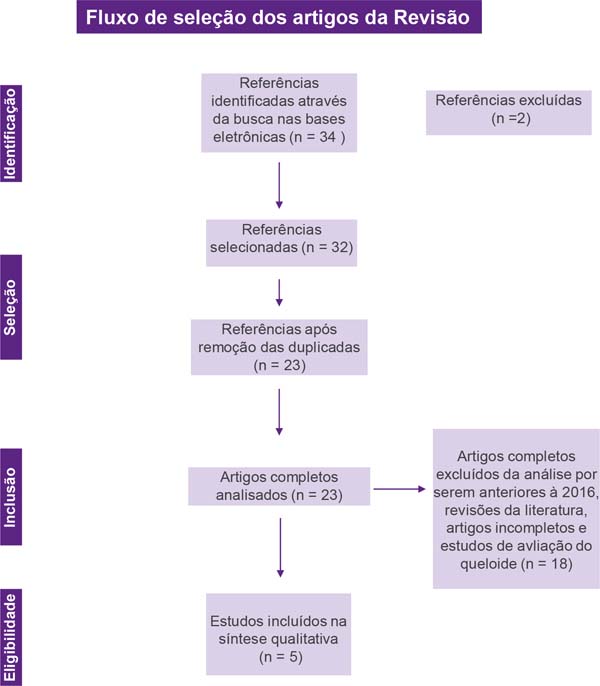
Foram considerados artigos de qualquer desenho, exceto revisões, em qualquer idioma, desde que houvesse relação com a temática central. Os critérios de exclusão foram: relatórios não publicados, revisões da literatura, estudos de avaliação dos sintomas, artigos publicados no período anterior a 2016 e estudos com ausência de texto na íntegra. Os artigos que se enquadraram nos critérios de elegibilidade foram selecionados pelo título e resumo por duas revisoras e os artigos que não atenderam aos critérios de inclusão foram excluídos. Após a triagem do título e resumo, os estudos foram submetidos a um gerenciador de referências públicas (Mendeley v.1.17.9) para eliminar as duplicatas. O resultado desta seleção pode ser observado na Figura 1.
Posteriormente, os artigos em texto completo restantes foram examinados por um terceiro revisor. Qualquer discordância foi resolvida por meio de discussão até que um consenso fosse alcançado, ou com o envolvimento de um quarto revisor. Em seguida, foram extraídos os seguintes pontos de cada estudo, quando disponíveis: autoria, ano de publicação, título, objetivos e resultados. Estes dados foram dispostos em tabelas no Microsoft Word 2016, para análise final de inclusão.
RESULTADOS
A pesquisa bibliográfica inicial encontrou 34 estudos. Destes, 12 estudos foram identificados usando PubMed/Medline, 20 usando a BVS, 2 na SciELO. Após seleção por título e resumo, 32 artigos foram executados em Mendeley para eliminar duplicadas. Os 23 artigos de texto completo resultantes foram revisados para estabelecer se a publicação atendeu aos critérios de inclusão e 5 foram considerados elegíveis (Figura 1).
Dos 5 artigos elegíveis para esta revisão, 1 é estudo de coorte, 2 relatos de caso, 1 ensaio clínico randomizado e 1 estudo caso-controle (Quadro 1). A estratégia de busca e os critérios de inclusão e exclusão do estudo são detalhados na Figura 1.
| Referência | Título | Tipo de estudo |
|---|---|---|
| Cardoso et al. (2016)2 | Aplicação de toxina botulínica na cicatrização por segunda intenção | Relato de caso |
| Pruksapong et al. (2017)9 | Efficacy of Botulinum Toxin A in Preventing Recurrence Keloids: Double Blinded Randomized Controlled Trial Study: Intraindividual Subject | Ensaio Clínico Randomizado |
| Zhou et al. (2017)10 | Evaluation on efficacy and adverse reactions of combined therapy with botulinum toxin type A in treatment of keloid | Caso-controle |
| Rasaii et al. (2019)11 | Intralesional triamcinolone alone or in combination with botulinium toxin A is ineffective for the treatment of formed keloid scar: A double blind controlled pilot study | Coorte |
| Pires et al. (2020)12 | Toxina Botulínica Tipo A no Tratamento das Cicatrizes Hipertróficas por Queimadura em Idade Pediátrica: Caso Clínico | Relato de caso |
Fonte: Produção dos próprios autores.
Quanto aos tratamentos, os estudos apresentam variações em relação a suas populações, métodos e critérios clínicos, como apresenta a Quadro 2.
| Referência | Método | Critérios clínicos |
|---|---|---|
| Cardoso et al. (2016)2 | N=1 Idade = 36 anos Aplicação de toxina botulínica do tipo A |
Cicatriz decorrente
de cirurgia micrográfica de Mohs em região supralabial; Cicatriz
operatória de 3 x 1,6cm; Aplicação no pós-operatório imediato |
| Pruksapong et al. (2017)9 | N=25 pacientes, 50 queloides Idade média = 26 anos Grupo controle = injeção de corticoterapia Grupo de estudo = toxina botulínica tipo A |
Apresentar duas cicatrizes queloides; Não estar grávida ou amamentando; Cicatrizes maiores que 10cm; Não ser alérgico a toxina, lidocaína; Não apresentar condições médicas indesejáveis e utilizar fármacos anticoagulantes ou antiplaquetários |
| Zhou et al. (2017)10 | N=58 Grupo controle = injeção de betametasona e ácido hialurônico tópico Grupo de estudo = toxina botulínica tipo A combinada com injeção de betametasona e ácido hialurônico tópico |
Apresentar
cicatrizes queloides; Não apresentar restrições aos componentes farmacológicos do estudo |
| Rasaii et al. (2019)11 | N=23 Idade média = 23 anos Grupo controle = acetonido de triancinolona intralesional mais placebo Grupo de Estudo = toxina botulínica tipo A combinada com solução salina |
Apresentar duas cicatrizes queloides; Não estar grávida ou em amamentação; Ausência de doença da junção neuromuscular ou utilização de bloqueadores da junção neuromuscular |
| Pires et al. (2020)12 | N=1 Idade = 12 anos Aplicação de toxina botulínica do tipo A com analgesia tópica prévia com lidocaína + prilocaína 25 mg/g em creme |
Cicatrizes
decorrentes de queimaduras 2° e 3° em região da face, couro
cabeludo, pavilhões auriculares, cervical, face anterior do tórax e
membros superiores; Aplicação em cicatriz axilar direita e bordo radial do primeiro dedo da mão direita; Aplicação 5 meses pós-queimadura |
Fonte: Produção dos próprios autores.
Os estudos selecionados apresentam diferentes desfechos e conclusões em relação ao uso da TBA. Na Quadro 3 é possível observar os tratamentos utilizados, resultados e conclusões dos estudos analisados.
| Referência | Tratamento | Resultados | Conclusões |
|---|---|---|---|
| Cardoso et al. (2016)2 | 8 unidades de TBA na ferida operatória, com cicatrização por segunda intenção. | Cicatrização completa da ferida em 18 dias com formação de tecido cicatricial levemente eritematoso no lábio superior, com discreta extensão para a região supralabial, mantido no pós-operatório tardio, favorecendo a estética e funcionalidade. | As propriedades moleculares da TBA sugerem que sua ação é melhor no início da cicatrização, quando os fibroblastos ainda estão na fase proliferativa e em intensa atividade apoptótica, necessitando de estudos maiores sobre este processo em cicatrização por segunda intenção. |
| Pruksapong et al. (2017)9 | Grupo controle = Injeção de acetoneto de
triancinolona (10mg/cc) sete dias após a remoção do ponto, sendo
repetida no primeiro, segundo e terceiro mês. Grupo de estudo = TBA intradérmico, com dose de 1,5 unidades / 1cm de comprimento (Botox® 50 unidades de toxina com 0,9% NSS para injeção 2,5cc, concentração 2 unidades por 0,1cc) sete dias após a retirada dos pontos (uma dose). |
No primeiro e terceiro mês, o desfecho no grupo da
toxina foi mais favorável do que no controle, enquanto o desfecho no
grupo controle foi mais favorável do que no grupo toxina no sexto
mês de seguimento. |
A utilização de TBA é significativamente melhor na prevenção de queloides de recorrência quando comparada à corticoterapia após um e três meses. Entretanto, a corticoterapia oferece resultados significativamente melhores no acompanhamento de 6 meses. |
| Zhou et al. (2017)10 | Grupo controle =
injeção de betametasona e ácido hialurônico tópico. Grupo de estudo = toxina botulínica tipo A combinada com injeção de betametasona e ácido hialurônico tópico. Ambos os grupos de pacientes foram injetados localmente com betametasona, uma vez a cada 4 semanas, 3 vezes consecutivas, e ácido hialurônico tópico foi usado diariamente. Os pacientes no grupo de tratamento combinado foram injetados com toxina botulínica tipo A na periferia da lesão cutânea após a primeira injeção de betametasona. máxima por sessão de 130U BOTOX®, com uma aplicação mensal, durante 3 meses. |
A estética das
lesões cutâneas no grupo de estudo melhorou melhor após 3
aplicações. Os escores de dor e coceira no grupo de controle
diminuíram durante 1 mês de tratamento, mas aumentaram gradualmente
em 2 e 3 meses; em contraponto, nos pacientes no grupo de estudo
diminuíram gradualmente dentro de 3 meses de tratamento, sendo esta
diferença estatisticamente significativa. No decorrer de 3 meses de tratamento, a espessura das lesões de pele no grupo de estudo diminuiu gradualmente, mas a redução no grupo de controle não foi significativa. A dor, sintomas de coceira e a espessura da pele dos pacientes do grupo de controle aumentaram 2 semanas após cada injeção, enquanto o grupo de tratamento combinado não apresentou recidiva. A incidência de reações adversas no grupo controle foi de 26,7% e no grupo de estudo foi de 25,0%, não havendo diferença significativa entre dois grupos. |
A TBA combinada com
injeção local de betametasona e ácido hialurônico tópico para o
tratamento de queloides é mais eficaz do que somente a injeção local
de betametasona e ácido hialurônico tópico, e não há diferença
significativa na incidência de reações adversas, sendo favorável
para aplicação clínica. |
TBA: toxina botulínica tipo A. Fonte: Produção dos próprios autores.
DISCUSSÃO
As questões estéticas e funcionais relacionadas as cicatrizes, em especial queloides, acabam gerando desconforto e insatisfação por parte das pessoas que as têm. Estudos como o de Motoki et al.13 apresentam resultados negativos dos entrevistados em relação aos transtornos dimórficos do autoconceito e do corpo, e ainda afirmam que pessoas com queloides em regiões socialmente mais vistas como face, tórax e membros superiores relatam maior impacto negativo em sua imagem corporal.
O desenvolvimento de estratégias de tratamento deste quadro é um desafio para a comunidade científica, uma vez que queloides não se desenvolvem em animais, o que limita as possibilidades de investigação e teste de novos elementos terapêuticos1. Como possibilidades, a comunidade clínica e científica utiliza estratégias já testadas em outros quadros, além de estudos com células in vitro para gerar novas opções14. Lee et al.15 apresentam a terapia combinada como principal alternativa no tratamento de queloides, seja esta terapêutica através lasers, crioterapia ou injeção intralesional de fármacos, apresentando maior segurança e eficácia quando comparada a monoterapias individuais.
Como terapêutica emergente, o uso da toxina botulínica tipo A vem ganhando cada vez mais atenção das comunidades clínica e científica. Pode-se observar esse maior interesse quando neste trabalho foram encontrados inicialmente 34 estudos que relacionavam o uso da TBA para o tratamento do queloide. Nesta revisão, cinco estudos foram elegíveis, variando entre estudo de coorte, relatos de caso, ensaio clínico randomizado e estudo caso-controle. Devido às dificuldades anteriormente citadas do desenvolvimento de novas pesquisas na área, a variação dos tipos de estudo ainda é pouca, o que pode ser visto como um fator de entrave para o tratamento do quadro.
Os estudos analisados apresentam variações em suas populações e critérios clínicos, mas é possível observar que em duas pesquisas10,11 foi utilizada a terapêutica combinada, como defendem Lee et al.15, apresentando estas duas pesquisas resultados favoráveis à replicação da terapia combinada para o tratamento de queloide. Em relação às amostras e metodologias, pode-se destacar ausência de protocolos de aplicação e deficiências metodológicas consideráveis, principalmente em relação a tamanho de amostras e uniformidade dos tratamentos.
Foi observado também que os estudos destacaram a exclusão de participantes que apresentem alergias aos componentes do tratamento, gestantes e lactantes, que fazem uso de fármacos anticoagulantes ou antiplaquetários, bem como portadores da doença da junção neuromuscular ou utilização de bloqueadores da junção neuromuscular, sendo a efetividade do tratamento com TBA não testada nestas populações, portanto, sem indicação de evidências científicas e replicabilidade clínica para os mesmos9-11.
Os cinco estudos realizaram a aplicação da TBA de forma intradérmica, seja no rebordo da cicatriz/ferida operatória, ou diretamente no local. Sohrabi & Goutos16 somam a estes estudos quando afirmam, em sua revisão, que outras pesquisas também apontam a aplicação de TBA em queloide como tratamento em ascensão para minimizar a tensão no rebordo da cicatriz e otimização da atividade dos fibroblastos, implicando diretamente na patogênese da formação das cicatrizes. No presente estudo, ainda foi observada variação da posologia da TBA. Por ser composto de estudos com populações, idades e quadros clínicos distintos, esta revisão não pôde definir um padrão de dosagem da toxina, estando esta posologia ligada e dependente da manifestação clínica, tamanho da cicatriz e evento que desencadeou o processo cicatricial.
Apesar destas variações, os cinco estudos observados se relacionam com os achados resultantes da terapia baseada na TBA. É possível destacar como principais resultados a aceleração do processo de cicatrização de feridas operatórias e redução da formação cicatricial2, resultados significativos a curto prazo na redução de queloides9, melhora e manutenção dos aspectos estéticos, funcionais e sintomáticos, principalmente de dor e coceira10-12. Em outras revisões5,16 também foi possível encontrar a replicabilidade destes resultados, sendo a utilização da TBA para queloide uma possibilidade de tratamento clínico eficaz e com evidências já apresentadas em meio clínico e científico.
A utilização da toxina botulínica tipo A para o tratamento de cicatrizes queloides se justifica principalmente por seus mecanismos quimioimobilizadores da musculatura da região, e atuação na atividade fibroblástica. Os estudos concluem que a utilização da toxina botulínica tipo A tem melhor ação no início do processo de cicatrização, com ação direta nos fibroblastos2, que este tratamento apresenta menos reações adversas e melhores resultados a curto prazo quando comparado a outros tratamentos farmacológicos injetáveis9,10, que esta alternativa age melhor no gerenciamento de sintomas em diferentes populações e manifestações clínicas5, até mesmo em idade pediátrica16, encorajando, assim, a comunidade clínica a considerar a TBA com alternativa terapêutica para casos selecionados e bem analisados de queloides, levando sempre em consideração as particularidades clínicas e de manifestação do quadro.
CONCLUSÃO
Os estudos mais recentes sugerem um bom potencial de ação da utilização da toxina botulínica tipo A para o tratamento de cicatrizes queloides, principalmente para resultados a curto prazo, e redução de sintomas locais como a dor e prurido, quando comparada a outros tratamentos farmacológicos. Entretanto, existem deficiências nos estudos por serem dotados de pequenas populações, curtos períodos de acompanhamento e ausência de homogeneidade nos resultados encontrados. Dessa forma, é necessário que se desenvolvam maiores estudos com melhores metodologias, objetivando uma melhor definição da utilização de TBA para o tratamento de queloides em diferentes situações, e o desenvolvimento de protocolos unificados de gestão de cicatrizes para melhor replicabilidade clínica.
REFERÊNCIAS
1. Ogawa R. Keloid and Hypertrophic Scars Are the Result of Chronic Inflammation in the Reticular Dermis. Int J Mol Sci. 2017;18(3):606.
2. Cardoso AS, Teixeira DA, Oliveira BV, Carneiro PP, Junqueira RF. Botulinum toxin application in the secondary intention healing. Surg Cosmet Dermatol 2016;8(2):163-6.
3. Hochman B, Farkas CB, Isoldi FC, Ferrara SF, Furtado F, Ferreira LM. Distribuição de queloide e cicatriz hipertrófica segundo fototipos de pele de Fitzpatrick. Rev Bras Cir Plást. 2012;27(2):185-9.
4. Gouveia BN, Ferreira LD, Rocha Sobrinho HM. O uso da toxina botulínica em procedimentos estéticos. Rev Bras Mil Ciênc. 2020;6(16):56-63.
5. Brasil. Ministério da Saúde. Biblioteca Virtual em Saúde. Queloide. 2021. Elaborado por: Sociedade Brasileira de Cirurgia Dermatológica e Sociedade Brasileira de Dermatologia. Brasília: Ministério da Saúde; 2021 [acesso 2021 Out 30]. Disponível em: https://bvsms.saude.gov.br/queloide/
6. Kasyanju Carrero LM, Ma WW, Liu HF, Yin XF, Zhou BR. Botulinum toxin type A for the treatment and prevention of hypertrophic scars and keloids: Updated review. J Cosmet Dermatol. 2019;18(1):10-5.
7. Santos CMC, Pimenta CAM, Nobre MRC. The PICO strategy for the research question construction and evidence search. Rev Latino Am Enferm. 2007;15(3):508-11.
8. Tricco AC, Lillie E, Zarin W, O’Brien KK, Colquhoun H, Levac D, et al. PRISMA Extension for Scoping Reviews (PRISMA-ScR): Checklist and Explanation. Ann Intern Med. 2018;169(7):467-73.
9. Pruksapong C, Yingtaweesittikul S, Burusapat C. Efficacy of Botulinum Toxin A in Preventing Recurrence Keloids: Double Blinded Randomized Controlled Trial Study: Intraindividual Subject. J Med Assoc Thai. 2017;100(3):280-6.
10. Zhou M, Wang L, Jiang R, Zhu M, Chen F. Evaluation on efficacy and adverse reactions of combined therapy with botulinum toxin type A in treatment of keloid. J Jilin Un (Medicine Ed.). 2017;6:386-90.
11. Rasaii S, Sohrabian N, Gianfaldoni S, Hadibarhaghtalab M, Pazyar N, Bakhshaeekia A, et al. Intralesional triamcinolone alone or in combination with botulinium toxin A is ineffective for the treatment of formed keloid scar: A double blind controlled pilot study. Dermatol Ther. 2019;32(2):e12781.
12. Pires M, Soudo A, Costa MJ. Toxina Botulínica Tipo A no Tratamento das Cicatrizes Hipertróficas por Queimadura em Idade Pediátrica: Caso Clínico. Rev Soc Port Med Fís Reab. 2020;32(3):126-9.
13. Motoki THC, Isoldi FC, Brito MJA, Filho AG, Ferreira LM. Keloid negatively affects body image. Burns. 2019;45(3):610-4.
14. Dai X, Lei TC. Botulinum toxin A promotes the transdifferentiation of primary keloid myofibroblasts into adipocyte-like cells. Basic Clin Pharmacol Toxicol. 2021;129(6):462-9.
15. Lee YI, Kim J, Yang CE, Hong JW, Lee WJ, Lee JH. Combined Therapeutic Strategies for Keloid Treatment. Dermatol Surg. 2019;45(6):802-10.
16. Sohrabi C, Goutos I. The use of botulinum toxin in keloid scar management: a literature review. Scars Burn Heal. 2020;6:2059513120926628.
1. Universidade Estadual do Ceará, Fortaleza,
Ceará, Brasil
2. Santa Casa de Santos, Santos, São Paulo,
Brasil
Autor correspondente: Eduardo Lafayette Monteiro Av. Senador Ruy Carneiro, 212, Miramar, João Pessoa, PB, Brasil, CEP: 58032-101, E-mail: eduardomlafayette@gmail.com
Artigo submetido: 10/07/2023.
Artigo aceito: 04/02/2024.
Conflitos de interesse: não há.






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter