

Case Report - Year 2023 - Volume 38 -
Produção de secreção leitosa após reconstrução mamária tardia com retalho musculocutâneo de latíssimo do dorso com implante
Milky secretion after late breast reconstruction with latissimus dorsi musculocutaneous flap with implant
RESUMO
Apresentamos um caso raro de uma paciente de 28 anos com carcinoma ductal invasivo submetida a quimioterapia neoadjuvante, mastectomia radical modificada, radioterapia e reconstrução mamária tardia com retalho de latíssimo do dorso associado a implante. Um ano depois, foi submetida a reconstrução do complexo areolopapilar sobre a ilha cutânea do retalho do grande dorsal com enxerto de pele total da coxa e enxerto da porção caudal da papila contralateral. Ela engravidou seis meses após a reconstrução do complexo areolopapilar e, inesperadamente, apresentou produção de leite pela mama reconstruída.
Palavras-chave: Retalhos cirúrgicos; Neoplasias da mama; Aleitamento materno; Mamoplastia; Implantes de mama
ABSTRACT
We present a rare case of a 28-year-old patient with invasive ductal carcinoma who underwent neoadjuvant chemotherapy, modified radical mastectomy, radiotherapy, and late breast reconstruction with latissimus dorsi flap associated with the implant. One year later, she underwent reconstruction of the nipple-areola complex over the cutaneous island of the latissimus dorsi flap with a total skin graft from the thigh and graft from the caudal portion of the contralateral papilla. She became pregnant six months after the reconstruction of the nipple-areola complex and, unexpectedly, presented milk production by the reconstructed breast.
Keywords: Surgical flaps; Breast neoplasms; Breast feeding; Mammaplasty; Breast implants
INTRODUÇÃO
Pacientes submetidas a cirurgia de mama correm maior risco de serem incapazes de amamentar. A produção de leite não é esperada quando todos os tecidos mamários são removidos – como é o caso das mastectomias. Este breve relato descreve um caso raro de uma mulher que conseguiu amamentar após mastectomia radical, retalho de latíssimo do dorso e reconstrução com implante.
A produção e secreção de leite dependem da presença e funcionamento adequado do tecido da glândula mamária1. As pacientes submetidas a mastectomia radical têm o tecido produtor de leite removido, impossibilitando a amamentação2.
Apresentamos o caso de uma paciente com câncer de mama submetida a reconstrução mamária tardia com retalho de latíssimo do dorso (RLD) e implante após mastectomia radical modificada (MRM). Posteriormente, a paciente engravidou e apresentou secreção láctea via complexo areolopapilar (CAP) reconstruído. O isolamento da pandemia de COVID-19 impossibilitou a análise laboratorial da secreção, não sendo possível confirmar que se tratava de leite.
RELATO DE CASO
Mulher de 28 anos, nulípara, não fumante e sem comorbidades, procurou-nos para reconstrução tardia da mama direita. Aos 25 anos, ela foi diagnosticada com carcinoma ductal invasivo na mama direita, Grau 3, cT3N2aM0, CS-IIIA (imuno-histoquímica: Ki67+; escore HER2 3+; RE-; RP-).
Ela recebeu quatro ciclos de quimioterapia neoadjuvante com adriamicina e ciclofosfamida durante dois meses. Quatro ciclos adicionais de consolidação de paclitaxel e trastuzumabe foram realizados. Após a quimioterapia, ela foi submetida a MRM, linfadenectomia axilar e reconstrução mamária imediata com expansor de tecido. O exame anatomopatológico revelou carcinoma invasivo grau II com margens claras, sem invasão angiolinfática, focos de carcinoma in situ e sem infiltração papilar. Cinco linfonodos foram examinados e todos estavam normais. Não houve menção ao tamanho do tumor; apenas o estadiamento final foi mencionado (ypT1bN0M0).
Logo após o término da expansão, a paciente recebeu quimioterapia de manutenção com trastuzumabe (completando 18 doses) e radioterapia adjuvante. Ela recebeu radioterapia externa com um acelerador linear de 6MV usando uma técnica 3D. A dose adjuvante prescrita foi de 50,4Gy na mama direita e fossa supraclavicular (frações de 180cGy). O tratamento foi interrompido no último dia devido a radiodermatite após a administração de uma dose total de 48,6Gy. Segundo o laudo, ela evoluiu com o agravamento da radiodermatite; o expansor extrudiu e foi, portanto, removido.
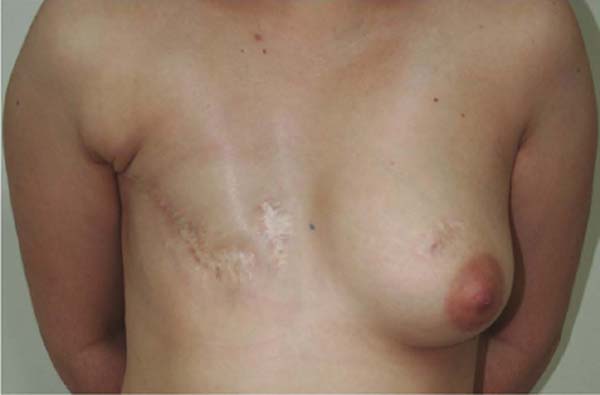
Ela nos procurou após 18 meses de mastectomia para reconstrução mamária tardia (Figura 1). Foi realizado um procedimento RLD com a colocação de um implante texturizado de 320ml (Silimed™, Natural, projeção extra-alta).
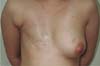
Ela ficou satisfeita com o resultado um ano após a cirurgia e não desejou procedimentos de simetrização das mamas (Figura 2). Em seguida, foi realizada a reconstrução do CAP. A aréola foi reconstruída com enxerto de pele total da coxa medial e a papila foi reconstruída com enxerto da porção caudal da papila contralateral. A paciente residia em outra cidade e não retornou para acompanhamento após a retirada das suturas.
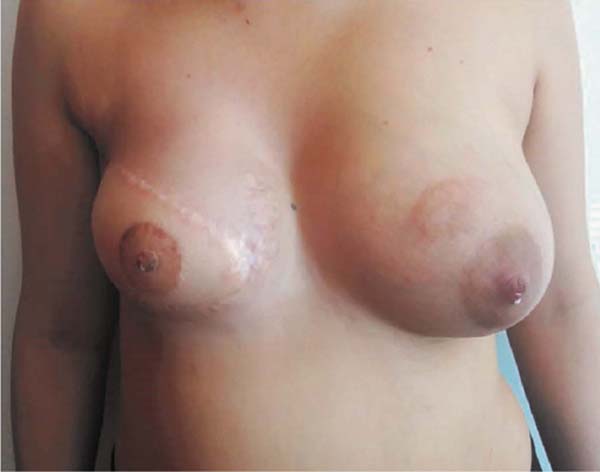
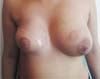
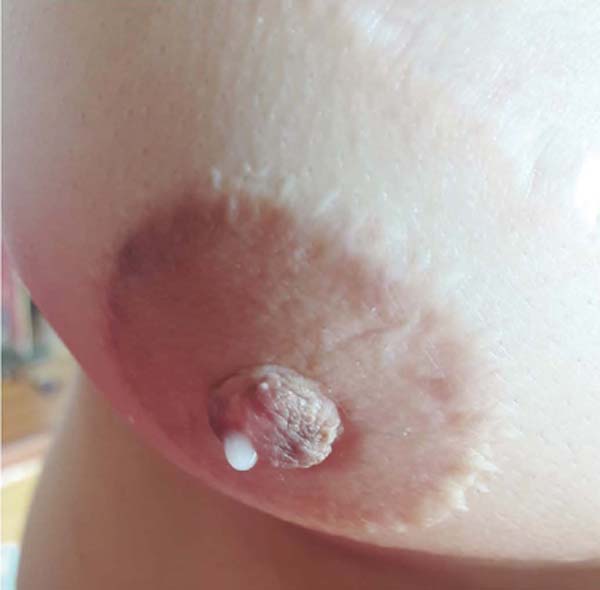
Ela entrou em contato conosco seis meses depois para nos informar que havia engravidado. Após o nascimento da criança, em fevereiro de 2020, ela voltou a nos contatar para relatar que o bebê mamava normalmente na mama esquerda, apesar da retirada da papila caudal, e que a mama direita produzia secreção láctea em pequena quantidade (Figuras 3 e 4, Vídeo 1).
Devido ao isolamento social imposto pela pandemia de COVID-19, a paciente não pôde retornar para exames de imagem. A paciente relatou amamentação contínua por cinco meses até julho de 2020.
DISCUSSÃO
A amamentação é inversamente proporcional à quantidade de tecido removido após a redução da mama2,3. Quando todo o tecido mamário é removido, a produção de leite não é esperada2.
Madeira et al.4 descreveram uma paciente com síndrome de Poland submetida a RLD e reconstrução com implante. Cinco anos depois, ela engravidou e amamentou com sucesso. No entanto, essa paciente pode ter exibido restos rudimentares de tecido mamário conectado ao CAP4. Por outro lado, nossa paciente foi submetida a mastectomia radical, radioterapia e reconstrução do CAP sobre a ilha cutânea do RLD.
Sakai & Sakai5 descreveram uma técnica de compartilhamento de mamilo que consiste em colher a camada externa do mamilo doador e enrolar esse tecido em forma de espiral antes de enxertá-lo. Esperase que essa técnica viabilize a amamentação, pois visa preservar a anatomia da doadora. No nosso caso, no entanto, a porção caudal da papila foi utilizada, reduzindo a probabilidade de amamentação. No entanto, alguns ductos podem ter sido deixados sem corte, permitindo a ejeção do leite.
A sucção do CAP pelo bebê estimula suas terminações nervosas a secretar prolactina e ocitocina, induzindo assim a produção e ejeção do leite1. Podese supor que o fragmento de papila contralateral enxertado na mama reconstruída produziu secreção láctea em resposta a estímulos hormonais, pois é a única estrutura saindo do tecido mamário. Isso, no entanto, contradiz o entendimento atual da fisiologia da lactação. Devido à raridade dessa situação, os cirurgiões devem estar abertos a teorias alternativas, incluindo morfologia da construção, bioeletricidade e campo morfogenético6,7.
CONCLUSÃO
MRM, irradiação, reconstrução total da mama com RLD em conjunto com o implante e reconstrução do CAP sobre a ilha cutânea do RLD tornam improvável a produção de secreção láctea. Pesquisas adicionais são necessárias para elucidar essa ocorrência incomum.
REFERÊNCIAS
1. Karimi FZ, Sadeghi R, Maleki-Saghooni N, Khadivzadeh T. The effect of mother-infant skin to skin contact on success and duration of first breastfeeding: A systematic review and meta-analysis. Taiwan J Obstet Gynecol. 2019;58(1):1-9. DOI: 10.1016/j.tjog.2018.11.002
2. Kraut RY, Brown E, Korownyk C, Katz LS, Vandermeer B, Babenko O, et al. The impact of breast reduction surgery on breastfeeding: Systematic review of observational studies. PLoS One. 2017;12(10):e0186591. DOI: 10.1371/journal.pone.0186591
3. Alipour S. Local Complications of Breast Surgery during Pregnancy and Lactation. Adv Exp Med Biol. 2020;1252:101-5. DOI: 10.1007/978-3-030-41596-9_13
4. Madeira EB, de França JC, de Sousa Almeida Filho B, Araújo AL, Vieira SC. Normal Breastfeeding after Breast Reconstruction in a Patient with Poland’s Syndrome. Breast Care (Basel). 2011;6(6):479-81. DOI: 10.1159/000335223
5. Sakai S, Sakai S. New nipple-sharing technique without damaging breastfeeding functionality of donor site, and spiral graft to Reconstructed Breast area. Ann Breast Cancer Res. 2021;5(1):1018. DOI: 10.47739/2641-7685/1018
6. Levin M, Martyniuk CJ. The bioelectric code: An ancient computational medium for dynamic control of growth and form. Biosystems. 2018;164:76-93. DOI: 10.1016/j.biosystems.2017.08.009
7. Tamborini M. Challenging the Adaptationist Paradigm: Morphogenesis, Constraints, and Constructions. J Hist Biol. 2020;53(2):269-94. DOI: 10.1007/s10739-020-09604-7
1. Universidade Federal de São Paulo, São Paulo, SP, Brasil.
2. Universidade do Vale do Sapucaí, Pouso Alegre, MG, Brasil.
Autor correspondente: Daniela Francescato Veiga Av. Prefeito Tuany Toledo, 470, Fatima, Pouso Alegre, MG, Brasil CEP: 37550-000 E-mail: danielafveiga@gmail.com
Artigo submetido: 29/03/2022.
Artigo aceito: 15/03/2023.
Conflitos de interesse: não há.








 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter