

Original Article - Year 2023 - Volume 38 -
Efeito do bevacizumabe na viabilidade de retalho inguinal livre em ratos
Bevacizumab effect on viability of free groin flaps in rats
RESUMO
Introdução: Bevacizumabe é um dos fármacos mais utilizados no tratamento do câncer. Existem evidências de que drogas antiangiogênicas reduzem a taxa de sobrevivência dos retalhos, porém não está claro se isso se aplica ao bevacizumabe. Investigamos o efeito de bevacizumabe na viabilidade de retalhos livres em ratos.
Método: Os animais foram randomizados em três grupos. O grupo Enxerto recebeu injeção intravenosa de soro fisiológico 0,9% (SF 0,9%) e foi submetido a uma enxertia de pele total. Os grupos Retalho-SF e Retalho-BVZ foram submetidos a retalhos inguinais livres e receberam injeções intravenosas, respectivamente, de SF 0,9% e Bevacizumabe.
Resultados: O grupo Enxerto apresentou menor percentual de área de retalho viável (22,81%) em relação ao grupo Retalho-SF (83,98%; p<0,0001) e Retalho-BVZ (60,50%; p=0,0048). Os pedículos do grupo Retalho-BVZ apresentaram menor patência, mas a diferença em relação ao grupo Retalho-SF não foi significante (artérias, p=0,0867; veias, p=0,9999). A ocorrência de necrose foi significativamente maior nos grupos Enxerto (87,50%) e Retalho-BVZ (60,00%) em relação ao grupo Retalho-SF (0%) (p=0,0010). A ocorrência de inflamação foi menor no grupo Retalho-SF (33,33%) em relação aos grupos Enxerto (87,5%) e Retalho-BVZ (70,00%), porém essa análise não atingiu significância (p=0,0588). Não houve diferenças significantes na ocorrência de hemorragia ou trombose intraluminal entre os grupos.
Conclusão: O aumento da inflamação, redução da patência e das áreas viáveis dos retalhos, apesar de não significantes, corroboram com efeitos deletérios do bevacizumabe evidenciados na análise histológica e demandam futuros estudos dos potenciais efeitos adversos da droga.
Palavras-chave: Bevacizumabe; Retalhos cirúrgicos; Retalhos de tecido biológico; Sobrevivência de tecidos; Ratos; Microcirurgia
ABSTRACT
Introduction: Bevacizumab is among the most frequently used drugs in cancer treatment. There is evidence that some anti-angiogenic drugs reduce flap survival, but it is unclear whether this applies to Bevacizumab. We investigated the effect of Bevacizumab on the viability of free flaps in rats.
Method: The animals were randomly assigned to one of three groups. The Graft group received intravascular saline and was submitted to a full-thickness skin graft. The Flap-Saline and the Flap- BVZ groups underwent a free groin flap after receiving, respectively, intravascular saline solution or intravascular administration of Bevacizumab.
Results: The Graft group showed a lower percentage of the viable area (22.81%) relative to the Flap- Saline (83.98%; p<0.0001) and the Flap-BVZ groups (60.50%; p=0.0048). The lowest vascular pedicle patency was observed in the Flap-BVZ group, but the difference relative to the Flap-Saline was not significant (arteries, p=0.0867; veins, p=0.9999). A significant difference was observed in the occurrence of necrosis (p=0.0010), which was higher in the histological samples of the Graft (87.50%) and the Flap- BVZ (60.00%) relative to the Flap-Saline Group (0%). Inflammation occurred less frequently in the Flap-Saline (33.33%) compared to the Graft (87.5%) and Flap- BVZ group (70.00%), but the difference did not reach significance (p=0.0588). No significant differences emerged in the occurrence of hemorrhage or intraluminal thrombosis.
Conclusion: The increase in inflammation, decrease in patency and reduction of viable area, though not significant, are in line with the histological analysis and call for further research on the potential adverse effects of the drug.
Keywords: Bevacizumab; Surgical flaps; Free tissue flaps; Tissue survival; Rats; Microsurgery
INTRODUÇÃO
A angiogênese é um processo que ocorre fisiologicamente durante períodos de crescimento tecidual, reparo tecidual ou no ciclo reprodutivo. Esse processo é regulado pelo equilíbrio entre fatores pró-angiogênicos e antiangiogênicos e resulta na formação de novos vasos sanguíneos. O crescimento tumoral e a metástase são altamente dependentes do processo angiogênico1, 2, 3, 4. Folkmann foi pioneiro ao estabelecer, no início da década de 1970, a dependência do crescimento tumoral sólido da angiogênese, incentivando assim mais pesquisas sobre agentes antiangiogênicos como uma opção para o tratamento do câncer5.
O Vascular Endothelial Growth Factor (VEGF) tem sido implicado como uma das principais proteínas pró-angiogênicas secretadas pelo tumor que atuam sobre o tecido circundante e levam à formação de novos vasos. Esse estado neovascularizado favorece o crescimento do tumor e sua passagem de uma fase latente para uma fase metastática3, 4. Consequentemente, drogas que bloqueiam a sinalização da angiogênese, especialmente anticorpos anti-VEGF, estão entre as drogas antiangiogênicas mais utilizadas no tratamento de alguns dos tumores mais prevalentes3, 4.
Bevacizumabe (Avastin®, Genentech) foi o primeiro inibidor de angiogênese aprovado pela FDA, o que ocorreu em 2004. Foi inicialmente usado para tratar câncer colorretal metastático e posteriormente associado ao 5-fluorouracil para tratar câncer de mama, pulmão, ovário e glioblastoma3, 4. Liga-se seletivamente à isoforma VEGF-A, impedindo sua ligação aos seus receptores de tirosina quinase (VEGFR-1 e 2), evitando assim o início da cascata angiogênica no tumor3, 4, 6.
Bevacizumabe (BVZ) tem vários efeitos colaterais e tem sido implicado em complicações na cicatrização de feridas, como deiscência, hematomas, sangramento e infecções. Alguns pacientes apresentam essas complicações mesmo seguindo a recomendação de aguardar 28 dias após a cirurgia para reiniciar a administração do BVZ7, 8.
Até onde sabemos, os efeitos das drogas antiangiogênicas na viabilidade do retalho livre em humanos ainda não foram investigados. Esses efeitos foram estudados em modelos animais, mas apenas em retalhos aleatórios. Dobryansky et al.9 concluíram que a administração prévia de endostatina (inibidor da angiogênese) em camundongos causou uma diminuição estatisticamente significativa nas taxas de sobrevivência de retalhos cutâneos randômicos.
O número de pacientes diagnosticados com câncer tem aumentado em todo o mundo. Por exemplo, os relatórios globais de câncer registraram 18 milhões de novos casos e 9 milhões de mortes relacionadas à doença em 201710. A alta incidência da doença associada ao uso crescente de drogas antiangiogênicas aumenta a probabilidade de que os pacientes com câncer eventualmente precisem de cirurgia reconstrutiva urgente ou reimplante.
Essa cirurgia pode ser necessária por diferentes razões, incluindo o tratamento do câncer. Vale ressaltar que a microcirurgia reconstrutiva revolucionou o tratamento de lesões complexas, algumas antes consideradas irreparáveis. Diferentes estratégias de reconstrução tornaram-se disponíveis para tratar o câncer com uma única cirurgia, transferindo diferentes tipos de tecidos de uma área doadora saudável para o local afetado, promovendo melhores resultados funcionais e diminuindo a incidência de amputações de membros11.
OBJETIVO
O presente estudo teve como objetivo avaliar o efeito da administração prévia de BVZ na viabilidade de retalhos inguinais livres em ratos e anastomoses microvasculares.
MÉTODO
Animais
Trinta ratos Wistar machos adultos (207-391g) foram usados no estudo. Este modelo animal oferece diversas vantagens, como o tamanho favorável de manejo do animal e sua alta resistência a infecções e traumas cirúrgicos. Além disso, tem sido amplamente utilizado na literatura12, 13, 14, 15 e sua adoção facilita a análise comparativa. O protocolo do estudo foi aprovado pelo Comitê de Pesquisa Animal da Universidade Federal do Ceará (Protocolo nº 126/2016) de acordo com a legislação.
Antes de serem operados, os animais foram mantidos em gaiolas confortáveis com espaço para quatro animais adultos, livre acesso a ração e água, e sob ciclo claro-escuro de 12/12 horas (luzes acesas às 5h). Todos os procedimentos cirúrgicos foram realizada após injeção anestésica intraperitoneal de uma mistura de cetamina (80mg/kg) e xilazina (10mg/kg).
Todos os ratos foram alojados individualmente após a cirurgia e receberam um protetor pós-operatório para roedores, conforme descrito por Westin & Hedén16 para prevenir a canibalização do retalho (Figura 1).

Design experimental
Trata-se de um estudo experimental randomizado com análise comparativa da viabilidade de retalho livre e enxerto de pele nos seguintes grupos, cada um com 10 animais. O grupo Enxerto foi submetido a enxertia de pele de espessura total na região da virilha, recebendo infusão intravenosa de 0,5mL de soro fisiológico sete dias antes do procedimento. Os ratos do grupo Flap-Saline foram submetidos a retalho livre na virilha após infusão intravenosa de 0,5mL de solução salina sete dias antes do procedimento. Por fim, os animais do grupo BVZ-Flap foram tratados com BVZ na dose de 5mg/kg diluída em 0,5mL de solução salina sete dias antes do procedimento de retalho inguinal livre.
Todos os tratamentos (BVZ ou solução salina) foram administrados por via intravenosa na veia lateral da cauda.
Modelo de retalho
O procedimento cirúrgico baseou-se em um retalho livre de pele na virilha. Uma área circular de 3×3cm foi demarcada na virilha e levantada como um retalho de pele com base nos vasos epigástricos caudais superficiais direitos. O pedículo vascular foi dissecado realizando ligaduras com fio de náilon 7-0 e 8-0 em todos os ramos dos vasos femorais distais à emergência dos vasos epigástricos caudais superficiais: os ramos colaterais (vasos femorais caudais proximais e vasos geniculares proximais mediais) e a bifurcação distal dos vasos femorais (vasos poplíteo e safeno) foram ligados17. O fluxo sanguíneo do retalho vem do segmento proximal da artéria femoral e continua diretamente pela artéria epigástrica caudal superficial (Figura 1).
A veia epigástrica caudal superficial em direção à veia femoral proximal transporta a drenagem venosa. A artéria e a veia femoral foram clampeadas distalmente à ascensão dos vasos femorais profundos e proximal à saída dos vasos epigástricos caudais superficiais, cortadas e anastomoses microcirúrgicas foram realizadas (suturas interrompidas de náilon 10-0). A perfusão do retalho foi então avaliada verificando-se seu colo ou o sangramento de suas bordas.
O teste de esvaziamento e reenchimento (Acland) foi aplicado aos vasos para avaliar a perviedade. Se a perfusão do retalho fosse considerada comprometida, a anastomose responsável era identificada por meio do teste de Acland, excisada e refeita. A sutura da pele foi realizada com pontos contínuos de mononáilon 5-0. O grupo Enxerto foi submetido ao mesmo procedimento descrito acima, mas as anastomoses não foram realizadas para comparar as taxas de sobrevivência do enxerto com o retalho.
Todos os procedimentos foram realizados pelo mesmo cirurgião (primeiro autor) por meio da técnica padronizada descrita acima.
Monitoramento de retalhos
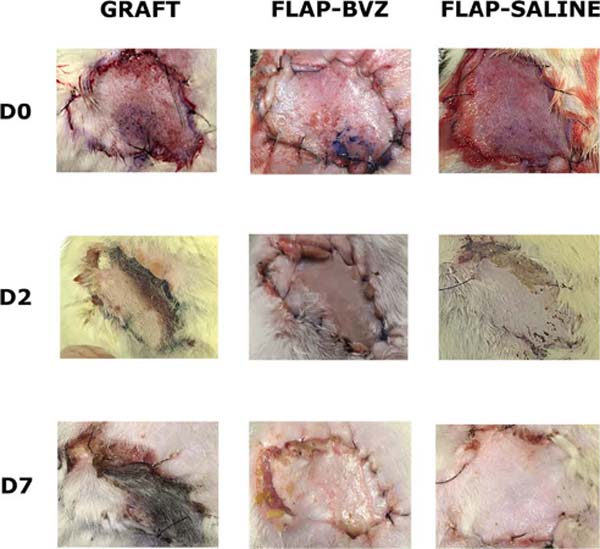
Os ratos foram avaliados nos dias 0, 2 e 7 quanto à sobrevivência, cor e textura do retalho ou enxerto de pele. A avaliação consistiu em análise macroscópica (realizada nos dias 0, 2 e 7) e análise histológica (realizada após o sacrifício dos animais no dia 7).
Os animais foram novamente anestesiados no dia 7, e uma câmera digital de alta resolução (12 megapixels) foi usada para obter fotografias coloridas padronizadas com 3024 × 4032 pixels, que permitiram a medição da área de necrose e deiscência por meio de software de computador (Image J versão 1.52a)18.
Primeiro, o software mediu a área total da retalho em pixels. Em seguida, foi realizada a seleção manual das cores rosa e branca, consideradas tecidos viáveis. Áreas vermelhas ou pretas foram consideradas deiscência ou necrose e excluídas da segunda seleção. A área de tecido viável foi dividida pela área total do retalho e multiplicada por 100, resultando na porcentagem de tecido viável. Dois assistentes de pesquisa “cegos” realizaram as medições separadamente e as médias das duas medições foram analisadas.
Além disso, os animais de Flap-BVZ e Flap-Saline foram reoperados no dia 7, e seu pedículo vascular foi explorado para perviedade. O teste de esvaziamento e reenchimento (teste de Acland) foi realizado e registrado e, posteriormente, os vasos foram seccionados distalmente à anastomose, com o registro da presença de sangramento nos vasos pérvios.
Análise histológica
Os animais foram sacrificados no sétimo dia após a cirurgia com alta dose de cetamina (240mg/kg) e xilazina (30mg/kg). A área do retalho e um pequeno segmento, incluindo a região das anastomoses da artéria e veia femoral, foram excisados e fixados com formol a 10% para inclusão em parafina. Os animais submetidos ao procedimento de enxertia de pele (grupo Enxerto) tiveram apenas a área de pele enxertada colhida. Os tecidos embebidos em parafina foram seccionados em fatias de 5 μm e preparados para coloração com hematoxilina/eosina.
Foram feitos esforços para posicionar os vasos verticalmente nos blocos de parafina, realizando cortes axiais, possibilitando medir, sob microscopia de luz, a espessura da camada da parede vascular e registrar a presença de trombose intraluminal. Todas as preparações foram observadas, pontuadas e avaliadas por um anatomopatologista experiente e “cego”.
Fotografias padronizadas de lâminas de segmentos arteriais foram realizadas com câmera de microscopia digital de alta resolução e, por meio de software de computador (Image J)18, foram medidas as camadas da parede vascular para investigação de hiperplasia intimal.
As amostras de pele eram triangulares, com pedículos em ângulos inferiores. Foram feitos quatro cortes: zona do pedículo, zona intermediária, zona da derme profunda e derme superficial associada à zona da epiderme. O patologista classificou esses cortes de amostra, classificando os achados de necrose e inflamação como ausentes, leves, moderados ou intensos. O patologista classificou a presença de hemorragia como presente ou ausente.
Análise estatística
As medidas de viabilidade do retalho e espessura da artéria do pedículo vascular, que eram variáveis contínuas, foram inicialmente analisadas pelo teste de Shapiro-Wilk para verificar a normalidade da distribuição. Como esse requisito foi atendido para ambas as variáveis, foram calculadas estatísticas descritivas (média e desvio padrão) e métodos paramétricos foram usados.
As comparações entre os grupos Graft, Flap-SF e Flap-BVZ em relação à porcentagem de área de tecido viável foram feitas por meio de uma análise de variância (ANOVA) unidirecional. Sempre que a ANOVA indicou diferenças significativas, testes de comparações múltiplas de Tukey foram realizados para verificar diferenças entre os pares de grupos. Um teste t não pareado comparou os grupos Flap-SF e Flap-BVZ quanto à espessura da parede arterial do pedículo vascular.
Variáveis ordinais, intensidade de necrose e medidas de inflamação em preparações histológicas foram expressas como mediana, intervalo interquartil e valores mínimo e máximo. As comparações entre os grupos Graft, SF-Flap e BVZ-Flap em relação a essas variáveis foram feitas por meio do teste de Kruskal-Wallis, complementado pelos testes de comparações múltiplas de Dunn, para verificar diferenças entre os grupos aos pares.
Variáveis categóricas, como a ocorrência nas preparações histológicas de necrose, inflamação e hemorragia nos retalhos ou enxertos e trombose intraluminal no pedículo vascular, bem como os testes de esvaziamento e reenchimento e sangramento na artéria e veia de do pedículo vascular, foram expressos em frequência absoluta e relativa. Essas variáveis foram analisadas pelo teste exato de Fisher e pelo teste Qui-quadrado.
Todas as análises empregaram testes bicaudais com o nível de significância definido em p<0,05. GraphPad Prism 8.0 (GraphPad Software, San Diego, Califórnia, EUA) foi usado para realizar a análise estatística e plotar os gráficos.
RESULTADOS
Inicialmente, 30 animais foram operados. No entanto, 7 animais desprenderam o colete protetor e canibalizaram o retalho; eles foram, portanto, removidos do estudo. Após obter a aprovação do Comitê de Pesquisa Animal, 7 novos animais foram aleatoriamente designados para um grupo com perdas. Um animal do grupo Enxerto faleceu no pós-operatório imediato, possivelmente devido a complicações anestésicas ou sangramento. Então, dos 29 animais restantes, 10 pertenciam ao grupo Flap-SF, 10 ao grupo Flap-BVZ e 9 ao grupo Enxerto.
Medição macroscópica da sobrevivência do tecido
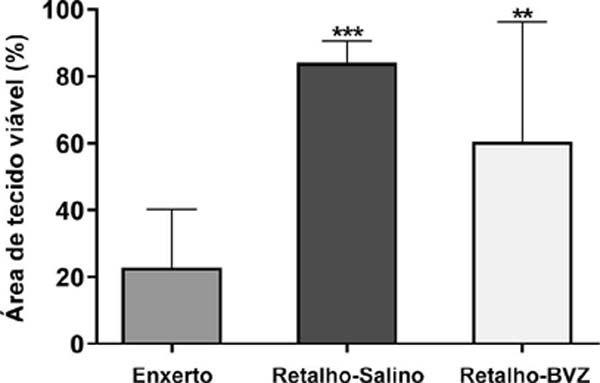
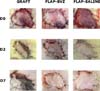
A ANOVA mostrou diferença estatisticamente significativa entre os grupos no percentual de viabilidade tecidual. O grupo Enxerto teve uma porcentagem significativamente menor de área de tecido viável do que os outros dois grupos (média ± desvio padrão: 22,81±17,33%). O Grupo Flap-BVZ (60,50±35,87%) apresentou menor percentual de área de tecido viável em relação ao Grupo Flap-Saline (83,98±6,54%), mas essa diferença não foi estatisticamente significativa (Figura 2). A Figura 3 mostra a evolução macroscópica geral da viabilidade do retalho ou enxerto de pele de animais selecionados em cada grupo nos dias 0, 2 e 7.
Testes de patência
O teste de esvaziamento e reenchimento (teste de Acland) foi positivo, mostrando perviedade em maior percentual de artérias (100%) e veias (90%) dos animais do grupo Flap-Saline em relação ao Grupo Flap-BVZ. Neste último, 60% das artérias e 80% das veias foram consideradas pérvias. A diferença não foi estatisticamente significativa nem para artérias (p=0,0867) nem veias (p=0,999).
O teste de sangramento (secção do pedículo e observação do sangramento) foi coincidente com o teste de Acland, confirmando menor percentual de patência em artérias (60%) e veias (80%) do grupo Flap-BVZ em relação ao Flap-Saline (perviedade confirmada em 100% das artérias e 90% das veias). Essa diferença não foi significativa.
Análise histológica
Devido a problemas operacionais durante a coleta ou preparação das lâminas, foi impossível analisar 2 das 29 amostras coletadas (uma do grupo Graft; uma do grupo Flap-Saline). Restaram, portanto, 27 amostras, assim distribuídas: 10 do grupo Flap-BVZ, 9 do grupo Flap-SF e 8 do grupo Enxerto.
As amostras de pele do retalho foram analisadas separadamente em quatro seções (epiderme e derme, derme profunda, zona intermediária e pedículo vascular). O anatomopatologista descreveu o grupo
Flap-Saline como apresentando vasos pérvios e, na maioria de suas amostras, ausência de necrose ou infiltrados inflamatórios (Figura 4).
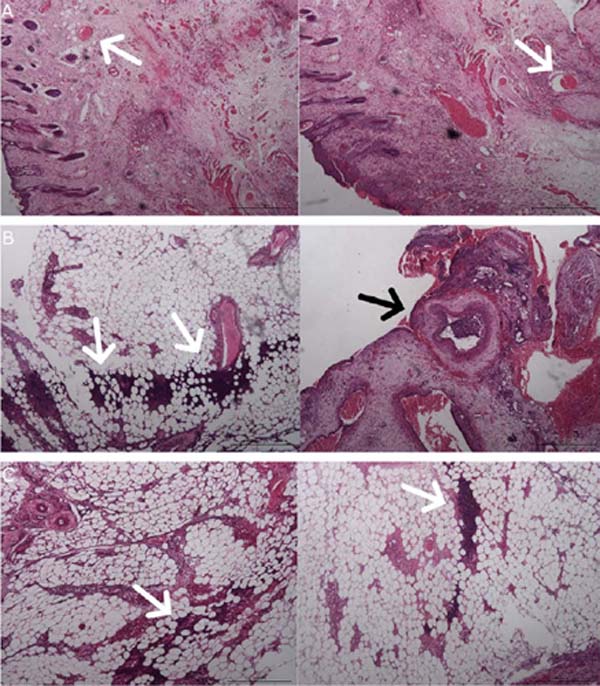
As amostras do grupo Flap-BVZ apresentaram alguns vasos trombosados e maior número de focos de necrose com infiltrados inflamatórios difusos (Figura 4).
As amostras do grupo Enxerto apresentaram maior intensidade de focos de necrose e infiltrados inflamatórios que os demais grupos, estendendo-se por toda a profundidade dos diferentes cortes (Figura 4). Alguns vasos dos animais do grupo Enxerto também foram trombosados.
A classificação da intensidade de necrose e infiltrados inflamatórios mostrou intensidade significativamente maior de necrose e inflamação no grupo Enxerto em comparação com o grupo Flap-Saline (p=0,0015 e p=0,0279, respectivamente). O grupo Flap -BVZ apresentou intensidade mediana de necrose e inflamação maior que o grupo Flap-Saline, mas essa diferença foi insignificante (Figura 5).
Análises adicionais foram realizadas nas quais os parâmetros histopatológicos foram avaliados considerando apenas a presença ou ausência de necrose, inflamação e hemorragia. Necrose significativamente maior ocorreu nos grupos Enxerto e Flap-BVZ em comparação com o Grupo Flap-Saline (Tabela 1).
| Grupos | Necrose | Total | |
|---|---|---|---|
| Presente | Ausente | ||
| Enxerto | 7 (87,50%) | 1 (12,50%) | 8 (100,00%) |
| Flap-Saline | 0 (0,00%) | 9 (100,00%) | 9 (100,00%) |
| Flap-BVZ | 6 (60,00%) | 4 (40,00%) | 10 (100,00%) |
| Total | 13 | 14 | 27 |
Dados expressos em frequência absoluta e relativa (percentagem) de observação de 8 animais do grupo Enxerto, 9 ratos do grupo Flap-Saline e 10 animais do grupo Flap-BVZ. O teste Qui-quadrado foi utilizado para investigar a ocorrência de necrose entre os três grupos. A ocorrência de necrose foi significativamente maior no grupo Enxerto e Flap-BVZ do que no grupo Flap-Saline (p=0,001).
A ocorrência de inflamação foi menor no grupo Flap-Saline do que nos grupos Graft e Flap-BVZ, mas com significância marginal (p=0,0588) (Tabela 2).
| Grupos | Infiltrados | Total | |
|---|---|---|---|
| Presente | Ausente | ||
| Enxerto | 7 (87,50%) | 1 (12,50%) | 8 (100,00%) |
| Flap-Saline | 3 (33,33%) | 6 (66,67%) | 9 (100,00%) |
| Flap-BVZ | 7 (70,00%) | 3 (30,00%) | 10 (100,00%) |
| Total | 17 | 10 | 27 |
Dados expressos em frequência absoluta e relativa (percentagem) de observação de 8 animais do grupo Enxerto, 9 ratos do grupo Flap-Saline e 10 animais do grupo Flap-BVZ. O teste Qui-quadrado foi utilizado para comparar os três grupos quanto à ocorrência de inflamação. Não houve diferenças estatisticamente significativas entre os três grupos quanto à ocorrência de inflamação. No entanto, as diferenças observadas podem ser consideradas marginalmente significativas (p=0,0588).
Não foram encontradas diferenças significativas entre os três grupos na ocorrência de hemorragia.
Não houve diferença estatística entre os grupos Flap-Saline e Flap-BVZ quanto à ocorrência de trombose intraluminal nos vasos do pedículo. A medida das paredes arteriais dos diferentes grupos também não apresentou diferença significativa.
DISCUSSÃO
No presente estudo, retalhos livres inguinais foram realizados em ratos para analisar a influência do BVZ na viabilidade desses retalhos e seus efeitos no pedículo vascular, especificamente na região das anastomoses. Observou-se diferença significativa histologicamente na ocorrência de necrose. Isso não reduziu significativamente a porcentagem de tecido viável do retalho macroscópico ou a patência do pedículo vascular. No entanto, as diferenças entre os grupos nessas medidas apontaram todas na mesma direção da análise histológica.
Múltiplos estudos em animais modelos, geralmente usando ratos, camundongos e coelhos, avaliaram o efeito de drogas antiangiogênicas na cicatrização de feridas. Essas drogas foram inicialmente alegadas como tendo efeitos deletérios no fechamento de feridas, mas alguns estudos subsequentes concluíram que a inibição parcial da angiogênese pode reduzir a formação de tecido cicatricial, diminuindo a incidência de cicatrizes hipertróficas e proporcionando melhores resultados cosméticos19, 20.
A literatura aponta vários efeitos adversos do bevacizumabe (BVZ) na cicatrização de feridas. Hematomas, sangramento, deiscência e infecção estão entre os mais comumente relatados7, 8. No entanto, até onde sabemos, nenhuma pesquisa está avaliando a influência do BVZ nos retalhos. Dobryansky et al.9 examinaram a influência de uma droga antiangiogênica em retalhos cutâneos randômicos, mas a endostatina foi a droga administrada como inibidora da angiogênese.
A literatura mostra grande divergência quanto à dosagem de BVZ utilizada em ratos. Acun et al.21 concluíram que uma dose de 2,5mg/kg de BVZ administrada por via intraperitoneal foi suficiente para prevenir a formação de aderências intraperitoneais. Outro estudo mostrou que essa dose é eficaz na regressão das lesões endometrióticas peritoneais22. Outros autores têm utilizado doses variando entre 2,5 e 10mg/kg de BVZ por via intraperitoneal, repetindo a dose diariamente ou semanalmente23, 24. Divergências também ocorrem quando a via intravenosa de administração é escolhido: Stegmayr et al.25 utilizaram doses maiores, de 10 a 45mg/kg, enquanto Thorn et al.26 empregaram dose única de 1 mg/kg. Uma dose única de 5mg/kg de BVZ administrada por via intravenosa foi adotada neste estudo, seguindo Sperling et al.27.
Uma dose mais alta pode alterar significativamente algumas análises dos efeitos do BVZ em retalhos livres em pesquisas futuras.
No presente estudo, observamos menor percentual de sobrevida de tecido viável no grupo Enxerto em relação aos grupos Flap-BVZ e Flap-Saline, mas a diferença entre os dois últimos grupos foi insignificante. A porcentagem de “pega” do Enxerto, denominação dada à área que evolui sem necrose quando um enxerto de pele é realizado em humanos, é de cerca de 70-100% de sobrevivência do tecido28, 29, 30.
No entanto, essa alta taxa de sobrevivência não é obtida em modelos de ratos, que têm uma porcentagem de “pega” mais baixa, de cerca de 20 a 30% de sobrevivência do enxerto. Esse menor índice provavelmente se deve à dificuldade de imobilização dos animais no pós-operatório12, 31, 32. O achado do grupo Enxerto, com média de 22,81% de tecido viável, é compatível com os resultados observados nos estudos citados anteriormente12, 31, 32. O percentual médio de 83,98% de área viável do grupo Flap-Saline também concorda com a literatura, em que a taxa média de sobrevivência do retalho livre da virilha varia de 75-90% da área33, 34, 35.
No presente estudo, o grupo tratado com BVZ no pré-operatório apresentou percentual de tecido viável de 60,50%, comparado a 83,98% do grupo Flap-Saline. No entanto, essa diferença não foi estatisticamente significativa. Dobryansky et al.9 investigaram a influência da endostatina na sobrevida do retalho randômico dorsal em camundongos. Vinte camundongos foram divididos em dois grupos principais: Grupo I, que recebeu endostatina no pré-operatório, e Grupo II, que recebeu solução salina no pré-operatório. Este último foi considerado um grupo controle. O percentual de sobrevida do retalho no nono dia de pós-operatório no Grupo I foi de 20%, significativamente menor do que o percentual observado no Grupo II controle (100%). O efeito aparentemente deletério do BVZ no retalho neste estudo é menor do que o efeito da endostatina relatado por Dobryansky et al.9.
No nosso estudo, as mesmas taxas de perviedade foram obtidas no teste de esvaziamento e reenchimento (teste de Acland) e no teste de sangramento. Perviedade de 100% das anastomoses arteriais e 90% das anastomoses venosas foram encontradas no grupo Flap-Saline. Esses valores são compatíveis com os encontrados na literatura, que mostra que a perviedade em retalhos inguinais livres em ratos é de cerca de 70 a 100%13, 14, 33.
O grupo Flap-BVZ apresentou menor perviedade de seu pedículo vascular no pós-operatório do que o grupo Flap-Saline. Tanto o teste de Acland quanto o de sangramento mostraram perviedade em 60% das artérias e 80% das veias. Essa redução na patência observada no Flap-BVZ em relação ao grupo Flap-Saline chegou perto, mas não ficou abaixo do nível de significância. Como a diferença não alcançou significância, esses achados devem ser interpretados com cautela.
Não se pode excluir que o bevacizumabe imponha um efeito prejudicial na vascularização do retalho, prejudicando a perfusão e levando à necrose. Os achados quanto à ocorrência de necrose e inflamação corroboram essa possibilidade. No entanto, como enfatizamos, recomenda-se cautela devido às diferenças marginalmente significativas, e mais pesquisas são necessárias.
Este estudo tem limitações. Primeiro, o estudo exigiu o sacrifício de ratos Wistar no sétimo dia de pós-operatório.
Portanto, por razões éticas, o número de animais utilizados deve ser limitado ao mínimo necessário para uma avaliação estatística confiável.
O pequeno tamanho da amostra pode ter impedido que algumas análises que mostravam diferenças limítrofes alcançassem significância estatística. Futuros estudos com maiores quantidades de animais e maiores doses podem alcançar significância em algumas dessas análises.
Em segundo lugar, não pudemos usar outras tecnologias de monitoramento de retalho, como fluxometria a laser-Doppler ou angiografia com fluorescência de indocianina verde, devido a restrições operacionais. Optamos pela utilização de dois testes de patência amplamente empregados em estudos semelhantes ao nosso, isoladamente13,14 ou combinados com outras tecnologias33, 36.
Vale ressaltar que, nestes últimos estudos, os testes de patência e as demais tecnologias apresentaram resultados semelhantes, o que fala a favor de sua validade33, 36. Agora que nossos achados forneceram, pelo que sabemos pela primeira vez, uma indicação do potencial efeito deletério do BVZ, pesquisas futuras usando tecnologia adicional são justificadas. Particularmente relevantes seriam, por exemplo, estudos que incluíssem análise histológica do tecido do retalho com coloração imuno-histoquímica, o que poderia ajudar a avaliar a microvascularidade.
CONCLUSÃO
Em resumo, a administração prévia de BVZ causou maior necrose histológica e inflamação em retalhos inguinais livres em ratos, mas não houve redução significativa na porcentagem de sobrevivência do retalho e patência do pedículo vascular. No entanto, mais estudos são necessários para confirmar os resultados observados e estimar um período seguro de retirada do BVZ antes e após a realização desse tipo de procedimento.
REFERÊNCIAS
1. Stephenson JA, Morgan B, Al-Taan O, Dennison AR, Goddard JC. Tumour Angiogenesis: A Growth Area—From John Hunter to Judah Folkman and Beyond. J Cancer Res. 2013;2013:1-6. DOI: 10.1155/2013/895019
2. Risau W. Mechanisms of angiogenesis. Nature. 1997;386(6626):671-4. DOI: 10.1038/386671a0
3. Samant RS, Shevde LA. Recent advances in anti-angiogenic therapy of cancer. Oncotarget. 2011;2(3):122-34.
4. Chellappan DK, Leng KH, Jia LJ, Aziz NABA, Hoong WC, Qian YC, et al. The role of bevacizumab on tumour angiogenesis and in the management of gynaecological cancers: A review. Biomed Pharmacother. 2018;102:1127-44. DOI: 10.1016/j.biopha.2018.03.061
5. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285(21):1182-6. DOI: 10.1056/NEJM197111182852108
6. Zhang J, Gao B, Zhang W, Qian Z, Xiang Y. Monitoring antiangiogenesis of bevacizumab in zebrafish. Drug Des Devel Ther. 2018;12:2423-30. DOI: 10.2147/DDDT.S166330
7. Thornton AD, Ravn P, Winslet M, Chester K. Angiogenesis inhibition with bevacizumab and the surgical management of colorectal cancer. Br J Surg. 2006;93(12):1456-63. DOI: 10.1002/bjs.5624
8. Sharma K, Marcus JR. Bevacizumab and wound-healing complications: mechanisms of action, clinical evidence, and management recommendations for the plastic surgeon. Ann Plast Surg. 2013;71(4):434-40. DOI: 10.1097/SAP.0b013e31824e5e57
9. Dobryansky M, Galiano RD, Cetrulo CL Jr, Bhatt KA, Michaels J, Ashinoff R, et al. Endostatin inhibits ischemia-induced neovascularization and increases ischemic tissue loss. Ann Plast Surg. 2004;52(5):512-8; discussion 518. DOI: 10.1097/01.sap.0000123022.98361.c5
10. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. DOI: 10.3322/caac.21492
11. Wei FC, Mardini S, eds. Flaps and Reconstructive Surgery. Philadelphia: Saunders/Elsevier; 2009. DOI: 10.1016/B978-0-7216-0519-7.X0001-9
12. Werker PM, Kon M, Green C, Franken RJ, Overgoor ML. Survival characteristics of the epigastric free flap in DA-rats. Microsurgery. 1992;13(2):67-71. DOI: 10.1002/micr.1920130204
13. Tønseth KA, Tindholdt TT, Haga M, Hokland BM, Åbyholm FE. Free SIEA-flap transposition in a rat model with preservation of the limb circulation. Eur J Plast Surg. 2006;29(3):123-6. DOI: 10.1007/s00238-006-0067-9
14. Wallmichrath J, Baumeister RG, Gottschalk O, Giunta RE, Frick A. The free groin flap in the rat: a model for improving microsurgical skills and for microvascular perfusion studies. J Plast Surg Hand Surg. 2014;48(3):191-6. DOI: 10.3109/2000656X.2013.852100
15. Demir A, Acar M, Yldz L, Karacalar A. The effect of twisting on perforator flap viability: an experimental study in rats. Ann Plast Surg. 2006;56(2):186-9. DOI: 10.1097/01.sap.0000196561.92828.d7
16. Westin M, Hedén P Calcitonin gene-related peptide delays the no-reflow phenomenon in the rat island flap. Ann Plast Surg. 1988;21(4):329-34. DOI: 10.1097/00000637-198810000-00006
17. Kochi T, Imai Y, Takeda A, Watanabe Y, Mori S, Tachi M, et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 2013;8(12):e84047. DOI: 10.1371/journal.pone.0084047
18. Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 2012;9(7):671-5. DOI: 10.1038/nmeth.2089
19. Tonnesen MG, Feng X, Clark RA. Angiogenesis in wound healing. J Investig Dermatol Symp Proc. 2000;5(1):40-6. DOI: 10.1046/j.1087-0024.2000.00014.x
20. DiPietro LA. Angiogenesis and wound repair: when enough is enough. J Leukoc Biol. 2016;100(5):979-84. DOI: 10.1189/jlb.4MR0316-102R
21. Acun G, Ozdemir H, Sunamak O, Ozdemir ZU, Baskan E, Yazi M, et al. The Effect of Single-Dose Intraperitoneal Bevacizumab on Peritoneal Adhesion Formation. Rev Invest Clin. 2018;70(6):279-84. DOI: 10.24875/RIC.18002589
22. Soysal D, Kızıldağ S, Saatlı B, Posacı C, Soysal S, Koyuncuoğlu M, et al. A novel angiogenesis inhibitor bevacizumab induces apoptosis in the rat endometriosis model. Balkan J Med Genet. 2015;17(2):73-80. DOI: 10.2478/bjmg-2014-0077
23. Ozsoy Z, Ozsoy S, Gevrek F, Demir E, Benli I, Daldal E, et al. Effect of bevacizumab on acetic acid-induced ulcerative colitis in rats. J Surg Res. 2017;216:191-200. DOI: 10.1016/j.jss.2017.05.011
24. Aslan A, Kaya ZB, Bulduk EB, Ocal O, Ucar M, Erpolat OP, et al. Prophylactic Bevacizumab May Mitigate Radiation Injury: An Experimental Study. World Neurosurg. 2018;116:e791-e800. DOI: 10.1016/j.wneu.2018.05.094
25. Stegmayr C, Oliveira D, Niemietz N, Willuweit A, Lohmann P, Galldiks N, et al. Influence of Bevacizumab on Blood-Brain Barrier Permeability and O-(2-18F-Fluoroethyl)-l-Tyrosine Uptake in Rat Gliomas. J Nucl Med. 2017;58(5):700-5. DOI: 10.2967/jnumed.116.187047
26. Thorn M, Piche-Nicholas N, Stedman D, Davenport SW, Zhang N, Collinge M, et al. Embryo-fetal transfer of bevacizumab (Avastin) in the rat over the course of gestation and the impact of neonatal Fc receptor (FcRn) binding. Birth Defects Res B Dev Reprod Toxicol. 2012;95(5):363-75. DOI: 10.1002/bdrb.21026
27. Sperling J, Schäfer T, Ziemann C, Benz-Weiber A, Kollmar O, Schilling MK, et al. Hepatic arterial infusion of bevacizumab in combination with oxaliplatin reduces tumor growth in a rat model of colorectal liver metastases. Clin Exp Metastasis. 2012;29(2):91-9. DOI: 10.1007/s10585-011-9432-6
28. Landau AG, Hudson DA, Adams K, Geldenhuys S, Pienaar C. Full-thickness skin grafts: maximizing graft take using negative pressure dressings to prepare the graft bed. Ann Plast Surg. 2008;60(6):661-6. DOI: 10.1097/SAP.0b013e318146c288
29. Rao K, Tillo O, Dalal M. Full thickness skin graft cover for lower limb defects following excision of cutaneous lesions. Dermatol Online J. 2008;14(2):4.
30. Harvey I, Smith S, Patterson I. The use of quilted full thickness skin grafts in the lower limb--reliable results with early mobilization. J Plast Reconstr Aesthet Surg. 2009;62(7):969-72. DOI: 10.1016/j.bjps.2007.10.082
31. Zografou A, Tsigris C, Papadopoulos O, Kavantzas N, Patsouris E, Donta I, et al. Improvement of skin-graft survival after autologous transplantation of adipose-derived stem cells in rats. J Plast Reconstr Aesthet Surg. 2011;64(12):1647-56. DOI: 10.1016/j.bjps.2011.07.009
32. Zhang F, Oswald TM, Lin L, Wang S, Lin S, Lineaweaver WC. Improvement of full-thickness skin graft survival by application of vascular endothelial growth factor in rats. Ann Plast Surg. 2008;60(5):589-93. DOI: 10.1097/SAP.0b013e31816d78fe
33. van Adrichem LN, Hoegen R, Hovius SE, Kort WJ, van Strik R, Vuzevski VD, et al. The effect of cigarette smoking on the survival of free vascularized and pedicled epigastric flaps in the rat. Plast Reconstr Surg. 1996;97(1):86-96. DOI: 10.1097/00006534-199601000-00015
34. Casal D, Pais D, Iria I, Mota-Silva E, Almeida MA, Alves S, et al. Model of Free Tissue Transfer: The Rat Epigastric Free Flap. J Vis Exp. 2017;15(119):55281. DOI: 10.3791/55281
35. Parsa FD, Spira M. Evaluation of anastomotic techniques in the experimental transfer of free skin flaps. Plast Reconstr Surg. 1979;63(5):696-9. DOI: 10.1097/00006534-197905000-00014
36. Cuadros CL. One hundred percent patency of one-millimeter polytetrafluoroethylene (Gore-tex) grafts in the carotid arteries of rats. Microsurgery. 1984;5(1):1-11. DOI: 10.1002/micr.1920050102
1. Instituto Dr José Frota, Departamento de Cirurgia da Mão e Microcirurgia, Fortaleza,
CE, Brasil.
2. Universidade Federal do Ceará, Faculdade de Medicina, Unidade de Farmacologia Clínica,
Núcleo de Pesquisa e Desenvolvimento de Medicamentos, Fortaleza, CE, Brasil.
3. Universidade Federal do Ceará, Faculdade de Medicina, Fortaleza, CE, Brasil.
Autor correspondente: João Mamede Instituto Dr. José Frota Rua Barão do Rio Branco, 1816, Fortaleza, CE, Brasil. CEP: 60025-061 E-mail: joaomamed@gmail.com
Artigo submetido: 20/01/2022.
Artigo aceito: 07/04/2022.
Conflitos de interesse: não há.







 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter