

Original Article - Year 2023 - Volume 38 -
Reconstrução bilateral imediata de mamas pósmastectomia preservadora de pele: incisão transversal e implantes em plano misto
Immediate bilateral breast reconstruction after skin-sparing mastectomy: cross-sectional incision and implants in mixed plane
RESUMO
Introdução: Complicações nas reconstruções imediatas de mamas pós-mastectomias preservadoras de pele são recorrentes. Os autores descrevem conduta para redução delas e melhoria do resultado anatômico/estético utilizando implantes. O objetivo é reduzir a incidência de necroses areolares, melhorar a projeção das mamas nas reconstruções com implantes submusculares, recuperar a sensibilidade parcial ou total e facilitar a simetrização.
Método: A mastectomia é realizada com incisão transversal lateral, do bordo areolar à axila. A reparação com implantes incluídos em plano misto por divulsão do músculo peitoral, dividindo-o em duas porções na direção de suas fibras, associação da fáscia do músculo serrátil e tecido celular subcutâneo inferior/lateral, e/ou músculo peitoral menor na área superolateral. A incisão é suturada quando não há ptose mamária, ou superposta por desepidermização de um dos bordos, podendo incluir redução do diâmetro e relocação da aréola. Ou desepidermização fusiforme da pele periareolar e medialmente a ela. A mastectomia contralateral redutora de riscos teve procedimento semelhante, melhorando a simetria.
Resultados: Foram operadas 106 pacientes (212 mamas) com resultados satisfatórios e complicações por infecção, posicionamento dos implantes na curva de aprendizado, e irregularidades de superfície.
Conclusão: Reconstrução imediata das mamas pós-mastectomia preservadora de pele pelo método proposto é opção possível, obtendo boa simetrização e projeção das mamas, retorno da sensibilidade e ausência de necrose total de aréola.
Palavras-chave: Mama; Próteses e implantes; Mamoplastia; Neoplasias da mama; Procedimentos cirúrgicos reconstrutivos
ABSTRACT
Introduction: Complications in immediate breast reconstruction after skin-preserving mastectomies are recurrent. The authors describe conduct to reduce them and improve the anatomical/esthetic result using implants. The objective is to reduce the incidence of areolar necrosis, improve breast projection in reconstructions with submuscular implants, recover partial or total sensitivity, and facilitate symmetrization.
Method: The mastectomy involves a lateral transverse incision from the areolar border to the armpit. Repair with implants included in a mixed plane by divulsion of the pectoral muscle, dividing it into two portions in the direction of its fibers, the association of the serratus muscle fascia and inferior/lateral subcutaneous tissue, and/or pectoralis minor muscle in the superolateral area. The incision is sutured when there is no breast ptosis or superimposed by de-epidermization of one of the borders, which may include a reduction in diameter and relocation of the areola. Or fusiform de-epidermization of the periareolar skin and medially to it. The contralateral risk-reducing mastectomy had a similar procedure, improving symmetry.
Results: 106 patients (212 breasts) were operated on with satisfactory results and complications due to infection, positioning of the implants on the learning curve, and surface irregularities.
Conclusion: Immediate breast reconstruction after skin-preserving mastectomy by the proposed method is a possible option, obtaining good breast symmetrization and projection, return of sensitivity, and absence of total necrosis of the areola.
Keywords: Breast; Prostheses and implants; Mammaplasty; Breast Neoplasms; Reconstructive surgical procedures
INTRODUÇÃO
Data do final do século XIX a primeira descrição da tentativa de reparação da área da mastectomia com retalho miocutâneo de grande dorsal, realizada por Tanzini, em 19061. Após 19812, a agressividade do tratamento de tumores mamários foi sendo reduzida, preservando músculos, pele, às vezes o complexo areolopapilar (CAP), e parte da glândula. Era reconstruída após quadrantectomia e radioterapia no intraoperatório, ou posteriormente.
Depois de 1991, as mastectomias preservadoras de pele, e às vezes CAP, em casos de ausência de metástase ganglionar que não exigiam radioterapia, recebiam reparação imediata e mudanças nas incisões3. Com a melhoria dos implantes, se tornaram opção do arsenal de táticas. Possibilitam menor tempo cirúrgico, recuperação rápida, menor custo hospitalar e aceitação pelas pacientes.
Em uma mama recebendo implante e a contralateral corrigida com os próprios tecidos, a simetria não é adequada. E há descrição de incidência de 7,3% de carcinoma ductal oculto e 4,6% de carcinoma lobular “in situ” nesta mama4 e risco cumulativo de surgimento de 0,5 a 1% a cada ano de vida5. Em presença de BRCA1/2 e história familiar de câncer de mama6, pode-se indicar mastectomia subcutânea contralateral (redutora de riscos), reparando-a com implante. A permanência dessa mama, redução de riscos7 e melhores simetria e estética é decisão da paciente8,9.
A reparação pós-mastectomia tem intercorrências, sob qualquer conduta, ocorrendo mesmo em mãos experientes (34,64%)10. A retirada dos tecidos próximos ao CAP, por necessidade ou prevenção, reduz a vascularização periareolar, com eventual necrose.
Se a cobertura de pele e subcutâneo for de espessura menor que 1,5/2,0cm, a inclusão do implante no plano supramuscular não é ideal. Preconiza-se alojá-lo sob o músculo peitoral e serrátil anterior, mas a projeção da mama reconstruída se reduz pela pressão muscular. E pode ocorrer deslocamento do implante em direção cranial, causando desconforto durante contração muscular, ou deslocamento lateroinferior.
E o esvaziamento da mama causa redução da sensibilidade.
OBJETIVO
O objetivo é descrever tática como tentativa de reduzir incidência de necrose areolar, melhorar projeção das mamas com implantes submusculares, analisar subjetivamente a recuperação da sensibilidade tátil da mama, e objetivamente a dolorosa, e facilitar simetrização.
MÉTODO
Trata-se de estudo retrospectivo de casos com análise de prontuários.
Foram excluídos os referentes a mastectomia unilateral com inclusão de expansores e posterior reparação, reconstruções tardias, reconstruções imediatas ou tardias com retalhos, reparações secundárias, reparações em mastectomias higiênicas.
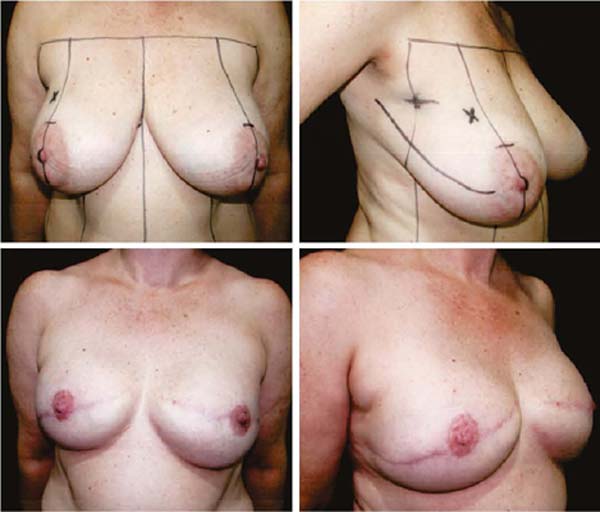
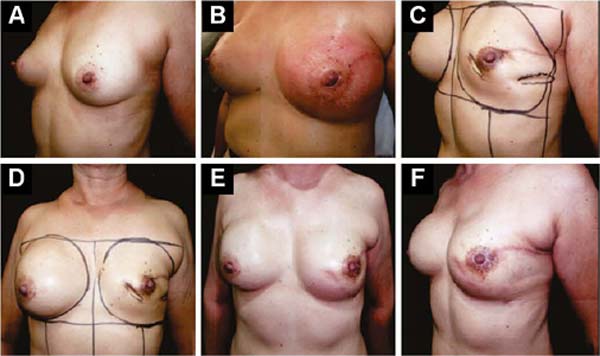
Paciente de pé, marcam-se as linhas mamárias que formam o quadrilátero onde se locará a base do implante (Figura 1A)11. A mastectomia é realizada com incisão transversal, do bordo lateral da aréola até a região axilar, aproveitando-a para detectar e retirar o gânglio sentinela, ou esvaziamento axilar (Figura 1B).
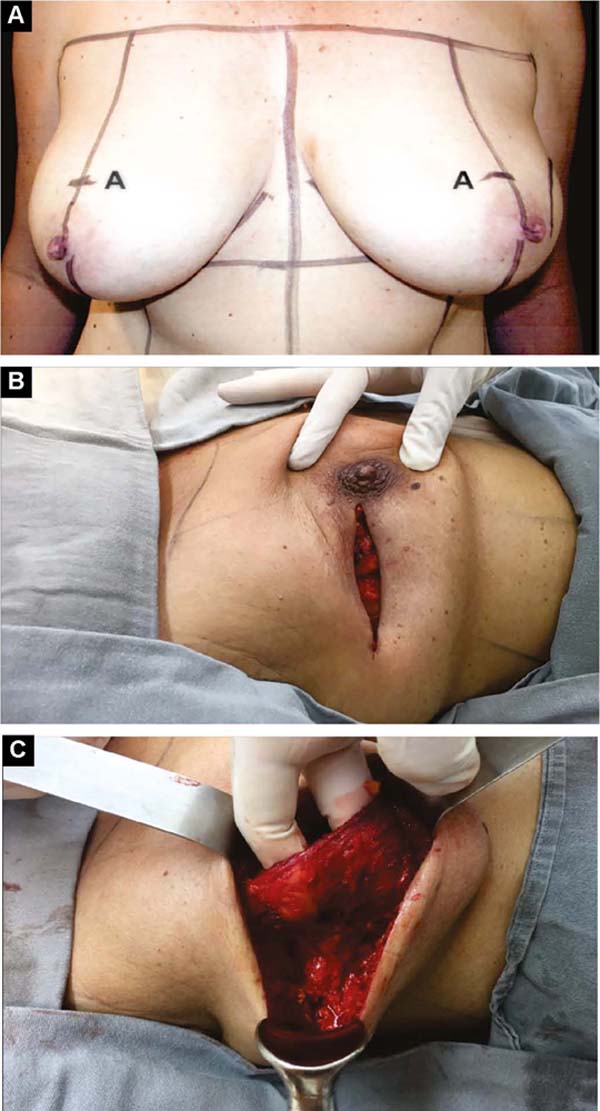
No descolamento do tecido glandular, a espessura de pele e subcutâneo deve ser homogênea e decrescente, da base da mama até a papila, sem prejuízos do tratamento oncológico. Se há ptose mamária, encurvase a incisão com concavidade caudal.
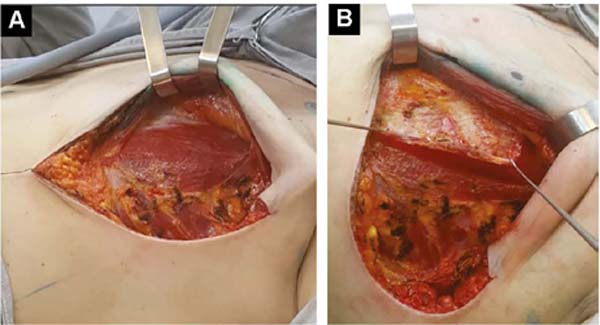
Após procedimentos oncológicos, não havendo esvaziamento ganglionar, o músculo grande peitoral é divulsionado obliquamente na direção das fibras, na metade de sua largura (Figura 1C), descolando-o suavemente com o dedo indicador. Na direção caudal e medial inferior utiliza-se bisturi elétrico, ultrapassando o sulco submamário (HLBL) em 2 centímetros; elevando junto à aponeurose anterior do músculo reto abdominal, realizando nela três incisões verticais, afrouxando sua constrição.
Para cima, descola-se até 1,5cm abaixo da linha mamária horizontal superior e paramedial até a linha mamária vertical medial a 1,5cm da linha medioexternal11, de modo semelhante ao que é utilizado em aumento mamário por alguns autores12,13,14. Lateralmente, descola-se todo o músculo peitoral, até encontrar a aponeurose do músculo serrátil anterior. Adiante, ela é descolada incluindo fibras musculares, somada ao tecido celular subcutâneo frouxo sobre a delicada aponeurose, em conjunto até a linha axilar anterior (VLBL)11, suficiente para obter o contorno lateral e inferior da loja e acomodar o implante (Figura 2A).
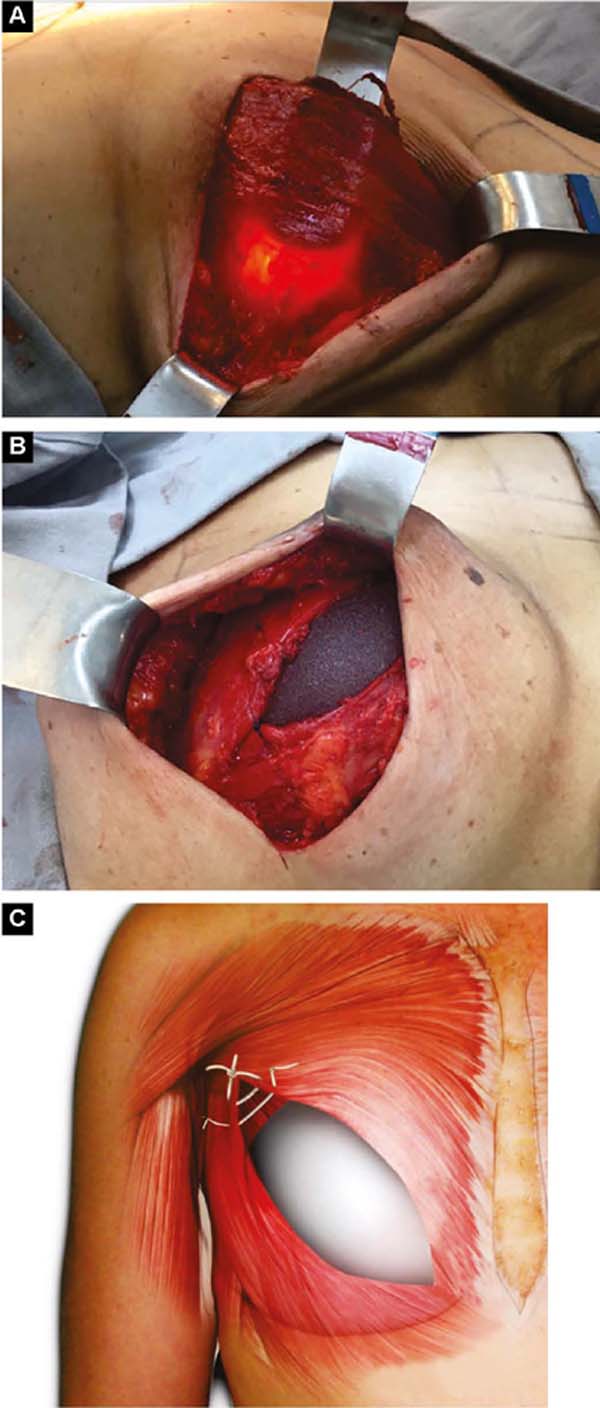
Este é alojado entre as duas vertentes do músculo peitoral. No seu contorno o implante é coberto pelo músculo e no centro fica livre para se projetar e obter melhor proporção base/altura15 (Figura 2B). Pontos de tração suave com fios absorvíveis são dados entre as vertentes divulsionadas na metade superolateral, sobre o implante, para prevenir retração destas durante a cicatrização (Figuras 2B e 2C).
Se o músculo pequeno peitoral tem boa extensão e volume, o peitoral maior é descolado para medial a partir do seu bordo lateral, e o menor para lateral até a linha axilar anterior (VLBL), reforçando a parte superolateral da loja (Figuras 3A e 3B). Após a introdução do implante, o bordo lateral do grande peitoral é suturado ao bordo medial do pequeno.
A pele e tecido subcutâneo da lateral do tórax, que são descolados da mama durante a mastectomia, são fixados a ele com pontos separados de fios absorvíveis16,17.
Haverá três opções para o fechamento final da pele, determinadas pela quantidade excedente no pré-operatório.
Primeira: Sem ptose inicial (AM de 0 a 2cm) é realizada sutura subdérmica e pele. Se a ptose é pequena (AM de 3/4cm)11, a parte inferior do retalho é desepitelizada e suturada ao bordo lateral do músculo peitoral, reforçando a cobertura superolateral do implante.
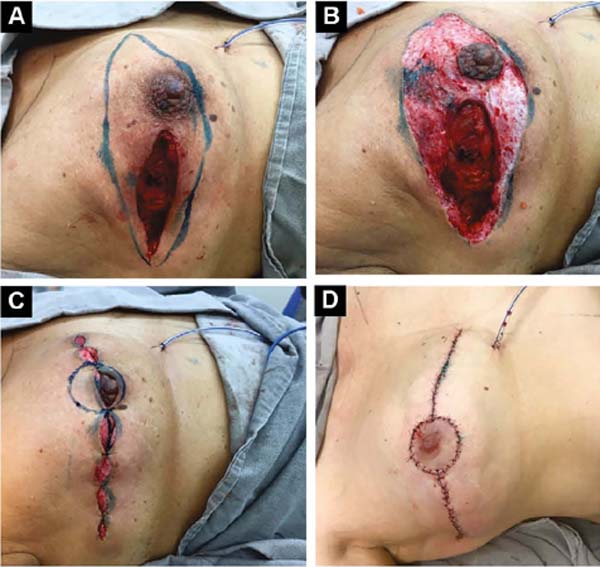
Segunda: Com ptose média (AM de 4/5cm) e necessidade de relocação ou redução do diâmetro areolar, além do procedimento descrito na primeira opção, marca-se o excedente na região periareolar, desepidermiza-se e reposiciona-se a aréola.
Terceira: Com ptose grande (AM maior que 5cm)11, marca-se fuso transversal por pega bidigital, em torno e medialmente à aréola. O diâmetro desta é demarcado, e a área desepidermizada, como o novo sítio areolar (Figuras 4A, 4B, 4C e 4D).
O fechamento das áreas desepidermizadas deve ser realizado com poucos pontos simples separados subdérmicos com fios absorvíveis, não estrangulando a circulação, permitindo irrigação areolar e periareolar. A derme que dobra sob si mesma protege o implante e dá maior projeção à mama. Sutura-se a pele com pontos não absorvíveis separados, com tração e constrição suaves.
A drenagem a vácuo da loja subcutânea é necessária até que o volume diário drenado seja menor que 30ml/24 horas. A extremidade do dreno é colocada na região axilar e extruído no polo medial inferior (Figura 4D). O mesmo procedimento é realizado na mama contralateral, a fim de se obter simetrização e redução de riscos.
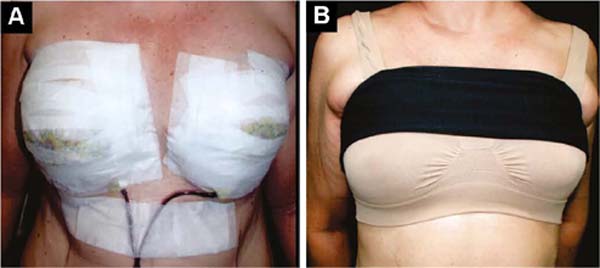
O curativo inicial cobre as incisões com pomada isolante e a mama é coberta com um sutiã de esparadrapo microporado, que permanece e é retocado até a retirada dos pontos, em torno de 12 dias (Figura 5A).
Sobre ela, a partir do primeiro dia, aplica-se sutiã delicado e sem costura ligeiramente compressivo, mais faixa que comprime ligeiramente os implantes no sentido caudal, evitando seu deslocamento para cima, até a formação da cápsula fibrosa em 2 meses (Figura 5B).
RESULTADOS
Foram operadas 106 pacientes (212 mamas) no mesmo ato cirúrgico da mastectomia preservadora de pele e redutora de risco contralateral, utilizando a tática descrita, de junho de 2009 a julho de 2019. As pacientes são de clínica privada e assinaram Termo de Consentimento Informativo e Esclarecedor.
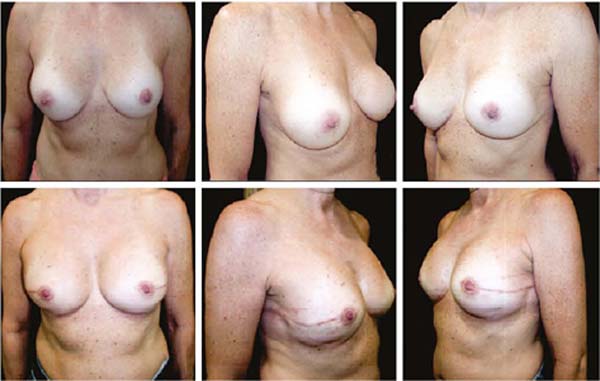
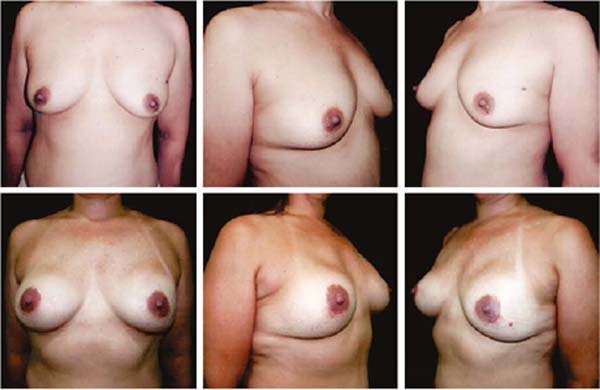
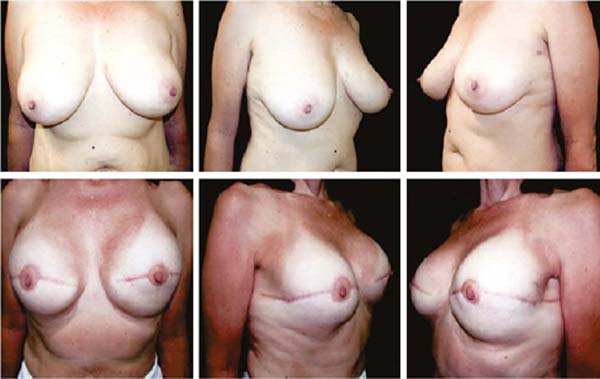
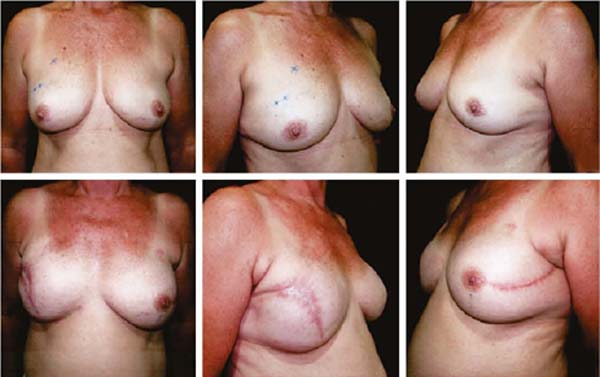
As Figuras 6A, 6B, 6C, 6D, 6E e 6F; 7A, 7B, 7C, 7D, 7E e 7F; 8A, 8B, 8C, 8D, 8E e 8F; 9A, 9B, 9C, 9D, 9E e 9F são de pacientes operadas com bom resultado.
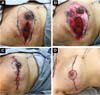
Três pacientes tiveram sinais inflamatórios e seroma após um mês (Tabela 1). Em duas, o líquido drenado foi submetido a três culturas. Destas, as duas primeiras foram negativas e a terceira, em laboratório diverso, detectou S. epidermidis. A terceira paciente apresentou resultado positivo na primeira cultura. Nos três casos, o implante foi removido e após quatro meses reoperadas. Removeu-se o tecido fibrótico e inclusão de novo implante (Figuras 10A, 10B, 10C, 10D, 10E e 10F). Todas apresentaram contratura capsular de grau moderado tardiamente.
| 106 Pacientes - 212 Mamas | |
|---|---|
| Irregularidade de superfície | 25 - 23,58% |
| Seromas | 3 - 2,83% |
| Seroma pós-trauma | 1 - 0,94% |
| Infecção S. epidermidis | 3 - 2,83% |
| Hematomas | 1 - 0,94% |
| Necrose areolar | 1 - 0,94% |
| Deiscência de suturas | 2 - 1,88% |
| Implantes altos | 2 - 1,88% |
| Tumor na mama contralateral | 5 - 4,71% |
| Complicações e resultados inadequados | 35,82% de pacientes e 17,91% das mamas |
Uma paciente apresentou seroma tardio após três meses por trauma, drenado por uma semana, sem vácuo, e uso de anti-inflamatórios. A resolução foi satisfatória. Um caso de hematoma foi tratado clinicamente. Apenas uma paciente apresentou necrose areolar parcial marginal na metade inferior, com cicatrização espontânea. Neste, a incisão lateral contornou a aréola inferiormente até o polo medial.
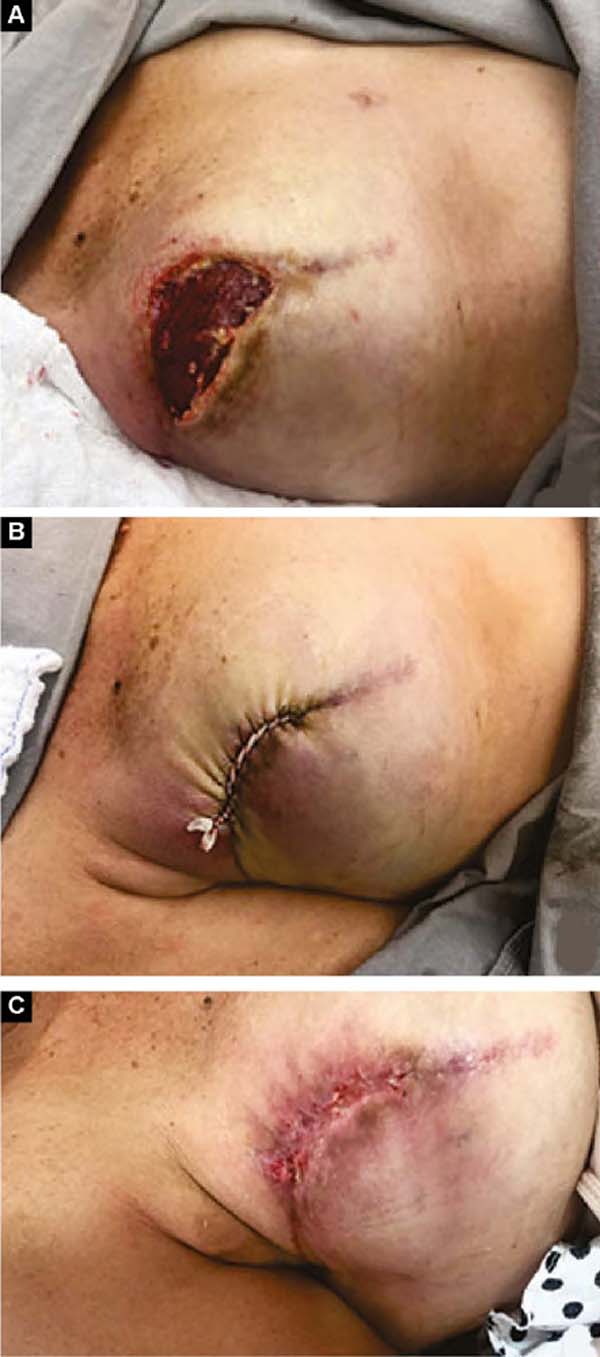
Duas pacientes apresentaram deiscência de sutura da pele. Em uma o implante ficou protegido pela área desepidermizada e a cicatrização foi espontânea. No outro houve exposição do músculo e foi solucionado com curativo elástico18,19 (Figuras 11A, 11B e 11C e Figuras 12A, 12B, 12C, 12D, 12E e 12F).
O implante se posicionou alto no pós-operatório de 2 meses em dois casos iniciais.
Irregularidade de superfície foi o mau resultado mais frequente (25 casos).
A projeção obtida foi sempre semelhante a mamas de boa forma.
A obtenção da simetria perfeita ficou dependente da regularidade na espessura do “retalho pós-mastectomia”, obtida mais facilmente quando ele era homogêneo bilateralmente.
DISCUSSÃO
Antes da puberdade, o tecido subcutâneo sobre os brotos mamários apresenta espessura homogênea. O estímulo hormonal depende do nível sérico, da qualidade elástica da pele, e do número de brotos. As mamas, ao crescerem, distendem mais ou menos a pele e reduzem a espessura do subcutâneo, desde a periferia dela no tórax até o CAP. Essa é a causa principal de existirem várias formas e volumes mamários baseados na extensão da base e na projeção da mama. Preservá-lo com espessura decrescente é conveniente, permanecendo vasos e nervos que formam rede vascular e nervosa superficial até a papila, essenciais para reduzir deficiência circulatória e retorno da sensibilidade.
O volume mamário removido é medido e colocado em frasco graduado de 2000ml contendo 1000ml de água. O tecido acrescido colabora com a escolha do volume do implante, desconsiderando os axilares retirados em associação com o mamário.
No pré-operatório discute-se com a paciente sobre volume conveniente e possível, baseado na mama existente. Deve-se considerar o remanescente de pele, a extensão lateral e vertical do tórax e do músculo peitoral maior.
A medida da ptose não é o único parâmetro que determina a extensão das cicatrizes. O volume do implante também.
Após três casos de infeção tardia por S. epidermidis, passou-se rotineiramente a re-esterilizar a pele e lavar a loja com soro fisiológico após a mastectomia e não ocorreram outros casos.
Duas pacientes, com 2 meses de pós-operatório apresentaram implantes altos, apesar de bem posicionados no ato cirúrgico no início da utilização da tática. Modificou-se a conduta usando faixa transversal nos polos mamários superiores, e incisões relaxadoras na aponeurose do músculo reto.
Em tumores próximos da pele em quadrantes que não sejam os laterais, necessitando resseção, o fuso foi realizado no sentido da base da mama até a aréola. Na axila, fez-se incisão transversal no mesmo sentido, obtendo o gânglio sentinela. A conduta une ou não as duas incisões, com desepidermização, dependendo da ptose.
Quando houve remoção da aréola, o procedimento foi semelhante e sua reparação foi postergada para outro tempo cirúrgico, ou tatuada. Ou refeita imediatamente com enxerto da aréola contralateral, se havia excedentes. Esta mama sempre apresentou o ápice mais plano do que a contralateral, necessitando enxerto de gordura posterior.
É conveniente portar volumes diferentes de implantes a fim de decidir qual será utilizado durante a reconstrução. A mastectomia subcutânea contralateral, em geral, foi mais conservadora de tecidos e o volume utilizado foi frequentemente menor.
A tática descrita possibilitou eliminar necrose total de aréola, mesmo que a região periareolar apresentasse mínimo subcutâneo após a mastectomia.
As incisões transversais propiciam boas cicatrizes, e juntamente com a espessura preservada do subcutâneo recuperam a sensibilidade mamária parcial ou total entre dois meses e dois anos20.
Todas as 106 pacientes operadas pela tática receberam o procedimento no lado contralateral, objetivando a simetrização. Esta é de difícil obtenção. Cinco pacientes possuíam tumor não diagnosticado na mama contralateral.
No pós-operatório, o medo da mutilação pela perda da mama é substituído por sensação de alívio e entusiasmo ao se obter mamas muitas vezes mais adequadas do que as anteriores à cirurgia. Este fato facilita a aceitação de quimioterapia com a possível queda dos cabelos. A retirada da mama contralateral também provocou sensação de alívio.
A satisfação da paciente em ter realizado a mastectomia contralateral é de 84 a 96%7,8, mas depende da qualidade do resultado obtido. Estes foram melhores em pacientes com tumores pequenos e sem comprometimento de gânglios axilares. Pode-se então preservar o tecido gorduroso subcutâneo mais espesso e homogêneo, e sem necessidade de remoção das aréolas.
Quando houve gânglio sentinela positivo, prevendo possível radioterapia, realizou-se a inclusão de expansor de pele para reparação da mama e mastectomia contralateral, depois do término do tratamento. Mas os resultados de simetrização não alcançaram a mesma qualidade.
Nas irregularidades de superfície provocadas pela mastectomia, fez-se necessário um segundo tempo a fim de realizar correção com enxerto de gordura, melhorando os resultados. É conveniente discutir antecipadamente a necessidade de segundo tempo cirúrgico.
A tática de deixar o músculo grande peitoral aberto, além de propiciar maior projeção da mama, elimina o desconforto da pressão pela contração muscular. E, a longo prazo, possíveis alterações costais.
A reconstrução imediata com implantes tornouse a melhor opção dos autores. Mas, as reconstruções tardias com áreas doadoras de volume adequado são as que eles preferem.
Considerando 212 mamas operadas em 106 pacientes, a incidência total de complicações ou resultados insatisfatórios foi de 17,91% das mamas ou 35,82% das pacientes, sendo a mais prevalente a irregularidade de superfície.
CONCLUSÃO
A reconstrução imediata das mamas com incisão transversal e implantes em plano misto, pós-mastectomia preservadora de pele e mastectomia contralateral redutora de riscos, é mais uma opção possível. Permite boa projeção, redução de necroses areolares e retorno da sensibilidade táctil/dolorosa parcial ou total, facilitando a simetrização.
REFERÊNCIAS
1. Tanzini I. Sopra il mio nuovo processo di amputazione della mamella. Gaz Med Ital. 1906;57:141.
2. Veronesi U, Saccozzi R, Del Vecchio M, Banfi A, Clemente C, De Lena M, et al. Comparing radical mastectomy with quadrantectomy, axillary dissection, and radiotherapy in patients with small cancers of the breast. N Engl J Med. 1981;305(1):6-11.
3. Toth BA, Lappert P. Modified skin incisions for mastectomy: the need for plastic surgical input in preoperative planning. Plast Reconstr Surg. 1991;87(6):1048-53.
4. Alba B, Schultz BD, Cohen D, Qin AL, Chan W, Tanna N. Risk-to-Benefit Relationship of Contralateral Prophylactic Mastectomy: The Argument for Bilateral Mastectomies with Immediate Reconstruction. Plast Reconstr Surg. 2019;144(1):1-9.
5. Yi M, Hunt KK, Arun BK, Bedrosian I, Barrera AG, Do KA, et al. Factors affecting the decision of breast cancer patients to undergo contralateral prophylactic mastectomy. Cancer Prev Res (Phila). 2010;3(8):1026-34.
6. Herrinton LJ, Barlow WE, Yu O, Geiger AM, Elmore JG, Barton MB, et al. Efficacy of prophylactic mastectomy in women with unilateral breast cancer: a cancer research network project. J Clin Oncol. 2005;23(19):4275-86.
7. Crosby MA, Garvey PB, Selber JC, Adelman DM, Sacks JM, Villa MT, et al. Reconstructive outcomes in patients undergoing contralateral prophylactic mastectomy. Plast Reconstr Surg. 2011;128(5):1025-33.
8. Chagpar AB. Contralateral Prophylactic Mastectomy: Pro and Cons. Am J Hematol Oncol. 2016;12(4):21-4.
9. Buchanan PJ, Abdulghani M, Waljee J F, Kozlow JH, Sabel MS, Newman LA, et al. An Analysis of the Decisions Made for Contralateral Prophylactic Mastectomy and Breast Reconstruction. Plast Reconstr Surg. 2016;138(1):29-40.
10. Cosac OM, Campos AC, Dias RCS, Costa RSC, Da-Silva SV, Damasio AA. Reconstruções mamárias: estudo retrospectivo de 16 anos. Rev Bras Cir Plást. 2019;34(2):210-7.
11. Bozola AR, Bozola AC. Indicações e Limites da Mamoplastia com “cicatriz em L”: experiência de 30 anos. Rev Bras Cir Plást. 2018;33(1):24-32.
12. Bracaglia R, Gentileschi S, Fortunato R. The “triple-plane technique” for breast augmentation. Aesthetic Plast Surg. 2011;35(5):859-65. DOI: 10.1007/s00266-011-9668-1
13. Rigo MH, Piccinini PS, Sartori LDP, de Carvalho LAR, Uebel CO. SMS-Split Muscle Support: A Reproducible Approach for Breast Implant Stabilization. Aesthetic Plast Surg. 2020;44(3):698-705.
14. Procópio LD, Silva DDP, Rosique R. Implante submuscular em duplo bolso para mastopexias de aumento. Rev Bras Cir Plást. 2019;34(2):187-95.
15. Bozola AR, Longato FM, Bozola AP. Análise geométrica da forma da beleza da mama e da forma de prótese baseado na proporção Phi: aplicação prática. Rev Bras Cir Plást. 2011;26(1):94-103.
16. Baroudi R, Ferreira CA. Seroma: how to avoid it and how to treat it. Aesthet Surg J. 1998;18(6):439-41.
17. Pollock H, Pollock T. Progressive tension sutures: a technique to reduce local complications in abdominoplasty. Plast Reconstr Surg. 2000;105(7):2583-6; discussion 2587-8.
18. Santos ELN, Oliveira RA. Sutura elástica para tratamento de grandes feridas. Rev Bras Cir Plást. 2012;27(3):475-7.
19. Vidal MA, Mendes Junior CES, Sanches JA. Sutura elástica - uma alternativa para grandes perdas cutâneas. Rev Bras Cir Plást. 2014:29(1):146-50.
20. Bozola AR. Reconstrução Mamária Tardia com Expansão Prévia da Área da Mastectomia e Preenchimento com Retalho TRAM Desepidermizado. Rev Bras Cir Plást. 2005;20(2):95-101.
1. Faculdade Estadual de Medicina de São José do Rio Preto, Divisão de Cirurgia Plástica,
São José do Rio Preto, SP, Brasil
Autor correspondente: Antonio Roberto Bozola Avenida Brigadeiro Faria Lima, 5544, Vila São José, São José do Rio Preto, SP, Brasil CEP: 15090-000 E-mail: ceplastica@hotmail.com
Artigo submetido: 27/08/2020.
Artigo aceito: 13/09/2022.
Conflitos de interesse: não há.







 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter