

Case Report - Year 2021 - Volume 36 -
Os desafios no tratamento de paciente grande queimado e politraumatizado com trombose arterial em membro inferior durante a pandemia de COVID-19: relato de caso
The challenges in the treatment of large burned and polytraumatized patients with arterial thrombosis in the lower limb during the COVID-19 pandemic: a case report
RESUMO
Introdução: A pandemia de COVID-19 se espalhou rapidamente pelo mundo trazendo a necessidade de ações emergenciais para o controle da doença em nível coletivo e individual. Assim, a Divisão de Cirurgia Plástica e Queimaduras do maior complexo hospitalar da América Latina foi fisicamente destinada aos infectados. Neste contexto, encontramos os desafios de tratar um paciente grande queimado e politraumatizado, que apresentou trombose arterial em membro inferior, uma rara complicação associada à queimadura térmica. Todo tratamento foi realizado em hospital não especializado ao atendimento de trauma.
Relato de Caso: Paciente masculino, 18 anos, sem comorbidades, com queimaduras predominantemente de 3º grau de 50% de superfície corpórea queimada e neurotrauma grave, que apresentou trombose arterial em perna direita 24 horas após a queimadura. Paciente submetido à amputação do membro e a seriadas intervenções cirúrgicas para desbridamento e enxertia de pele. Apesar dos protocolos de prevenção, paciente foi infectado pela COVID-19 durante a internação.
Conclusão: Este caso enfoca uma complicação rara relacionada à lesão por queimadura, que ainda não possui critérios de diagnóstico e medidas profiláticas definidas. Além disso, a pandemia de COVID-19 trouxe impactos em diversos âmbitos nos serviços de saúde, sendo fundamental o compartilhamento de conhecimentos durante esta pandemia pela busca de adaptações à situação de crise.
Palavras-chave: Queimaduras; Traumatismo múltiplo; Trombose; Coagulação intravascular disseminada; Vírus da SARS.
ABSTRACT
Introduction: The COVID-19 pandemic spread rapidly worldwide, bringing the need for emergency actions to control the disease at the collective and individual level. Thus, the Division of Plastic Surgery and Burns of the largest hospital complex in Latin America was physically aimed at the infected. In this context, we find the challenges of treating a large burned and polytraumatized patient, who presented arterial thrombosis in the lower limb, a rare complication associated with the thermal burn. All treatment was performed in a hospital not specialized in trauma care.
Case Report: Case Report: Male patient, 18 years old, without comorbidities, with predominantly third-degree burns of 50% of body surface burned and severe neurotrauma. He presented arterial thrombosis in his right leg 24 hours after the burn. The patient underwent limb amputation and serial surgical interventions for debridement and skin grafting. Despite the prevention protocols, the patient was infected by COVID-19 during hospitalization.
Conclusion: This case focuses on a rare complication related to burn injury, which does not yet have diagnostic criteria and defined prophylactic measures. Besides, the COVID-19 pandemic has impacted various health services areas, and it is essential to share knowledge during this pandemic by seeking adaptations to the crisis situation.
Keywords: Burns; Multiple trauma; Thrombosis; Disseminated intravascular coagulation; SARS virus.
INTRODUÇÃO
Em 11 de março de 2020 foi declarada a pandemia de COVID-19, causada pelo novo coronavírus. No dia 30/03/2020, quando haviam sido registrados 320 casos no Brasil, a Divisão de Cirurgia Plástica e Queimaduras do maior complexo hospitalar da América Latina foi fisicamente destinada aos infectados; os pacientes queimados foram contrarreferenciados e os profissionais da saúde foram realocados.
Neste contexto, tivemos o desafio de tratar um paciente grande queimado e politraumatizado com trombose arterial em membro inferior direito, rara complicação associada à queimadura. Seu tratamento foi conduzido em um dos institutos do complexo que não é especializado no atendimento ao trauma, mas para onde foi deslocada temporariamente a estrutura para esses atendimentos, e onde ele permaneceu internado pela necessidade de cuidados multidisciplinares especializados.
RELATO DE CASO
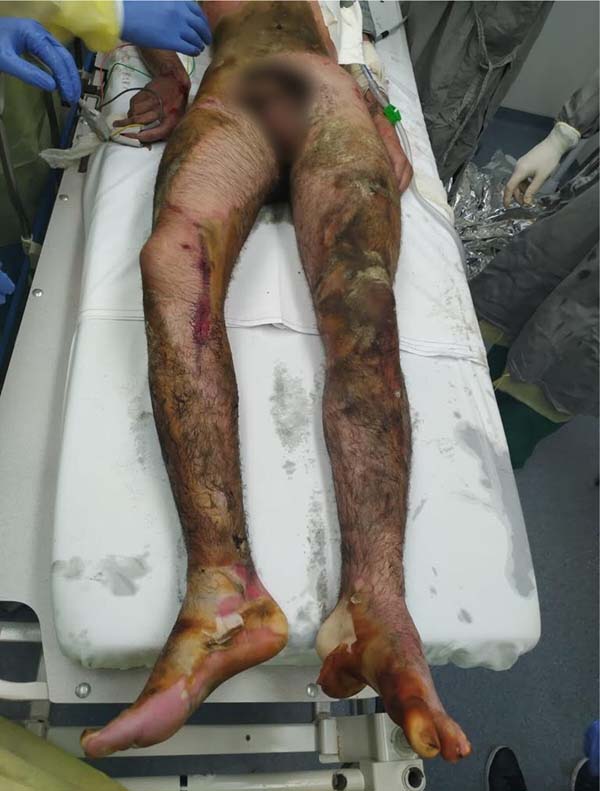
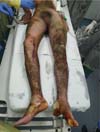
Paciente do sexo masculino, 18 anos, sem comorbidades, vítima de colisão com caminhão, seguida de explosão de tanque de gasolina de sua moto, apresentava queimadura predominantemente de 3º grau com superfície corpórea queimada (SCQ) estimada de 50% em membros inferiores, abdome, dorso inferior e antebraço esquerdo, e queimaduras de 2º grau superficial em antebraço direito (Figura 1).
À tomografia computadorizada (TC), identificada hemorragia subaracnoide, hemoventrículo (IV ventrículo) e sinais de lesão axonal difusa. Em TC de controle houve sinais de piora do edema cerebral; optou-se por derivação ventricular externa (DVE) e passagem de cateter para monitorização da pressão intracraniana (PIC) pela equipe da neurocirurgia.
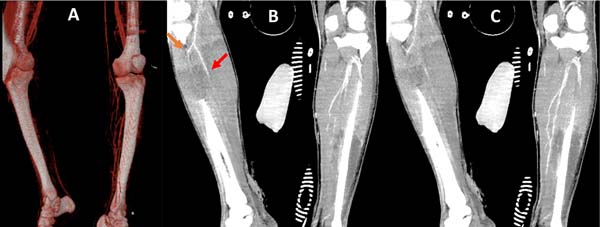
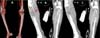
Após 24 horas apresentou edema, diminuição da temperatura e cianose não fixa de membro inferior direito com pouca melhora da possível congestão venosa pós-escarotomia. Após 12 horas com a piora da perfusão, foi submetido à angiotomografia (AngioTC) (Figura 2), evidenciando fluxo filiforme e por vezes ausência de fluxo em artéria tibial anterior e posterior, tronco tibiofibular, fibular e difícil caracterização nos segmentos mais distais, evoluindo com cianose fixa. Diante do quadro de lesão vascular ainda não delimitada, queimadura profunda extensa e neurotrauma grave, optou-se por amputação após compensação clínica.
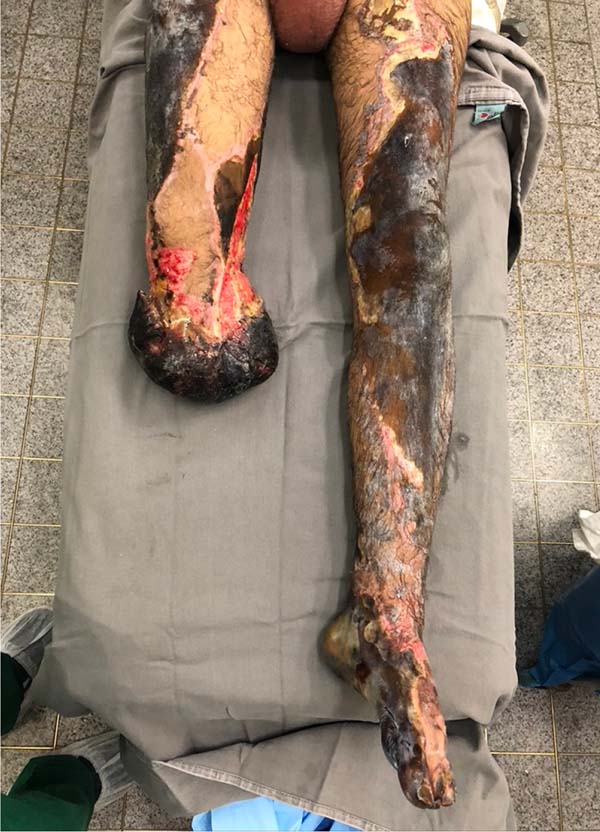
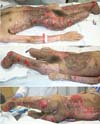
Após retirada de DVE e PIC com melhora do quadro clínico, realizada amputação transtibial aberta no 13º dia de internação (DIH). Após 6 dias, o coto apresentava-se isquêmico com presença de necroses (Figura 3), necessitando de ampliação do nível de amputação para transfemoral.
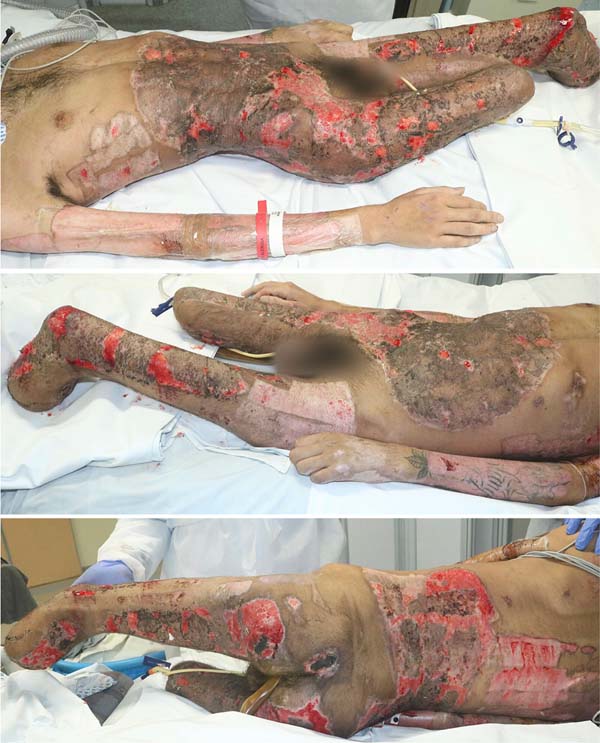
A partir daí, realizamos operações seriadas semanais com desbridamento e enxertia de pele em malha. A Tabela 1 sumariza nossas intervenções cirúrgicas. Neurologicamente, o paciente apresentou melhora do nível de consciência e coordenação motora, possuindo ainda áreas de ulceração (Figura 4) para enxertias futuras.
No 27º DIH, foi colhido teste molecular (RT-PCR) para COVID-19, que viera negativo, para investigação de picos febris sem outros sintomas, tratada com antibioticoterapia por infecção de corrente sanguínea. No 41º DIH, realizado teste sorológico COVID-19 de todos internados da mesma unidade de terapia intensiva (UTI) devido à infecção de um dos pacientes. Neste, houve positividade para imunoglobulina G.
| #Cirurgia - Dia de internação (DIH) | Evolução |
|---|---|
| #1 - 2º DIH DVE pela equipe da neurocirurgia. | Retirada no 5º DIH após pressão intracraniana se manter normal com DVE fechada por 72 horas. |
| #2 - 12º DIH Amputação transtibial aberta direita pela cirurgia vascular (CV): o músculo apresentava-se com pouco sangramento, presença de hematomas, vasos trombosados; optou-se então por manter retalho muscular aberto sem cobertura cutânea para avaliar viabilidade, e instalada terapia por pressão subatmosférica (VAC). | Curativo VAC retirado após 6 dias evidenciando retalho muscular de coto com necroses e aspecto isquêmico (Figura 2). |
| #3 - 18º DIH Amputação transfemoral direita pela CV. Desbridamento e enxertia em abdome e antebraço esquerdo. | Abertura de curativo do enxerto após 6 dias: integração >90%. |
| #4 - 24º DIH Amputação transtibial esquerda pela CV devido à extensão e profundidade da queimadura no pé, levando a inviabilidade de reconstrução do membro. Desbridamento e enxertia em coto transfemoral direita. | Abertura de curativo do enxerto após 6 dias: integração >90%. |
| #5 - 31º DIH Desbridamento e enxertia em dorso, região inguinal e glúteo à direita. | Abertura de curativo do enxerto após 7 dias: integração ~60%. |
| #6 - 32º DIH Traqueostomia pela cirurgia torácica para proteção de via aérea após falha de extubação (status neurológico + agitação psicomotora). | |
| #7 - 38º DIH Desbridamento e enxertia em coto esquerdo. | Abertura de curativo do enxerto após 7 dias: integração ~80%. |
| #8 - 45º DIH Desbridamento e enxertia em dorso e glúteos. | Abertura de curativo do enxerto após 7 dias: integração ~80%. |
DISCUSSÃO
A queimadura extensa é das mais severas e complexas formas de trauma1. Neste caso, houve um benéfico compartilhamento de atuação entre a equipe assistencialista do instituto não especializado com a equipe da divisão de queimaduras. Houve necessidade da enfermagem, não afeita ao tratamento de pacientes queimados, rapidamente ser treinada quanto à realização dos curativos, sendo fundamentais os esforços conjuntos com a equipe da cirurgia plástica para a integração dos enxertos e restauração da área doadora (reutilizada após 15 dias).
A ativação precoce da coagulação descontrolada e a fibrinólise podem ser consequências da lesão endotelial e da resposta inflamatória sistêmica2. Evidências atuais sugerem que o aumento incontrolável do sistema de coagulação é proporcional à SCQ, profundidade da queimadura, lesão inalatória e hemodiluição na fase de ressuscitação volêmica3.
A queimadura grave pode causar trombose de capilares e veias de pequeno calibre, mas raramente de médio e grande calibre4,5. Poucos casos de trombose arterial induzida por queimadura foram relatados, apesar de bem descrita em necropsias de pacientes queimados5. Dentre estes casos, a maioria dos pacientes tinham fatores de risco como doença aterosclerótica ou cateterização da artéria6. Neste caso, o paciente sem comorbidades apresentou alterações laboratoriais precoces (Tabela 2) associadas à hemoconcentração com aumento da hemoglobina e hematócrito (aumento da viscosidade sanguínea, fator de risco para trombose); discrasia sanguínea com o aumento do tempo de atividade da protrombina (TAP) e tempo de tromboplastina parcial ativada (TTPa) e consumo de plaquetas, sugerindo coagulação intravascular disseminada (CIVD). Na CIVD ocorre atividade procoagulante contínua com deposição de fibrina em pequenos e médios vasos que consomem e depletam os fatores de coagulação, podendo ocasionar tromboses e sangramentos7. Estudos cinéticos com fibrinogênio e plaquetas marcadas revelam que, além deste consumo sistêmico, ocorre significativo consumo local nas áreas queimadas8. Neste caso, a AngioTC sugeriu trombo arterial nativo, que poderia ser causado por aterosclerose, aneurisma, dissecção ou hipercoagulabilidade9. O trauma poderia originar trombose arterial subsequente a um pseudoaneurisma ou dissecção arterial, o que não foi visto no exame de imagem10. Assim, a etiologia mais provável da trombose foi pela hipercoagulabilidade associada à CIVD secundária à resposta inflamatória sistêmica do grande queimado.
| Hb (g/dL)/Ht (%) | Plaquetas | RNI | TTPA | PCR | |
|---|---|---|---|---|---|
| 11/04/20 | 19,9 / 55 | 565.000 | 1,6 | 1,3 | |
| 12/04/20 | 23 / 65 | 309.999 | 1,9 | 1,17 | 39 |
| 13/04/20 | 20,0 / 61 | 183.000 | 2,2 | 1,39 | 117 |
| 14/04/20 | 12,2 / 35 | 76.999 | 1,5 | 1,22 | 87,68 |
| 15/05/20 | 11,6 / 32 | 77.000 | 1,2 | 1,2 | 103,54 |
O uso de trombolíticos estava contraindicado pelo neurotrauma11, e a embolectomia foi preterida, pois precisaria ser realizada precocemente quando o paciente ainda necessitava de compensação clínica e neurológica. Por este motivo, e pela profundidade e extensão das queimaduras, optamos pela amputação do membro.
Apesar da ausência de complicações infecciosas locais, consideramos a abordagem cirúrgica tardia. Além de aguardar melhores condições clínicas, a perda física de nossa estrutura especializada em queimaduras acarretou dificuldades de logística, desde a obtenção de sala operatória, até a disponibilidade dos nossos equipamentos e insumos específicos. Felizmente, após a reorganização do complexo hospitalar, conseguimos realizar intervenções cirúrgicas semanais.
Para prevenção da COVID-19, houve alocação dos pacientes internados de acordo com seu status infeccioso, com alas para suspeitos, infectados e não infectados. Todo paciente atendido no pronto-socorro realiza triagem infecciosa RT-PCR e é considerado suspeito, permanecendo em isolamento com precaução de gotículas. Após resultado, o paciente é encaminhado para sua respectiva ala, onde é realizada constante vigilância dos sinais infecciosos (febre e sintomas respiratórios). Se presentes, são novamente transferidos para ala suspeita até completa investigação com exame de imagem e novo RT-PCR para COVID-19. Além disso, houve impedimento à visitação de qualquer paciente, seja na enfermaria ou UTI. Apesar destes esforços, o paciente foi infectado durante a internação e, felizmente, não apresentou nenhuma complicação respiratória ou outra complicação trombótica.
CONCLUSÃO
Apesar do conhecimento da coagulopatia relacionada à queimadura, ainda necessitamos de evidências de critérios diagnósticos, profilaxia e tratamento. A COVID-19 causou importantes mudanças em nossa prática clínico-cirúrgica. Assim, o compartilhamento de conhecimentos e habilidades, interação entre profissionais de diversas áreas, e a busca por soluções adaptadas à situação de crise podem despontar como legado positivo frente à pandemia.
REFERÊNCIAS
1. Zuo KJ, Medina A, Tredget EE. Important developments in burn care. Plast Reconstr Surg. 2017 Jan;139(1):120e-38e. DOI: https://doi.org/10.1097/PRS.0000000000002908
2. Glas GJ, Levi M, Schultz MJ. Coagulopathy and its management in patients with severe burns. J Thromb Haemost. 2016 Mai;14(5)865-74.
3. Marsden NJ, Van M, Dean S, Azzopardi EA, Hemington GS, Evans PA, et al. Measuring coagulation in burns: an evidence-based systematic review. Scars Burn Heal. 2017 Set;3:2059513117728201. DOI: https://doi.org/10.1177/2059513117728201
4. Counce JS, Cone JB, McAlister L, Wallace B, Caldwell Junior FT. Surgical complications of thermal injury. Am J Surg. 1988 Dez;156(6):556-7. DOI: https://doi.org/10.1016/s0002-9610(88)80552-x
5. Sevitt S. A review of the complications of burns, their origin and importance for illness and death. J Trauma. 1979 Mai;19(5):358-69. DOI: https://doi.org/10.1097/00005373-197905000-00010
6. Barret JP, Dziewulski PG. Complications of the hypercoagulable status in burn injury. Burns. 2006;32(8):1005-8. DOI: https://doi.org/10.1016/j.burns.2006.02.018
7. Pintão MCT, Franco RF. Coagulação intravascular disseminada. Medicina (Ribeirão Preto). 2001 Dez;34:282-91.
8. Levi M, Van Der Poll T. Disseminated intravascular coagulation: a review for the internist. Intern Emerg Med. 2013 Set;8(1):23-32. DOI: https://doi.org/10.1007/s11739-012-0859-9
9. Leung LLK. Clinical features and diagnosis of acute lower extremity ischemia. Waltham, MA: UpToDate; 2020.
10. Mitchell ME, Carpenter JP. Clinical features and diagnosis of acute lower extremity ischemia. Waltham, MA: UpToDate; 2020.
11. Braun JD. Embolism to the lower extremities. Waltham, MA: UpToDate; 2020.
1. Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo, Departamento de Cirurgia
Plástica e Queimaduras, São Paulo, SP, Brasil.
Autor correspondente: Rafael Eiki Takemura, Avenida Doutor Enéas Carvalho de Aguiar, 255, Cerqueira César, São Paulo, SP, Brasil., CEP: 05403-000, E-mail: eikitakemura@gmail.com
Artigo submetido: 06/07/2020.
Artigo aceito: 10/01/2021.
Conflitos de interesse: não há.
Instituição: Disciplina de Cirurgia Plástica da Faculdade de Medicina da Universidade de São Paulo, Brasil.






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter