

Case Report - Year 2021 - Volume 36 -
Desconforto mamário após mamoplastia de aumento: relato de caso
Breast discomfort after augmentation mammoplasty: a case report
RESUMO
A mamoplastia com próteses é uma das cirurgias plásticas mais realizadas no mundo. O processo cicatricial ao redor do implante e a presença de um biofilme pode acarretar o desenvolvimento de patologias como contratura capsular e seroma. Essas patologias parecem estar relacionadas fisiopatologicamente com o desenvolvimento do linfoma associado aos implantes mamários (BIA-ALCL), sendo este também um diagnóstico diferencial. A proposta deste trabalho é relatar o caso de uma paciente com desconforto mamário, que após 2 cirurgias prévias para drenagem de seroma e troca de próteses, apresentava desconforto mamário e alteração em exames de imagens da mama esquerda. Sendo submetida a uma capsulectomia em bloco da mama esquerda e completa à direita, tendo suas próteses substituídas. Os exames para investigação de BIA-ALCL foram negativos e os achados patológicos foram sugestivos de contratura capsular à esquerda e formação de dupla cápsula à direita. O trabalho enfatiza a importância do diagnóstico diferencial em patologias mamárias, o acompanhamento a longo prazo e medidas de profilaxia na formação do biofilme.
Palavras-chave: Seroma; Biofilmes; Contratura capsular em implantes; Linfoma anaplásico de células grandes; Implantes de mama.
ABSTRACT
Mammoplasty with prostheses is one of the most performed plastic surgeries in the world. However, the healing process around the implant and the presence of a biofilm can lead to the development of pathologies such as capsular contracture and seroma. These pathologies seem to be physiologically related to the development of lymphoma associated with breast implants (BIA-ALCL), which is also a differential diagnosis. The purpose of this study is to report the case of a patient with breast discomfort who, after two previous surgeries for seroma drainage and prosthesis replacement, presented breast discomfort and alteration in imaging of the left breast. She was, submitted to a capsulectomy in a block of the left breast and complete on the right, having her prostheses replaced. Bia-ALCL investigation tests were negative and pathological findings were suggestive of left capsular contracture and double capsule formation on the right. The study emphasizes the importance of differential diagnosis in mammary pathologies, long-term follow-up, and prophylaxis measures in biofilm formation.
Keywords: Seroma; Biofilms; Capsular contracture in implants; Large cell anaplastic lymphoma; Breast implants.
INTRODUÇÃO
A colocação de próteses mamárias promove reações fisiológicas cicatriciais ao redor do implante, formando uma cápsula fibrosa que tem sido relacionada ao desenvolvimento de diversas patologias mamárias¹. Entre elas destacam-se seromas, contratura capsular e mais recentemente o linfoma anaplásico de células gigantes associado ao implante mamário (BIA-ALCL)2,3.
O BIA-ALCL, uma patologia maligna rara, descrito pela primeira vez há mais de
20 anos3, com fisiopatologia sabidamente relacionada à cápsula periprotética, recentemente gerou maior preocupação após um comunicado aberto do FDA à população geral4.
A evolução lenta e achados clínicos inespecíficos da doença, além do aumento simultâneo da incidência mundial de BIA-ALCL e do próprio procedimento de colocação de próteses mamárias, torna fundamental a discussão e conscientização na prática médica para um reconhecimento precoce, cuidadoso e individualizado dos diagnósticos diferenciais de patologias mamárias após a mamoplastia de aumento com prótese.
O objetivo do trabalho é revisar diagnóstico diferencias do desconforto mamário após mamoplastia de aumento, chamando a atenção para medidas de prevenção da formação do biofilme, bem como a importância na suspeição do BIA-ALCL.
RELATO DE CASO
O relato de caso segue o modelo preconizado pelo SCARE5, sendo aprovado pelo comitê de ética e pesquisa da Universidade Franciscana sob o parecer de número 4.023.210.
Paciente de 36 anos, feminina, branca, nutricionista, buscou atendimento em clínica privada, referindo desconforto em mama esquerda há aproximadamente 1 ano.
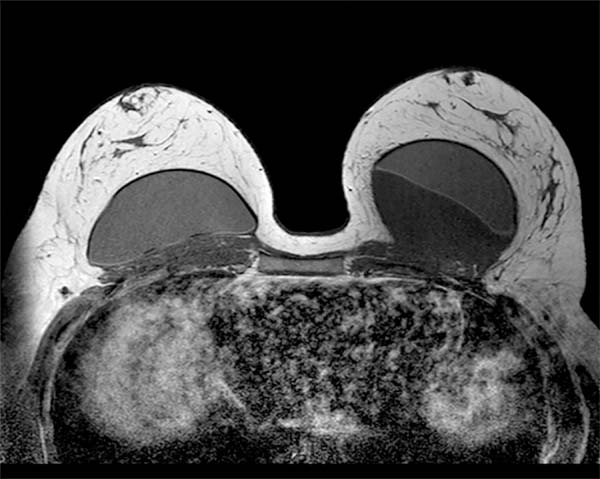
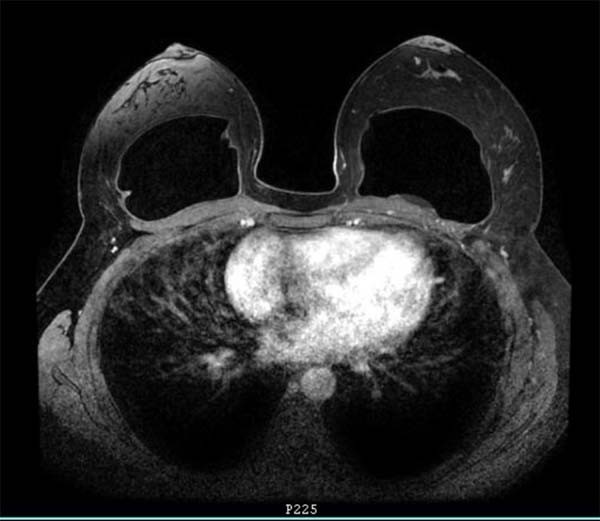
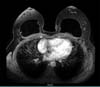
Paciente previamente hígida, IMC de 30kg/m2 sem história de tabagismo, sem antecedentes pessoais e familiares de neoplasias. História pregressa de mastopexia com implante texturizados em 2015, tendo uma deiscência de sutura na mama esquerda, sendo submetida à ressutura 2 meses após, com resolução satisfatória. Em 2016, apresentou seroma (125ml) na mama esquerda. Exames culturais foram negativos, sendo submetida à troca dos implantes, sendo utilizados nessa cirurgia implantes macrotexturizados, redondos de perfil alto, de 310g. As primeiras cirurgias foram realizadas por outra equipe não havendo dados relativos à técnica usada e cuidados profiláticos quanto à formação de biofilme. Em 2018, a paciente começou a apresentar desconforto na mama esquerda, porém com exames normais (ressonância e ultrassonografia). Em 2019, com persistência dos sintomas, novamente realizou exame de ressonância magnética, que evidenciou pequena coleção de líquido em região posterior ao implante mamário esquerdo (6ml), de classificação BI-RADS II (Figura 1), quando procurou o atendimento.
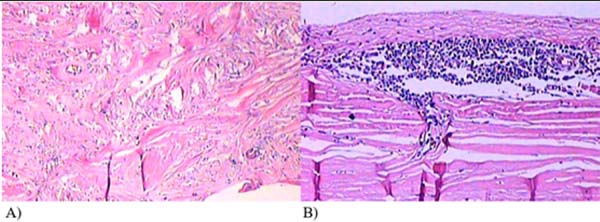
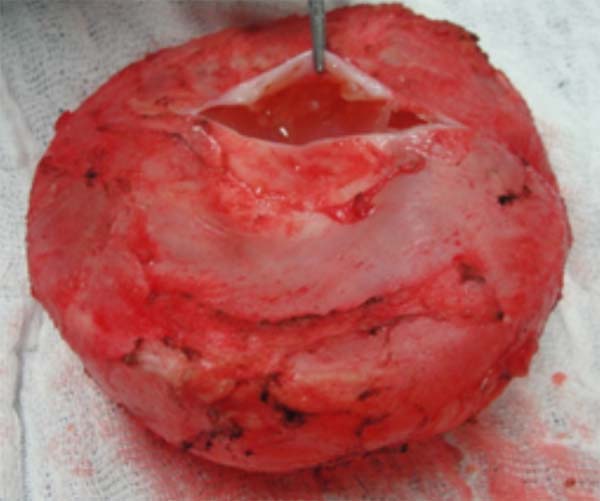
Considerando o pequeno volume e a localização de difícil acesso para punção ou coleta de material, decidiu-se pelo procedimento cirúrgico. Em setembro de 2019, através de uma incisão em sulco mamário ampliada, foi realizada uma capsulectomia completa em bloco na mama esquerda e uma capsulectomia total à direita com troca dos implantes. Nesse procedimento, foi adotado as medidas de redução de contratura capsular e formação de biofilme, sendo realizado a lavagem da loja com solução antibiótica, troca das luvas e mínimo manejo dos implantes, sendo utilizado nesse procedimento próteses redondas, microtexturizadas, de perfil alto e volume de 300cc. A cápsula da mama esquerda apresentava-se espessada, com a presença de uma septação na região posterior com líquido translúcido (Figura 2). A mama direita apresentava uma cápsula dupla, com deslizamento entre os folhetos, porém sem líquido. Todo material foi enviado para análise histopatológica e pesquisa de CD30 e ALK, levando-se em conta a possibilidade de BIA- ALCL (Figuras 3 e 4). Após o procedimento, não ocorreram complicações, tendo a paciente permanecido satisfeita e assintomática num seguimento de um ano após a cirurgia.
DISCUSSÃO
O caso evidencia a importância de diferenciar a reação fisiológica do organismo ao implante mamário de patologias como a contratura capsular, formação de seroma e o BIA-ALCL. Essencialmente, a reação cicatricial se inicia com o recrutamento de células inflamatórias e mais tardiamente com fibroblastos e miofibroblastos, formando a cápsula periprotética, algumas condições podem causar um desequilíbrio nesse processo2,6.
Após a colocação da prótese nessa paciente em 2015, ocorreu uma deiscência na ferida operatória da mama esquerda que pode ter favorecido a formação de um biofilme ao redor do implante esquerdo2,6, o que poderia explicar a formação do seroma unilateral, mesmo anos após a colocação6,7. Bengtson et al. (2011)8 associam a formação de seroma tardio a uma cápsula dupla de aderência fibrosa circunferencial, com camada interna aderida à prótese e a externa ao tecido mamário, porém não aconteceu isso na mama direita. Hall-Findlay (2011)9 destaca a possível causa mecânica do seroma tardio, associada à separação da cápsula em duas camadas com superfícies ásperas (dupla cápsula) após microtraumas, criando o seroma devido às forças de cisalhamento6,9.
Devido ao seroma em 2016, foi realizada a troca das próteses e capsulectomia parcial, sendo feito apenas exames microbiológicos, que vieram negativos. A paciente apresentou desconforto mamário 2 anos após, provavelmente em decorrência de uma contratura capsular, mesmo que não evidenciada nos exames em 2018.
A contração do tecido fibrótico ao redor do implante, geralmente mais frequente nos primeiros 12 meses após a cirurgia, pode causar alterações na palpação, dor ou deformidade visível, o que não acontece em situações normais1. A contratura capsular é considerada a complicação inerente ao procedimento com maior necessidade de reintervenção2, cuja incidência e gravidade é correlacionada com alinhamento das fibras de colágeno7.
Em 2019, após repetir o US e RM, uma coleção pequena atrás do implante da mama esquerda com cerca de 6 ml foi identificada. Nesse mesmo ano, houve o recall das próteses mamárias de uma determinada marca, associada ao BIA-ALCL, o que era o caso das próteses dessa paciente. Relatos na literatura têm levantado discussões sobre complicações associadas aos implantes mamários texturizados, como seroma tardio, cápsula dupla e BIA-ALCL3,4,6.
Diversos estudos consideram que a contaminação bacteriana, que pode acontecer ainda durante o procedimento de colocação de prótese, seria responsável pela formação de biofilme e, posteriormente, resposta inflamatória e ativação do sistema imunológico². Essa resposta, associada à predisposição genética, poderia ao longo do tempo ser responsável pelo desenvolvimento do BIA-ALCL devido à estimulação crônica do antígeno bacteriano3,9-13.
Segundo as diretrizes de diagnóstico e tratamento do BIA-ALCL do National Comprehensive Cancer Network, de 201914, derrames periprotéticos sintomáticos, com mais de 1 ano após o implante, devem ser investigados através de imagem por ultrassom ou ressonância magnética e testados para BIA-ALCL. Se o achado tiver mais de 50ml, é indicada investigação através de punção por agulha fina, sendo solicitado a citologia, a citometria de fluxo para caracterização dos linfócitos “T”, com pesquisa de imuno-histoquímica para CD30, ALK entre outros marcadores, se houver massa palpável pode-se realizar biópsia incisional ou core biopsy e, em casos inconclusivos, prosseguir a investigação com mais imagens.
Segundo Leberfinger et al. (2017)15, o número de mulheres com implantes necessários para causar 1 caso de BIA-ALCL antes dos 75 anos foi de 6.920, mas apesar de baixo risco absoluto para o desenvolvimento da doença, existe um aumento na incidência nos últimos anos. O BIA-ALCL é geralmente indolente e de crescimento lento, com excelente prognóstico, principalmente quando tratado com cirurgia, a qual deve ser para remover o implante com a cápsula fibrosa e qualquer massa associada. A excisão cirúrgica completa prolonga a sobrevida global e a sobrevida livre de eventos em comparação com todas as outras intervenções terapêuticas14.
Considerando a apresentação clínica inespecífica e os exames não conclusivos, somados ao temor da paciente diante de uma patologia relacionada à marca da prótese que ela tinha, foi indicado um explante com capsulectomia completa em bloco na mama esquerda, e capsulectomia à direita, com substituição bilateral das próteses. Nesse procedimento as cápsulas foram totalmente removidas e sendo realizado as medidas para prevenção da formação de biofilme e contratura capsular. A paciente ficou assintomática e o diagnóstico final foi de contratura capsular, com uma septação posterior devido à cápsula residual.
CONCLUSÃO
Esse estudo salienta a importância do acompanhamento a longo prazo de pacientes com próteses mamárias, levando em consideração o aumento da incidência de relatos de seromas tardios, dupla cápsula, infecções subclínicas com formação de biofilme e seus mecanismos fisiopatológicos interligados com a formação do BIA-ALCL, uma patologia de excelente prognóstico se tratada em estágio inicial.
REFERÊNCIAS
1. Chao AH, Garza R, Povoski SP. A review of the use of silicone implants in breast surgery. Expert Rev Med Devices. 2016;13(2):143-56.
2. Mempin M, Hu H, Chowdhury D, Deva A, Vickery K. The A, B and C’s of silicone breast implants: anaplastic large cell lymphoma, biofilm and capsular contracture. Materials (Basel). 2018 Nov;11(12):2393.
3. Real DSS, Resendes BS. Breast implant-associated anaplastic large-cell lymphoma: a systematic literature review. Rev Bras Cir Plást. 2019;34(4):531-8.
4. De Boer M, Van Leeuwen FE, Hauptmann M, Overbeek LIH, De Boer JP, Hijmering NJ, et al. Breast implants and the risk of anaplastic large-cell lymphoma in the breast. JAMA Oncol. 2018 Mar;4(3):335-41.
5. Agha RA, Franchi T, Sohrabi C, Mathew G, Kerwan A, SCARE Group. The SCARE 202 guideline: updating consensus surgical case report (SCARE) guidelines. Int J Surg. 2020 Dez;84:226-30.
6. Scala FD, Polizzi RJ, Casala TG, Santos FZF, Squarisi JMO, Freitas DIBV. Late seroma in breast reconstructions and mammoplasty with silicone implants: a case report and literature review. Rev Bras Cir Plást. 2015;30(3):468-72.
7. Calobrace MB, Schwartz MR, Zeidler KR, Pittman TA, Cohen R, Stevens WG. Long-term safety of textured and smooth breast implants. Aesthet Surg J. 2017 Dez;38(1):38-48.
8. Bengtson B, Brody GS, Brown MH, Glicksman C, Hammond D, Kaplan H, et al. Managing late periprosthetic fluid collections (seroma) in patients with breast implants: a consensus panel recommendation and review of the literature. Plast Reconstr Surg. 2011 Jul;128(1):1-7.
9. Hall-Findlay EJ. Breast implant complication review: double capsules and late seromas. Plast Reconstr Surg. 2011 Jan;127(1):56-66.
10. Zingaretti N, Galvano F, Vittorini P, De Francesco F, Almesberger D, Riccio M, et al. Smooth prosthesis: our experience and current state of art in the use of smooth sub-muscular silicone gel breast implants. Aesthetic Plast Surg. 2019;43:1454-66. DOI: https://doi.org/10.1007/s00266-019-01464-9
11. Fricke A, Wagner JA, Kricheldorff J, Rancsó C, Von Fritschen U. Microbial detection in seroma fluid preceding the diagnosis of breast implant-associated anaplastic large cell lymphoma: a case report and review of the literature. Case Reports Plast Surg Hand Surg. 2019;6(1):116-20.
12. Moon DJ, Deva AK. Adverse events associated with breast implants: the role of bacterial infection and biofilm. Clin Plast Surg. 2021 Jan;48(1):101-8. DOI: https://doi.org/10.1016/j.cps.2020.09.009
13. Batista BN, Garicochea B, Aguilar VLN, Millan FMCS, Fraga MFP, Sampaio MMC, et al. Report of a case of anaplastic large cell lymphoma associated with a breast implant in a Brazilian patient. Rev Bras Cir Plást. 2017;32(3):445-9.
14. Clemens MW, Jacobsen ED, Horwitz SM. 2019 NCCN consensus guidelines on the diagnosis and treatment of breast implant-associated anaplastic large cell lymphoma (BIA-ALCL). Aesthet Surg J. 2019 Jan;3939(Supl 1):S3-13.
15. Leberfinger AN, Behar BJ, Williams NC, Rakszawski KL, Potochny JD, MacKay DR, et al. Breast implant-associated anaplastic large cell lymphoma: a systematic review. JAMA Surg. 2017 Dez;152(12):1161-8.
1. Universidade Franciscana, Faculdade de Medicina, Santa Maria, RS, Brasil.
GCR Análise estatística, Conceitualização, Investigação, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição
VHA Análise e/ou interpretação dos dados, Coleta de Dados, Conceitualização, Redação - Preparação do original, Redação - Revisão e Edição
Autor correspondente: Giancarlo Cervo Rechia Rua Pinheiro Machado, 2494, Sala 402, Bairro Centro, Santa Maria, RS, Brasil. CEP 97050-600 E-mail: giancarlorechia@hotmail.com
Artigo submetido: 22/05/2020.
Artigo aceito: 23/04/2021.
Conflitos de interesse: não há.





 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter