

Original Article - Year 2021 - Volume 36 -
Estudo prospectivo da reposta inflamatória em pacientes submetidas à abdominoplastia pós-cirurgia bariátrica
Prospective study of inflammatory response in patients submitted to abdominoplasty after bariatric surgery
RESUMO
Introdução: A obesidade é uma doença inflamatória crônica associada a alterações de marcadores inflamatórios como as interleucinas e PCR. O objetivo deste estudo é avaliar a resposta inflamatória, através das variações das interleucinas e PCR, em pacientes submetidas à abdominoplastia.
Métodos: Quatorze pacientes foram submetidas à abdominoplastia após perda ponderal alcançada por meio da cirurgia bariátrica com manutenção da perda ponderal por, ao menos, 18 meses. Os níveis de IL4, IL6, IL10 e PCR foram verificados nos tempos: pré-operatório, durante a cirurgia, 24 horas após a cirurgia, 7o dia pós-operatório e 14o dia pós-operatório.
Resultados: IL4 aumentou nas 24 horas de pós-operatório e seguiu em ascensão até o 14 o dia. IL10 subiu durante a cirurgia e começou a cair nas 24 horas de pós-operatório a níveis inferiores aos iniciais. IL6 começou a subir durante a cirurgia, mais expressivamente nas 24 horas de pós-operatório, seguida de queda até o 14o dia. A PCR aumentou nas 24 horas de pós-operatório e continuou alta até o 14o dia.
Conclusão: A abdominoplastia promoveu uma amenização do quadro inflamatório sistêmico crônico.
Palavras-chave: Obesidade; Cirurgia plástica; Abdominoplastia; Inflamação; Mediadores da Inflamação; Cirurgia bariátrica
ABSTRACT
Introduction: Obesity is a chronic inflammatory disease associated with changes in inflammatory markers such as interleukins and CRP. This study evaluates the inflammatory response, through variations in interleukins and CRP, in patients undergoing abdominoplasty.
Methods: Fourteen patients underwent abdominoplasty after weight loss achieved through bariatric surgery to maintain weight loss for at least18 months. Il4, IL6, IL10 and PCR levels were verified at times: preoperative, during surgery, 24 hours after surgery, 7th postoperative day and 14th postoperative day.
Results: IL4 increased in the 24 hours postoperatively and continued on the rise until the 14th day. IL10 went up during surgery and began to fall in the 24 hours postoperatively to levels lower than the initial ones. IL6 began to rise during surgery, being more expressive in the 24 hours postoperatively, followed by a fall until the 14th day. CRP increased 24 hours postoperatively and remained discharged until the 14th day.
Conclusion: Abdominoplasty reduced the chronic inflammatory systemic condition.
Keywords: Obesity; Plastic surgery; Abdominoplasty; Inflammation; Inflammation Mediators; Bariatric surgery.
INTRODUÇÃO
A obesidade é uma doença inflamatória1, caracterizada pela produção de citocinas, concernentes às respostas inflamatórias2-4. Estas citocinas são interleucinas (IL) produzidas no tecido gorduroso graças às suas propriedades endócrinas. Destarte, a resposta inflamatória da obesidade acarreta elevação da produção de interleucinas inflamatórias e redução das interleucinas com propriedades anti-inflamatórias5. A variação destas interleucinas promove uma alteração do perfil glicêmico e insulínico, caracterizando uma concomitante síndrome metabólica6,7.
OBJETIVO
Este trabalho tem o objetivo de analisar as variações da resposta inflamatória, através das modificações dos níveis das interleucinas e consequente modificação das taxas de proteína C-reativa (PCR) de pacientes pós-bariátricas submetidas à abdominoplastia em âncora.
MÉTODOS
O presente estudo prospectivo foi realizado com quatorze pacientes do sexo feminino que foram submetidas à abdominoplastia em âncora8 após perda ponderal obtida através da cirurgia bariátrica. Os critérios de inclusão foram: apresentar perda de peso às custas da cirurgia bariátrica e manutenção do novo peso há, ao menos, 18 meses; estar em acompanhamento no grupo de cirurgia do contorno corporal do Hospital de Clínicas da FMUSP no período de realização do trabalho, primeiro semestre do ano de 2018; em acompanhamento multidisciplinar, composto por endocrinologista, cirurgião do aparelho digestivo, psicólogo e cirurgião plástico. Os critérios de exclusão foram: pacientes que eram tabagistas, usavam hormônios contraceptivos ou de reposição, drogas recreativas ou que pudessem afetar o comportamento.
A média etária, na ocasião da cirurgia plástica, foi de 45,92 anos, com extremos de 29 a 60 anos. O intervalo médio entre a cirurgia bariátrica e a abdominoplastia foi de 5,8 anos, variando entre 2 e 12 anos. O IMC (índice de massa corpórea) médio antes da cirurgia bariátrica foi de 45,63kg/m2 e antes da abdominoplastia foi de 29,62kg/m2, com extremos de 21,3 a 36,7kg/m2. O peso médio das peças cirúrgicas ressecadas foi de 2.068kg, variando entre 1.000 a 3.600kg (Tabelas 1 e 2).
| Idade das pacientes (anos): | |
|---|---|
| Antes da cirurgia bariátrica | Antes da abdominoplastia |
| Média 42 - 35 | Média 45-95 |
| Mínima 21 | Mínima 29 |
| Máxima 58 | Máxima 60 |
Foram coletadas amostras de sangue em cinco tempos: pré-operatório, intraoperatório, 24 horas após a cirurgia, 7º dia pós-operatório e 14º dia pós-operatório.
As análises quantitativas das interleucinas IL4, IL6 e IL10 foram feitas com método de imunoensaio com “beads” magnéticas Milliplex e MagPix System (Merck Millipore, USA) e os resultados foram aferidos em pg/dL (picogramas por decilitros).
A proteína C-reativa (PCR) foi analisada pelo C-Reactive Protein Gen.3. Teste imunoturbidimétrico para determinação quantitativa in vitro de PCR em soro e plasma humanos, utilizando os sistemas Roche/Hitachi cobas c, e medida em mg/dL.
As pacientes assinaram o termo de consentimento livre e esclarecido autorizando o estudo previamente ao procedimento.
O projeto foi aprovado pela comissão de ética em pesquisa (CAPPesq) do hospital sob o número 48112015.8.0000.0068. Não possui suporte de agências de fomento de pesquisa e tampouco entidades privadas, portanto não há conflito de interesses.
RESULTADOS
Os resultados obtidos foram agrupados em valores absolutos e apresentam-se na Tabela 3.
| Pré | Trans | 24hPO | 7PO | 14PO | |
|---|---|---|---|---|---|
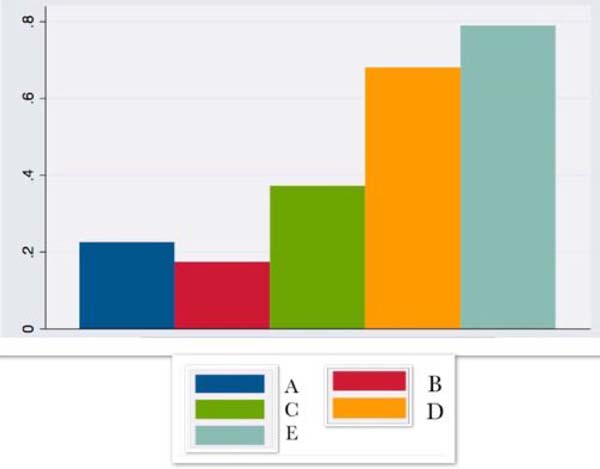
| IL4 | 0,22 ± 0,4 | 0,17 ± 0,2 | 0,37 ± 1,0 | 0,68 ± 1,2 | 0,79 ±2,2 |
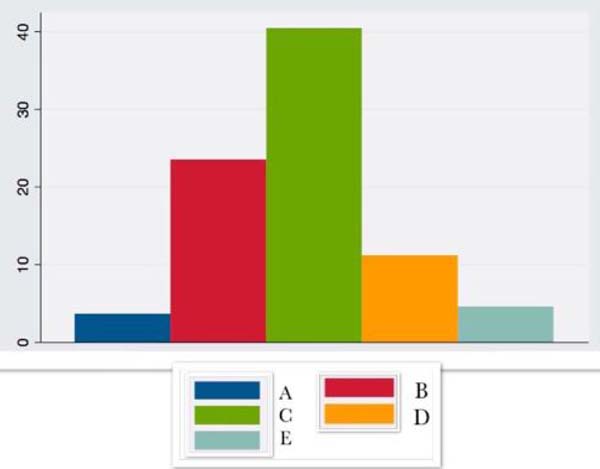
| IL6 | 3,66 ± 13,0 | 23,5 ± 23,9 | 40,43 ±15,1 | 11,2 ± 8,4 | 4,53 ± 8,5 |
| IL10 | 6,02 ± 6,2 | 47,4 ± 50,6 | 11,48 ± 6,9 | 6,18 ± 6,3 | 4,59 ± 4,2 |
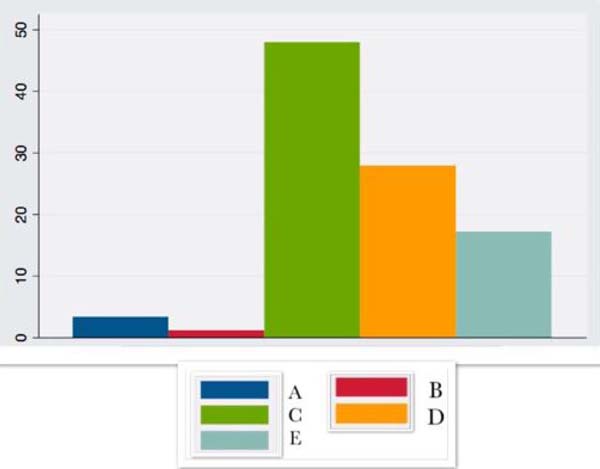
| PCR | 3,3 ± 7,7 | 1,15 ± + - 1,3 | 47,9 ±24,1 | 27,85 ± 19,8 | 17,2 ± 38,6 |
Esses resultados têm representação gráfica nas Figuras 1, 2, 3 e 4; onde os períodos pré-operatório (A), transoperatório (B), 24 horas após a cirurgia (C), 7º dia pós-operatório (D) e 14º dia pós-operatório (E) são apresentados.
A IL4 começou a subir nas primeiras horas após a cirurgia e manteve-se em ascensão até o 14º dia pós-operatório.
A IL6 apresentou aumento no intraoperatório, sendo mais expressiva nas 24 horas após a cirurgia, com queda progressiva até o 14º dia pós-operatório.
A IL10 apresentou aumento no intraoperatório, seguido de queda a níveis inferiores aos iniciais.
A PCR apresentou grande aumento nas primeiras horas após a cirurgia, permanecendo elevada até o 14º dia pós-operatório.
DISCUSSÃO
O tecido gorduroso é responsável pela produção de interleucina IL6, considerada um marcador inflamatório, e IL4 e IL10, anti-inflamatórias2-4. A IL6, além de outras propriedades, estimula a produção de proteínas inflamatórias no fígado, com especial destaque, objeto deste estudo, da proteína C-reativa (PCR). As pacientes do estudo, por se tratarem de pacientes com obesidade severa - IMC médio de 45,63kg/m2 (35,6 a 56,7kg/m2) - antes da cirurgia bariátrica, apesar de terem apresentado grandes perdas ponderais, ainda mantiveram IMC elevado, na ocasião da abdominoplastia, correspondendo a 29,62kg/m2 (21,3 a 36,7kg/m2); por conseguinte, com padrão basal de marcadores inflamatórios ainda elevados, dado que são moderadamente obesas. Apesar de ser notório que a perda de peso induzida pela cirurgia bariátrica, além de diminuir as doenças relacionadas ao excesso de peso, minimizam o estado inflamatório em pacientes obesas mórbidas7-10.
De acordo a literatura2,11-13, a IL4, com atividade anti-inflamatória, é produzida pela interação do complexo monócito/macrófago com o tecido adiposo. Em resposta ao trauma, ela inicia curva ascendente nas primeiras horas do pós-operatório mantendo-se em ascensão até o 14º dia pós-operatório.
As pacientes aqui compulsadas podem ser tidas como de baixo grau de inflamação crônica, associado ao aumento de marcadores inflamatórios como IL6 e PCR14,15, que têm aumento considerável no intra e pós-operatório imediato, correspondendo à resposta inflamatória ao trauma cirúrgico16. A PCR, por sua vez, apresenta um valor de base já elevado, relacionado com a própria obesidade, mesmo com a perda de peso cirurgicamente alcançada10, permanecendo elevada até o 14º dia pós-operatório no presente estudo ou por até seis meses segundo outros autores10,17.
A IL10, uma citocina anti-inflamatória produzida pelos adipócitos, apresentou aumento no intraoperatório, seguida de queda a níveis inferiores aos iniciais. Tal fato concorda com a bibliografia atinente12,18 e revela uma reação anti-inflamatória que acompanha as manifestações da IL6, considerada antagônica e cuja atividade inflamatória modifica-se no período estimado.
A abdominoplastia pós-cirurgia bariátrica não se limita a um melhor resultado estético e qualidade de vida, como já avaliado por outros autores19,20; sobretudo promove modificação dos marcadores inflamatórios e anti-inflamatórios, que, dada a ressecção do tecido gorduroso, acarretam uma amenização do quadro inflamatório crônico.
CONCLUSÃO
Pacientes com obesidade severa, apesar de grandes perdas ponderais à custa da cirurgia bariátrica, tendem a persistir com excesso de tecido dermogorduroso e, por conseguinte, marcadores inflamatórios e anti-inflamatórios basais elevados que, em resposta ao trauma cirúrgico, alteram-se por mais tempo.
Embora este estudo tenha sido realizado em menor tempo quando comparado aos estudos de outros autores, obteve-se resultados semelhantes, o que permite afirmar que, nas abdominoplastias em âncora, a minimização do quadro inflamatório dar-se-ia ao longo do tempo.
AGRADECIMENTOS
Ao Prof. Lineu Tadeu Velasco - Professor Titular da Disciplina de Emergências Clínicas do Departamento de Clínica Médica da Faculdade de Medicina da Universidade de São Paulo - em cujo laboratório - LIM-51, permitiu a realização das dosagens das interleucinas presentes no trabalho.
REFERÊNCIAS
1. Gallo JRB, Maschi-Signorini LB, Cabral CRB, Zuccari DAPC, Nogueira ML, Bozzola AR, et al. Skin protein profile after major weight loss and its role in body contouring surgery. Plast Reconstr Surg Glob Open. 2019 Ago;7(8):e2339. DOI: https://doi.org/10.1097/GOX.0000000000002339
2. Mathis D. Immunological goings-on in visceral adipose tissue. Cell Metab. 2013 Jun;17(6):851-9. DOI: https://doi.org/10.1016/j.cmet.2013.05.008
3. Zeyda M, Stulnig TM. Obesity, inflammation, and insulin resistance--a mini- review. Gerontology. 2009;55(4):379-86.
4. Hotamisligil GS. Inflammation and metabolic desorders. Nature. 2006;444(7121):860-7.
5. Bulló M, Casas-Agustench P, Amigó-Correig P, Aranceta J, Salas-Salvadó J. Inflammation, obesity and comorbidities: the role of diet. Public Health Nutr. 2007 Out;10(10A):1164-72.
6. Shah A, Mehta N, Reilly MP. Adipose inflammation, insulin resistance, and cardiovascular disease. JPEN J Parenter Enteral Nutr. 2008 Nov/Dez;32(6):638-44.
7. Modolin MLA, Wilson Junior C, Rocha RI, Camargo CP, Giuliani NR, Gemperli R. Analysis of inflammatory and metabolic bomarkers in pacientes submetted to abdominoplasty after bariatric surgery. Acta Cir Bras. 2019;34(5):e201900506. DOI: http://dx.doi.org/10.1590/s0102-86502019005000000
8. Correa-Iturraspe M. Tratamiento quirurgico de la obesidad. Rev Assoc Med Argent. 1952,66:340-5.
9. Freitas Junior WR, Oliveira LVF, Perez EA, Ilias EJ, Lottenberg CP, Silva AS, et al. Systemic inflammation in severe obese patients undergoing surgery for obesity and weight-related diseases. Obes Surg. 2018;28:1931-42. DOI: https://doi.org/10.1007/s11695-017-3104-9
10. Chiappetta S, Schaack HM, Wölnerhannsen B, Stier C, Squillante S, Weiner RA. The impact of obesity and metabolic surgery on chronic inflammation. Obes Surg. 2018;28:3028-40. DOI: https://doi.org/10.1007/s11695-018-3320-y
11. Sippel C, Bastian RMA, Giovanella J, Faccin C, Contini V, Dal Bosco SM. Processos inflamatórios da obesidade. RAS. 2014 Out/Dez;12(42):48-56.
12. Gómez FI, Ortega MG, Alonso AA, Soler IO, Tafalla SA, Paredes MP, et al. Obesity, endothelial function and inflammation: the effects of weight loss after bariatric surgery. Nutr Hosp. 2016 Nov;33(6):1340-6.
13. Kohen VL, Candela CG, Fernández CF, Rosa LZ, Milla SP, Urbieta M, et al. Parámetros hormonales e inflamatorios en un grupo de mujeres com sobrepeso/obesidad. Nutr Hosp. 2011;26(4):884-9.
14. Arismendi E, Rivas E, Agustí A, Rios J, Barreiro J, Vidal J, et al. The systemic inflammome of severe obesity before and after bariatric surgery. Obes Sist Inflamm. 2014;9(9):e107859.
15. Lasselin J, Magne E, Beau C, Ledaguenel P, Dexpert S, Aubert A, et al. Adipose inflammation in obesity: relationship with circulating levels of inflammatory markers and association with surgery-induced weight loss. J Clin Endocrinol Metab. 2014 Jan;99(1):E53-61. DOI: https://doi.org/10.1210/jc.2013-2673
16. Barnes MA, Carson MJ, Nair MG. Non-traditional cytokines: how catecolamines and adipokines influence macrofages in immunity, metabolismo and central nervous system. Cytokine. 2015;72(2):210-9.
17. Hanusch-Enserer U, Cauza E, Spak M, Dunky A, Rosen HR, Wolf H, et al. Acute-phase response and immunological markers in morbid obese patients and patients following adjustable gastric banding. Int J Obes. 2003 Mar;27(3):355-61. DOI: https://doi:10.1038/sj.ijo.802240
18. Pamanicolau DA, Wilder RL, Manolagas SC, Chrousos GP. The pathophysiologic roles of interleukin-6 in human disease. Ann Intern Med. 1998 Jan;128(2):127-37.
19. Wilson Junior C, Modolin MLA, Gemperli R, Gobbi CIC, Faintuch J, Ferreira MA. Quality of life after abdominoplasty in women after bariatric surgery. Obes Surg. 2008 Jun;18(6):728-32.
20. Modolin MLA, Wilson Junior C, Rocha RI, Faintuch J, Camargo CP, Gemperli R. Quality of life after postbariatric abdominoplasty in females: interest of age, current weight and weight loss. J Obes Weight Loss Ther. 2015;5:272.
1. Hospital das Clínicas de São Paulo, Grupo de Contorno Corporal da Disciplina de
Cirurgia Plástica do HC-USP, São Paulo, SP, Brasil.
2. Hospital das Clínicas da USP, Professor Titular do Serviço de Cirurgia Plástica
do HC-USP, São Paulo, SP, Brasil.
Autor correspondente: Nádia de Rosso Giuliani, Rua Capitão Rosendo, 100, Apt. 23b, Vila Mariana, São Paulo, SP, Brasil. CEP: 04120-060 E-mail: nagiuliani@yahoo.com.br
Artigo submetido: 19/08/2020.
Artigo aceito: 23/04/2021.
Conflitos de interesse: não há.
COLABORAÇÕES
NRG Análise e/ou interpretação dos dados, Análise estatística, Concepção e desenho do estudo, Metodologia, Realização das operações e/ou experimentos, Redação - Revisão e Edição
MM Aprovação final do manuscrito, Supervisão
WCJ Redação - Revisão e Edição, Supervisão
RIR Redação - Revisão e Edição, Supervisão
RG Supervisão










 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter