

Case Reports - Year 2020 - Volume 35 -
Complicação grave do uso irregular de silicone industrial em paciente transexual: relato de caso
Severe complication by irregular use of industrial silicone in a transsexual patient: a case report
RESUMO
O uso do silicone líquido industrial como material para modificação estética no contorno corporal é uma prática realizada de forma clandestina há cerca de 60 anos. Atualmente, a maioria dos relatos provém de países da Ásia e América do Sul e as vítimas são principalmente mulheres e transexuais. Devido ao grande número de casos com complicações, o uso do silicone industrial para fins estéticos nunca foi aprovado. Entretanto, continua a ser aplicado isoladamente ou associado a outros produtos, determinando graves complicações locais e sistêmicas. Relata-se um caso de óbito de paciente transexual após injeção de silicone industrial em coxas e glúteos.
Palavras-chave: Silicones; Morte; Aloenxertos; Necrose; Pessoas transgênero; Contorno corporal
ABSTRACT
The use of industrial liquid silicone as a material for aesthetic modification of body contour is a practice that has been carried out clandestine for about 60 years. Currently, most reports come from countries in Asia and South America, and the victims are mainly women and transsexuals. Due to the large number of cases with complications, the use of industrial silicone for aesthetic purposes has never been approved. However, it continues to be applied alone or associated with other products, determining severe local and systemic complications. We report a case of death of a transsexual patient after injecting industrial silicone in the thighs and buttocks.
Keywords: Silicones; Death; Allografts; Necrosis; Transgender people; Body contour.
INTRODUÇÃO
A injeção clandestina de silicone líquido industrial para modificação do contorno corporal tornou-se popular há cerca de 70 anos, quando o silicone de grau industrial foi desenvolvido durante a Segunda Guerra Mundial para fins militares1-3.
Desde a publicação de Andrews et al., em 19894, mostrando pela primeira vez as complicações locais e sistêmicas do silicone líquido em humanos, esse tipo de material teve seu uso contraindicado pela Food and Drug Administration (FDA) e pela antiga Divisão de Medicamentos (DIMED) no Brasil4,5.
Atualmente, a maioria das vítimas são mulheres e transexuais provenientes de países da Ásia e América do Sul. Por falta de recursos para a realização de cirurgias plásticas, acabam recorrendo a profissionais não habilitados1-3.
Apesar das proibições, o uso do silicone industrial para fins estéticos continua sendo feito isoladamente ou em associação com outros produtos, levando a complicações graves e potencialmente fatais1,6.
OBJETIVO
Relatar um caso de óbito após injeção de silicone industrial em glúteos e coxas em paciente transexual.
RELATO DO CASO
Neste estudo, relata-se o caso de uma paciente transexual feminina, 24 anos, hígida, apresentando injeção de 3000ml de silicone líquido industrial em glúteos e na face anterolateral das coxas. Tal procedimento foi realizado em ambiente domiciliar, por profissional não habilitado.
Após 5 dias iniciou quadro de sinais flogísticos e epidermólise no local das infiltrações, sendo submetida a um desbridamento superficial em serviço médico próximo à sua residência. Devido a uma piora do estado geral, procurou então o pronto-socorro do Hospital das Clínicas da Universidade de São Paulo.
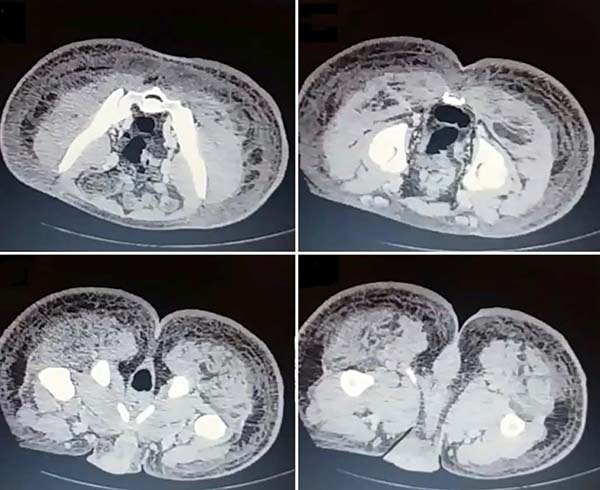
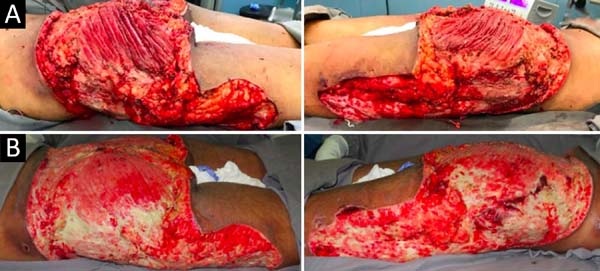
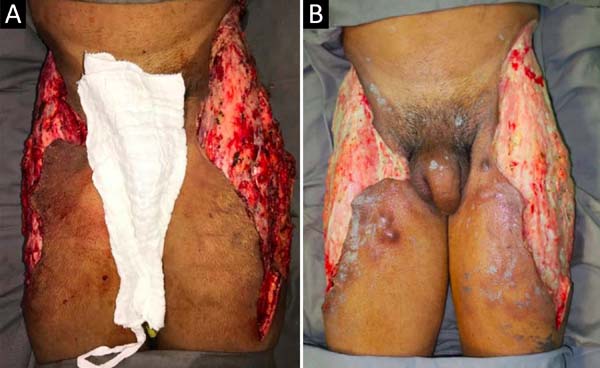
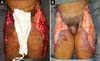
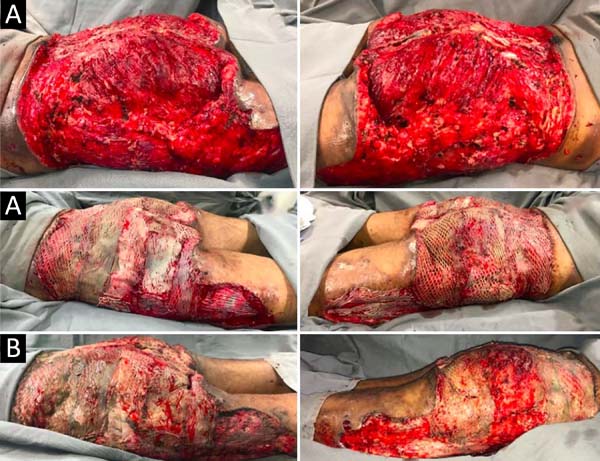
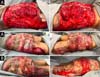
Na admissão, já apresentava necrose extensa nos glúteos e região lateral do quadril associada a sinais de choque séptico, sendo necessária intubação orotraqueal e uso de droga vasoativa. Os exames de imagem evidenciaram densificação difusa com lâminas líquidas de permeio, mais acentuadas nas regiões lombar, sacral, glúteos e raízes das coxas (Figura 1). A paciente foi submetida a um total de seis procedimentos cirúrgicos sequenciais para desbridamento amplo de tecidos desvitalizados, com identificação de coleções purulentas e substância viscosa, compatível com silicone (Figuras 2, 3 e 4). Inicialmente, foi utilizada a terapia por pressão negativa. Após o segundo desbridamento, esta foi substituída por curativo simples com sulfadiazina de prata 1% e nitrato de cério. A antibioticoterapia foi guiada por culturas.
Com um quadro de insuficiência renal aguda dialítica atribuída à sepse e ao uso de drogas nefrotóxicas, a paciente permaneceu em leito de UTI.
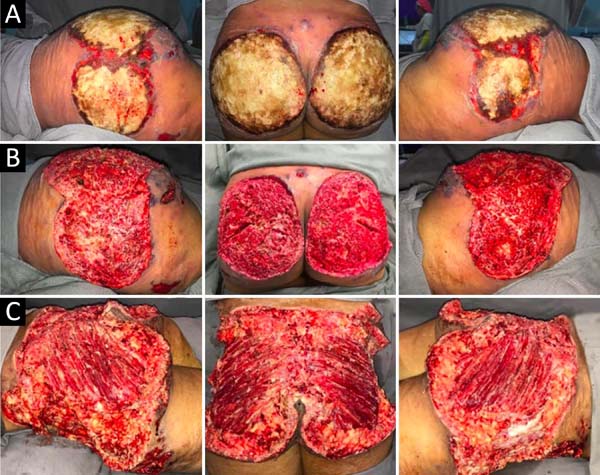
No trigésimo segundo dia de internação, tendo em vista um aparente controle local e sistêmico da infecção, foi realizada enxertia de pele parcial alógena, em malha (3:1), sobre as áreas cruentas com a finalidade de reduzir o grau de espoliação (Figura 5).
No entanto, cinco dias após a enxertia, a paciente apresentou nova piora clínica com instabilidade hemodinâmica, evoluindo a óbito. O laudo da necropsia definiu a causa da morte como choque séptico de foco pulmonar e cutâneo.
DISCUSSÃO
O polidimetilsiloxano (silicone) é um composto formado pela conjugação do silício com oxigênio e metano. Na sua fabricação é inerentemente contaminado com impurezas, metais pesados e polímeros voláteis. Além disso, ao endurecer acaba liberando ácido acético, que pode ser responsável pelo dano tecidual inicial após a injeção. Essa combinação de fatores contribui para as graves complicações frequentemente observadas6.
Além do seu uso isolado, o silicone também é intencionalmente associado a outros agentes com a finalidade de aumentar a inflamação e a fibroplasia nos locais de injeção, evitando a sua migração pela ação gravitacional. A fórmula de Sakurai é um exemplo conhecido da sua associação com azeite. Outros agentes esclerosantes utilizados são óleo de cróton, veneno de cobra e óleo de amendoim7.
O termo siliconoma foi criado por Winer et al., em 19642, para descrever a reação de corpo estranho semelhante às já descritas após a injeção de óleo e parafina. Estas substâncias promovem um tipo equivalente de reação tecidual anatomopatológica, chamada de lipogranulomatose esclerosante1,5,8,9.
Numa tentativa de eliminação, através da atividade fagocitária de macrófagos tissulares e de células sanguíneas circulantes, o silicone pode ser transportado por via linfática para órgãos à distância, levando a quadros de embolia. Além disso, a sua própria injeção intravascular pode resultar também em embolia imediata4,10,11.
Neste contexto, em decorrência da natureza ilegal da prática, existem poucos relatos de reações agudas. Esses pacientes relutam em procurar atendimento médico, exceto em circunstâncias de risco de vida. As manifestações sistêmicas mais graves incluem comprometimento pulmonar, neurológico, cardíaco, hepático, gastrointestinal e sepse12.
Do ponto de vista local, as complicações variam desde alterações da cor e consistência da pele até um processo inflamatório intenso com nódulos, ulcerações, necrose, abscessos e fístulas. São observadas também retrações e deformidades cicatriciais. O período de latência para o aparecimento dessas sequelas é variável, podendo chegar a até 30 anos. Portanto, a identificação e a punição dos responsáveis é frequentemente difícil5,10.
Segunda a literatura, a eliminação completa dos depósitos de silicone é inviável, já que o silicone na forma líquida se difunde pelos tecidos profundos, formando ilhas de fibrose entre tecidos saudáveis. Dessa forma, a sua erradicação culminaria em ressecções muito ampliadas levando a sequelas ainda mais graves3,5,9.
O desbridamento dos tecidos desvitalizados e a irrigação precoces podem minimizar o dano causado pela reação inicial de endurecimento do silicone e diluir os contaminantes. Além da intervenção cirúrgica, o uso de curativos antimicrobianos, antibióticos endovenosos e esteroides sistêmicos também é recomendado5,9.
A enxertia de pele alógena, como curativo biológico, é uma opção até que o leito das feridas esteja devidamente preparado para receber os autoenxertos ou outra cobertura definitiva. Retalhos locais ou regionais devem ser usados para reconstruir áreas com exposição de estruturas profundas.
Apesar dos relatos de terapias adjuvantes como oxigênio hiperbárico, o uso de corticosteroides intralesionais e imunomoduladores tópicos, ainda não existem estudos suficientes validando a sua eficácia. Já a lipoaspiração não parece ser eficaz na remoção de tecidos impregnados com óleo fibrosado. A intensa fibrose local, por si só dificulta a aspiração com cânulas, bem como aumenta o risco de lesões de estruturas adjacentes3,5.
A Agência Nacional de Vigilância Sanitária (Anvisa) proíbe o uso de silicone líquido de grau industrial em procedimentos estéticos, sendo sua aplicação considerada crime contra a saúde pública previsto no Código Penal. Para finalidades estéticas, o polidimetilsiloxano (silicone) é matéria-prima para inúmeros tipos de próteses e implantes, devendo ser manipulados por pessoas habilitadas e em ambiente hospitalar13.
O uso exclusivo do produto médico que contém óleo de silicone autorizado pela Anvisa é para o tratamento de doenças da retina com a finalidade de promover tamponamento intraocular9,14. Portanto, além de restrito ao médico especialista em oftalmologia, é vedada a sua utilização para preenchimentos faciais ou no tratamento do contorno corporal15.
CONCLUSÃO
A injeção de silicone líquido industrial com finalidade estética para alteração do contorno corporal, além de fortemente contraindicada, é considerada crime contra a saúde pública previsto no Código Penal. Sua utilização indevida produz complicações graves, de tratamento difícil e potencialmente fatais, como descritas neste relato de caso.
REFERÊNCIAS
1. Behar TA, Anderson EE, Barwick WJ, Mohler JL. Sclerosing lipogranulomatosis: a case report of scrotal injection of automobile transmission fluid and literature review of subcutaneous injection of oils. Plast Reconstr Surg. 1993 Fev;91(2):352-61.
2. Winer LH, Sternberg TH, Lehman R, Ashley FL. Tissue reactions to injected silicone liquids. A report of three cases. Arch Dermatol. 1964 Dez;90:588-93.
3. Hage JJ, Kanhai RC, Oen AL, van Diest PJ, Karim RB. The devastating outcome of massive subcutaneous injection of highly viscous fluids in male-to-female transsexuals. Plast Reconstr Surg. 2001 Mar;107(3):734-41.
4. Andrews JM, Haddad CM, Ramos RR, Martins DMFS, Ferreira LM. Morbidade e mortalidade após injeção de silicone líquido em seres humanos. A Folha Médica. 1989 Ago;99(2).
5. Freitas RJ, Cammarosano MA, Rossi RHP, Bozola AR. Injeção ilícita de silicone líquido: revisão de literatura a propósito de dois casos de necrose de mamas. Rev Bras Cir Plást. 2008;23(1):53-7.
6. Chasan PE. The history of injectable silicone fluids for soft-tissue augmentation. Plast Reconstr Surg. 2007;120(7):2034-40;discussion:2041-3.
7. Balkin SW. DPM injectable silicone and the foot: a 41-year clinical and histologic history. Dermatol Surg. 2005;31:1557.
8. Narins RS, Beer K. Liquid injectable silicone: a review of its history, immunology, technical considerations, complications, and potential. Plast Reconstr Surg. 2006 Set;118(3 Suppl):77S-84S.
9. Rohrich RJ, Potter JK. Liquid injectable silicone: is there a role as a cosmetic soft-tissue filler?. Plast Reconstr Surg. 2004 Abr;113(4):1239-41.
10. Gemperli R, Alonso N, Lodovici O, Pigossi N. Estudo clínico das reações sistêmicas e locais ao uso indevido do silicone líquido e/ou óleo mineral. Rev Hosp Fac Med S Paulo. 1984;39(4):158-62.
11. Schmid A, Tzur A, Leshko L, Krieger BP. Silicone embolism syndrome: a case report, review of the literature, and comparison with fat embolism syndrome. Chest. 2005 Jun;127(6):2276-81.
12. Bartsich S, Wu JK. Silicone embolism syndrome: a sequela of clandestine liquid silicone injections. A case report and review of the literature. J Plast Reconstr Aesthet Surg. 2010;63(1):e1-3.
13. Agência Nacional de Vigilância Sanitária (ANVISA). Portal ANVISA [Internet]. Brasília (DF): ANVISA; 2020; [acesso em 2020 Mar 10]. Disponível em: http://portal.anvisa.gov.br/
14. Siqueira RC, Gil ADC, Jorge R. Cirurgia de descolamento de retina com injeção de óleo de silicone no sistema de vitrectomia transconjuntival sem sutura de 23-gauge. Arq Bras Oftalmol. 2007;70(6):905-9.
15. Agência Nacional de Vigilância Sanitária (ANVISA). Consultas [Internet]. Brasília (DF): ANVISA; 2020; [acesso em 2020 Fev 10]. Disponível em: https://consultas.anvisa.gov.br/#/saude/253510028760211/
1. Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo,
SP, Brasil.
Instituição: Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.
MM Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Coleta de Dados, Conceitualização, Metodologia, Redação - Preparação do original, Visualização
GGRM Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Coleta de Dados, Concepção e desenho do estudo, Gerenciamento do Projeto, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição
EfBB Análise estatística, Aprovação final do manuscrito, Coleta de Dados, Concepção e desenho do estudo, Metodologia, Redação - Preparação do original
DAM Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Concepção e desenho do estudo, Metodologia, Redação - Preparação do original, Supervisão, Validação
AAMJ Aprovação final do manuscrito, Redação - Revisão e Edição, Supervisão, Validação
RG Análise e/ou interpretação dos dados, Redação - Revisão e Edição, Supervisão
Autor correspondente: Gustavo Gomes Ribeiro Monteiro, Rua Enéas de Carvalho Aguiar, 255, Ribeirão Preto, SP, Brasil. CEP: 14020-130. E-mail: monteiroggr@hotmail.com
Artigo submetido: 14/04/2019.
Artigo aceito: 12/06/2020.
Conflitos de interesse: não há.




 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter