

Review Article - Year 2020 - Volume 35 -
Síndrome da embolia gordurosa secundária ao uso de polimetilmetacrilato na bioplastia: uma revisão sistemática
Fat embolism syndrome secondary to the use of polymethylmethacrylate in bioplasty: a systematic review
RESUMO
A síndrome da embolia gordurosa (SEG) é definida como a presença de êmbolos gordurosos, não apenas no sistema pulmonar, como também na circulação sistêmica, com manifestações inflamatórias, neurológicas e cutâneas. Na cirurgia estética, atualmente, o material polimetilmetacrilato (PMMA) apresenta indicação para técnicas de preenchimento cutâneo, utilizado na forma injetável em pequenos procedimentos estéticos não incisionais, conhecidos como bioplastia. O presente estudo teve como objetivo fazer uma revisão sistemática de literatura para mostrar estudos clínicos que abordassem a ocorrência de síndrome da embolia gordurosa em pacientes que se submeteram a infiltração de PMMA (polimetilmetacrilato) na bioplastia. Mesmo com esgotamento de fontes e ampliação da pesquisa sistemática que seguiu os preceitos do protocolo PRISMA, a resposta foi de apenas um artigo que foi adicionado ao presente estudo. Infelizmente não há revisões ou estudos experimentais que contemplem a SEG na infiltração com PMMA. A maioria dos relatos disponibilizados é proveniente de lipoaspiração e correlacionados ao trauma ósseo quando citado o uso de PMMA. Esta revisão serve de alerta para os estudos e relatos não científicos sobre os riscos da utilização de PMMA na bioplastia, mas não se obteve relatos ou relacionados com a embolia gordurosa, potencialmente fatal.
Palavras-chave: Polimetilmetacrilato; Embolia gordurosa; Preenchedores dérmicos; Cirurgia plástica; Efeitos adversos de longa duração
ABSTRACT
Fat embolism syndrome (FES) is defined as the presence of fatty emboli, not only in the pulmonary system, but also in the systemic circulation, with inflammatory, neurological and cutaneous manifestations. Currently, in cosmetic surgery, the polymethylmethacrylate (PMMA) material is indicated for skin filling techniques used in injectable form in small non-incisional aesthetic procedures, known as bioplasty. The objective of this study was to carry out a systematic review of the literature to show clinical studies that addressed the appearance of fat embolism syndrome in patients who underwent PMMA (polymethylmethacrylate) infiltration in bioplasty. Even with the exhaustion of sources and the expansion of systematic research that followed the precepts of the PRISMA protocol, the answer was only one article that was added to the present study. Unfortunately, no reviews or experimental studies are looking at FES in PMMA infiltration. Most of the available reports are about liposuction and correlate with bone trauma when PMMA use is mentioned. This review serves as a wake-up call for nonscientific studies and reports on the risks of using PMMA in bioplasty, but no reports or articles were obtained related to life-threatening fat embolism.
Keywords: Polymethylmethacrylate; Fat embolism; Dermal fillers; Plastic surgery; Long-term adverse effects.
INTRODUÇÃO
Em todo o mundo, as práticas de saúde são direcionadas para uma abordagem mais preventiva, percebendo posturas que valorizam estilos de vida e comportamentos mais saudáveis com base na prevenção de doenças. Nesse contexto, também é reconhecido, que homens e mulheres buscam estratégias para reduzir sinais visíveis de envelhecimento1.
Ao exemplo da América do Norte que ocupa, atualmente, o primeiro lugar, considerando o número total de procedimentos estético-cosméticos cirúrgicos e não cirúrgicos realizados2. O Brasil ocupa o segundo lugar, sendo o primeiro colocado apenas quando os procedimentos cirúrgicos são considerados1,2.
No entanto, nos últimos anos, observa-se ênfase em procedimentos estéticos minimamente invasivos3. Essa tendência culminou com o uso de uma variedade de métodos não-incisionais para combater os efeitos do envelhecimento, sendo o aumento de tecido mole com implantes faciais infiltrativos o mais popular4.
Atualmente, um grande número de materiais de preenchimento está disponível para essa finalidade, cada um com sua composição química, indicações específicas e eficácia5. Esta ampla gama de materiais disponíveis requer que especialistas estéticos e cirurgiões plásticos escolham o preenchimento adequado para cada queixa estética de seus pacientes5,6.
O preenchimento ideal aplicado para tratar os sinais de envelhecimento ou para aumento de tecido mole deve fornecer bons resultados estéticos e apresentar um efeito em longo prazo. Também deve ser seguro, biocompatível e estável no local da implantação, com complicações de baixo risco e não migratório6.
De acordo com Lemperle et al., em 20067, todos os preenchedores dérmicos injetáveis podem causar complicações. Os efeitos colaterais tardios podem ser divididos naqueles causados por treinamento insuficiente ou erros técnicos durante a injeção, e aqueles causados por reações imunológicas (alérgicas e não alérgicas) à substância injetada. Formações de granulomas são eventos raros decorrentes do resultado da reação de hipersensibilidade do tipo IV a um corpo estranho. Geralmente, ocorrem em um período de meses a anos após a injeção3.
Entre as complicações agudas estão aquelas associadas à técnica utilizada durante a aplicação e são, em sua maioria, locais. No entanto, devido a uma reação inflamatória crônica, pode se apresentar anos após a infiltração, sendo possível ocorrer episódios de remissão - reativação2,4.
A reação histológica é sempre semelhante e o gatilho para essa estimulação súbita de macrófagos pode ser uma infecção sistêmica do paciente. Enchimentos dérmicos, tais como silicone, colágeno bovino, Artecoll® (Hafod B.V, Rotterdam, Holanda) e Restylane®8 (Q-Med AB, Estocolmo, Suécia) têm sido usados em todo o mundo.
O colágeno bovino (Zyderm®, Zyplasta®, McGhan Medical Corporation 3M, EUA) foi introduzido entre 1981 e 1983, tornando-se o padrão para os injetáveis9. A Artecoll® (Canderm Pharma Inc., Canadá) foi distribuída entre 1994 a 2006, e a Restylane® (Q-Med AB, Estocolmo, Suécia) iniciou seu avanço triunfante em 19978. Desde então, uma variedade de materiais foi introduzida, tais como o Radiesse® (Merz, Brasil), o qual é aprovado para aumento do osso facial e tem sido usado off-label desde 2003 para tratamento de rugas10; e, Sculptra® (Aventis, EUA), que é aprovado para lipodistrofia facial proveniente do vírus da imunodeficiência humana, mas tem sido utilizado para tratamento de rugas desde 2005. A Food and Drug Administration (FDA - EUA) aprovou Restylane® em 2003, Hylaform® (Genzy me Biosurgery, EUA) em 2004, Captique® em 2005 e Juvedermem® 2006 (ambos da Allergan, EUA) para o tratamento de rugas faciais9.
A molécula de polimetilmetacrilato (PMMA) não possui nenhum componente animal em sua estrutura, o que torna essa molécula um material biocompatível e, também, confere estabilidade mesmo após décadas do implante inicial. Suas aplicações comerciais são microesferas de PMMA suspensas em colágeno bovino2.
No contexto de indicações do composto PMMA destaca-se preenchimento de sulcos, de rugas profundas, de cicatrizes, de defeitos dérmicos, de tecidos moles e ósseos6. É empregado, também, em procedimentos restaurativos para a correção volumétrica facial e corporal da síndrome da lipodistrofia, decorrente do uso de antirretrovirais em pacientes portadores do vírus da imunodeficiência humana11.
A síndrome da embolia gordurosa (SEG) é uma entidade clínica mal definida que surge das manifestações sistêmicas de êmbolos de gordura dentro da microcirculação. A gordura embolizada nos leitos capilares causa dano tecidual direto, além de induzir uma resposta inflamatória sistêmica, resultando em sintomas pulmonares, cutâneos, neurológicos e retinianos. Ocorre com mais frequência após trauma ortopédico; no entanto, pacientes com muitas condições clínicas, incluindo lipoaspiração, transplante de medula óssea, pancreatite e, como constatado no presente estudo, raramente em procedimentos com uso de preenchimentos de PMMA na bioplastia12.
OBJETIVO
O presente estudo teve como objetivo realizar uma revisão sistemática de literatura, a fim de evidenciar estudos clínicos que abrangessem a SEG em pacientes submetidos à infiltração de PMMA na bioplastia.
MÉTODOS
Estratégias de pesquisa e critérios de elegibilidade
Foi realizada uma pesquisa nas bases de dados PubMed/MEDLINE e LILACS/BVS onde foram incluídos artigos que abordassem o tema “síndrome da embolia gordurosa secundária ao uso de PMMA na bioplastia’’.
Estudos em humanos, maiores de 18 anos (adultos), cuja publicação em idioma inglês, publicados entre o dia 01 de janeiro de 2000 e 08 de janeiro de 2019 e texto publicado com acesso na íntegra foram incluídos caso relatassem a SEG pós bioplastia com uso do PMMA na intervenção.
Artigos de revisão (metanálises e/ou sistemáticas), cartas ao editor, relatos de caso e estudos experimentais em que a complicação após utilização de PMMA não incluísse SEG não foram adicionados.
Após a resposta das bases de dados eletrônicas foi feita busca manual por artigos pertinentes, já que a amostra não se mostrou suficientemente adequada. Dessa forma foi ampliada a data de procura para janeiro de 1970 a janeiro de 2019.
Foram incluídos nos termos de busca, em inglês: “fat embolismsyndrome”, “polymethylmethacrylate” and “fat embolismsyndrome”. Em português: “PMMA”, “polimetilmetacrilato”, “síndrome embolia gordurosa”, “embolia lipídica”. Em espanhol: “PMMA”, “polimetilmetacrilato”, “embolia grasa”, “embolia lipídica”. Como protocolos foram seguidas as recomendações de Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Extrações de dados
Os dados da pesquisa, após extração, foram incluídos e as controvérsias foram revisadas pelos autores desse artigo. Informações, tais como: autores, ano de publicação e país de origem foram revisados para identificar e excluir publicações duplicadas do mesmo coorte. Os dados extraídos incluíram o número total de pacientes e lesões, idade, sexo e ocorrência.
RESULTADOS
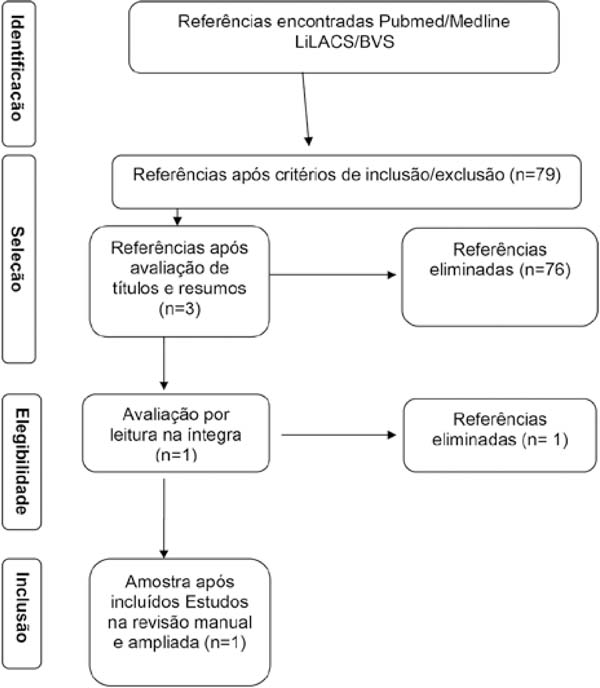
Na busca eletrônica PubMed/MEDLINE foram encontradas 20 referências de artigos de pesquisa (research articles). Depois da leitura de títulos foram excluídas 18 referências, restando 2 referências. Ao se realizar a leitura na íntegra, foram excluídos 2 estudos, pois não contemplavam o direcionamento a bioplastia e uso do PMMA. A exclusão destes artigos se fez baseada nos critérios de inclusão e exclusão descritos previamente.
Na base de dados LILACS/BVS foram encontradas 59 referências de artigos de pesquisa (índice por assunto). Depois da leitura de títulos foram excluídas 50 referências, restando 9 referências. Ao se realizar a leitura na íntegra, foram excluídos 3 estudos que não contemplavam o direcionamento a bioplastia e utilização do PMMA, e os restantes 6 também foram excluídos por se tratarem de estudos em relação a lipoaspiração não contemplando o uso de PMMA. A exclusão destes artigos se fez baseada nos critérios de inclusão e exclusão descritos previamente.
Desta forma, foi efetuada uma busca manual, nas três línguas (inglês, português e espanhol) e ampliada a data de procura para janeiro de 1970 a 08 de janeiro de 2019. Como resultado encontrado, apenas um artigo, foi elencado com disposição do artigo para leitura na íntegra (língua espanhola). Os critérios da seleção estão descritos na Figura 1.
O Quadro 1 descreve o único estudo que foi selecionado, por busca manual, para o presente artigo, nos quais apresenta os autores, país de origem da pesquisa, os principais objetivos e as principais características do estudo.
| Autor/ano | País de Origem | Métodos e Objetivos | Características do estudo |
|---|---|---|---|
| Salgado e Olvera, em 200813. | México | Apresentação de caso clínico e desfechos. | Relato de caso clínico com desfechos após SEG em paciente pós procedimento com infiltração de PMMA. |
Fonte: Elaborado pelo autor.
DISCUSSÃO
A busca bibliográfica resultou em apenas um artigo, em concordância com descritores, e requisitos de inclusão e exclusão. Infelizmente não há um número expressivo de artigos que contemplem a SEG na infiltração com PMMA. A maioria dos relatos disponibilizados é proveniente de lipoaspiração, e correlacionados ao trauma ósseo quando citado o uso de PMMA.
O sujeito do único relato era do sexo feminino, 26 anos, que iniciou a condição 24 horas após a injeção de PMMA na região glútea bilateral em uma clínica estética. A paciente apresentou febre, ansiedade, diaforese, cefaleia, tontura, sonolência e disartria13.
Ao exame físico na admissão, apresentou pressão arterial de 110/70mmHg, frequência cardíaca de 113 batimentos por minuto, frequência respiratória de 21 incursões respiratórias por minuto, com suporte suplementar de oxigênio por máscara e nebulizador; temperatura corporal de 38,4°C, com Glasgow de 12. Apresentava-se consciente13.
A tomografia pélvica revelou material abundante, difuso e não encapsulado, entre a pele e o glúteo máximo. Sua gestão foi na Unidade de Terapia Intensiva, com suporte geral, ventilação mecânica no controle de volume em modo assistido. Também foi prescrito antibioticoterapia de amplo espectro e anticoagulação com heparina de baixo peso molecular13.
A paciente desenvolveu pneumonia, síndrome de resposta inflamatória sistêmica e edema cerebral. Devido à intubação prolongada e ao manuseio inadequado das secreções houve necessidade de realizar uma traqueostomia. Apresentou evolução clínica prolongada; porém, satisfatória, que permitiu permanecer sem suporte de ventilação mecânica. O foco infeccioso respiratório foi controlado e a paciente evoluiu com estabilidade hemodinâmica. A paciente teve alta após três semanas de hospitalização. Nesse relato de caso, a infiltração maciça de PMMA ocasionou a destruição do tecido adiposo, que, juntamente com as microesferas deste produto, condicionou a embolia gordurosa na paciente13.
O caso apresentado por Salgado e Olvera, em 200813, foi de não profissionais médicos que realizaram o procedimento. Esse tipo de prática tem gerado um problema de saúde pública, já que na maioria das vezes, os sujeitos não possuem formação médica e não há estatísticas confiáveis sobre a incidência ou prevalência de complicações de pacientes em relação às substâncias utilizadas.
A SEG foi descrita primeiramente em 1862, por Zenker, que visualizou células adiposas na circulação pulmonar de um indivíduo politraumatizado após efetuar biópsia14. O termo SEG é uma consequência grave dos êmbolos gordurosos que provoca um padrão distinto de sintomas e sinais clínicos15.
A manifestação clínica típica é a tríade da insuficiência respiratória aguda, trombocitopenia e disfunção neurológica15. Nenhum critério diagnóstico definitivo ou testes foram desenvolvidos, o que torna o diagnóstico de SEG mais difícil. Geralmente ocorre dentro de 48 horas após o trauma ou durante procedimentos cirúrgicos na maioria dos pacientes12.
Existem duas principais teorias para a gênese da embolia gordurosa, tais como a teoria mecânica e a teoria bioquímica. A primeira sugere que a obstrução da vasculatura sistêmica pela embolia gordurosa decorre a partir da liberação direta da medula óssea no sistema venoso após o trauma. Uma pressão intramedular elevada após o trauma ocasiona a liberação de gordura através de sinusoides venosos abertos. Essa gordura embolizada favorece a obstrução dos leitos capilares12.
Já a segunda teoria propõe que a resposta inflamatória ao trauma provoca a liberação de ácidos graxos livres da medula óssea no sistema venoso. As elevações dos ácidos graxos livres e dos mediadores inflamatórios proporcionam lesões aos leitos capilares. Níveis elevados de ácidos graxos livres têm sido correlacionados à hipoxemia e à indução de inflamação pulmonar12.
Em relação à abordagem terapêutica inexiste tratamento especifico para a SEG. As condutas baseiam-se em medidas de suporte clinico, estabilização hemodinâmica, reposição volumétrica, nutrição e oxigenoterapia ou ventilação mecânica com recrutamento alveolar em casos mais graves14. Inexistem dados suficiente para apoiar o início da terapia com esteroides, uma vez estabelecida a SEG. O mecanismo de ação proposto é, geralmente, um agente antiinflamatório que reduz a hemorragia perivascular e o edema. Um estudo experimental não mostrou efeito benéfico e não houve estudos clínicos prospectivos, randomizados e controlados que demonstraram um benefício significativo com o seu uso15.
CONCLUSÃO
Na atual conjuntura estética ocorre aumento significativo em técnicas minimamente invasivas às quais favorecem métodos não incisionais - tal como o implante de PMMA - a fim de minimizar os efeitos do envelhecimento e para correção de defeitos corporais. Sabe-se que, para evitar ou tratar distúrbios, tal como a SEG com implantes dérmicos, o conhecimento de sua composição, reações fisiológicas dos tecidos, tempo de absorção e persistência é indispensável. Urge a presença de mais estudos dirigidos ao PMMA em procedimentos estéticos, seus riscos e casos clínicos que constatem SEG e outros problemas pós-cirúrgicos potencialmente fatais para o paciente.
COLABORAÇÕES
|
CGAO |
Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Coleta de Dados, Conceitualização, Concepção e desenho do estudo, Gerenciamento de Recursos, Gerenciamento do Projeto, Investigação, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão, Validação, Visualização |
|
FRS |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização, Gerenciamento de Recursos, Investigação, Supervisão, Validação, Visualização |
|
FAAF |
Aprovação final do manuscrito, Coleta de Dados, Conceitualização, Redação - Preparação do original, Supervisão, Visualização |
|
RZDF |
Aprovação final do manuscrito, Coleta de dados, Conceitualização, Redação- Preparação do original, Supervisão, Visualização. |
REFERÊNCIAS
1. Chacur R, Menezes HS, Chacur NMBS, Alves DD, Mafaldo RC, Gomes LD, et al. Replacement of gluteal implants by polymethylmethacrylate filler: case report. Case Reports Plast Surg Hand Surg. 2019 Jan;6(1):20-4.
2. Souza TAB, Colomé LM, Bender EA, Lemperle G. Brazilian consensus recommendation on the use of polymethylmethacrylate filler in facial and corporal aesthetics. Aesthetic Plast Surg. 2018 Oct;42(5):1244-51.
3. Vedamurthy M. Beware what you inject: complications of injectables - dermal fillers. J Cutan Aesthet Surg. 2018 Apr/Jun;11(2):60-6.
4. Buck II DW, Alam M, Kim JYS. Injectable fillers for facial rejuvenation: a review. J Plast Reconstr Aesthet Surg. 2009 Jan;62(1):11-8.
5. Parada MB, Cazerta C, Afonso JPJM, Nascimento DIS. Overview and management of fillers complications. Surg Cosmet Dermatol. 2016;8(4):342-51.
6. Vargas AF, Amorim NG, Pitanguy I. Late complications of permanent fillers. Rev Bras Cir Plást. 2009;24(1):71-81.
7. Lemperle G, Rullan PP, Gauthier-Hazan N. Avoiding and treating dermal filler complications. Plast Reconstr Surg. 2006 Oct;118(3 Suppl 1):92S-107S.
8. Pollack SV. Some new injectable dermal filler materials: Hylaform, Restylane, and Artecoll. J Cutan Med Surg. 1999 Dec;(3 Suppl 4):S27-35.
9. Johl SS, Burgett RA. Dermal filler agents: a practical review. Curr Opin Ophthalmol. 2006 Oct;17(5):471-9.
10. Viscusi KS, Hanke CW. Soft tissue augmentation. In: Baran R, Maibach HI, eds. Textbook of cosmetic dermatology. 5th ed. Boca Raton: CRC Press; 2017. p. 473-80.
11. Antonio CR, Antonio JR, Oliveira GB, Alves FT. Polymethylmethacrylate (PMMA) filling in the lower limbs of a patient with lipodystrophy caused by antiretroviral drugs. Surg Cosmet Dermatol. 2014;6(4):373-5.
12. Kwiatt ME, Seamon MJ. Fat embolism syndrome. Int J Crit Illn Inj Sci. 2013 Jan;3(1):64-8.
13. Salgado EG, Olvera RM. Síndrome de embolia grasa secundario a infiltración de polimetilmetacrilato em región glútea. Cir Plast. 2008;18(2):78-80.
14. Jorens PG, Van Marck E, Snoeckx A, Parizel PM. Nonthrombotic pulmonary embolism. Eur Respir J. 2009 Aug;34(2):452-74.
15. Gupta A, Reilly CS. Fat embolism. Contin Educan Aesthetic Crit Care Pain. 2007 Oct;7(5):148-51.
1. Pontifícia Universidade Católica de Minas Gerais,Betim, MG,Brasil.
2. Hospital Eduardo de Menezes, Departamento de Infectologia, Belo Horizonte, MG,
Brasil.
Autor correspondente: Carina Gabriela Andrade Oliveira, Rua Pintarroxo, 157, Bairro Goiânia, Belo Horizonte, Minas Gerais, MG, Brasil. CEP: 31950-110. E-mail: carina.andradde@gmail.com
Artigo submetido: 29/06/2019.
Artigo aceito: 29/02/2020.
Conflitos de interesse: não há.




 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter