

Case Report - Year 2020 - Volume 35 -
Pioderma gangrenoso em dorso de mão pós-trauma
Pyoderma gangrenosum after trauma to the dorsum of the hand
RESUMO
Introdução: A gangrena pós-operatória de Cullen, também denominada de pioderma gangrenoso (PG) ou abscesso neutrofílico estéril, pelo fato das lesões cutâneas não conterem micro-organismos patogênicos teve sua primeira aparição na literatura médica no ano de 1924, pelo relato feito por Cullen, segundo Schofer e Baur. Mais tarde Brusting et al., em 1930, acrescentaram maiores detalhes a descrição inicial.
Objetivo: Relatar um caso raro de pioderma gangrenoso (PG) em extremidades de membros desencadeado por um trauma contuso em dorso de mão.
Discussão: O exame histopatológico do PG não é diagnóstico, portanto, a elucidação do quadro se baseia em evidências clínicas. A apresentação clínica é variável: a bolhosa, pustulosa e vegetante. Outras formas raras incluem o PG em locais de patergia (20-30%), periostomal, dorso da mão, PG maligno ou da cabeça e pescoço, multisistêmico e paraneoplásico.
Conclusão: O aparecimento do PG é de início súbito e raro em dorso de mão. É importante classificar sua forma clínica, estabelecer associações com patologias de base. A diversidade de drogas para a terapêutica demonstra a dificuldade de padronização de tratamento com variadas respostas, que pode ser empírico e evitar abordagem cirúrgica precoce.
Palavras-chave: Pioderma gangrenoso; Ferimentos e lesões; Traumatismo múltiplo; Extremidade superior; Doenças
ABSTRACT
Introduction: Cullen’s postoperative gangrene, also called pyoderma gangrenosum (PG) or sterile neutrophilic abscess, was first described in the medical literature by Cullen in 1924. Later Brusting et al., in 1930, described PG in more detail.
Objective: To report a rare case of pyoderma gangrenosum (PG) in an extraneous limb that was triggered by blunt trauma to the dorsum of the hand.
Discussion: A histopathological exam is not sufficient to diagnose PG, Therefore, a PG diagnosis is based on clinical evidence. The clinical presentation is variable and includes rare bullous, pustular and vegetative forms. Other rare forms of PG occur at sites of pathergy (20-30%), periostomal skin, the dorsum of the hand, the head and neck. PG can also be multisystemic and paraneoplastic.
Conclusion: The appearance of sudden-onset PG is rare in the dorsum of the hand. It is important to classify PG’s clinical forms, and to establish associations between PG and underlying pathologies. It is also very important to avoid surgery during early PG. The many drugs used to treat PG, and the multiple patient responses, demonstrate the difficulty of standardizing treatment. Physicians may have to use an empirical approach to select the appropriate drug for each patient.
Keywords: Pyoderma gangrenosum; Wounds and injuries; Multiple trauma; Upper extremity; autoimmune diseases.
INTRODUÇÃO
A gangrena pós-operatória de Cullen, também denominada de pioderma gangrenoso (PG)1 ou abscesso neutrofílico estéril, pelo fato das lesões cutâneas não conterem micro-organismos patogênicos teve sua primeira aparição na literatura médica no ano de 1924, pelo relato feito por Cullen, segundo Schofer e Baur, em 20021. Mais tarde Brusting et al., em 19302, acrescentaram maiores detalhes a descrição inicial.
Sua etiologia é desconhecida. Está relacionada, em grande parte dos casos, a neoplasias malignas, doenças reumatológicas, artrites, doenças inflamatórias intestinais, como retocolite ulcerativa, ou doença de Chron, gamopatias monoclonais, colagenoses, doença de Behçet, granulomatose de Wegener, doenças mieloproliferativas e infecciosas, principalmente hepatites e Síndrome de Imunodeficiência Adquirida (SIDA)2.
A patologia caracteriza-se por úlceras dolorosas, de tamanhos e profundidades variáveis, apresentando bordas mal delimitadas. Não tem origem neoplásica, assim como também não tem associação com vasculites primárias. Por mais que a lesão possa sofrer infecção secundária, a mesma não possui como causa um quadro infeccioso3.
O pioderma gangrenoso é uma dermatose neutrofílica inflamatória rara, sua incidência ocorre entre 3 a 10 casos por milhão de pessoas ao ano. Tem alta morbidade e, na maioria das vezes, é crônica e recidivante. Acomete comumente o adulto-jovem, na faixa etária entre 20 e 50 anos; é mais incidente em mulheres que em homens. Crianças e adolescentes constituem 4% dos casos1-5. A incidência no Brasil em um estudo retrospectivo mostrou um índice de 0,38 casos por 10.000 atendimentos6.
O objetivo deste trabalho é relatar um caso raro de pioderma gangrenoso em extremidade de membro desencadeado por um trauma contuso em dorso de mão, atendido na Unidade de Cirurgia Plástica do Hospital Regional da Asa Norte (HRAN), Brasília-DF.
RELATO DE CASO
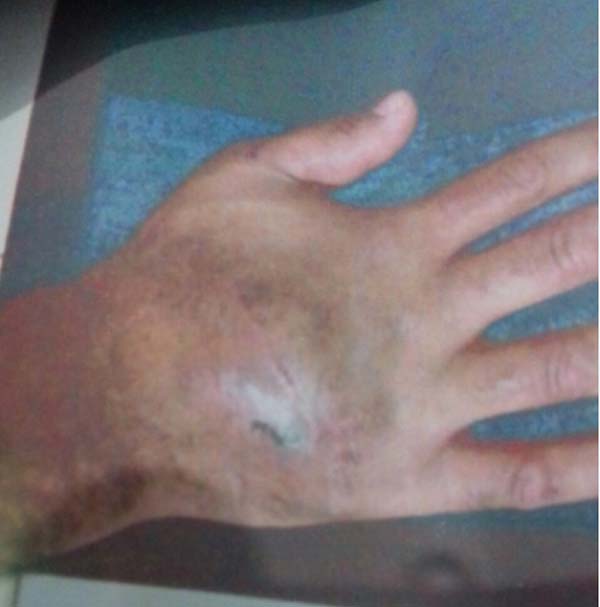
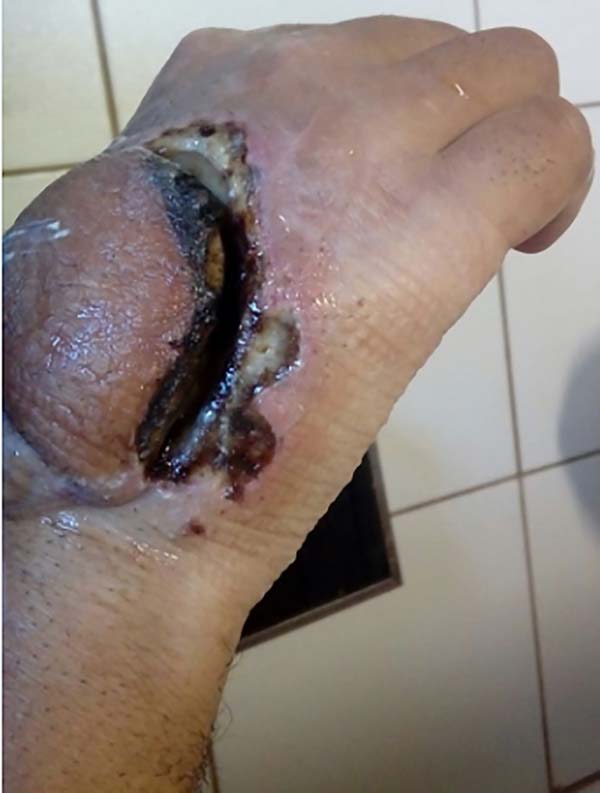
Paciente caucasiano, 33 anos, masculino, mecânico, desconhece qualquer comorbidade. Paciente vítima de acidente com instrumento de trabalho marreta, com trauma no dorso da mão direita (Figura 1).
Na ocasião do trauma, houve surgimento de edema, que deu lugar a um volumoso hematoma em poucos dias, sendo drenado cirurgicamente no posto de saúde de sua cidade. Após a drenagem ocorreu formação de ferida crônica em dorso de mão (Figura 1).
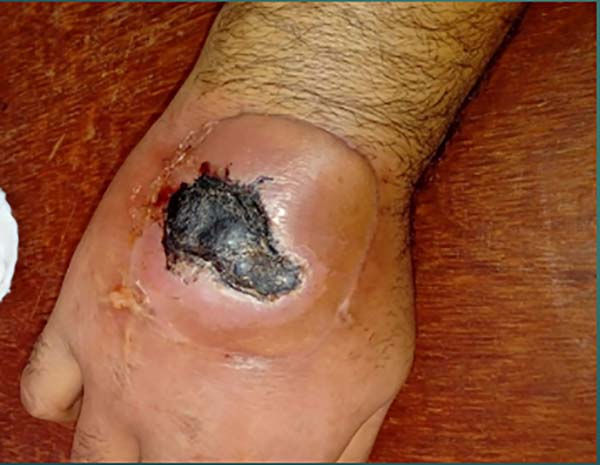
Paciente foi encaminhado para um Serviço Especializado em Goiânia, sendo submetido a um retalho chinês (Figura 2) que após 10 dias de cirurgia, com retalho viável, houve descolamento da borda do retalho do leito da ferida, com necrose de bordas evoluindo com perda total do retalho (Figura 2), e após desbridamento e preparo da ferida foi realizado biópsia: processo inflamatório crônico exsudativo agudizado e culturas negativas.
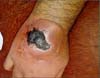
Realizou-se novo retalho após 36 dias da perda do primeiro, sendo confeccionado novo retalho fasciocutâneo interósseo posterior, que apresentou a mesma evolução com descolamento do leito e necrose da borda retalho do leito da ferida, apesar de não ter apresentado nenhum sofrimento vascular precoce nos dois procedimentos, uma nova ferida reaberta (Figuras 3 e 4).
Foi encaminhado para nosso serviço Unidade de Cirurgia Plástica do HRAN em Brasília, para dar continuidade ao tratamento, realizou-se um desbridamento superficial da necrose, coletado novo tecido e osso para cultura e biópsia, cujos histopatológicos foram inconclusivos, cultura para fungos negativa, BAAR negativo, microscopia para leishmania negativa, cultura para tuberculose negativa, cultura para aeróbios negativa. Apenas sinais de processo inflamatório crônico agudizado sem sinais de neoplasia.
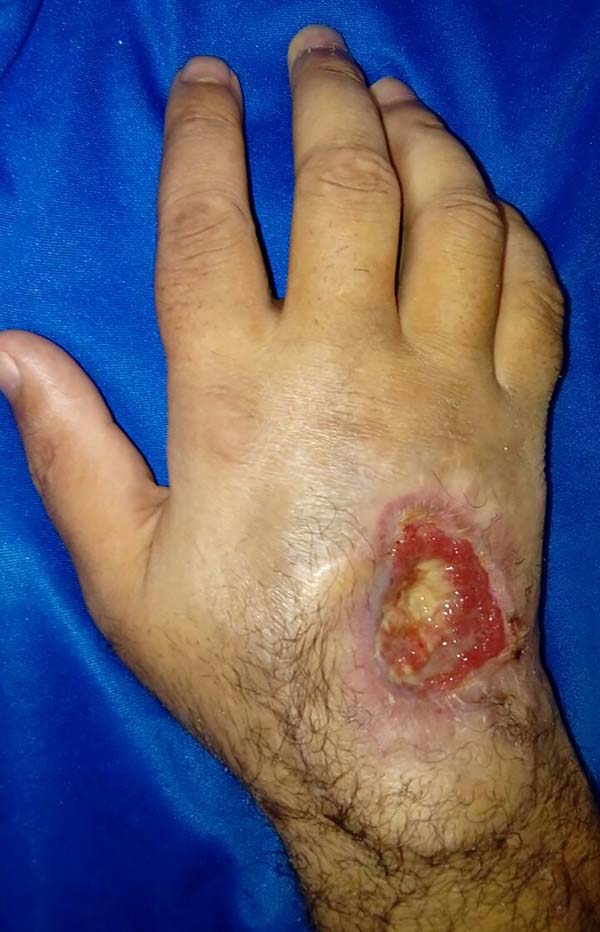
Portanto, após discussão clínica na Unidade, a suspeita se direcionou, após exclusão de outros diagnósticos, para confirmação de pioderma gangrenosa, não realizou mais desbridamento cirúrgico no HRAN, iniciou corticoide terapia sistêmica, prednisona dose máxima (Prednisona 70mg 1x ao dia) e infiltração da borda da ferida com triancinolona houve melhora importante do quadro com granulação e com quase fechamento da ferida espontaneamente (Figura 5), porém alguns meses após alta hospitalar, iniciou um novo processo de necrose e exposição óssea com dor articular de difícil analgesia com melhora parcial com uso de morfina na sua cidade de origem.
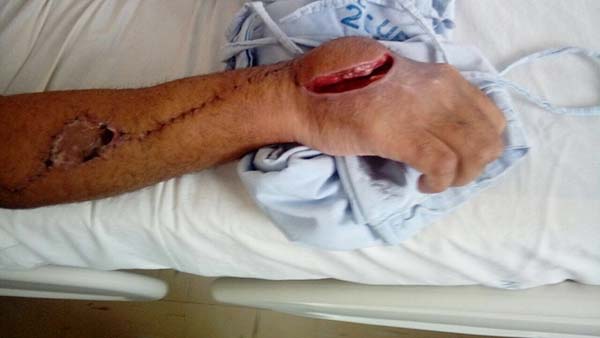
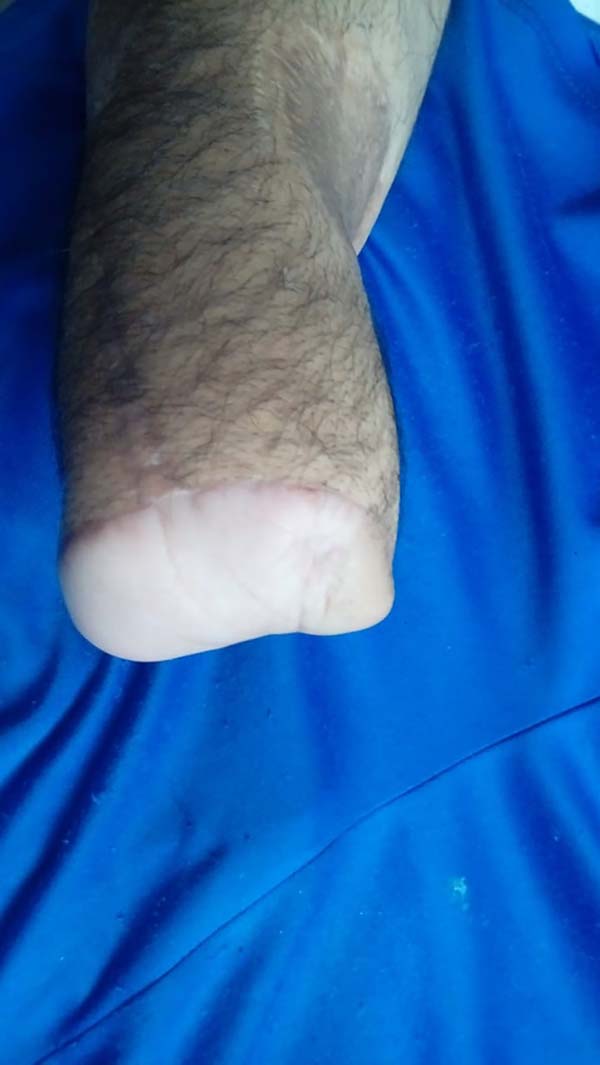
Foi acompanhado pelo reumatologista e ortopedista da sua cidade, que continuou com a manutenção da corticoterapia, mas culminou com infecção óssea, após realizar exames radiológicos complementares, na última internação no seu Hospital de Origem, relata que a dor na articulação não respondia à analgesia venosa com morfina, associado com quadro de osteomielite aguda com início de sepse, optaram por realizar amputação da mão ao nível do punho (Figura 6).
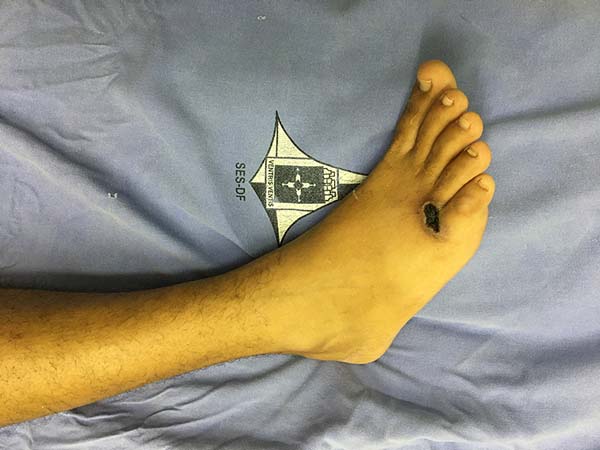
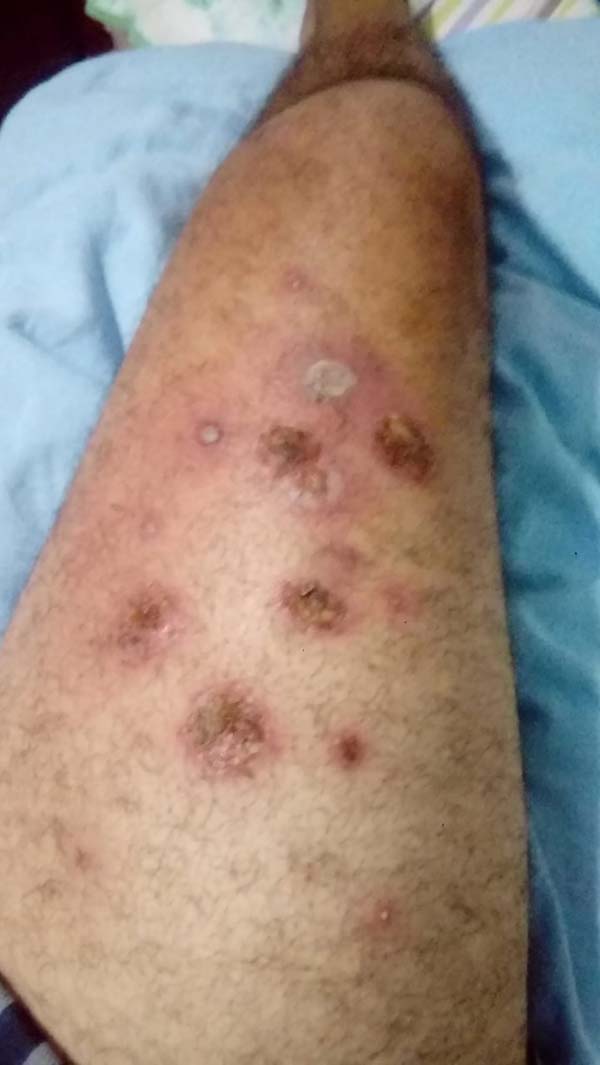
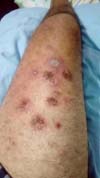
Paciente evoluiu com melhora importante do quadro e sem dor no pós-operatório, mas apresentou processo de patergia em membros inferiores após leve trauma local no tornozelo do pé, deflagrou aberturas de novas feridas no dorso de pé e na porção anterior de coxa e foi iniciado uso de imunomodulador - Adalimumabe associado com Metrotexate, com melhora clínica importante das feridas (Figuras 7 e 8).
DISCUSSÃO
O exame histopatológico do PG não é diagnóstico, portanto, a elucidação do quadro se baseia em evidências clínicas. Encontram-se edema, sinais de inflamação massiva por neutrófilos, ingurgitação, trombose de vasos pequenos e medianos, necrose e hemorragia. O infiltrado leucocitário PMN decorre de desenvolvimento de abscesso e de necrose por liquefação de tecido, com trombose secundária de vênulas. As lesões originam dermatite granulomatosa supurada e regridem com notável fibroplasia6.
Um fundo imunológico foi observado no contexto do pioderma, onde evidenciou um comportamento celular de autofagismo, induzido pelo sistema imune, alteração esta que levou a se considerar essa enfermidade uma doença autoimune. O que se correlaciona com o caso relatado devido à perda dos dois retalhos realizados para cobertura da ferida6,7.
A explicação está no fato de a reação imunológica implicar numa vasodilatação capilar e consequente rash cutâneo. Iniciando então, uma sequência de reações, com intensa migração de neutrófilos para a região, permanecendo na camada basal da pele, seguida de grande produção de colagenase. Esta degrada o colágeno e os capilares responsáveis pela nutrição da pele e a camada basal. Com o rompimento das ligações que mantêm a camada basal unida, a pele se desfaz e a necrose se inicia. A necrose, por sua vez, atrai ao local uma grande quantidade de neutrófilos e macrófagos, para fagocitose dos debris celulares auxiliando na limpeza da ferida. Os neutrófilos em maior quantidade produzem mais colagenase, que destrói mais tecido cutâneo e o processo se torna cíclico6,7.
A apresentação clínica é variável. No entanto, existem formas mais raras, ou atípicas, que são a bolhosa, pustulosa e vegetante. Outras formas, ainda mais raras, incluem o PG em locais de patergia (em 20-30% dos casos), periostomal, dorso da mão, cabeça e pescoço, multissistêmico e paraneoplásico6,7.
Esta patologia geralmente inicia na forma de um nódulo doloroso e profundo ou como uma pústula superficial hemorrágica, associa-se também após pequenos traumas. Após o surgimento do nódulo ou à pústula segue- se uma lesão ulcerada e dolorosa com bordas irregulares, de aspecto inflamatório e elevado, a coloração é avermelhada escura ou púrpura e com um fundo necrótico granular sendo encontrado pequeno abscesso6,7.
Na forma ulcerada, as lesões produzem um exsudato de aspecto hemorrágico e purulento em seu interior. Com o aumento das lesões, um padrão serpiginoso é notado, e este, resulta da escavação das bordas ou do aparecimento de pústulas hemorrágicas novas.
As lesões, quando superficiais, podem limitar-se apenas à derme, mas, mais comumente, se estendem para o tecido subcutâneo até a fáscia com exposição de músculo e osso.
Podem aparecer simultaneamente num padrão paulatino em diferentes locais, existindo predileção para os membros inferiores, abdome e nádegas. Interessante ressaltar que as mucosas são comumente poupadas, embora lesões aftosas possam ocorrer na cavidade oral, algumas vezes com envolvimento maciço da mesma: faringe e laringe.
O início do PG pode apresentar dois padrões evolutivos diferentes: início explosivo com alastramento das lesões rapidamente, dor, febre, toxicidade sistêmica, flictenas hemorrágicos, supurações e bordas com halo inflamatório; ou início lento, granulações maciças no interior da úlcera, crosta e hiperceratose nas bordas, atingindo extensas áreas e regressão espontânea em algumas localizações com progressão em outras, marcam essa segunda forma8,9.
As quatro formas clínicas e histopatológicas distintas:
Vegetativa – correspondendo a 12,5%10: é a forma mais localizada e menos agressiva, apresentando lesões de aspecto verrucoso superficial e fundo não purulento. Também denominada de pioderma granulomatoso superficial. Nesta forma a ocorrência se dá no tronco, cabeça e pescoço. Apresenta rápida resposta à terapia, quando adequada.
Bolhosa – 6,25%10: guarda associação com quadros leucêmicos, de início agudo, superficial com pápulas, púrpuras e lesões azuladas, bolhosas e hemorrágica.
Ulcerativa – 81,52%10: começa na forma de uma pequena pústula circundada por um halo inflamatório, dolorida de evolução rápida. Com a resolução das lesões, nota-se uma cicatriz atrófica e uma epiderme em aspecto de “papel de fumo”11.
Pustular – associada a febre e artralgias, é uma apresentação rara, guarda associação com as doenças inflamatórias intestinais. Ocorre principalmente na face extensora das extremidades. Depois de controlada a patologia intestinal, a doença pode regredir sem deixar cicatrizes, embora as lesões possam coexistir com a forma ulcerativa10,11.
O diagnóstico é clínico e, na sua maioria, feito por exclusão de quadros semelhantes. Culturas para fungos e bactérias mostram-se negativas de um modo geral, histopatológico compatível com dermatose neutrofílica6-11. Fato este que se comprova neste caso pelas várias biópsias com mesmo resultado e culturas negativas, neste relato se enquadra na forma ulcerativa e pustular (Figura 8).
A doença pode aparecer num contexto pós-traumático ou pós-operatório, neste caso geralmente confundido com infecção da ferida cirúrgica. O tratamento é realizado de forma inespecífica, importante salientar que o desbridamento cirúrgico não está indicado devido a seu potencial de promover o fenômeno da patergia12,13.
Comprovado pelos dois procedimentos cirúrgicos realizados neste caso, que culminaram com a perda do retalho e o desbridamento local que reativou e piorou a atividade da doença.
Em 50 a 70% dos pacientes, associa-se o PG a uma doença de base, como doença inflamatória intestinal, reumática, hematológica ou malignidade, hepatites B e C, SIDA, lúpus eritematoso sistêmico, psoríase e artropatias reativas3,14,15. Neste relato não se apresentou nenhuma outra patologia associada até o momento.
Febre, mal-estar e mialgias são relatados. A artrite está presente em 37% dos casos e apresenta padrão variável: reumatoide clássico, assimétrica de membros inferiores e monoartrite3. Neste relato o paciente apresentou artralgia de alta intensidade e febre com mialgia de difícil analgesia, aliviada com uso de morfina.
Em até 25% dos casos, pode ocorrer o fenômeno da patergia, em que novas lesões surgem em decorrência de traumas, como picadas de insetos, injeções intravenosas, desbridamentos e, até mesmo, biópsia. E, segue relatos na literatura em procedimentos cirúrgicos diversos, como: ginecológicos apontado por Meyer et al., em 200616; a associação a áreas doadoras de enxertos cutâneos de espessura parcial por Coltro et al., em 200617; como também em pós-operatório de mamoplastia relatados por Soares et al., em 201318.
Também se comprova o fenômeno de patergia em nosso caso, devido ao trauma da cirurgia e os desbridamentos realizados, houve piora do quadro clínico e após um pequeno trauma leve no pé houve o aparecimento de nova lesão próxima ao local do trauma, durante o tratamento da mão (Figuras 7 e 8).
São conhecidas associações de distúrbios hematológicos, como a leucemia e a síndrome mielodisplásica (SMD) com a forma bolhosa. Em 54% dos casos, há associação da forma bolhosa à leucemia18.
Alternativas terapêuticas como imunomoduladores, corticoides e imunossupressores são citadas. Ficando à mercê da clínica apresentada pelo paciente, assim como a experiência do médico quanto a escolha do fármaco a ser utilizado19.
O tratamento desta condição é através da imunossupressão. Tratamentos locais destinam-se as lesões muito pequenas e precoces. A região afetada deve ser mantida limpa e úmida, pode-se fazer uso de curativos oclusivos ou de hidrogel.
Deve-se evitar a indicação de desbridamento cirúrgico, uma vez que isso poderia causar aumento das lesões pelo fenômeno de patergia.
Os resultados mais satisfatórios provêm da infiltração intralesional de triancinolona (20mg/mL em aplicações mensais), que pode acarretar a remissão após cinco a oito semanas3. Foi aplicado neste caso, porém, com resposta clínica inicialmente e piora após termino de aplicação (Figura 5).
Uma outra alternativa farmacológica são injeções intralesionais de ciclosporina em uma solução 1:3 em soro fisiológico, duas vezes por semana.
O tratamento sistêmico está indicado na grande maioria dos casos, podendo manter a terapêutica local como coadjuvante do tratamento geral. Corticoides podem ser usados, em doses altas (prednisona ou prednisolona oral, 1-3mg/kg/dia) no início, ou em forma de pulsoterapia (metilprednisolona, 1g/dia por três dias). Com o controle da doença, as doses são gradualmente reduzidas, tendo sido aplicado neste caso, porém sem resposta clínica20-23.
A ciclosporina é o padrão ouro. A maioria dos casos apresenta uma boa resposta a doses relativamente baixas da ciclosporina (3-6mg/kg/dia). É importante a monitorização da pressão arterial, função renal e hepática e triglicerídeos. Outras opções: tacrolimus, azatioprina, dapsona, talidomida e clofazimina21.
Recentemente evidências demonstraram, que o Infliximabe, obteve êxito no tratamento de casos resistentes a outras terapêuticas21. Por indicação do reumatologista fez-se a associação, neste relato de caso, de Metrotexate e Adalimumabe.
Em razão do princípio fundamental da terapia dessa enfermidade se basear na imunossupressão, infecções devem ser obrigatoriamente excluídas.
A cirurgia tem lugar no tratamento final do PG, quando enxertos ou retalhos poderão ser necessários para o fechamento de grandes áreas de perda cutânea, após o controle e remissão total da doença23.
O pioderma gangrenoso da mão é raro e é geralmente confundido com infecção, numa série de 7 casos publicada por Huish et al., 200124, apresentaram treze diagnósticos errados (variação de 1 a 3/paciente) resultaram em 16 cirurgias desnecessárias (média de 2,2/paciente) incluindo 4 amputações e 2 enxertos de pele com falha, O diagnóstico incorreto resulta em tratamento, cirurgia desnecessária e até mesmo o aparecimento do PG de início súbito24.
É importante classificar sua forma clínica, estabelecer associações com patologias de base e avaliar a resposta imune. A diversidade de drogas para a terapêutica demonstra a dificuldade de padronização de tratamento, que pode ser empírico inicialmente. A administração de corticoides, imunossupressores e imunomoduladores, combinadas com cuidados locais, pode deter o curso da patologia. Também existe raras descrições de resistência às medicações comumente utilizadas com prognóstico reservado, como nosso caso, que evoluiu com amputação.
REFERÊNCIAS
1. Schofer H, Baur S. Successful treatment of postoperative pyoderma gangrenosum with cyclosporin. J Eur Acad Dermatol Venereol. 2002;16(2):148-51.
2. Brusting LA, Goeckerman WH, O’Leary PA. Pyoderma (ecthyma) gangrenosum: clinical and experimental observations in 5 cases occurring in adults. Arch Derm Syphilol. 1930;22(4):655-80.
3. Blitz NM, Rudikoff D. Pyoderma gangrenosum. Mt Sinai J Med. 2001;68(4-5):287-97.
4. Serra-Baldrich E, Boixareu MJT. Pioderma gangrenoso: consideraciones. Act Dermatol. 2001;4(2):115-22.
5. Tanus R, Cassol T, D’Aquino Neto V. Pioderma gangrenoso em membro inferior: relato de caso. Arq Catarin Med. 2009;38(Supl 1):70-2.
6. Graças AM, Alecrim ES, Lyon S. Pioderma gangrenoso: evidências clínicas e características. Rev Med Minas Gerais. 2016;26:e-1790.
7. Konopka CL, Padulla GA, Ortiz MP, Beck AK, Bitencourt MR, Dalcin DC. Pioderma gangrenoso: um artigo de revisão. J Vascul Bras. 2013;12(1):25-33.
8. Hadi A, Lebwohl M. Clinical features of pyoderma gangrenosum and current diagnostic trends. J Am Acad Dermatol. 2011;64(5):950-4.
9. Wani I, Bhat IHG, Mir M, Mir M, Hassan N, Mustafa A. Pyoderma gangrenosum of abdominal wall: a case report. Oman Med J. 2011;26(1):64-5. DOI: http://doi.org/10.5001/omj.2011.18
10. Conrad C, Trüeb RM. Pyoderma gangrenosum. J Dtsch Dermatol Ges. 2005;3(5):334-42. DOI: http://dx.doi.org/10.1111/j.1610-0387.2005.05022.x
11. Newman B, Cescon D, Domenchini A, Siminovitch KA. CD2BP1 and CARD 15 mutations are not associated with pyoderma gangrenosum in patients with inflammatory bowel disease. J Invest Dermatol. 2004;122(4):1054-5. DOI: http://dx.doi.org/10.1111/j.0022-202X.2004.22430.x
12. Zold E, Nagy A, Devenyi K, Zeher M, Barta Z. Successful use of adalimumab for treating fistulizing Crohn’s disease with pyoderma gangrenosum: two birds with one stone. World J Gastroenterol. 2009;15(18):2293-5. DOI: http://dx.doi.org/10.3748/wjg.15.2293
13. Souza CS, Chioss MPV, Takada MH, Foss NT, Roselino AMF. Pioderma gangrenoso: casuística e revisão de aspectos clínico-laboratoriais e terapêuticos. An Bras Dermatol. 1999;74(5):465-72.
14. Beber AAC, Knob CF, Shons KRR, Neumaier W, Silva JCN, Monticielo OA. Pioderma gangrenoso associado à artrite reumatoide: descrição de caso. Rev Bras Reumatol. 2014;54(4):322-5.
15. Binus AM, Qureshi AA, Li VW, Winterfield LS. Pyoderma gangrenosum: a retrospective review of patient characteristics, comorbidities and therapy in 103 patients. Br J Dermatol. 2011;165(6):1244-50. DOI: https://doi.org/10.1111/j.1365-2133.2011.10565.x
16. Meyer TN. Pioderma gangrenoso: grave e mal conhecida complicação da cicatrização. Rev Bras Cir Plást. 2006;21(2):120-4.
17. Coltro PS, Valler CS, Almeida PCC, Gomez DS, Ferreira MC. O papel da patergia no pioderma gangrenoso em áreas doadoras de enxertos cutâneos: relato de caso. Rev Bras Cir Plást. 2006;21(4):231-5.
18. Soares JM, Rinald AE. Pioderma gangrenoso pós-mamoplastia redutora: relato de caso e discussão. Rev Bras Cir Plást. 2013;28(3):511-4.
19. Batista MD, Fernandes RL, Rocha MAD, Ikino JK, Pinheiro RF, Chauffaille MLF, et al. Pioderma gangrenoso bolhoso e síndrome mielodisplásica. An Bras Dermatol. 2006;81(5 Supl 3):S309-12.
20. Ahronowitz I, Harp J, Shinkai K. Etiology and management of pyoderma gangrenosum: a comprehensive review. Am J Clin Dermatol. 2012;13(3):191-211. DOI: http://dx.doi.org/10.2165/11595240-000000000-00000
21. Lazarus GS, Goldsmith LA, Rocklin RE, Pinals RS, De Buisseret JP, David JR, et al. Pyoderma gangrenosum, altered delayed hypersensitivity and polyarthritis. Arch Dermatol. 1972;105(1):46-51. DOI: http://dx.doi.org/10.1001/archderm.1972.01620040018003
22. Friedman S, Marion JF, Scherl E, Rubin PH, Present DH. Intravenous cyclosporine in refractory pyoderma gangrenosum complicating inflammatory bowel disease. Inflamm Bowel Dis. 2001;7(1):1-7. DOI: http://dx.doi.org/10.1097/00054725-200102000-00001
23. Miller J, Yentzer BA, Clark A, Jorizzo JL, Feldman SR. Pyoderma gangrenosum: a review and update on new therapies. J Am Acad Dermatol. 2010;62(4):646-54. DOI: http://dx.doi/10.1016/j.jaad.2009.05.030
24. Huish SB, Bountiful UT, De La Paz EM, Cincinnati OH, Ellis PRIII, Dallas TX, et al. Pyoderma gangrenosum of the hand: a case series and review of the literature. J Hand Surg Am. 2001;26(4):679-85.
1. Hospital Regional da Asa Norte, Brasília, DF, Brasil.
Autor correspondente: Altino Vieira de Rezende Filho Neto Setor SMAS, Trecho 1, Lote C, Bloco J, Brasília, DF, Brasil. CEP: 71218-010. E-mail: altinofn@hotmail.com
Artigo submetido: 21/1/2019.
Artigo aceito: 21/4/2019.
Conflitos de interesse: não há.






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter