

Review Article - Year 2020 - Volume 35 -
Lipoenxertia em reconstruções mamárias com expansor e implantes
Fat grafting in breast reconstructions with expanders and implants
RESUMO
A lipoenxertia autóloga foi inicialmente descrita há mais de 100 anos por Neuber objetivando correção de defeitos faciais. Ao mesmo tempo, Czerney descreveu a utilização de lipoma nas costas para recriar uma mama pós-mastectomias. A técnica foi popularizada por Coleman, que descreveu o uso de lipoaspiração e purificação de adipócitos para injeção na face como preenchimento de tecido mole. Bircoll e Novack (1987 apud Costantini et al.4) expandiram então esta aplicação para as mamas. Em 1990 houve um crescimento no uso da lipoenxertia, após o trabalho de Coleman, que confirmou que o tecido adiposo poderia ser transferido satisfatoriamente com a formalização de um protocolo restrito para preparação e injeção de gordura. A técnica de Coleman é de longe a mais comumente usada. O tecido adiposo é infiltrado com uma solução tumescente e, em seguida, manualmente aspirada. O lipoaspirado é subsequentemente centrifugado para isolar o tecido adiposo da fração oleosa e aquosa e finalmente injetado. A transferência de gordura de uma área em excesso, como o abdômen ou as coxas para reconstrução ou melhorar a forma e o volume da mama, não é uma ideia nova. Seguindo o trabalho de Illouz sobre a lipoaspiração, que levou ao seu uso generalizado em todo o mundo. As imagens mamográficas após lipoenxertia são variadas, a absorção de gordura e sua evolução à necrose gordurosa variam de cistos lipídicos a achados suspeitos de malignidade, como microcalcificações agrupadas, áreas espiculadas de opacidade aumentada e massas focais.
Palavras-chave: Mama; Aloenxertos; Implante mamário; Dispositivos para expansão de tecidos; Literatura de revisão como assunto
ABSTRACT
Autologous fat grafting was first described more than 100 years ago by Neuber to correct facial defects. At the same time, Czerney described the use of a lipoma on the back to recreate a post-mastectomy breast. The technique was popularized by Coleman, who described the use of liposuction and adipocyte purification for injecting into the face as a soft tissue filling. Then, Bircoll and Novack (1987 apud Costantini et al.4) extended this use to breasts. In 1990, there was a growth in the use of fat grafting after Coleman's technique. This confirmed that adipose tissue could be satisfactorily transferred with the formalization of a restricted protocol for fat injection preparation. Coleman's technique is by far the most commonly used. The adipose tissue is infiltrated with a tumescent solution and then manually aspirated. The liposuction material is subsequently centrifuged to isolate the adipose tissue from the oily and aqueous fraction and was then injected. Transferring fat from an excess area such as the abdomen or thighs to reconstruct or improve the shape and volume of the breast is not a new idea. Later, a study by Illouz on liposuction promoted the widespread use of the technique worldwide. Postoperative mammographic images to control fat absorption and necrosis vary. These can present as lipid cysts, suspected malignant findings such as grouped microcalcifications, spiculated areas of increased opacity, and focal masses.
Keywords: Breast; Allografts; Breast implant; Tissue expansion devices; Review literature as a subject.
INTRODUÇÃO
O uso da lipoenxertia autóloga para a correção de defeitos volumosos foi inicialmente descrita há mais de 100 anos para correção de defeitos faciais. Ao mesmo tempo em que foi utilizada a gordura, produto de um lipoma nas costas, para recriar uma mama em um paciente após mastectomia1.
A evolução contemporânea da lipoenxertia autóloga foi popularizada por Coleman et al.2, que descreveu o uso de lipoaspiração e purificação de adipócitos para injeção na face como um preenchimento de tecido mole. Bircoll e Novack (1987 apud Costantini et al.), expandiram então esta aplicação para as mamas3,4.
O interesse na injeção de gordura foi reavivado no início dos anos 1990, por Coleman, que confirmou que o tecido adiposo poderia ser transferido satisfatoriamente com a estipulação de que um protocolo estrito para preparação e injeção de gordura era respeitado2,5.
A técnica de Coleman para lipoenxertia de gordura é de longe a mais comumente usada. O tecido adiposo é infiltrado com uma solução tumescente (por exemplo, solução de Klein) e, em seguida, manualmente colhida através de incisões na pele, introdução de cânula de 3mm com dois furos, de bordas rombas, conectadas a uma seringa de 10ml. O lipoaspirado é subsequentemente centrifugado por 3 min a 3.000rpm para isolar o tecido adiposo para a fração oleosa e aquosa e finalmente injetado. Todo o procedimento pode ser realizado sob anestesia local assistida2,6.
A análise de diferentes drogas anestésicas demonstrou maior viabilidade de células-tronco adiposas dentro do tecido adiposo tratado com bupivacaína, mepivacaína, ropivacaína e lidocaína em comparação com o tratamento combinado comarticaína e epinefrina. Embora não se espere uma variabilidade entre as amidas, a epinefrina pode afetar os receptores α1 nos tecidos adjacentes que sustentam as células implantadas. No geral, a solução tumescente melhorou a viabilidade celular em comparação com a técnica seca e nenhuma diferença significativa foi observada entre os anestésicos comumente usados, com exceção da articaína e epinefrina7.
Transferir a gordura de uma área onde ela está presente em excesso, como o abdômen ou as coxas, até o peito, a fim de melhorar a forma e o volume da mama, não é uma ideia nova. Seguindo o trabalho de Illouz, em 19838, sobre a lipoaspiração, que levou ao seu uso generalizado em todo o mundo, foi tentador usar a gordura dos depósitos adiposos para aumentar o volume da mama.
As quantidades injetadas variaram de 100 a 250ml em cada mama6. Fournier, em 20009, teve o cuidado de afirmar que apenas injetou no espaço retro glandular e não no parênquima mamário.
O enxerto de gordura também foi utilizado para tratar cicatrizes de queimaduras. Foram avaliadas a evolução das cicatrizes em 1 ano após o tratamento por meio de um questionário e exames físico e histopatológico. No primeiro ano de acompanhamento, todos os pacientes relataram uma melhora em sua condição clínica. Os achados histológicos mostraram nova deposição de colágeno, neoangiogênese e hiperplasia dérmica no contexto de novo tecido, demonstrando regeneração tecidual10.
As imagens mamográficas, do controle pós-operatório de lipoenxertia em casos de necrose gordurosa, variam de cistos lipídicos a achados suspeitos de malignidade, como microcalcificações agrupadas, áreas espiculadas de opacidade aumentada e massas focais10.
A necrose gordurosa é um achado histológico não específico e vários processos estão envolvidos em sua etiopatogênese. Além da cirurgia, as causas mais comuns de necrose gordurosa são isquemia, radioterapia e trauma. Outros incidentes raros foram relatados de necrose de gordura na mama causada por terapia anticoagulante com warfarina sódica (Coumadin) e enoxaparina sódica. A calcifilaxia (hipersensibilidade à calcinose local associada ao hiperparatireoidismo secundário na insuficiência renal) também foi relatada10.
O aumento da incidência de câncer após lipoenxertia foram observados em revisões de trabalhos in vitro e em animais que comprovaram essa hipótese, mas concluíram que não existiam evidências sobre o assunto in vitro11.
OBJETIVO
Realizar uma revisão bibliografia sobre o uso da lipoenxertia em reconstruções mamárias com expansor e implantes, e relatar três casos de pacientes submetidas ao procedimento em uma clínica particular de Fortaleza.
MÉTODOS
Revisão bibliográfica em sites de pesquisas científicos como BIREME, NCBI, PubMed, Scielo e acesso a trabalhos publicados nas revistas da Sociedade De Cirurgia Plástica Brasileira e Americana.
Descrição de três casos de pacientes que foram submetidas à reconstrução mamária, com uso de próteses e expansores associados à lipoenxertia de gordura. Incisões foram feitas nas áreas doadoras de gordura usando uma lâmina de bisturi n° 15. Para a aspiração de gordura abdominal, duas incisões laterais, em flancos, foram feitas e introduzido cânula de 3 furos de diâmetro de 3mm, usando seringa de 60ml.
A gordura foi injetada em pequenas quantidades, na forma de cilindros finos por retro infusão. Foi necessário criar micro túneis em várias direções. A transferência foi feita de um plano profundo para um plano superficial. Uma boa visualização espacial era necessária para formar uma espécie de favo de mel tridimensional, de modo a evitar a criação de bolsões de gordurosa que levariam à necrose de gordura.
O método que utilizamos para preparação do enxerto de gordura foi a sedimentação. O processamento de gordura é necessário porque o lipoaspirado contém não apenas adipócitos, mas também fibras de colágeno, sangue e detritos.
A avaliação pré-operatória baseou-se em métodos antropométricos e foram acompanhadas mensalmente com seguimento ultrassonográfico das mamas para controle da lipoenxertia e mamografia conforme a idade.
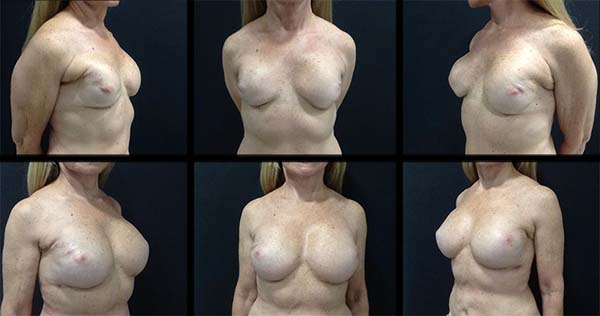
Caso 1: Feminino, 65 anos, casada, submetida à mastectomia total direita – 200ml em 2002 e esquerda – 250ml em 2008 submetida à reconstrução imediata com prótese, retornando em 2016 para correção de assimetria mamária. Antecedentes mórbidos pessoais: radioterapia em complexo areolopapilar e hormonioterapia por 5 anos. Ao exame: mamas assimétricas, ptosadas grau 1, com contratura bilateral – Baker 3, mais intensa à direita e ausência de tecido adiposo bilateralmente. Realizado retirada de próteses, colocação de novas com 332ml à direita e 350ml à esquerda, além de lipoenxertia de 80ml à direita e 60 ml à esquerda. Segunda lipoenxertia 2 meses depois de 70ml à direita e 80ml à esquerda (Figura 1).
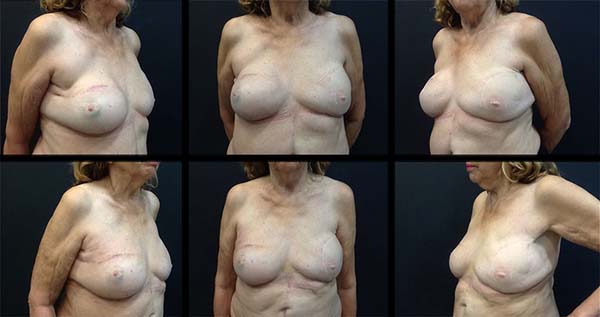
Caso 2: Feminino, 75 anos, casada, submetida à mastectomia total direita por carcinoma ductal in situ, reconstrução tardia com retalho miocutâneo de músculo reto abdominal (TRAM) em 2007, procurou o serviço por insatisfação com resultado obtido. Antecedentes mórbidos pessoais: mãe com melanoma em pulmão e mamas. Realizado colocação de prótese expansora de 350ml à direita em 12/2015. Em 06/2016, troca de expansor por prótese de silicone em mama direita de 350ml e prótese de 332ml à esquerda, além de lipoenxertia de 120ml nas mamas (Figura 2).
Caso 3: Feminino, 38 anos, casada, submetida à mastectomia total com esvaziamento axilar direito por tumor > 5cm reconstrução imediata com prótese expansora de 450ml em 2013, procurou o serviço com desejo de simetrização mamária. Antecedentes mórbidos pessoais: radioterapia 05/2013 e quimioterapia neoadjuvante. Em 2015 troca de expansor por prótese de silicone em mama direita 495ml e prótese de 250 ml à esquerda (Figura 3).
DISCUSSÃO
O material de aumento ideal requer certas qualidades, incluindo biocompatibilidade, falta de toxicidade, resultados consistentes e reproduzíveis e custo-efetividade. Os enxertos de gordura autólogos atendem a muitas qualidades de um material de aumento ideal com a adição de uma sensação natural, personalização para cada paciente individual e facilidade de remoção em caso de complicação ou insatisfação do paciente. O maior desafio da transferência de gordura autóloga é manter a longevidade e a durabilidade dos enxertos de gordura, o que está relacionado às técnicas de coleta e preparo de gordura. Embora tenha havido alguns estudos clínicos sobre este assunto, algumas questões importantes não podem ser respondidas: (1) Algum método atual de lipoenxertia pode ser aceito como padrão?; (2) Existe método de preparação enxerto de gordura mais viável e funcional?; e, (3) Um protocolo comum de coleta e preparação de gordura pode ser encontrado à luz das informações atuais da literatura?
Coleman et al.2, questionaram uma restrição ao uso de lipoenxertia pelo comitê de especialistas americanos em 1987, e afirmaram que as calcificações e liponecrose observadas após procedimentos de lipoenxertia, também são observadas em outros procedimentos mamários, tais como redução mamária e mastopexia.
Várias técnicas de preparo têm sido sugeridas na literatura para manter a viabilidade dos enxertos de gordura após serem colhidos e processados.
De acordo com uma pesquisa da Sociedade Americana de Cirurgia Plástica Estética, a técnica de microcânula de Coleman é o método mais comum de coleta autóloga de gordura (54%), seguida por cânula padrão de lipoaspiração (25%), seringa e agulha de grande calibre (16%), e técnicas de excisão direta (5%). A mesma pesquisa descobriu que, após a coleta de gordura, 47% dos entrevistados realizam a centrifugação de gordura, 29% realizam lavagens de gordura, 12% citam “outras” técnicas de tratamento não especificadas e 12% não usam nenhum método de preparação12.
Outros métodos de coleta e processamento de gordura foram relatados na literatura e usados clinicamente para lipoenxertia estrutural. Har-Shai et al., em 199913, usaram uma abordagem integrada em que os enxertos de gordura foram colhidos com uma seringa e centrifugação a 1000rpm. Depois de centrifugar, suspenderam o aspirado em meio de cultura celular enriquecido para aumentar a sobrevivência de enxertos autólogos de gordura. Eles usaram essa técnica integrada em 15 pacientes e relataram que a quantidade de enxerto ingerida variou entre 50% e 90% nos acompanhamentos de 6 e 24 meses12,14.
Pu et al., em 200815, relataram que a técnica modificada incluiu aspiração de gordura sob baixa pressão com seringa de 20ml e separação dos tecidos adiposos com gravidade sem centrifugação. Além disso, eles refinaram pacotes de gordura com gaze e palitos de algodão para remover componentes gordurosos e não gordurosos. Embora tenham relatado que um bom volume foi mantido após a injeção de gordura em um acompanhamento de longo prazo, é importante evitar a exposição dos enxertos de gordura ao ar para maximizar a viabilidade do enxerto e minimizar a contaminação.
Também compararam sua técnica de coleta com a lipoaspiração convencional e mostraram que a coleta de gordura com baixa pressão com uma seringa produz mais adipócitos com função celular ótima do que as pressões negativas superiores a 20cm H2O geradas pela lipoaspiração convencional. Entretanto, não há estudo comparativo12,13.
Quanto a utilização, o uso de enxerto de gordura em deformidades da parede torácica e da mama está se expandindo rapidamente. Parece representar um grande avanço no tratamento da síndrome de Poland e provavelmente revolucionará o tratamento de casos graves, produzindo reconstrução de qualidade inigualável após procedimentos que envolvem curto pós-operatório simples e poucas cicatrizes5.
Esse mesmo raciocínio é utilizado para enxertos em tecidos com radioterapia, nos quais a vascularização é escassa e, mesmo assim, apresenta bons resultados. A maioria dos trabalhos realizados tem um número elevado de complicações, sendo a necrose gordurosa e as imagens a ela relacionadas as complicações mais frequentes, no seguimento radiológico da área enxertada11.
A porcentagem de pacientes que necessitaram de outra sessão de lipoenxertia para cada grupo não demonstrou diferenças significativas entre os grupos. Até agora, os desfechos clínicos, a necrose da gordura experimentada na ultrassonografia de mama e a necessidade de novos enxertos de gordura revelaram que a gordura enriquecida em plasma rico em plaquetas não é superior ao enxerto de gordura isoladamente11.
Efeitos positivos do plasma rico em plaquetas em favor dos processos de angiogênese e proliferação de células-tronco derivadas do tecido adiposo foram demonstrados experimentalmente. Em relação à angiogênese, os fatores de crescimento do plasma rico em plaquetas estimulam as células endoteliais próximas ao seu local de aplicação, favorecendo a proliferação e a formação de novos capilares. Além disso, em um estudo in vitro, concluíram que o plasma é um contribuinte potencial em possivelmente iniciar o processo de angiogênese, recrutando as células endoteliais que revestem os vasos sanguíneos e iniciando o início da regeneração óssea13,15,16,17.
Em relação à proliferação celular, o plasma rico em plaquetas ativado contém grandes quantidades de PDGF-AB e TGF-β1 e eles promoveram a proliferação de células-tronco humanas derivadas de tecido adiposo e fibroblastos dérmicos humanos in vitro. A proliferação celular foi promovida ao máximo quando 5% de plasma rico em plaquetas ativado foi adicionado ao meio de cultura. Paradoxalmente, a adição de 20% de plasma rico em plaquetas ativado não o promoveu15,16,17.
Procedimentos de lipofilling podem modificar imagens radiológicas, no entanto, sua interferência tem sido estudada na literatura, e estudos radiológicos sugerem que as tecnologias de imagem (ultrassonografia, mamografia e ressonância magnética) podem identificar as microcalcificações causadas pela injeção de gordura. Além disso, estudos de seguimento recentes demonstraram a segurança do procedimento, não detectando aumento de nova doença ou recidiva tumoral18,19.
Acompanhamentos oncológicos não revelaram risco aumentado de recidiva local após mastectomia ou após tratamento conservador. A impressão clínica parece mesmo sugerir o contrário, mas para confirmar essa impressão clínica, estudos oncológicos mais complexos devem ser realizados que correspondam às populações tratadas com populações de referência com o mesmo status oncológico5,18,19.
O volume de gordura enxertada foi estável após três a quatro meses e permanece assim, se o paciente mantiver peso constante ou se o paciente perder peso, o volume da gordura transferida diminui e o tamanho de mama menor resultante pode levar à assimetria. Consequentemente, é importante para o paciente para entender que ela deve manter um peso estável. Inversamente, se ela ganha peso, o volume da mama aumenta em relação à gordura do depósito adiposo.
Quando uma segunda sessão era necessária para obter plenitude suficiente, a reabsorção parecia ser menor (entre 20% e 30%). Essa redução na taxa de reabsorção de gordura tem sido avaliada clinicamente. Em alguns casos em que os pacientes necessitaram de uma segunda sessão de transferência de gordura, uma avaliação interferométrica confirmou objetivamente essa impressão clínica.
O retalho do músculo grande dorsal tem substituído gradualmente a retalho miocutâneo de músculo reto abdominal (TRAM) nos últimos 10 anos, porque o curso pós-operatório é mais simples e o procedimento faz melhor uso do torácico local tecido, evitando um efeito de patch na mama. Em alguns casos, no entanto (se o paciente estiver muito magro ou se houver atrofia acentuada do retalho), a mama reconstruída pode ser muito pequena.
O retalho de grande dorsal autólogo é o tecido mais adequado para receber transferência de gordura, pois é muito bem vascularizado e grandes quantidades de gordura podem ser injetado. Nos estágios iniciais de nossa experiência injetamos quantidades moderadas (100 a 120ml), por causa da taxa de reabsorção isso não foi suficiente. Lipomodelagem então tornou possível corrigir anormalidades localizadas ou defeitos da área do decote6.
Algumas técnicas de avaliação do volume mamário são descritas na literatura com fins históricos e outras demonstram-se modernas, práticas e fidedignas.
1. Método antropométrico
Com base em medições de ponta a ponta, a mama feminina é vista geometricamente como uma meia elipse e seu volume pode ser calculado com fórmulas matemáticas. Medições podem ser realizadas usando fotografias ou mamografias também. Técnica prática, porém, com alta dependência do observador20.
2. O dispositivo de medição Grossman-Roudner
É uma peça de plástico circular com um corte ao longo da linha do raio. Mostrou-se prática e ser muito rentável, como o custo do tempo e material são apenas US$ 1,00. Embora tenha sido utilizado para medidas antropomórficas da mama em 50 mulheres, a validação exata deste método está ausente20.
3. Princípio de Deslizamento da Água de Arquimedes
Método simples e com valor apenas histórico, é baseado o princípio de deslocamento de água de Arquimedes20.
4. Imagem de superfície 3D
Usando dispositivos de imagem 3D, a criação de um modelo 3D virtual do paciente em pé facilita a eliminação da compressão do tecido mamário. Permite a simulação do status de pós aumento e pode ajudar o paciente a encontrar o volume de aumento desejado. O método não é invasivo e a coleta de dados não é dependente do examinador se for baseada em protocolos padronizados. Como a ressonância magnética é considerada o padrão ouro para medições de volume sem contato, a validade da imagem 3D foi comparada às medidas de ressonância magnética20.
5. Volumetria com ressonância nuclear magnética
Com base na sua excelente sensibilidade na detecção de complicações do transplante autólogo de gordura, como cistos de óleo, calcificações ou necrose, a ressonância magnética é de grande interesse após o transplante de gordura autóloga para a mama. A ressonância magnética já é o padrão ouro na detecção de outras patologias da mama, como a ruptura do implante, e seu uso na imagem da mama está aumentando. No entanto, além da avaliação qualitativa, exames de ressonância magnética da mama também podem ser usados para avaliação quantitativa20.
RESULTADOS
Caso 1. A paciente apresentou, após 6 anos de reconstrução primária das mamas, contratura capsular bilateralmente, devido a radioterapia pós-adjuvante, classificadas em Baker 3. Realizado colocação de novas próteses de 332ml à direita e 350ml à esquerda de perfil anatômico e lipoenxertia 80ml em mama direita e 60ml em mama esquerda, apresentando bom envelope mamário. Após 2 meses, nova lipoenxertia para melhora do contorno mamário e correção de pequenas deformidades. Evoluiu com boa aceitação cirúrgica e acompanhamento ao ultrassom mamário sem alterações decorrentes ao procedimento (Figura 1).
Caso 2. Senhora idosa com reconstrução mamária tardia à direita com retalho muscular de reto abdominal ipsilateral, reclamando de insatisfação com resultado obtido, devido à grande assimetria entre as mamas. Foi iniciado tratamento com a troca da prótese por um expansor de 350ml e, posteriormente, no intervalo de 6 meses, trocado por prótese de silicone anatômica de mesmo volume do expansor e prótese de mesmo perfil de 332ml em mama esquerda; 120ml de enxerto de gordura foi usado para correção de pequenas assimetrias e deformidades residuais. Edema, dor e discreta hiperemia inicial desapareceram após 15 a 30 dias. Paciente apresentou-se satisfeita com resultado obtido e sem intercorrências durante acompanhamento ambulatorial (Figura 2).
Caso 3. Paciente jovem submetida à reconstrução mamária imediata com prótese expansora de 450ml e após término de tratamento adjuvante com radioterapia, realizou troca do expansor por prótese de silicone de 495ml em mama direita e 250ml em mama esquerda. E pré-operatório de lipoenxertia mamária para refinamento de bordas e confecção de novo complexo areolopapilar (Figura 3).
CONCLUSÃO
O enxerto de gordura é um procedimento pouco invasivo, seguro, simples e efetivo. Tem excelente indicação em reconstrução de mama, para refinamentos pós-reconstrução e defeitos de contorno secundários, podendo também ser usado para melhorar a qualidade de tecidos em mamas irradiadas e, até mesmo, para reposição do volume total da mama, como estudos recentes vêm demonstrando6,18,19.
A medição do volume mamário após a lipoenxertia é fundamental no acompanhamento a longo prazo. A maioria dos métodos discutidos nesta revisão foi apresentado em publicações mais antigas, incluindo-se o método antropométrico, os modelos termoplásticos e o princípio de deslocamento da água de Archimedes, métodos ultrapassados frente às técnicas mais modernas e fidedignas de volumetria, como a ressonância magnética e a varredura da superfície corporal em 3D20.
Apesar dos últimos trabalhos apresentarem sucesso, quanto ao procedimento de lipoenxertia nos últimos 15 anos, não existem dados de Nível I ou Nível II para justificar uma recomendação de um protocolo consensual para a prática clínica2,5,8,9,11,12,14,18.
A lipoenxertia associada aos expansores e próteses mamárias, realizada nos casos relatados, obtiveram resultados satisfatórios do ponto de vista do paciente e da equipe cirúrgica, sendo utilizados com a finalidade de aumento do volume mamário, melhora da pele e da estrutura de suporte dos tecidos, além de proporcionar refinamento e correções de pequenas imperfeições após procedimento cirúrgico.
COLABORAÇÕES
|
CCO |
Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Aquisição de financiamento, Coleta de Dados, Conceitualização, Gerenciamento de Recursos, Gerenciamento do Projeto, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Validação |
|
CCS |
Concepção e desenho do estudo, Supervisão |
REFERÊNCIAS
1. Pereira Filho O, Ely JB. Lipoenxertia mamária seletiva. Arq Catarin Med. 2012;41(Supl 1).
2. Coleman SR, Saboeiro AP. Fat grafting to the breast revisited: safety and efficacy. Plast Reconstr Surg. 2007;119(3):75-85.
3. Weichman KE, Broer PN, Tanna N, Wilson SC, Allan A, Levine JP, et al. The role of autologous fat grafting in secondary microsurgical breast reconstruction. Ann Plast Surg. 2013;71(1):24-30.
4. Costantini M, Cipriani A, Belli P, Bufi E, Fubelli R, Visconti G, et al. Radiological findings in mammary autologous fat injections: a multi-technique evaluation. Clin Radiol. 2013;68(1):27-33. DOI: https://doi.org/10.1016/j.crad.2012.05.009
5. Delay E, Garson S, Tousson G, Sinna R. Fat injection to the breast: technique, results, and indications based on 880 procedures over 10 years. Aesthet Surg J. 2009;29(5):360-76.
6. Gardani M, Bertozzi N, Grieco MP, Pesce M, Simonacci F, Santi PL, et al. Breast reconstruction with anatomical implants: a review of indications and techniques based on current literature. Ann Med Surg. 2017;21:96-104.
7. Strong AL, et al. The current state of fat grafting: a review of harvesting, processing, and injection techniques. Plast Reconst Surg. 2015;136(4):897-912.
8. Illouz YG. Body contouring by lipolysis: a 5-year experience with over 3000 cases. Plast Reconstr Surg. 1983;72:591-7.
9. Fournier PF. Fat grafting: my technique. Dermatol Surg. 2000;26(12):1117-28.
10. Illouz YG. Surgical remodeling of the silhouette by aspiration lipolysis or selective lipectomy. Aesthet Plast Surg. 1985;9(1):7-21.
11. Carvajal J, Patiña JH. Mammographic findings after breast augmentation with autologous fat injection. Aesthet Surg J. 2008;28(2):153-62.
12. Blumenschein AR, Freitas-Junior R, Tuffanin AT, Blumenschein DI. Lipoenxertia nas mamas: procedimento consagrado ou experimental?. Rev Bras Cir Plást. 2012;27(4):616-22.
13. Har-Shai Y, Lindenbaum ES, Gamliel-Lazarovich A, Beach D, Hirshowitz B. An integrated approach for increasing the survival of autologous fat grafts in the treatment of contour defects. Plast Reconstr Surg. 1999;104(4):945-54.
14. Özkaya Ö, Egemen O, Barutça SA, Akan M. Long-term clinical outcomes of fat grafting by low- pressure aspiration and slow centrifugation (Lopasce technique) for different indications. J Plast Surg Hand Surg. 2013;47(5):394-8.
15. Pu LLQ, Coleman SR, Cui X, Ferguson Junior RE, Vasconez HC, et al. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 2008;122(3):932-7.
16. Salgarello M, Visconti G, Rusciani A. Breast fat grafting with platelet-rich plasma: a comparative clinical study and current state of the art. Plast Reconstr Surg. 2011;127(6):2176-85.
17. Herold C, Ueberreiter K, Busche MN, Vogt PM. Autologous fat transplantation: volumetric tools for estimation of volume survival. A systematic review. Aesthet Plast Surg. 2013;37(2):380-7.
18. Kakudo N, Kushida S, Minakata T, Suzuki K, Kusomoto K. Platelet-rich plasma promotes epithelialization and angiogenesis in a splitthickness skin graft donor site. Med Mol Morphol. 2011;44(4):233-6.
19. Eppley BL, Woodell JE, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing. Plast Reconstr Surg. 2004;114(6):1502-8.
20. Gentile P, Scioli MG, Orlandi A, Cervelli V. Breast reconstruction with enhanced stromal vascular fraction fat grafting: what is the best method?. Plast Reconstr Surg Global Open. 2015;3(6):e406.
1. Hospital Geral de Fortaleza, Fortaleza, CE, Brasil.
2. Instituto do Câncer do Ceará, Fortaleza, CE, Brasil.
Autor correspondente: Carlos Cunha Oliveira Ávila Goulart, 900, Papicu, Fortaleza, CE, Brasil. CEP 60175-295. E-mail: carloscunhaoliveira@hotmail.com
Artigo submetido: 2/12/2018.
Artigo aceito: 20/10/2019.
Conflitos de interesse: não há.







 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter