

Original Article - Year 2020 - Volume 35 -
Comparação histológica entre mamas irradiadas e não irradiadas em reconstrução mamária
Histological comparison between irradiated and non-irradiated breasts in breast reconstruction
RESUMO
Introdução: O tratamento do câncer de mama inclui, além de terapias curativas, a reconstrução mamária. Entre as estratégias adjuvantes, a radioterapia fornece desfechos favoráveis em termos de redução da taxa de recorrência da doença. Esse estudo tem como objetivo comparar as diferenças histológicas entre mamas irradiadas e não irradiadas em um mesmo paciente.
Métodos: Estudo prospectivo de coorte em pacientes submetidos à reconstrução mamária com prótese ou expansor sob retalho muscular de peitoral maior, comparando os padrões histológicos de pele, tecido celular subcutâneo, músculo peitoral maior e cápsula do implante, de mamas irradiadas e não irradiadas em amostras pareadas de um mesmo paciente. Todos os pacientes deveriam receber irradiação em apenas uma das mamas. A análise anatomopatológica foi comparada aos achados clínicos e aos aspectos macroscópicos do transoperatório.
Resultados: O trabalho contou com um total de 7 pacientes, sendo a idade média de 52,15 anos. Os principais achados histológicos em pele e tecido celular subcutâneo da mama irradiada foram: hiperplasia epidérmica, achatamento da camada papilar, atrofia dos apêndices dérmicos, congestão vascular no tecido gorduroso, alta densidade das fibras de colágeno dérmico, hialinização das paredes vasculares, redução das fibras elásticas na derme profunda e alinhamento unidirecional das fibras de colágeno. Os principais achados histológicos de cápsula e músculo peitoral maior na mama irradiada foram: menor densidade de fibras elásticas, fibrose perivascular, metaplasia sinovial, sequestro de músculo esquelético na interface com a cápsula, hialinização capsular e fibroesclerose capsular.
Conclusão: Encontramos alterações histológicas comuns nas mamas irradiadas em boa parte das pacientes, achados esses que são compatíveis com as alterações clínicas e macroscópicas observadas. Esse estudo apresenta-se como um piloto para o desenvolvimento de novos estudos que pesquisem os mecanismos fisiopatológicos relacionados às alterações histológicas descritas.
Palavras-chave: Mama; Neoplasias da mama; Radioterapia; Radioterapia adjuvante; Próteses e implantes
ABSTRACT
Introduction: The treatment of breast cancer includes not only curative therapies but also breast reconstruction. Radiotherapy, an adjuvant strategy, provides favorable outcomes by reducing the rate of recurrence of the disease. This study aimed to compare histological differences between irradiated and non-irradiated breasts in the same patient.
Methods: This is a prospective cohort study of patients undergoing breast reconstruction with prosthesis or expander under pectoralis major muscle flap that compared histological skin patterns, subcutaneous cell tissue, pectoralis major muscle, and implant capsule of irradiated and non-irradiated breasts in paired samples of the same patient. All patients included in this study were irradiated in only one breast. The results of the anatomopathological analysis were compared to clinical findings and intraoperative macroscopic aspects.
Results: The study included a total of 7 patients with a mean age of 52.15 years. The main histological findings in the skin and subcutaneous cellular tissue of the irradiated breast were as follows: epidermal hyperplasia, flattening of the papillary layer, atrophy of the skin appendages, vascular congestion in fatty tissue, high density of skin collagen fibers, hyalinization, and reduction of elastic fibers in the deep dermis and unidirectional alignment of collagen fibers. The main histological findings for the capsule and pectoralis major muscle in the irradiated breast were as follows: lower density of elastic fibrosis, perivascular fibrosis, synovial metaplasia, skeletal muscle sequestration at the interface with the capsule, capsular hyalinization, and capsular fribrosclerosis.
Conclusion: We found common histological changes in irradiated breasts in most patients. These findings are compatible with the clinical and macroscopic changes observed. This study presents itself as a pilot for the development of further studies investigating the physiopathological mechanisms of the described histological changes.
Keywords: Breast; Breast neoplasms; Radiotherapy; Adjuvant radiotherapy; Prostheses and implants.
INTRODUÇÃO
Desde a década de 1990 o tratamento do câncer de mama inclui não apenas terapias curativas, mas também a reconstrução mamária, o que fez crescer o interesse das pacientes em obter segurança oncológica e resultados estéticos melhores. Muitos estudos relataram que a reconstrução mamária não tem nenhum impacto negativo na segurança oncológica, tranquilizando as pacientes e as motivando a realizar o procedimento1,2.
Entre as estratégias adjuvantes, os estudos demonstram que a radioterapia fornece desfechos favoráveis em termos de redução da taxa de recorrência da doença, aumentando assim seu número de indicações. As diretrizes para radioterapia passaram a incluir critérios de indicação mais diversificados, ampliando ainda mais o uso dessa modalidade terapêutica3,4.
A reconstrução imediata é indicada pois pode melhorar significativamente a qualidade de vida de uma mulher, auxiliando na sua satisfação com a imagem corporal e em seu bem-estar psicossocial, quando comparada à reconstrução tardia5.
A reconstrução mamária utilizando implantes trata-se de um procedimento relativamente simples, de curto tempo cirúrgico e recuperação pós-operatória rápida, além de oferecer excelente resultado estético. Suas vantagens em relação à reconstrução com retalho autólogo incluem procedimentos de menor porte e com bons resultados, sem necessidade de transpor ilhas de pele de outras regiões do corpo para a mama6,7. Diante desses fatos é atualmente um dos mais populares métodos cirúrgicos. Esse aumento na indicação da reconstrução mamária com implantes, combinado com a ampla aplicação da radioterapia, resultou em maiores esforços para entender e evitar a complicações potenciais associadas à interação entre radiação e o implante. Contratura capsular, infecção e mau posicionamento do implante mamário foram mencionados como as principais complicações. Entre elas a contratura capsular se coloca como a mais importante, sendo a causa mais comum de reoperação3,8,9, mas sua patogênese induzida pela radiação ainda é desconhecida10.
Algumas das alterações cutâneas após a irradiação foram investigadas e os efeitos precoces (até 90 dias após o início da radiação) incluem: desidratação, alterações na pigmentação, perda de apêndices cutâneos, eritema e descamação. Alterações histológicas tardias (após 90 dias) incluem atrofia ou hiperplasia da epiderme, fibrose hipocelular da derme, alterações vasculares escleróticas e ausência de unidades pilossebáceas (anexos). Mas ainda não está claro se essas mudanças estão relacionadas às dificuldades e complicações de reconstrução mamária com o expansor/implante11,12. A suscetibilidade da pele a alterações após irradiação pode ser determinada geneticamente. Esse conceito é reforçado pelas diferenças individuais nas alterações provocadas pela radiação e pelas complicações desenvolvidas13,14,15.
Esse estudo tem como objetivo descrever e comparar as diferenças histológicas entre pele, tecido celular subcutâneo, músculo peitoral maior e cápsula do implante de mamas irradiadas e não irradiadas em um mesmo paciente, bem como direcionar novos estudos no sentido de analisar possíveis métodos de profilaxia e tratamento das complicações. Atualmente não há publicações que abordem tais comparações em todas as camadas de tecido.
MÉTODOS
Desenho do estudo
Pacientes e coleta de tecidos
Estudo prospectivo de coorte em pacientes submetidos à reconstrução mamária com prótese ou expansor sob retalho muscular de peitoral maior, no período entre janeiro e agosto de 2019, no Hospital Daher Lago Sul, Brasília (DF), comparando os padrões histológicos de pele, tecido celular subcutâneo, músculo peitoral maior e cápsula do implante, de mamas irradiadas e não irradiadas em amostras pareadas de um mesmo paciente. Todos os pacientes assinaram termo de consentimento informado autorizando e concordando com a realização dos procedimentos cirúrgicos e dos exames anatomopatológicos, além de seus registros para fins científicos. O estudo foi submetido à Plataforma Brasil e teve sua validação documental concluída pelo CEP da Fundação de Ensino e Pesquisa em Ciências da Saúde/FEPECS/SES/DF, cujo número CAAE é: 15942719.6.0000.5553.
As cirurgias foram realizadas no Hospital Daher Lago Sul - DF e no Hospital Brasília - DF. Todos os pacientes selecionados tinham história de radioterapia prévia em outra instituição, seguindo o esquema atual de referência (50 Gy), o qual consiste em 25 sessões de radioterapia durante 5 semanas mais uma dose adicional sobre o leito tumoral. Foram incluídos pacientes maiores de 18 anos, que foram submetidas à reconstrução mamária para tratamento de contratura capsular ou outras complicações da radioterapia adjuvante e para simetrização contralateral. Todos os pacientes deveriam receber irradiação em apenas uma das mamas.
Os tecidos para biópsia foram colhidos durante a reconstrução mamária. Amostras de pele e tecido celular subcutâneo com dimensões de comprimento, largura e profundidade variando entre 0,5 e 1,0cm, foram colhidas do sulco submamário bilateralmente.
Amostras de tecido capsular e músculo peitoral maior de 1,0x1,0cm foram colhidas na região de maior retração cicatricial na mama irradiada; e na porção inferomedial próximo ao sulco submamário da mama não irradiada.
A análise anatomopatológica foi descrita e comparada aos achados clínicos de exame físico e aos aspectos macroscópicos de transoperatório como cor, elasticidade, vascularização, cicatrização e sensibilidade dos tecidos, a fim de estabelecer correlações entre as variáveis clínicas/histológicas e a radiação.
Abordagem histológica
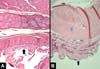
O processamento histológico dos espécimes de tecido foi realizado de acordo com o método descrito por Huanget et al., em 201616. Resumidamente, espécimes de tecido foram fixados em formaldeído tamponado e incluídos em parafina, corados por hematoxilina e eosina, tricrômico de Massom e em Voerhoff (fibras elásticas) para realização de microscopia de luz. A avaliação histológica foi realizada por um único patologista no laboratório Diagnose, Brasília (DF).
Foram avaliados aspectos quantitativos e qualitativos da epiderme. Na derme, panículo adiposo e cápsula do implante foram avaliados aspectos quantitativos e qualitativos quanto ao colágeno, celularidade, inflamação e vascularização.
RESULTADOS
Tivemos um total de 7 pacientes, sendo a idade média de 52,15 anos (variando de 34 a 68 anos), todas do sexo feminino, submetidas a 25 sessões de radioterapia convencional em uma das mamas, sendo a dose total de 50 Gy. O tempo médio entre a última sessão de radioterapia e a reconstrução mamária foi de 54,14 meses (variando de 7 a 204 meses). Em relação às complicações pós-operatórias da primeira cirurgia podemos destacar que todas as pacientes apresentaram contratura capsular, fato que motivou o segundo tempo cirúrgico. Uma paciente apresentou deiscência de sutura nas duas mamas, resolvida com curativos locais. Nenhuma apresentou infecção.
Em todas as pacientes foram colhidas biópsias de pele e tecido celular subcutâneo e em apenas 5 foram colhidas biópsias de cápsula e músculo peitoral maior, pois a mama contralateral à radioterapia não possuía implante. As principais alterações clínicas e macroscópicas apresentadas no momento do procedimento cirúrgico foram: pele ressecada (100%), perda da elasticidade da pele (85,71%), gordura hipovascularizada (100%), contratura capsular (100%), espessamento capsular (85,71%), hipotrofia muscular (100%), hipovascularização muscular (85,71%) e discromia dérmica (42,85%), como mostra a Tabela 1.
| Caso | Idade | Tempo entre última radiação e a cirurgia |
Lado irradiado |
Alterações clínicas e macroscópicas da mama irradiada | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| PR | PEP | GH | CC | EC | HM | HVM | DP | ||||
| 1 | 57 | 108 meses | Esquerdo | + | + | + | + | + | + | +/- | - |
| 2 | 68 | 204 meses | Direito | + | + | + | + | +/- | + | + | + |
| 3 | 60 | 24 meses | Esquerdo | + | + | + | + | + | +/- | + | + |
| 4 | 34 | 18 meses | Direito | + | + | + | + | + | +/- | + | - |
| 5 | 42 | 10 meses | Esquerdo | + | - | +/- | + | +/- | +/- | - | - |
| 6 | 40 | 7 meses | Direito | +/- | +/- | + | + | + | + | + | +/- |
| 7 | 64 | 8 meses | Direito | + | + | +/- | + | - | + | + | - |
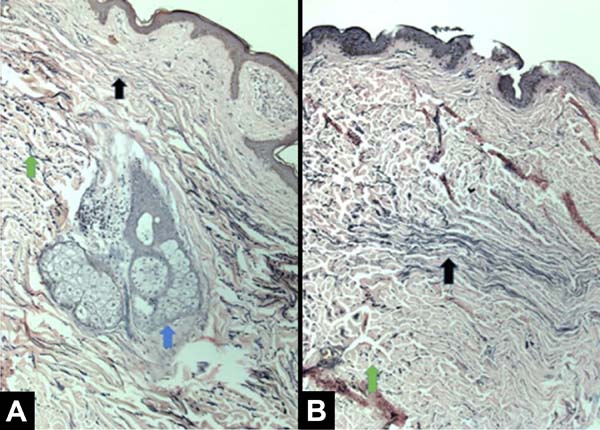
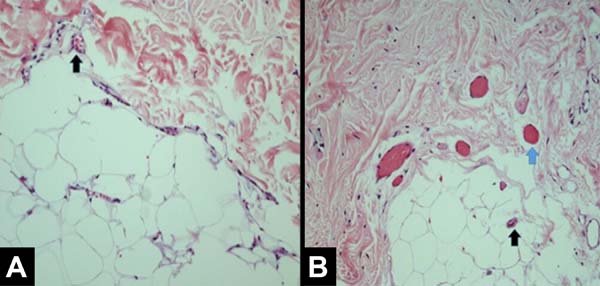
Os principais achados histológicos em pele e tecido celular subcutâneo da mama irradiada foram: hiperplasia epidérmica (71,42%), achatamento da camada papilar (85,71%), atrofia dos apêndices dérmicos (100%), congestão vascular no tecido gorduroso (71,42%), alta densidade das fibras de colágeno dérmico (100%), hialinização das paredes vasculares (85,71%), redução das fibras elásticas na derme profunda (85,71%) e alinhamento unidirecional das fibras de colágeno (100%), como ilustra a Tabela 2. Os achados descritos acima foram observados nas amostras de pele irradiada com consideráveis diferenças.
| Caso | Idade | Tempo entre última radiação e a cirurgia |
Lado irradiado |
Mama irradiada | Mama não-irradiada | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HE | ACP | AAD | CV | ADFC | HPV | RFEDP AUFC |
HE | ACP | AAD | CV ADFC |
HPV | RFEDP AUFC |
||||
| 1 | 57 | 108 meses | E | + | + | + | + | + | + | + + | - | - | - | - - | - | - + |
| 2 | 68 | 204 meses | D | +/- | + | + | + | +/- | + | + + | - | - | - | - + | - | +/- - |
| 3 | 60 | 24 meses | E | + | +/- | + | + | + | + | + + | - | + | - | - - | - | - - |
| 4 | 34 | 18 meses | D | + | + | + | + | + | +/- | + + | - | +/- | - | - - | +/- | - - |
| 5 | 42 | 10 meses | E | - | + | +/- | +/- | + | +/- | +/- + | - | - | - | +/- - | - | - - |
| 6 | 40 | 7meses | D | + | - | + | - | +/- | +/- | - +/- | - | - | - | - +/- | - | - - |
| 7 | 64 | 8 meses | D | - | + | + | - | +/- | - | +/- +/- | - | - | - | - - | - | - - |
HE: Hiperplasia epidérmica; ACP: Achatamento da camada papilar AAD: Atrofia dos apêndices dérmicos CV: Congestão vascular no subcutâneo; ADFC: Alta densidade das fibras de colágeno; HPV: Hialinização da parede vascular; RFEDP: Redução de fibras elásticas na derme profunda; AUFC: Alinhamento unidirecional das fibras de colágeno; * análise de pele e tecido celular subcutâneo; "-" (achado ausente); "+/-" (moderadamente presente); "+" (achado presente).
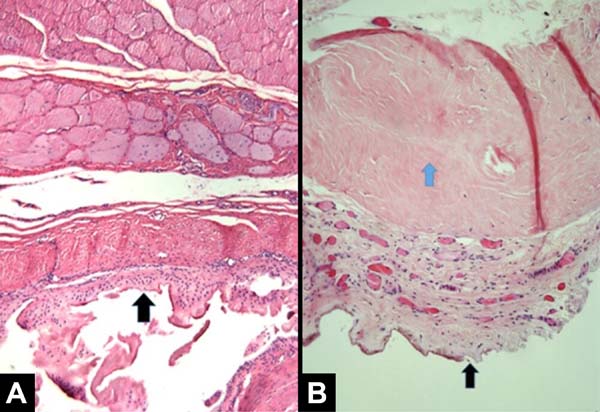
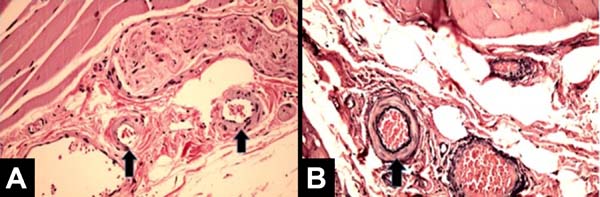
Os principais achados histológicos de cápsula e músculo peitoral maior na mama irradiada foram: menor densidade de fibras elásticas (80%), fibrose perivascular (100%), metaplasia sinovial (100%), sequestro de músculo esquelético na interface com a cápsula (80%), hialinização capsular (80%) e fibroesclerose capsular (100%), como ilustra a Tabela 3.
| Caso | Idade | Tempo entre última radiação e a cirurgia |
Grau de contratura capsular |
Lado irradiado |
Mama irradiada | Mama não irradiada | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MDFE | FP | MS | SME | HC | FC | MDFE | FP | MS | SME | HC | FC | |||||
| 1 | 57 | 108 meses | Baker 3 | E | + | + | + | +/- | + | + | - | +/- | - | - | - | - |
| 2 | 60 | 24 meses | Baker 2 | E | +/- | + | + | + | + | + | - | - | - | +/- | - | - |
| 3 | 34 | 18 meses | Baker 3 | D | + | +/- | + | + | + | + | - | - | - | - | - | - |
| 4 | 42 | 10 meses | Baker 2 | E | + | + | + | +/- | +/- | +/- | - | - | - | - | - | - |
| 5 | 40 | 7 meses | Baker 2 | D | + | - | + | - | - | + | - | - | - | - | - | - |
MDFE: Menor densidade de fibras elásticas; FP: Fibrose perivascular; MS: Metaplasia sinovial; SME: Sequestro de músculo esquelético; HC: Hialinização capsular; FC: Fibroesclerose capsular; * análise de cápsula e músculo peitoral maior; "-" (achado ausente); "+/-" (moderadamente presente); "+" (achado presente).
Todas as pacientes apresentaram achados anatomopatológicos semelhantes e condizentes com os achados clínicos. Vale ressaltar que os casos 5 e 7 apresentaram achados anatomopatológicos mais discretos e por vezes um padrão misto de apresentação, com áreas compatíveis com tecido normal na mama irradiada. As Figuras 1, 2, 3 e 4 ilustram as principais diferenças histológicas entre as mamas irradiadas e não irradiadas.
Casos clínicos
Caso 1
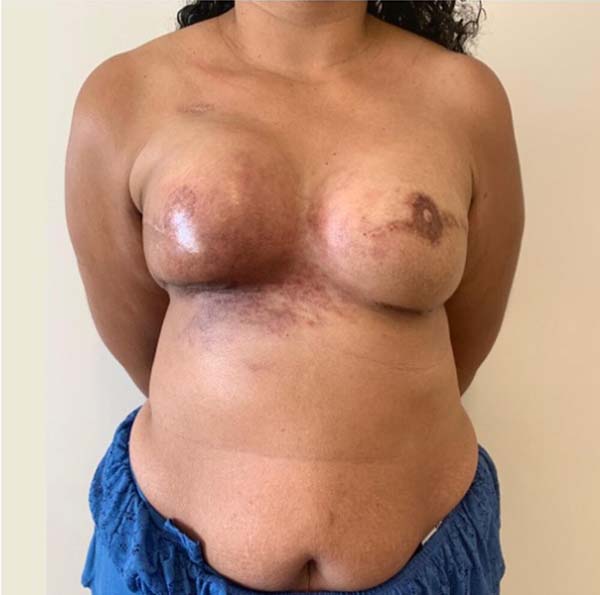
Paciente de 36 anos, sem comorbidades, com diagnóstico de carcinoma ductal invasivo em mama direita, submetida à quimioterapia neoadjuvante + mastectomia bilateral sem preservação de complexo areolopapilar, com esvaziamento axilar à direita + reconstrução imediata com expansores de válvula remota em plano retromuscular, em fevereiro de 2016, sem intercorrências. Realizou expansão com solução fisiológica até março de 2016 e radioterapia adjuvante em mama direita (última sessão em junho de 2016). Submetida a segundo tempo cirúrgico em fevereiro de 2017 para substituição de expansor por implantes de silicone + reconstrução de complexo areolopapilar bilateralmente + lipoaspiração de prolongamentos axilares, sem intercorrências. Devido ao desenvolvimento de radiodermite intensa não responsiva aos tratamentos clínicos foi submetida à reconstrução de mama direita com retalho transverso do músculo reto-abdominal microcirúrgico, em junho de 2019, como ilustra a Figura 5.
Caso 2
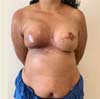
Paciente de 41 anos, sem comorbidades, com diagnóstico de carcinoma invasor em mama esquerda, submetida à mastectomia esquerda com biópsia de linfonodo sentinela (negativo) e mastectomia profilática contralateral + reconstrução imediata com implantes de silicone em plano retromuscular com amputação do polo inferior (Torek), em dezembro de 2017, sem intercorrências. Realizou radioterapia adjuvante em mama esquerda (última sessão em agosto de 2018). Submetida a segundo tempo cirúrgico em junho de 2019 para capsulotomia esquerda + reposicionamento do implante, lipoenxertia para simetrização e correção de cicatrizes em prolongamentos axilares (reconstrução do complexo areolopapilar programado para terceiro tempo) sem intercorrências, como ilustra a Figura 6.
DISCUSSÃO
Como resultado da detecção precoce e melhoria nos tratamentos, como cirurgia, terapias hormonais, quimioterapia e radioterapia, a taxa de mortalidade para o câncer de mama vem reduzindo desde a década de 1950. Portanto, mais pacientes com câncer de mama estão sobrevivendo e permanecendo com sequelas que devem ser tratadas. Nesse estudo procuramos descrever as diferenças histológicas de pele, tecido celular subcutâneo, cápsula do implante e músculo peitoral maior entre mamas irradiadas e não irradiadas de uma mesma paciente. Estudos anteriores abordam em sua maioria apenas a pele e o subcutâneo.
Os achados de hiperplasia da epiderme, achatamento da camada papilar, atrofia dos anexos dérmicos, alta densidade das fibras de colágeno dérmico e presença de fibras colágenas unidirecionais já tinham sido relatados11,12. A atrofia de anexos dérmicos é de importância clínica particular, pois a perda do tecido sebáceo e das glândulas sudoríparas causarão pele desidratada, resultando na necessidade de cuidados com a pele a longo prazo, usando hidratantes. É relatado que a dermatite de radiação crônica está associada a atipias de fibroblastos, os quais não são vistos em outros tipos de fibrose, como cicatrizes de queimadura de terceiro grau12,13. No presente estudo esses achados são corroborados e além deles outros foram descritos como: redução das fibras elásticas na derme profunda, congestão vascular no tecido gorduroso e hialinização das paredes vasculares. Apesar das alterações histológicas da dermatite por radiação já terem sido descritas12,13, elas têm sido consideradas clinicamente menores e com efeitos colaterais aceitáveis. No entanto, isso não se aplica quando há planejamento de reconstrução mamária com expansor/implante de silicone.
Archambeau et al., em 199511, encontraram alterações cutâneas decorrentes da irradiação progredindo por até 10 anos. Diante desse fato o atraso para indicar a reconstrução após radioterapia não aumenta a segurança. Tal fato poderia explicar os achados brandos encontrados nos casos 5 e 7, nos quais a última sessão de radioterapia era mais recente (10 e 8 meses, respectivamente).
Uma das principais complicações da radioterapia é fibroproliferação do tecido capsular em torno do implante com contratura capsular resultante. Isso leva a uma expansão inadequada com distorção e resultado estético indesejável, ocasionando por vezes uma cirurgia adicional. Atualmente, o mecanismo patogênico da fibroproliferação e contratura capsular induzidas por radiação é desconhecido. A correta descrição anatomopatológica das alterações observadas pode ajudar a desenvolver novos trabalhos no sentido de desvendar os mecanismos bioquímicos envolvidos nessa patogênese.
A compreensão da patogênese do processo fibroproliferativo, que ocorre com o tecido expandido e previamente submetido à radioterapia, provavelmente levará à descoberta de estratégias de prevenção ou tratamento clínico. Por exemplo, os inibidores seletivos da COX-2 são comercialmente disponíveis e foram eficazes em diminuir parcialmente a proliferação celular em modelos de fibrose mediados por níveis aumentados de catenina17. Existe um grande potencial para explorar protocolos de tratamento em um modelo animal e, eventualmente, em ensaios clínicos.
O encapsulamento ocorre como resultado de uma resposta inflamatória à presença do corpo estranho e a progressão da fibrose pode ser vista em tecidos próximos. Quando a progressão da fibrose se torna excessiva, devido à persistência da resposta inflamatória e exposição a fatores de risco externos, a contratura ocorre em torno da cápsula espessada18.
Portanto, a reconstrução de mama com implantes é realizada sob a presunção de que, se a radioterapia for administrada, a contratura capsular será reconhecida como uma limitação fundamental e muitas pesquisas são feitas no sentido de encontrar soluções para essa questão.
Kim et al., em 201819, confirmaram que a infiltração de miofibroblastos foi promovida em camundongos irradiados, sugerindo que esse fenômeno age como um catalisador para acelerar a progressão da contratura. Em nosso trabalho não encontramos infiltração desse tipo celular em nenhuma das amostras de mama irradiada.
Para reduzir a ocorrência de contratura capsular em torno dos implantes texturizados, alguns trabalhos relataram utilização de cobertura com matriz dérmica acelular e algumas medicações como montelucaste, antileucotrienos e esteróides20,5. Embora seja consenso que a radiação pode induzir a fibroproliferação tanto na pele como nos tecidos subcutâneos11,13, as ocorrências relativas de mecanismos moleculares específicos ainda não estão claras.
Acreditamos que a pele ressecada pode estar relacionada com a atrofia dos apêndices dérmicos. A perda da elasticidade da pele relacionada com a redução das fibras elásticas em derme profunda, hiperplasia epidérmica, achatamento da camada papilar, alta densidade de fibras de colágeno dérmicas e alinhamento unidirecional das fibras de colágeno. A gordura hipovascularizada relacionada com a congestão vascular no subcutâneo e a hialinização da parede vascular. A cápsula espessada e contraída relacionada com a menor densidade de fibras elásticas, hialinização capsular, fibroesclerose capsular e metaplasia sinovial. O músculo hipotrófico e hipovascularizado relacionado com a fibrose perivascular e sequestro de músculo esquelético pela cápsula.
Com os dados obtidos até o momento ainda não é possível estabelecer uma relação de causa e efeito, mas continuaremos inserindo novos pacientes ao estudo e procurando otimizar a análise quantitativa das informações para que isso seja possível no seguimento do mesmo. Pelo fato de cada avaliação histológica ter sido realizada entre as mamas de uma mesma paciente e não entre dois grupos diferentes, mesmo com um número reduzido de pacientes os resultados são expressivos.
CONCLUSÃO
Encontramos alterações histológicas comuns nas mamas irradiadas em boa parte das pacientes, achados esses que são compatíveis com as alterações clínicas e macroscópicas observadas. Esse estudo é descritivo e apresenta-se como um piloto para o desenvolvimento de novos estudos que pesquisem os mecanismos fisiopatológicos relacionados às alterações histológicas descritas, podendo assim propor métodos de profilaxia e tratamento para as complicações da radioterapia.
COLABORAÇÕES
|
AB |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Realização das operações e/ou experimentos |
|
RCSD |
Análise e/ou interpretação dos dados, Coleta de Dados, Concepção e desenho do estudo, Redação - Revisão e Edição |
|
ACC |
Análise e/ou interpretação dos dados |
|
COPC |
Análise e/ou interpretação dos dados |
|
MCC |
Aprovação final do manuscrito |
|
JCD |
Aprovação final do manuscrito |
REFERÊNCIAS
1. Albornoz CR, Bach PB, Mehrara BJ, Disa JJ, Pusic AL, McCarthy CM, et al. A paradigm shift in U.S. breast reconstruction: increasing implant rates. Plast Reconstr Surg. 2013;131(1):15-23.
2. Polednak AP. Postmastectomy breast reconstruction in Connecticut: trends and predictors. Plast Reconstr Surg. 1999;104(4):669-73.
3. Ji YH, Kim MS, Jung H, Yoo SY, Cho CK. Clinical characteristics of radiation oncology in Korea during past 10 years. J Korean Med Sci. 2009;24:1165-9.
4. Kronowitz SJ, Robb GL. Radiation therapy and breast reconstruction: a critical review of the literature. Plast Reconstr Surg. 2009;124(2):395-408.
5. Olbrich KC, Meade R, Bruno W, Heller L, Klitzman B, Levin LS. Halofuginone inhibits collagen deposition in fibrous capsules around implants. Ann Plast Surg. 2005;54(3):293-6;discussion:296.
6. Spear SL, Spittler CJ. Breast reconstruction with implants and expanders. Plast Reconstr Surg. 2001;107:177-87.
7. Iwahira Y, Yamakawa T, Maruyama Y, Saze M. Breast reconstruction using textured, integrated-valve tissue expanders. J Jpn Plast Reconstr Surg. 2004;24:771-8.
8. Malahias M, Jordan DJ, Hughes LC, Hindocha S, Juma A. A literature review and summary of capsular contracture: an ongoing challenge to breast surgeons and their patients. Int J Surg Open. 2016;3:1-7.
9. Ho AL, Bovill ES, Macadam SA, Tyldesley S, Giang J, Lennox PA. Postmastectomy radiation therapy after immediate two-stage tissue expander/implant breast reconstruction: a University of British Columbia perspective. Plast Reconstr Surg. 2014;134(1):1e-10e.
10. Dean C, Chetty U, Forrest AP. Effects of immediate breast reconstruction on psychosocial morbidity after mastectomy. Lancet. 1983;1(8322):459-62.
11. Archambeau JO, Pezner R, Wasserman T. Pathophysiology of irradiated skin and breast. Int J Radiat Oncol Biol Phys. 1995;31(5):1171-85.
12. Junkins-Hopkins JM. Disorders associated with physical agents: heat, cold, radiation, and trauma. In: Elder DE, Elenitsas R, Johnson BL, Murphy GE, Xu X, eds. Lever’s histopathology of the skin. 10th ed. Philadelphia: Lippincott Williams & Wilkins; 2009. p. 343-60.
13. Hymes SR, Strom EA, Fife C. Radiation dermatitis: clinical presentation, pathophysiology, and treatment 2006. J Am Acad Dermatol. 2006;54(1):28-46.
14. Hoeller U, Borgmann K, Bonacker M, Kuhlmey A, Bajrovic A, Jung H, et al. Individual radiosensitivity measured with lymphocytes maybe used to predict the risk of fibrosis after radiotherapy for breast cancer. Radiother Oncol. 2003;69:137-44.
15. Svensson JP, Stalpers LJ, Lange REE, Franken NA, Haveman J, Klein B, et al. Analysis of gene expression using gene sets discriminates cancer patients with and without late radiation toxicity. PLoS Med. 2006;3(10):e422.
16. Huang, J. et al. Harnessing structural darkness in the visible and infrared wavelengths for a new source of light. NATURE Nanotechnology, p. 60-66, 2016.
17. Spear SL, Onyewu C. Staged breast reconstruction with saline- filled implants in the irradiated breast: recent trends and therapeutic implications. Plast Reconstr Surg. 2000;105(3):930-42.
18. Dowden RV. Discussing the advantages of saline and silicone implants in clinical practice. Aesthet Surg J. 2011;31(2):265-6.
19. Kim JB, Jeon HJ, Lee JW, Choi KY, Chung HY, Cho BC, et al. A murine model of radiation-induced capsule-tissue reactions around smooth silicone implants. J Plast Surg Hand Surg. 2018;52(4):217-24.
20. Hester Junior TR, Ghazi BH, Moyer HR, Nahai FR, Wilton M, Stokes L. Use of dermal matrix to prevent capsular contracture in aesthetic breast surgery. Plast Reconstr Surg. 2012;130(5 Suppl 2):126s-36s.
1. Hospital Daher Lago Sul, Brasília, DF, Brasil.
Autor correspondente: Ronan Caputi Silva Dias SHTN , Trecho 2, Lote 3, Bloco E, Ap 206, Life Resort, Asa norte, Brasília, DF, Brasil CEP: 70800-230. E-mail: ronancaputidias8@gmail.com
Artigo submetido: 8/9/2019.
Artigo aceito: 22/2/2020.
Conflitos de interesse: não há.











 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter