

Case Report - Year 2019 - Volume 34 -
Retalho toracoabdominal para reconstrução de tumor de mama localmente avançado, em paciente com mutação de BRCA1
Thoracoabdominal flap for locally advanced breast tumor reconstruction in a patient with BRCA1 mutation
RESUMO
O presente estudo objetiva relatar a técnica do retalho toracoabdominal pós-mastectomia por tumor localmente avançado em paciente com mutação de BRCA1. Foi realizada a mastectomia com ressecção de quase todo o músculo peitoral maior à esquerda, com linfonodectomia axilar homolateral e reconstrução do grande defeito da parede torácica com retalho toracoabdominal fasciocutâneo, baseado nas artérias intercostais posteriores.
Palavras-chave: Reconstrução; Cirurgia plástica; Neoplasias da mama; Mutação; Oncologia cirúrgica
ABSTRACT
This case report describes the application of the thoracoabdominal flap technique after locally advanced tumor mastectomy in a patient with breast cancer 1 (BRCA1) mutation. The mastectomy included resection of nearly the entire left pectoralis major muscle, with homolateral axillary lymphadenectomy and reconstruction of the large chest wall defect with a fasciocutaneous thoracoabdominal flap based on the posterior intercostal arteries.
Keywords: Reconstruction; Plastic surgery; Breast neoplasms; Mutation; Surgical oncology.
INTRODUÇÃO
A reconstrução da parede torácica após extensa ressecção devido ao câncer de mama avançado ainda representa um desafio para os cirurgiões oncológicos e plásticos. No entanto, na última década, melhorias na técnica cirúrgica permitiram que os cirurgiões realizassem ressecção e reconstrução extensas em pacientes que apresentam tumores envolvendo tecido ou estruturas ósseas da parede torácica com resultados funcionais, estéticos e o obtenção de margens livres de neoplasia, fato importante para diminuir a recidiva da doença1.
Diante disso, relatamos o presente caso, utilizando a técnica de retalho toracoabdominal pós-mastectomia por tumor localmente avançado em paciente com mutação de BRCA1.
RELATO DO CASO
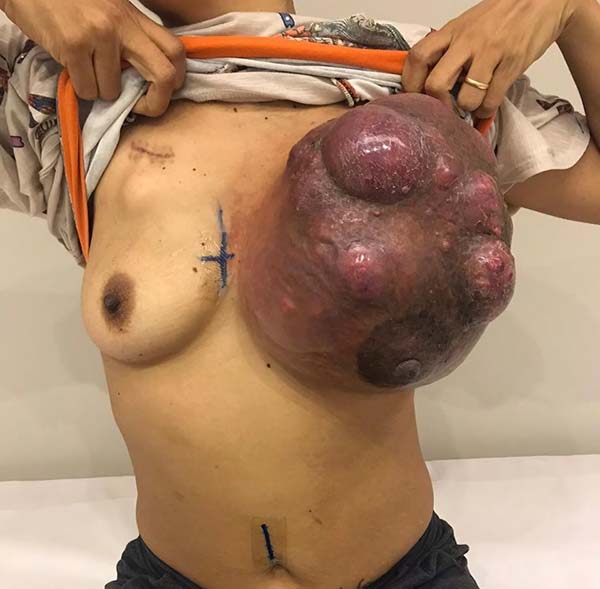
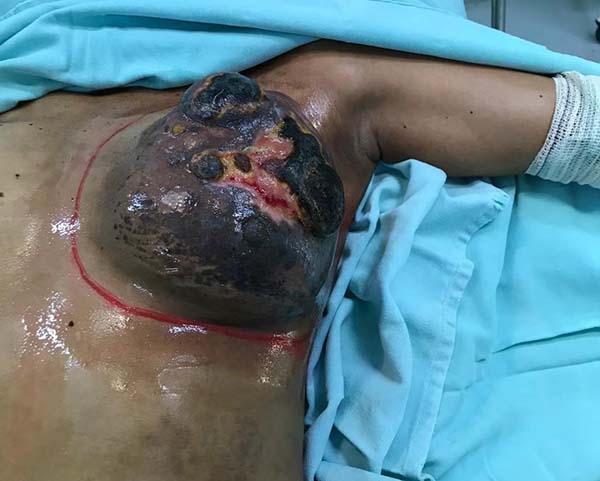
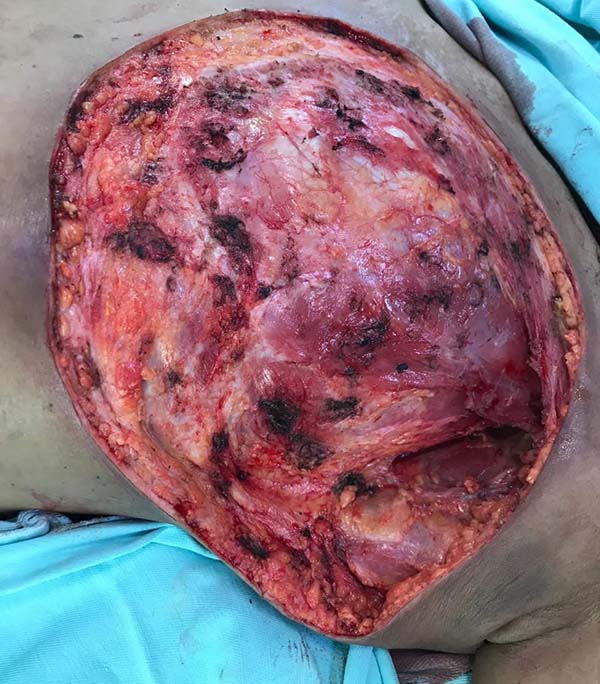
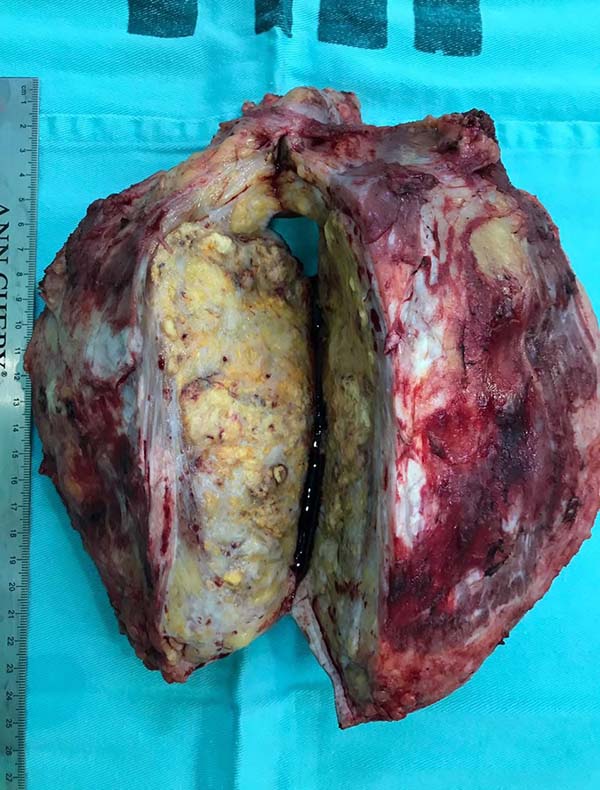
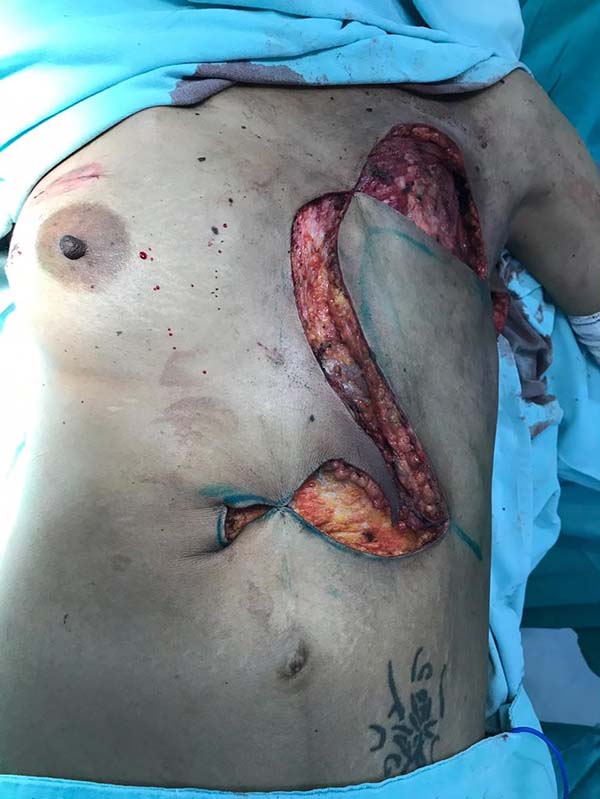
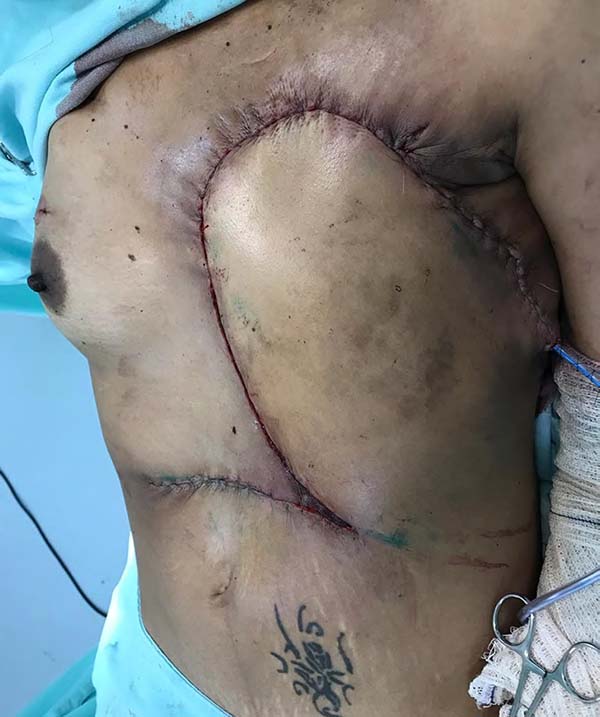
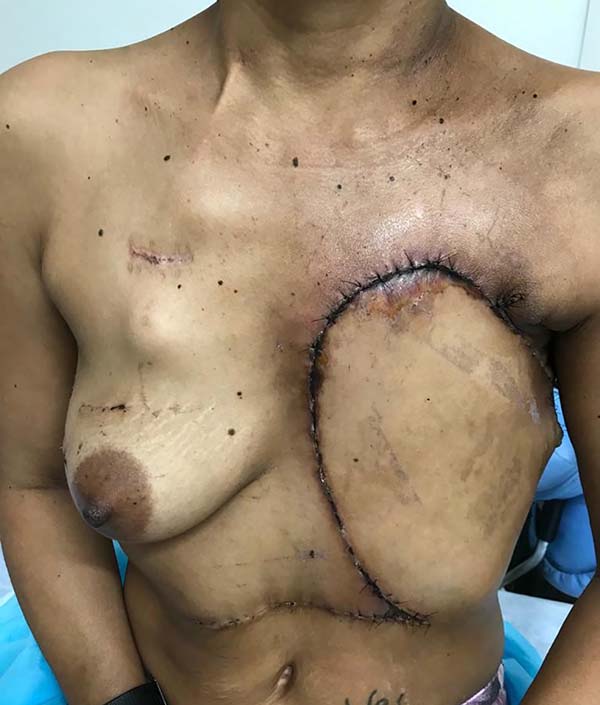
Paciente do sexo feminino, 40 anos de idade. Procurou o serviço com um tumor de mama localmente avançado, após quimioterapia e radioterapia neoadjuvante. Refere surgimento de nódulo na mama esquerda há um ano, com aumento e progressão da lesão após quimioterapia. Tratava-se de um carcinoma invasivo tipo não especial, estadiado como T4BN2MO - IIIB (Figura 1), tumor triplo negativo com Ki-67 de 70%. Foi encontrada uma mutação patogênica no gene BRCA1 c.3331_3334delCAAG (p.Gln1111Asnfs*5). Realizou-se o tratamento com Doxorrubicina 60mg/m2 e Ciclofosfamida 600mg/m2 de 21/21 dias por 3 ciclos com progressão da doença. Iniciou-se então novo tratamento com Paclitaxel 175mg/m2 de 21/21 dias, sem também apresentar resposta clínica. Foi neste momento iniciado tratamento combinado de radioterapia e quimioterapia com Cisplatina 30mg/m2 e Gencitabina 100mg/m2 semanalmente. Para Cisplatina e Gencitabina obteve resposta parcial (Figura 2). Ao exame físico apresentava tumor comprometendo toda a mama esquerda com ulceração medindo cerca 30x20cm, com metástase axilar esquerda confluente e móvel. Na ultrassonografia apresentava dois nódulos de características benignas (BI RADS III) na mama direita, localizados na união dos quadrantes superiores e laterais medindo 1,5cm cada. Foi indicado mastectomia esquerda com esvaziamento axilar e ressecção dos dois nódulos da mama direita com congelação no intraoperatório. Foi realizada a mastectomia esquerda com ressecção de quase todo o músculo peitoral com linfonodectomia axilar homolateral até o nível três (Figuras 3 e 4). Foi preservado o plexo do grande dorsal e o nervo torácico longo. O exame de congelação das margens e ressecção dos nódulos à direita foram negativos para neoplasia. Realizado reconstrução do grande defeito com retalho toracoabdominal fasciocutâneo, baseado nas artérias intercostais posteriores (Figuras 5 e 6). Paciente recebeu alta no primeiro dia de pós-operatório com queixas dolorosas de pouca intensidade (escala analógica visual 3). O dreno de sucção foi retirado 10 dias após a cirurgia. Apresentou apenas pequena área de deiscência no retalho que foi tratado com cuidados locais e apresentou bom resultado (Figura 7). Dois meses após o tratamento cirúrgico a paciente segue em acompanhamento oncológico, em uso de Capecitabina. Se a paciente não apresentar recidiva precoce está programada salpingooforectomia profilática laparoscópica após término do tratamento quimioterápico. O caso foi aprovado pelo Comitê de Ética e Pesquisa com o parecer de nº 2.948.415 e a paciente assinou consentimento livre e esclarecido.
DISCUSSÃO
O carcinoma de mama localmente avançado (CLAM) é representado pelo estádio III (IIIA, IIB e IIIC) que inclui tumores > 5cm (T3) ou que comprometem a parede torácica (T4a), pele (T4b) ou ambas (T4c) ou ainda, extenso comprometimento linfonodal (N2/N3) de uma ou mais cadeias linfáticas e carcinoma inflamatório. O CLAM compreende 10-25% de todos os cânceres de mama em países desenvolvidos e 40-50% nos países em desenvolvimento2.
O Tratamento do CLAM com combinação de quimioterapia neoadjuvante, cirurgia e radioterapia demonstrou aumentar a sobrevida. Estudos anteriores ao uso da quimioterapia neoadjuvante (QT neo) no tratamento demonstravam sobrevida global (SG) de 25% em 5 anos. Com o uso da QT neo a SG em 5 anos é de 80% e 45% em pacientes IIIA e IIIB, respectivamente. Assim, recomenda-se QT neo em pacientes com CLAM, e em caso de resposta inadequada à QT neo, a radioterapia pode ser adicionada como no presente caso, com o intuito de tornar a ressecção cirúrgica mais fácil ou exequível3.
Em pacientes com mutação de BRCA que apresentam câncer de mama unilateral a mastectomia contralateral deve ser realizada quando o diagnóstico ocorre em estágios iniciais. Por outro lado, na presença de doença localmente avançada a realização da mastectomia contralateral profilática (CPM) não encontra respaldo na literatura4. Baseado nisto, e em decisão conjunta com a paciente, não foi realizado a mastectomia contralateral profilática, já que o exame de congelação dos nódulos na mama oposta demonstrou tratar-se de fibroadenoma.
A extirpação cirúrgica radical nesses pacientes produz extensa perda cutânea na região torácica que não podem ser reparadas com o fechamento primário. A utilização de retalhos como os miocutâneos, proporcionam uma cobertura eficaz para grandes defeitos, porém, demanda um tempo cirúrgico maior, aumentando morbidades que pode retardar o tratamento adicional5, sobretudo em pacientes com tumores triplo negativos que apresentem tumor residual após a QT neo. Vale destacar que a adição de Capecitabina neste cenário aumenta a sobrevida6,7.
Contudo, apesar da indicação precisa de retalhos miocutâneos para a reconstrução de tórax após mastectomia, a importância dos retalhos fasciocutâneos locorregionais já foi demonstrada. Os retalhos fasciocutâneos são de rápida execução, baixa morbidade e apresentam índices de necrose parcial semelhantes aos dos retalhos miocutâneos, apesar das restrições quanto à quantidade de pele a ser mobilizada e à radioterapia prévia8. Por estas razões se optou por esta técnica no presente caso.
Os retalhos fasciocutâneos regionais devem ser bem vascularizados, como no caso apresentado, que se baseou na irrigação através das artérias intercostais posteriores, para que não haja sofrimento, necrose e desestabilização da parede9.
De fato, a extensão da ressecção deve ser sempre necessária o suficiente para o tratamento da doença, no entanto, a presença de um cirurgião, com expertise em reconstrução, é indispensável para o planejamento dessas cirurgias, facilitando a reconstrução subsequente10. Desse modo, fica evidente como o tratamento interdisciplinar, oferece benefícios aos pacientes.
CONCLUSÃO
Assim, o estudo corrobora com a ideia que a reconstrução com retalho toracoabdominal fasciocutâneo tem se mostrado eficaz para cobertura de áreas extensas pós-mastectomias, sem a necessidade do uso de outros retalhos ou de enxerto cutâneo. O tratamento interdisciplinar é importante para um bom desfecho cirúrgico como no presente caso.
COLABORAÇÕES
|
DRSF |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Coleta de Dados, Concepção e desenho do estudo, Gerenciamento do Projeto, Metodologia, Redação - Preparação do original |
|
ALNA |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Coleta de Dados, Concepção e desenho do estudo, Gerenciamento do Projeto, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original |
|
RJVV |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação -Revisão e Edição |
|
SCV |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Coleta de Dados, Concepção e desenho do estudo, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição |
REFERÊNCIAS
1. Persichetti P, Cagli B, Tenna S, Fortunato L, Vitelli CE. Role of cutaneous thoraco-abdominal flap in the surgical treatment of advanced stage breasttumors. Suppl Tumori. 2005 May/Jun;4(3):S177.
2. Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010 Jun;17(6):1471-4.
3. Sanchez AM, Franceschini G, Orlandi A, Di Leone A, Masetti R. New challenges in multimodal workout of locally advanced breast câncer. Surgeon. 2017 Dec;15(6):372-378.
4. Murphy BL, Hoskin TL, Boughey JC, Degnim AC, Glazebrook KN, Hieken TJ. Contralateral Prophylactic Mastectomy for Women with T4 Locally Advanced Breast Cancer. Ann Surg Oncol. 2016 Oct;23(10):3365-70.
5. Burattini ACB, Piteri RCO, Ferreira LF, Silveira Junior VF, Broetto J, Richter CA, et al. Safety and viability of a new format of thoracoepigastric flap for reconstruction of the chest wall in locally advanced breast cancer: a cross-sectional study. Rev Bras Cir Plást. 2016;31(1):2-11.
6. Székely B, Silber AL, Pusztai L. New Therapeutic Strategies for Triple-Negative Breast Cancer. Oncology (Williston Park). 2017 Feb;31(2):130-7.
7. Masuda N, Lee SJ, Ohtani S, Im YH, Lee ES, Yokota I, et al. Adjuvant Capecitabine for Breast Cancer after Preoperative Chemotherapy. N Engl J Med. 2017 Jun;376(22):2147-2159.
8. Deo SV, Purkayastha J, Shukla NK, Asthana S. Myocutaneous versus thoraco-abdominal flap cover for soft tissue defects following surgery for locally advanced and recurrent breast cancer. J Surg Oncol. 2003 May;83(1):31-5.
9. Dast S, Berna P, Qassemyar Q, Sinna R. A new option for autologous anterior chest wall reconstruction: the composite thoracodorsal artery perforator flap. Ann Thorac Surg. 2012 Mar;93(3):e67-9.
10. Franco D, Tavares Filho JM, Cardoso P, Moreto Filho L, Reis MC, Boasquevisque CHR, et al. Plastic surgery in chest wall reconstruction: relevant aspects - case series. Rev Col Bras Cir. 2015 Dec;42(6):366-370.
1. Universidade Estadual do Piauí, Teresina, PI, Brasil.
2. Sociedade Brasileira de Cirurgia Plástica, Clinica Oncocenter, Teresina, PI, Brasil.
3. Clínica Oncobem, Teresina, PI, Brasil.
4. Clinica Oncocenter, Teresina, PI, Brasil.
Autor correspondente: Danilo Rafael da Silva Fontinele Rua Agnelo Pereira da Silva, 2570, São João, Teresina, PI, Brasil. CEP: 64045-420. E-mail: drsilvafontinele@gmail.com
Artigo submetido: 6/1/2019.
Artigo aceito: 21/4/2019.
Conflitos de interesse: não há.



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter