

Review Article - Year 2019 - Volume 34 -
Linfoma anaplásico de grandes células relacionado ao implante mamário: revisão sistemática da literatura
Breast implant-associated anaplastic large-cell lymphoma: a systematic literature review
RESUMO
O linfoma anaplásico de grandes células associado ao implante de mama (Breast Implant Associated Anaplastic Large Cell Lymphoma - BIA-ALCL) é uma doença maligna recentemente descoberta, rara e possivelmente associada aos implantes mamários texturizados. Essa revisão da literatura teve como objetivo trazer novas atualizações acerca da epidemiologia, fisiopatologia e fatores de risco para desenvolvimento do BIAALCL. Foi realizado o levantamento de dados do período de dezembro de 2018 a fevereiro de 2019, através das bases de dados PUBMED, LILACS e Scielo sendo selecionados 10 artigos publicados entre 2016 e 2018. Foi encontrada uma incidência variando entre 2,8:100.000 a 1:3 milhões de pacientes com implantes mamários. Os dados coletados corroboram para a teoria de que não há uma relação direta de causa e efeito entre os implantes mamários, mormente os texturizados, e o desenvolvimento do BIA-ALCL, podendo esses ser considerados somente como fatores de risco e não agentes causadores. A teoria fisiopatológica mais aceita é a de que os implantes mamários com maior área de superfície levariam a formação de maior biofilme por maior adesão bacteriana gerando inflamação crônica mais proeminente, levando ao gatilho para a transformação maligna das células T. As informações explicitadas nessa revisão devem auxiliar na ampliação de estudos acerca da doença e criação de políticas públicas para a prevenção e diagnóstico precoce de tal enfermidade. Pelos dados encontrados há necessidade de que cirurgiões plásticos realizem acompanhamento mais próximo de seus pacientes, assim como orientem os pacientes antes das cirurgias sobre a existência da doença.
Palavras-chave: Implante mamário; Linfoma anaplásico de células grandes; Linfoma de células T; Linfoma não Hodgkin; Neoplasias da mama
ABSTRACT
Breast implant-associated anaplastic large-cell lymphoma (BIA-ALCL) is a newly discovered and rare cancer possibly associated with textured breast implants. This literature review investigates its epidemiology, pathophysiology, and risk factors. PubMed, LILACS, and SciELO databases were searched from December 2018 to February 2019, and 10 articles published between 2016 and 2018 were selected. The incidence of BIA-ALCL ranged from 2.8:100,000 to 1:3 million breast implants. The obtained data corroborate the hypothesis that there is no direct cause and effect relationship between breast implants, especially textured implants, and BIA-ALCL, and these implants can be considered risk factors but not causative factors. The most accepted hypothesis on disease pathophysiology is that breast implants with larger surface areas may promote bacterial adhesion and biofilm formation, leading to severe chronic inflammation, triggering the malignant transformation of T cells. This review provides knowledge on BIA-ALCL and helps develop and implement public policies for disease prevention and timely diagnosis. The data highlight that long-term follow up is necessary and that surgeons should advise patients of the potential risk of developing BIA-ALCL before performing the implant surgery.
Keywords: Breast implant; Anaplastic large-cell lymphoma; T-cell lymphoma; Non-Hodgkin's lymphoma; Breast cancer.
INTRODUÇÃO
O linfoma anaplásico de grandes células associado ao implante de mama (Breast Implant Associated Anaplastic Large Cell Lymphoma - BIA-ALCL) é um linfoma de células T CD30+ e ALK - do grupo dos linfomas não-Hodgkin1. É uma doença maligna recentemente descoberta e possivelmente associada aos implantes mamários, principalmente aos implantes texturizados usados tanto na cirurgia estética quanto reconstrutiva2.
O primeiro caso relatado de BIA-ALCL foi publicado em 1997, por Keech e Creech3, e em 2016, quase duas décadas após o primeiro relato da doença, a Organização Mundial de Saúde classificou o BIA-ALCL como uma entidade reconhecida4.
A exata incidência do BIA-ALCL não é conhecida, porém é estimada em torno de 1 caso a cada 30.000 mulheres com implantes por ano, com uma média de desenvolvimento da doença após a implantação de 10,7 anos5. Variações na estimativa do risco para desenvolvimento do BIA-ALCL (1:3.000.000 a 1:50.000 mulheres com implantes mamários) provavelmente ocorrem por limitações na obtenção da história clínica de tais pacientes, variações na forma de diagnóstico patológico, subnotificação, diagnósticos perdidos, duplicação de casos e falta de informações claras acerca do número total de implantes vendidos e implantados1.
A exata patogênese e os mecanismos que permeiam o BIA-ALCL não são claros. As teorias apreendidas da literatura aventam que implantes texturizados em associação ao microbioma mamário, potencialmente desencadeariam uma transformação maligna por aumentarem o risco de inflamação crônica guiada por antígeno.
O mesmo fator que atribui aos implantes texturizados uma menor taxa de contratura capsular, ou seja, sua maior área de superfície e interface com relevo, proporciona um aumento da adesão bacteriana e a formação de biofilme2, acarretando maior atividade inflamatória local. Apesar das crescentes evidências implicando inflamação crônica da cápsula de biofilme dos implantes mamários como causa etiológica, alguns autores sugerem precaução em tomar conclusões precipitadas até que a ciência entenda essa entidade incomum6.
A provável associação entre o implante mamário e o início da doença obriga as autoridades de saúde ao redor do mundo a monitorar e aumentar a investigação relacionada a essa doença7.
Essa revisão da literatura teve como objetivo trazer novas atualizações acerca da epidemiologia, fisiopatologia e fatores de risco para desenvolvimento do BIA-ALCL, assim como apresentar novas evidências acerca do papel das características dos implantes mamários na etiopatogenia da doença.
MÉTODOS
Foi realizado o levantamento de dados através das principais bases de dados PUBMED, LILACS e Scielo, utilizando como descritores: "BIA-ALCL"; "texturized implants"; "implantes texturizados"; "polyurethane implants" e "implantes de poliuretano", Breast Implant and Anaplastic Large Cell Lymphoma.
O período da pesquisa foi de dezembro de 2018 a fevereiro de 2019. Os fatores de inclusão foram: língua portuguesa ou inglesa; tipos de estudos: revisão sistemática da literatura, relatos de caso, estudos descritivos retrospectivos e ensaios clínicos. Os fatores de exclusão dessa revisão sistemática foram: artigos duplicados, artigos com mais de 3 anos de publicação (anteriormente a dezembro de 2015), metodologia inadequada ao propósito do trabalho, línguas não arregimentadas nos fatores de inclusão.
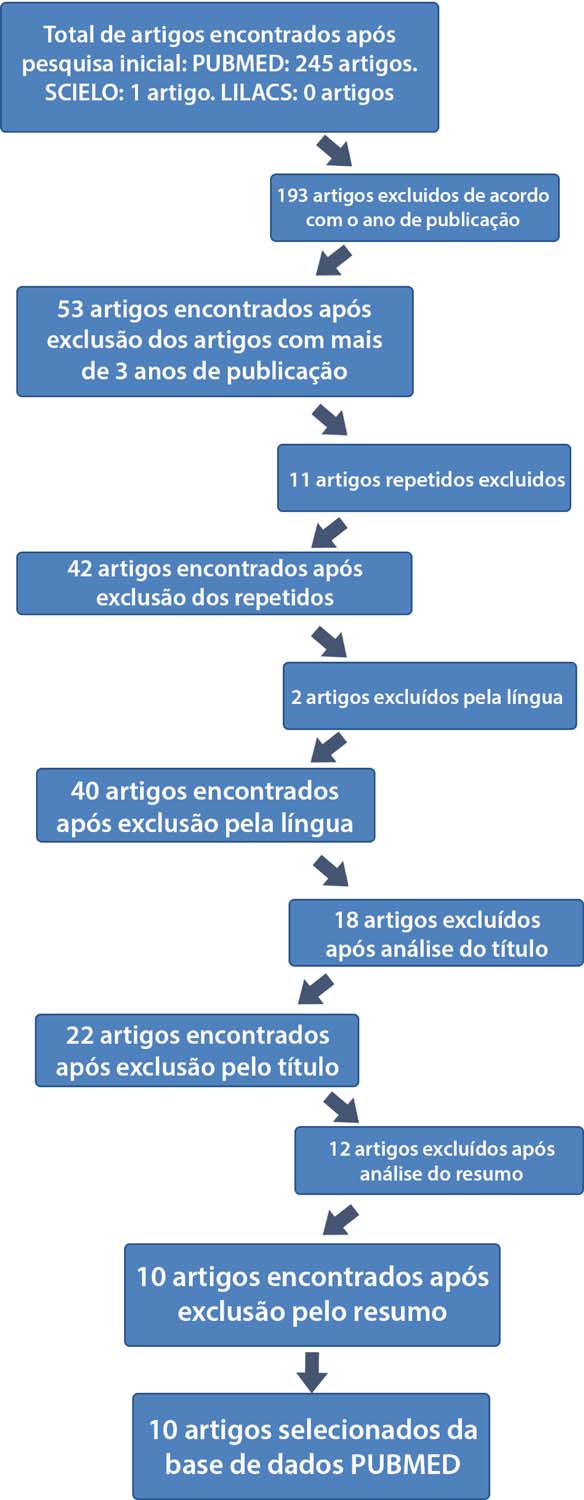
O número total de artigos encontrados foi de 53 após exclusão dos artigos com mais de 3 anos de publicação. 11 artigos foram excluídos por estarem repetidos nas bases de dados utilizadas; 2 artigos foram excluídos por não estarem escritos nas línguas especificadas nos fatores de inclusão; 18 artigos foram excluídos pelo título não fazer referência ao foco dessa revisão; 12 artigos foram excluídos após leitura do resumo por não dissertarem acerca do objetivo dessa revisão sistemática. Nenhum artigo foi excluído pelo tipo de estudo.
Após a exclusão foram selecionados 10 artigos publicados entre 2016 e 2018 que dissertavam acerca da epidemiologia, etiofisiopatogenia e fatores de risco relacionados às características do implante mamário, tais emoldurando os artigos de para essa análise como abaixo se delineará. A Figura 1 a seguir descreve os passos para a escolha dos artigos selecionados.
RESULTADOS
Foram selecionados os seguintes artigos explicitados no Quadro 1.
| 1) Breast Implant-Associated Anaplastic Large Cell Lymphoma 2 | P. Rastogi; A. K. Deva; H. Miles Prince | 22/outubro/2018 Current Hematologic Malignancy Reports Journal | Revisão de literatura | Não foi descrita a metodologia pelos autores. |
| 2) Breast implant-associated anaplastic large cell lymphoma: a pictorial review 8 | Amit Chacko; Thomas Lloyd | 30/abril/2018 Insights into Imaging Journal | Relatos de casos | Não foi descrita a metodologia pelos autores. |
| 3) Breast implant associated anaplastic large cell lymphoma: The UK experience. Recommendations on its management and implications for informed consent 5 | L. Johnson; J.M. O'Donoghue; N. McLean; P. Turton; A.A. Khan; S.D. Turner; A. Lennard; N. Collis; M. Butterworth; G. Gui; J. Bristol; J. Hurren; S. Smith; K. Grover; G. Spyrou; K. Krupa; I.A. Azmy; I.E. Young; J.J. Staiano; H. Khalil; F.A. MacNeill | 8/mai/2017 European Journal of Surgical Oncology | Estudo descritivo retrospectivo | Estudo retrospectivo em cima de dados acerca da implantação do implante mamário, a clínica, o tratamento e o seguimento de 18 pacientes diagnosticadas com BIA-ALCL entre 2012 e 2016 em 15 centros regionais por todo o Reino Unido. |
| 4) Breast Implant-Associated Anaplastic Large Cell Lymphoma: Case Report and Review of the Literature 3 | Eva Berlin; Kunwar Singh; Christopher Mills; Ilan Shapira; Richard L. Bakst; Manjeet Chadha | 21/jan/2018 Case Reports in Hematology Journal | Relato de caso e revisão da literatura | Não foi descrita a metodologia pelos autores. |
| 5) Breast Implant-Associated Anaplastic Large Cell Lymphoma A Systematic Review 4 | Ashley N. Leberfinger, MD; Brittany J. Behar, MD; Nicole C. Williams, MD, MBA; Kevin L. Rakszawski, MD; John D. Potochny, MD; Donald R. Mackay, DDS, MD; Dino J. Ravnic, DO, MPH | 18/out/2017 JAMA Surgery Journal | Revisão sistemática da literatura | Foi realizada uma revisão sistemática sobre o BIA-ALCL. As palavras chaves utilizadas foram: BIA-ALCL, linfoma e implantes mamários e câncer de implantes mamários. As plataformas utilizadas foram Pubmed, EBSCOhost, Web of Science e Google escolar. A pesquisa foi realizada em janeiro de 2017 por estudos publicados em todos os anos. 115 artigos foram incluídos desde o primeiro relato de caso em agosto de 1997 até janeiro de 2017. |
| 6) Breast Implant-Associated Anaplastic Large Cell Lymphoma: A Case Report and Review of the Literature 7 | Daniel E. Ezekwudo; Tolulope Ifabiyi; Bolanle Gbadamosi; Kristle Haberichter; Zhou Yu; Mitual Amin; Kenneth Shaheen; Michael Stender; Ishmael Jaiyesimi | 31/out/2017 Case Reports in Oncological Medicine | Relato de caso e revisão da literatura | Foi reportado um raro caso de BIA-ALCL e discutido a rara apresentação desta doença, as características histopatológicas da forma indolente e infiltrativa e sua importância clínica após revisão da literatura sobre o assunto. |
| 7) 22 Cases of Breast Implant-Associated ALCL: Awareness and Outcome Tracking from the Italian Ministry of Health 6 | Antonella Campanale, M.D.Rosaria Boldrini Marcella Marletta, M.D. | 14/abril/2017 Plastic and Reconstructive Surgery Journal | Estudo descritivo retrospectivo | Estudo retrospectivo com base nos casos notificados de BIA-ALCL coletados na base de dados da direção geral de dispositivos médicos e serviços farmacêuticos do Ministério da Saúde Italiano. Para cada caso foi coletado as seguintes variáveis: número de identificação, empresa de fabricação do implante atual utilizado pela paciente, preenchimento e superfície do implante, tempo desde a implantação, cirurgia prévia mamária, indicação do implante, idade da paciente, sintomas, marcadores de BIA-ALCL, estadiamento do BIA-ALCL, tratamento realizado e seguimento. |
| 8) Implications of Breast Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL) for Breast Cancer Reconstruction: An Update for Surgical Oncologists 9 | Anne C. O'Neill, MBBCh, PhD; Toni Zhong, MD, MHS; Stefan O. P. Hofer, MD, PhD | 31/jul/2017 Annals of Surgical Oncology | Revisão da literatura | Não foi descrita a metodologia pelos autores. |
| 9) Breast Implant and Anaplastic Large Cell Lymphoma Meta-Analysis 10 | Guillermo Ramos-Gallardo; Jesús Cuenca-Pardo; Eugenio Rodríguez-Olivares; Rufino Iribarren-Moreno; Livia Contreras-Bulnes; Alfonso Vallarta-Rodríguez; Marco Kalixto-Sanchez; Claudia Hernández; Ricardo Ceja-Martinez; Cesar Torres-Rivero | 18/jul/2016 Journal of Investigative Surgery | Revisão Sistemática com Metanálise | Foi realizada uma metanálise por meio de uma revisão usando as plataformas Pubmed, Embase, Cochrane, Fisterra, Google escolar e Lilacs. Foram procurados artigos publicados desde 1980 até agosto de 2015. A linguagem MESH foi usada para identificar as palavras-chave: linfoma ou linfoma não-Hodgkin ou linfoma anaplásico de grandes células ou ALCL ou BIA-ALCL e implante mamário ou prótese mamária, implantes mamários ou silicones ou silicone gel e efeitos adversos. |
| 10) Breast Implant-Associated Anaplastic Large Cell Lymphoma in Australia and New Zealand: High-Surface-Area Textured Implants Are Associated with Increased Risk 1 | Anna Loch-Wilkinson, M.B.B.S. Kenneth J. Beath Robert John William Knight, M.B.B.S. William Louis Fick Wessels, M.B.B.S. Mark Magnusson, M.B.B.S. Tim Papadopoulos, M.B.B.S. Tony Connell, B.Sc., M.B.B.S. Julian Lofts, M.B.B.S. Michelle Locke, M.B.B.S., M.D. Ingrid Hopper, M.B.B.S., B.Med.Sci.(Hons.), Ph.D. Rodney Cooter, M.B.B.S., M.D. Karen Vickery, B.V.Sc., Ph.D. Preeti Avinash Joshi, M.B.B.S., D.C.H., Ph.D. H. Miles Prince, M.B.B.S.(Hons.), M.D., A.F.R.A.C.M.A., M.A.C.D. Anand K. Deva, B.Sc.(Hons.), M.B.B.S., M.S. | Outubro/2017 Journal of Plastic and Reconstructive Surgery | Estudo descritivo retrospectivo | Todos os casos Australianos e da Nova Zelândia foram identificados e analisados. Toda a história do implante foi obtida e a freqüência de diferentes tipos de implantes associados a mama BIA-ALCL + também foi listada. Implantes reportados (Silimed, Biocell, Siltex e implante de superfície lisa) foram submetidos a análise de sua área superfície. O diagnóstico patológico foi confirmado por nova revisão das lâminas por novo patologista. Dados de venda de 3 empresas fabricantes de implantes mamários (Mentor - Siltex, Allergan - Biocell e Silimed - poliuretano) datados de 1999 a 2005 foram usados para a estimativa do risco implante-específico. |
Após a análise dos artigos selecionados, seguiu-se a determinação dos seguintes dados: epidemiologia acerca do BIA-ALCL, a fisiopatologia da moléstia e os dados acerca dos tipos de implantes mamários possivelmente implicados como de maior risco para desenvolvimento da comorbidade.
Epidemiologia:
Vários dados acerca de prevalência e incidência do BIA-ALCL foram coletados. Nos EUA, entre 1996-2015 foi calculada uma prevalência estimada de 1:30.000 mulheres com implantes texturizados2. De Jong et al., em 20088, estimaram a incidência de BIA-ALCL de 1-3 casos: 1 milhão de implantes mamários por ano6. O estudo descritivo retrospectivo do Ministério da Saúde italiano estimou uma incidência italiana de BIA-ALCL de 2,8:100.000 pacientes em risco (com implantes) em 2015 e 2,3:100.000 pacientes em risco em 20166. Em dezembro de 2016 a Administração Australiana de Produtos Terapêuticos reportou uma incidência de 1:1.000 até 1:10.000 para pacientes com implante texturizado7. Alguns autores estimaram o risco em 1:500.000 até 3 milhões de mulheres com implantes. Outros determinaram a incidência nos EUA baseados na literatura e base de dados institucional de 2,03:1 milhão de pessoas/ano7.
Variações nas incidências de BIA-ALCL foram encontradas ao redor do mundo (extremamente raro na Ásia em comparação com países ocidentais; menor incidência relativa no Brasil e Europa, e maiores incidências na Austrália e Nova Zelândia)2. Possivelmente essas variações estão relacionadas com a predominância de implantes lisos x texturizados em cada país e predisposição genética/étnica2.
Apesar de raro, a incidência do BIA-ALCL tem aumentado, acreditando-se que tal, assim como a prevalência, ocorre pelo fato do número de cirurgias com implante de silicone mamário estar em constante incremento9,10.
Características do implante mamário:
Em 2017 o FDA acumulou 359 relatos médicos de BIA-ALCL sendo a maioria dos casos em pacientes com implantes texturizados. Dos 232 casos que caracterizavam o tipo do implante 203 eram texturizados e 28 lisos4,9. Todos os 18 casos observados no estudo retrospectivo do Reino Unido analisado neste estudo ocorreram em implantes texturizados6. Na revisão sistemática analisada neste estudo 95 pacientes foram incluídas e quase todos os BIA-ALCL documentados foram associados a implantes texturizados5. Suportando tais dados foram relatados 5 casos de BIA-ALCL em um corte de 17.656 mulheres com os implantes Natrelle (que usam a textura biocell) levando a um risco de no mínimo 1:3.500 implantes texturizados Natrelle2.
Apesar de casos de BIA-ALCL serem reportados tanto em implantes lisos quanto texturizados, mais recentemente foi determinado que implantes texturizados foram usados em algum momento pelas pacientes em quase todos os casos11. Muitas das pacientes têm histórico de múltiplas cirurgias de troca de implante, o que pode dificultar a determinação de qual implante exatamente foi utilizado11.
Apesar de ainda haver relatos de caso associados a implantes lisos, muitos acreditam que isso se deve a uma história clínica incompleta11. Na metanálise revisada, a superfície dos implantes era texturizada em 21,3% (17 casos) e desconhecida em 78% (63 casos) e casos em implantes de superfície lisa não foram reportados. As marcas mais comuns foram McGhan (11 casos - 14%), Mentor (7%) e PIP (hidrogel) em 3%; em 76% dos casos a marca era desconhecida12.
No estudo descritivo retrospectivo australiano foram encontrados 55 casos de BIA-ALCL diagnosticados de 2007 a 2016 na Austrália e Nova Zelândia. Todas as pacientes foram expostas aos implantes texturizados. A análise comparativa desse estudo mostrou que o risco para desenvolvimento do BIA-ALCL é 14,11 vezes maior com implantes biocell texturizados (95% CI, 1.2 to 561.46; p=0,0005) e 10,84 vezes maior com implantes de poliuretano texturizados (Silimed) (95% CI, 1.0 to 566.34; p=0,05) em comparação com implantes texturizados Siltex. O maior risco estimado de casos de BIA-ALCL pelo número de implantações foi encontrado com o Biocell (1:3.817) em comparação com o de poliuretano (1:7.788) e o de Siltex (1:60.631). O risco do implante de poliuretano desse estudo pode ser confundido devido a menor exposição do mercado australiano e da Nova Zelândia ao implante em relação às outras duas texturas1.
O estudo descritivo retrospectivo do Ministério da Saúde italiano mostrou que a doença foi diagnosticada em 21 dos casos em implantes de silicone com superfície texturizada (1 dos casos com poliuretano) e em 1 caso com um implante de duplo lúmen (salino/silicone) com superfície texturizada9. 15 pacientes haviam recebido implantes prévios antes do diagnóstico de BIA-ALCL9. Com base no dado de que mais de 97% dos implantes da Itália são texturizados, mesmo que os 22 casos de BIA-ALCL tivessem sido diagnosticados em implantes texturizados de silicone, nesse estudo essa amostra não foi representativa o suficiente para correlacionar a patogênese da doença com determinado tipo de implante7.
Na era moderna do aumento e reconstrução das mamas a proporção de implantes texturizados excede em grande número os implantes lisos e isso pode em parte explicar porque quase todos os casos surgem em associação com implantes texturizados6. Por conta da grande maioria dos estudos sobre o BIA-ALCL vir dos EUA, os relatos são limitados aos implantes utilizados lá. Maior investigação é necessária para associação entre a doença e o tipo de implante em outros locais do mundo11.
Em relação ao material de preenchimento dos implantes, o BIA-ALCL foi relatado tanto em implantes de silicone quanto implantes salinos9. Na revisão sistemática analisada, pacientes com implantes de silicone parecem ser mais afetados do que aqueles com implantes salinos, respectivamente 61% e 39% dos casos. Isso pode estar relacionado com o maior uso de implante anatômico texturizado de silicone atualmente5. Na metanálise revisada 32 dos implantes eram de silicone (40%), 28 eram salinos (35%), 2 eram de poliuretano, 1 uma combinação de silicone e solução salina e em 17 casos a informação era desconhecida12. A maioria dos autores não mostrou diferença em relação ao material de preenchimento dos implantes11. Na revisão de literatura analisada não foi encontrada diferença significativa de incidência entre os implantes salinos e os de silicone10.
Fisiopatologia:
A exata fisiopatologia do BIA-ALCL é incerta4,6,10. O desenvolvimento do BIA-ALCL é provavelmente um processo complexo que envolve vários fatores incluindo o crescimento do biofilme bacteriano, a superfície do implante texturizado, a resposta imune e a genética do paciente1,5.
As teorias em relação à patogenia dizem que implantes texturizados e o microbioma da mama (principalmente as bactérias gram negativas) potencialmente desencadeiam transformação maligna por aumentarem o risco de inflamação crônica guiada por antígeno (resposta predominantemente via linfócitos Th1 e Th17)1,4,5,9,10. A teoria é de que em comparação com implantes lisos, as concavidades presentes nos implantes texturizados predispõem à infecção subclínica e/ou inflamação crônica, já que sua maior área de superfície e interface com relevo aumentam a adesão bacteriana e a formação de biofilme1,6,11.
Hu et al., em 201513, estudaram o biofilme gerado em humanos e porcos e encontraram aumento da resposta linfocítica em implantes texturizados em comparação com implantes lisos e no infiltrado gerado a maioria das células eram do tipo T. Além disso houve um crescimento linear da quantidade de células B e T em relação à quantidade de bactérias4.
Honghua et al., em 201614, reportaram um aumento na prevalência de certos organismos gram negativos (Ralstonia spp) no microbioma da cápsula dos implantes retiradas de pacientes com BIA-ALCL em comparação com os controles5,6. Um estudo analisando a mama saudável de pacientes com BIA-ALCL mostrou microbioma semelhante na comparação das mamas, porém nível significantemente menor de bactéria no tecido saudável5.
Nos estudos sobre o ALCL foi observado bactérias gram negativas em comparação com as da contratura capsular que são positivas12. Outras observações também apontam a infecção como etiologia pelo padrão de incidência em grupos, com alguns cirurgiões tendo múltiplos eventos o que poderia representar contaminação nosocomial1. O tempo de desenvolvimento da doença também corrobora com tal teoria, pois circunscreve o período necessário para o biofilme produzir inflamação, ativação imune e transformação para câncer. Além disso, não há documentação da doença na era pré-implantes texturizados5. Foi também sugerido que partículas do silicone embebidas na cápsula podem iniciar resposta inflamatória11.
Fatores genéticos do hospedeiro também parecem estar envolvidos (mutações no Janus Kinase and Signal Transducer and Activator of Transcription 3 - JAK-STAT3 (relacionado à proliferação, diferenciação e apoptose celular); mutações no tp53 e DNMT3A (DNA metiltransferase); entre outros, assim como alterações genéticas relacionadas à inflamação crônica2,5,10.
Apesar da evidência crescente de que inflamação crônica seria fator etiológico para a doença, alguns autores aconselham cuidado ao desenhar conclusões antes que a ciência entenda melhor essa entidade não usual6.
DISCUSSÃO
Os dados encontrados acerca da epidemiologia do BIA-ALCL mostram que a incidência estimada da doença varia muito de acordo com o tipo de estudo e das variáveis englobadas. A incidência variou conforme o país estudado e as características do implante (texturizado ou não). É provável que as diferentes incidências se devam a predominância de implantes lisos x texturizados em cada país, porém não se pode descartar que a hipótese de predisposição genética/racial exerça papel nessa grande variação.
Em relação ao tipo de superfície dos implantes mamários e seu possível gatilho para o desenvolvimento do bia-alcl, os dados coletados nessa revisão da literatura corroboram para a teoria de que os implantes texturizados tem grande papel na etiologia da doença. Todos os estudos analisados mostraram maior incidência da doença em pacientes com implantes texturizados ou histórico de uso anterior dos mesmos. Porém, devido às limitações dos estudos acerca de variáveis geográficas, em relação ao mercado atual de implantes mamários e a pequena quantidade de estudos acerca do bia-alcl ainda não é possível afirmar com certeza que implantes de superfície texturizada são os disparadores do desenvolvimento da doença, apesar de se apresentarem como fator de risco. Em relação ao material de preenchimento dos implantes mamários os estudos analisados em grande maioria não mostraram diferença na incidência do bia-alcl.
Há que se ressalvar que a grande maioria dos implantes utilizados em hodiernos tempos são texturizados, o que pode ser um grande viés de análise, pois caso uma análise regressiva proporcionada se realizasse, os implantes revestidos de poliuretano representariam risco muito superior aos implantes texturizados, pois mesmo com baixa utilização, apresentam taxas de 10,84 vezes maior de risco para o BIA-ALCL.
A fisiopatologia mais aceita atualmente é a de que os implantes mamários com maior área de superfície e, conseguintemente, maior interface com o meio (implantes texturizados) levariam à formação de maior biofilme por maior adesão bacteriana. Bactérias gram negativas associadas à inflamação crônica presentes no biofilme gerariam ativação imune com resposta predominantemente Th1 e Th17. Inflamação crônica seria o gatilho para a transformação maligna das células T que levariam ao BIA-ALCL. Fatores genéticos do hospedeiro (mutação JAK-STAT3, tp53, DNMT3A) também estariam relacionados à transformação maligna que induziriam a doença.
CONCLUSÃO
O BIA-ALCL é uma doença rara e uma entidade ainda pouco conhecida. De acordo com os dados analisados é possível concluir que não há uma relação direta de causa e efeito entre os implantes mamários, mormente os texturizados, e o desenvolvimento do BIA-ALCL, podendo esses ser considerados somente como fatores de risco e não agentes causadores.
Como diretrizes, tendo como arquétipo a revisão aqui delineada, há que se orientar os cirurgiões plásticos a realizarem acompanhamentos mais próximos de seus pacientes e sempre terem em mente a existência do BIA-ALCL para um diagnóstico precoce e tratamento efetivo.
Outrossim, é dever dos profissionais explicarem aos pacientes antes das cirurgias a existência do BIA-ALCL e sua incidência; além de, estando a média de manifestação do BIA-ALCL em 10 anos, programarem, além do exame físico minucioso das mamas, a orientação de que qualquer sintomatologia distinta das esperadas, acarretará na necessidade de investigação com exames complementares.
As informações explicitadas nessa revisão da literatura devem auxiliar na ampliação de estudos acerca dos fatores de risco e fisiopatologia da doença e futuramente criação de políticas públicas para prevenção, diagnóstico precoce e manejo de tal enfermidade.
COLABORAÇÕES
|
DSSR |
Análise e/ou interpretação dos dados, aprovação final do manuscrito, coleta de dados, conceitualização, concepção e desenho do estudo, gerenciamento de recursos, gerenciamento do projeto, investigação, metodologia, redação - preparação do original, redação - revisão e edição, supervisão. |
|
BSR |
Análise e/ou interpretação dos dados, coleta de dados, conceitualização, gerenciamento do projeto, investigação, metodologia, realização das operações e/ou experimentos, redação - preparação do original, redação - revisão e edição. |
REFERÊNCIAS
1. Loch-Wilkinson A, Beath KJ, Knight RJW, Wessels WLF, Magnusson M, Papadopoulos T, et al. Breast implant-associated anaplastic large cell lymphoma in Australia and New Zealand: high-surface-area textured implants are associated with increased risk. Plast Reconstr Surg. 2017 Oct;140(4):645-54.
2. Rastogi P, Deva AK, Prince HM. Breast implant-associated anaplastic large cell lymphoma. Current Hematologic Malig Rep. 2018 Dec;13(6):516-24.
3. Keech JA Jr, Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg. 1997 Aug;100(2):554-5.
4. Berlin E, Singh K, Mills C, Shapira I, Bakst RL, Chadha M. Breast implant-associated anaplastic large cell lymphoma: case report and review of the literature. Case Rep Hematol. 2018 Jan;2018:2414278.
5. Leberfinger AN, Behar BJ, Williams NC, Rakszawshi KL, Potochny JD, Mackay DR, et al. Breast implant - associated anaplastic large cell lymphoma: a systematic review. JAMA Surg. 2017 Dec;152(12):1161-68.
6. Johnson L, O'Donoghue JM, McLean N, Turton P, Khan AA, Turner SD, et al. Breast implant associated anaplastic large cell lymphoma: The UK experience. Recommendations on its management and implications for informed consent. Eur J Surg Oncol. 2017 Aug;43(8):1393-401.
7. Campanale A, Boldrini R, Marletta M. 22 Cases of Breast implant-associated ALCL: awareness and outcome tracking from the Italian Ministry of Health. Plast Reconstr Surg. 2018 Jan;141(1):11e-19e.
8. Jong D, Vasmel WL, Boer JP, Verhave G, Barbé E, Casparie MK, et al. Anaplastic large-cell lymphoma in women with breast implants. JAMA. 2008 Nov 5;300(17):2030-5.
9. Ezekwudo DE, Ifabiyi T, Gbadamosi B, Haberichter K, Yu Z, Amin M, et al. Breast implant-associated anaplastic large cell lymphoma: a case report and review of the literature. Case Rep Oncol Med. 2017 Oct;2017:6478467:[aprox.6 telas].
10. Chacko A, Lloyd T. Breast implant-associated anaplastic large cell lymphoma: a pictorial review. Insights into Imaging. 2018 Oct;9(5):683-6.
11. O'Neill AC, Zhong T, Hofer SOP. Implications of breast implant - associated anaplastic large cell lymphoma (BIA-ALCL) for breast cancer reconstruction: an update for surgical oncologists. Ann Surg Oncol. 2017 Oct;24(11):3174-3179.
12. Gallardo GR, Pardo JC, Olivares ER, Moreno RI, Bulnes LC, Rodríguez AV, et al. Breast implant and anaplastic large cell lymphoma meta-analysis. J Invest Surg. 2017 Feb;30(1):56-65.
13. Hu H, Jacombs A, Vickery K, Merten SL, Pennington DG, Deva AK. Chronic biofilm infection in breast implants is associated with an increased T-cell lymphocytic infiltrate: implications for breast implant-associated lymphoma. Plast Reconstr Surg. 2015 Feb;135(2):319-29.
14. Hu H, Johani K, Almatroudi A, Vickery K, Van Natta B, Kadin ME, et al. Bacterial Biofilm Infection Detected in Breast Implant-Associated Anaplastic Large-Cell Lymphoma. Plast Reconstr Surg. 2016 Jun;137(6):1659-69.
1. Universidade Federal de São Carlos, São Carlos, SP, Brasil.
Autor correspondente: Daniel Sundfeld Spiga Real Rua Dr. Domingos Faro, 285, Jardim Alvorada, São Carlos, SP, Brasil. CEP: 13562-003. E-mail: dplasticsurgery@hotmail.com
Artigo submetido: 8/6/2019.
Artigo aceito: 22/7/2019.
Conflitos de interesse: não há.





 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter