

Original Article - Year 2019 - Volume 34 -
Enxerto de gordura: lipofragmentado X lipoaspirado
Fat grafting: Lipofragmentation X Liposuction
RESUMO
Introdução: Com o objetivo de obter lipoenxerto autógeno e injetável de tecido ressecado em dermolipectomias, este estudo propõe um novo método para colheita e processamento do tecido adiposo, através de um dispositivo fragmentador específico. O principal objetivo foi estabelecer uma análise comparativa das características de qualidade e viabilidade do novo lipofragmentado em relação ao já conhecido lipoaspirado, amplamente aceito como fonte viável de lipoenxerto. Ensaios in vivo e in vitro foram delineados para avaliar o comportamento biológico das amostras, a fim de orientar novos e possíveis estudos em humanos com aplicações clínicas.
Métodos: Uma paciente pós-bariátrica que foi submetida a dermolipectomia abdominal teve sua peça cirúrgica ressecada e dividida em quatro partes que foram submetidas a Lipoaspiração e Lipofragmentação, sem e com infiltração prévia. Todas as amostras foram submetidas a centrifugação e então distribuídas para os ensaios que envolveram avaliação histológica, imunohistoquímica, citometria de fluxo, cultura celular e ainda a injeção de xenoenxerto no dorso de 10 ratos Wistar, retirados após seis semanas para avaliação de massa, volume e características histológicas.
Resultados: As amostras de gordura fragmentada, seca e infiltrada, mostraram características estruturais e comportamento biológico semelhantes aos das amostras de lipoaspirado.
Conclusões: A fragmentação da gordura transformou o tecido celular subcutâneo das dermolipectomias em uma nova variante de lipoenxerto injetável e viável, com características biológicas semelhantes àquelas do lipoaspirado tradicional. Embora ainda preliminares, nossos resultados embasam a realização de novas investigações buscando otimizar a técnica com vistas ao aprimoramento da enxertia gordurosa e suas possíveis aplicações na medicina regenerativa.
Palavras-chave: Tecido adiposo; Transplantes; Cirurgia plástica; Bioprótese; Sobrevivência de enxerto
ABSTRACT
Introduction: Aiming to obtain autogenous and injectable
lipografts from resected tissues in dermolipectomies, this
study proposes a new method for harvesting and processing
adipose tissue through a specific fragmenting device. The main
objective was to establish a comparative analysis of the quality
and viability characteristics of the new lipofragmentation
technique and those of the well-known liposuction technique,
widely accepted as a viable source of fat grafting. In vivo
and in vitro assays were designed to evaluate the biological
behavior of the samples to guide new and possible human
studies with clinical applications.
Methods: A post-bariatric
patient who underwent abdominal dermolipectomy had her
surgical specimen resected, which was divided into four parts
that underwent liposuction and lipofragmentation, with and
without prior infiltration. All samples were centrifuged and
distributed for assays with assessments involving histological
analysis, immunohistochemistry, flow cytometry, cell culture,
and xenograft injection on the back of 10 Wistar rats, which
was evaluated after six weeks for mass, volume, and histological
features.
Results: The structural characteristics and biological
behaviors of fragmented, dry, and infiltrated fat samples were
similar to those of liposuction samples.
Conclusions: Fat
fragmentation transformed the subcutaneous cellular tissue of
dermolipectomies into a new, viable injectable lipograft variant,
with biological characteristics similar to those of traditional
liposuction. Although still preliminary, our results support
further investigations to optimize the technique and improve fat
grafting and its possible applications in regenerative medicine.
Keywords: Adipose tissue; Transplants; Plastic surgery; Bioprosthesis; Graft survival.
INTRODUÇÃO
A possibilidade da reinjeção gordurosa através de cânulas vem transformando o lipoenxerto autólogo numa ferramenta conveniente e efetiva para restaurar volume e contorno subcutâneo em diversas situações clínicas1,2. Atualmente, existem várias possibilidades técnicas para cada etapa do processo de lipoenxertia, entretanto, não há um consenso absoluto e uniforme que possa garantir a melhor eficácia e previsibilidade na integração desses enxertos. Recentemente, dois trabalhos de revisão sistemática da literatura retrataram o estágio atual da lipoenxertia baseado em evidências, procurando elucidar os efeitos dos diferentes métodos de colheita, processamento e reinjeção nas taxas de integração do enxerto gorduroso. Interessantemente, muito poucas variáveis se aplicam ao método de colheita, incluindo diferentes tipos e tamanhos de cânulas, mas sempre utilizando algum tipo de lipoaspiração3,4.
A transferência de gordura vem sendo cada vez mais utilizada no contorno glúteo e mamário, porém a limitação volumétrica da lipoaspiração como método de colheita do material pode representar um impedimento formal para muitos pacientes, especialmente da população pós-bariátrica. Os grandes emagrecimentos promovem o esvaziamento do tecido celular subcutâneo, o que torna a lipoaspiração menos efetiva nesses casos, seja pela frouxidão tecidual estabelecida ou mesmo pela pouca quantidade de gordura remanescente. Assim, a necessidade de restaurar sua melhor volumetria em áreas localizadas, muitas vezes esbarra na dificuldade técnica ou mesmo impossibilidade de se obter gordura em quantidades suficientes através da lipoaspiração. Paradoxalmente, as dermolipectomias realizadas para suspensão e aperto corporal nesses pacientes, invariavelmente, produzem o descarte indesejável de tecido gorduroso viável, incorporado nas ressecções cirúrgicas5.
A fim de otimizar a obtenção de lipoenxerto autólogo e injetável das peças cirúrgicas de dermolipectomias, propomos um novo método de colheita e processamento do tecido adiposo através de um dispositivo fragmentador, que poderá converter a quase totalidade do tecido celular subcutâneo em lipoenxerto viável6.
OBJETIVO
O objetivo desse estudo é estabelecer uma comparação analítica entre as características e comportamento biológico da nova “Gordura Fragmentada” (Fragmented Fat) e do já consagrado “Lipoaspirado”, quando utilizados como lipoenxerto. Observações in vitro e in vivo foram delineadas para estabelecer e avaliar parâmetros que objetivamente possam comprovar a viabilidade do enxerto de gordura fragmentada e sustentar a propriedade de futuros estudos e aplicações clínicas em seres humanos.
MÉTODOS
O delineamento científico desse projeto foi devidamente protocolado e aprovado pelas comissões de ética da Faculdade de Medicina de Botucatu - Universidade Estadual Paulista (UNESP), para pesquisa em humanos (CAAE 73646217.7.0000.5411) e em animais (CEUA 1240/2017), tendo sido realizado entre os meses de setembro de 2017 e março de 2018.
Uma paciente adulta do sexo feminino, com grande emagrecimento pós cirurgia bariátrica, foi submetida a uma dermolipectomia abdominal anterior em âncora tendo a região infraumbilical de sua peça cirúrgica utilizada e medialmente dividida em duas partes. A metade esquerda recebeu a infiltração subcutânea de 400ml de solução fisiológica com agulha de Klein (t=tumescent) enquanto a metade direita foi mantida seca, sem qualquer infiltração (d=dry). A seguir, cada metade foi verticalmente dividida em duas partes, perfazendo então quatro diferentes peças que foram submetidas a duas técnicas de colheita do lipoenxerto (Figura 1A). As duas porções laterais receberam lipoaspiração por seringa com cânula de 2mm - Lipoaspirado: Seco e Tumescente (LAd e LAt), enquanto as duas porções centrais tiveram sua pele ressecada a bisturi e o tecido gorduroso dividido em pedaços menores, que foram então submetidos ao novo método de fragmentação - Lipofragmentado: Seca e Tumescente (FFd e FFt).
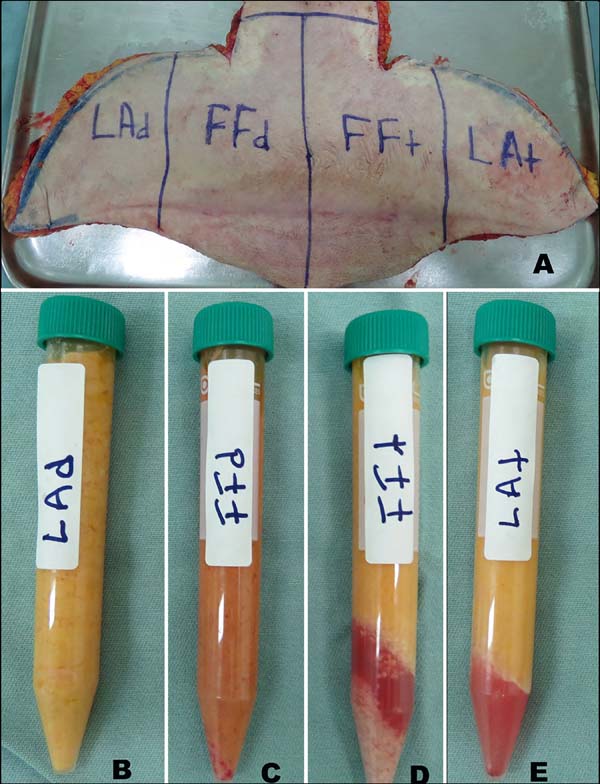
Todas as quatro amostras obtidas ao final, foram igualmente tratadas por centrifugação (1200 rpm por 3 minutos) e então distribuídas para os ensaios in vivo e in vitro (Figuras 1B, C, D e E). Cada uma das quatro amostras de tecido adiposo (FFd, FFt, LAd e LAt) foi agrupada e rotulada como uma cor diferente (azul, vermelho, verde e preto), a fim de preservar a manipulação às cegas durante as fases subsequentes do experimento, até que os resultados estivessem finalmente prontos para registro e interpretação.
Fragmentação da Gordura
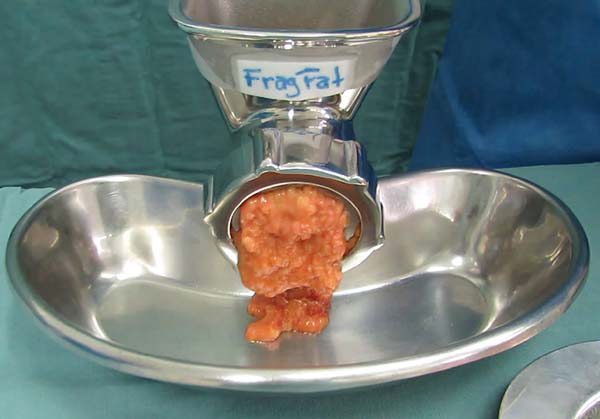
O fragmentador proposto é um aparato manual (Figura 2), construído em aço inoxidável (autoclavável) e concebido para receber em sua porção proximal, pedaços de tecido gorduroso numa câmara cilíndrica (Figura 2A), sendo gradativamente carreados por uma estrutura helicoidal central (Figura 2B), em direção a um dispositivo cortante distal, constituído por uma lâmina rotacional em forma de estrela (Figura 2C), e uma placa multiperfurada estacionária (Figura 2D). Por fim, um anel com rosca prende as estruturas em posição (Figuras 2E e F). Com o acionamento da manivela, à medida em que os pedaços de gordura (sem pele) são empurrados adiante pelo eixo helicoidal em direção ao dispositivo cortante distal, o tecido se projeta pelos orifícios da placa sendo imediata e continuamente seccionado em pequenos fragmentos pela lâmina rotacional. O grau da fragmentação é determinado pelo diâmetro dos orifícios da placa multiperfurada, proporcionando a consistência ideal para lipoinjeção de acordo com os diferentes tamanhos das cânulas e seus diâmetros internos. Nesse experimento, utilizamos a placa distal com orifícios de 2mm com o objetivo de obter o lipoenxerto em condições semelhantes ao Lipoaspirado que foi colhido através de cânula com 2mm de diâmetro (Figura 3).
Estudo In Vitro
Todas as amostras de Gordura Fragmentada (Lipofragmentado) e Lipoaspirado foram submetidas à rotina histológica incluindo imunohistoquímica, além de contagem de células viáveis, citometria de fluxo e cultura de células da fração vascular estromal. As amostras submetidas ao estudo in vitro foram disponibilizadas através de seringas de 1ml passando por uma cânula de 2mm, exatamente da mesma forma que no protocolo in vivo.
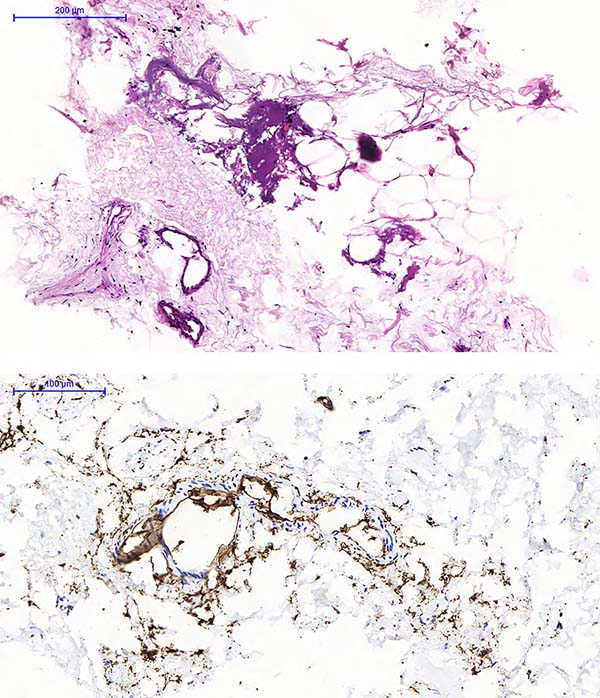
Avaliação Histológica: Cada uma das amostras (3g de gordura) foi imediatamente fixada em formol tamponado a 10%, concentrada por filtração gravitacional em papel poroso, processada em diferentes graduações de álcool e xilol, emblocada em parafina, cortada em 5 micra de espessura e corada em H&E. A caracterização imunohistoquímica foi obtida pela utilização do marcador progenitor estromal primário CD34. As lâminas histológicas foram observadas e comparadas por uma patologista experiente, buscando analisar possível distorção arquitetônica dos tecidos, degeneração dos adipócitos e o padrão imunohistoquímico.
Avaliação Biológica. O protocolo utilizado para dissociação enzimática será descrito sumariamente, conforme já pormenorizado em publicações prévias7,8. Cada uma das quatro amostras colhidas (10g) foi adicionada à 30 ml de solução de Collagenase filtrada (GibcoTM) utilizando a seguinte razão de ingredientes: 3mg de Collagenase tipo 2 por grama de tecido e 1ml de solução salina balanceada de Hank (GibcoTM) por mg de Collagenase + 3,5% de albumina de soro bovino (Sigma AldrichTM). Os tubos de 50ml, preenchidos com 10g de tecido e 30ml de solução de Collagenase filtrada, foram submersos em banho Maria a 37°C por 30min sob agitação constante até a solução tornar-se homogênea. As amostras foram submetidas à filtragem em dupla camada de gaze e nova centrifugação a 120 rpm por 10 minutos, quando as frações digeridas de gordura ficaram no sobrenadante, enquanto o pellet estromal se condensou no fundo.
A viabilidade das células em suspensão foi avaliada pela técnica do Trypan Blue9,10 (Sigma AldrichTM). A cultura das células dissociadas enzimaticamente e fenotipadas pela citometria de fluxo teve por objetivo avaliar a prevalência de possíveis e distintas populações progenitoras, comparando-se o comportamento biológico das mesmas entre os grupos11.
Neste estudo, 104 cels/ml foram semeadas em placas de 6 poços contendo o meio de cultura DMEM F12 (GibcoTM) suplementado com Streptomicina, Penicilina, Anfotericina B (GibcoTM) e 20% de soro fetal bovino. As células foram monitoradas diariamente através de microscópio invertido de contraste de fase (Axiovert A1 - Carl ZeissTM).
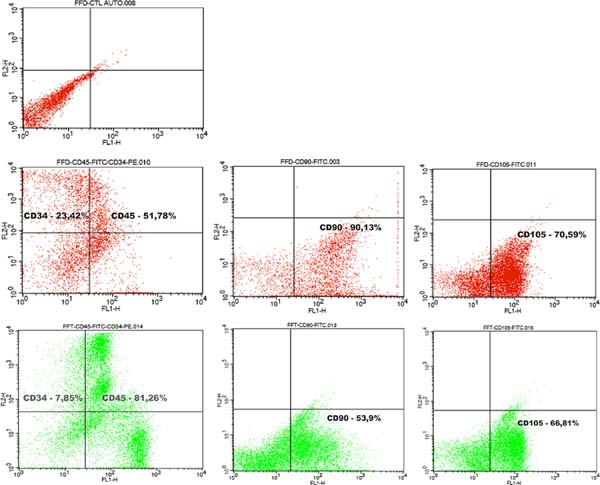
De acordo com uma definição conjunta da International Federation for Adipose Therapeutics and Science (IFATS) e da International Society for Cellular Therapy (ISCT)12, a caracterização de células tronco mesenquimais pela citometria de fluxo exige um padrão mínimo de expressão fenotípica, que confira positividade para alguns marcadores (utilizamos CD90 e CD105) e negatividade para outros (utilizamos CD34 e CD45)12. Nesse estudo, a avaliação da expressão molecular de superfície foi obtida com o equipamento FACScalibur BD e o software Cell Quest Pro utilizando FITC anti-human CD45 (368507 Biolegend) e PE anti-human CD34 (343505 Biolegend), FITC anti-human CD90 (Thy 1) (328107 Biolegend) e FITC anti-human CD105 (323203 Biolegend), com seus respectivos isótopos controle.
Estudo In Vivo
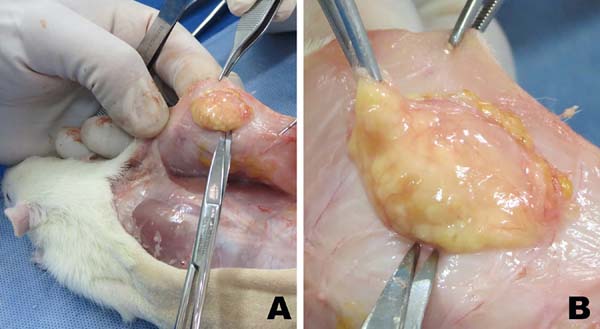
Com o objetivo de comparar a integração do lipoenxerto proveniente da Lipoaspiração e da Lipofragmentação em ambos os grupos, seco e infiltrado, as diferentes amostras obtidas foram rotuladas por diferentes cores (azul, vermelho, verde e preto) e distribuídas em seringas de 1ml, imediatamente levadas do bloco cirúrgico ao laboratório experimental, onde foram injetadas no subcutâneo dorsal de 10 ratos Wistar, sob anestesia e condições estéreis. Duas pequenas punções foram posicionadas na linha média dorsal dos ratos e através de uma cânula de 2mm de diâmetro realizou-se a retroinjeção subcutânea de 1ml de cada amostra (FFd, LAd, FFt and LAt), enxertando-as igualmente em cada um dos quadrantes, num protocolo de rotação em sentido horário do posicionamento das amostras para cada novo animal.
Os ratos foram marcados por números (método auricular) e cada amostra de enxerto injetada foi devidamente registrada pela respectiva cor e localização. Os animais foram mantidos em condições ambientais padronizadas e receberam diariamente injeções subcutâneas ventrais de ciclosporina (2mg/Kg), a fim de reduzir a resposta imunológica contra o xenoenxerto13. Após seis semanas, todos os ratos foram sacrificados e a gordura remanescente dos enxertos foi retirada cirurgicamente, para uma avaliação comparativa da massa e volume, além da preparação de rotina histológica para lâminas coradas em H&E e Tricrômio de Masson. Cada lâmina teve áreas randomicamente escolhidas para uma avaliação histológica às cegas, procurando classificar a presença de células adiposas íntegras, cistos e vacúolos, inflamação (infiltração linfocitária e de macrófagos), fibrose e neovascularização (densidade capilar).
A presença de cada uma dessas variáveis foi graduada numa escala de 0 a 5 sendo: 0, Ausente; 1, Mínimo; 2, Mínimo a moderado; 3, Moderado; 4, Moderado a extenso; 5, Extenso14.
RESULTADOS
O processo de fragmentação se mostrou efetivo em transformar os pedaços de tecido gorduroso da dermolipectomia numa textura de lipoenxerto injetável (Figura 3). Todas as amostras de material gorduroso obtido pela Lipoaspiração e pela Lipofragmentação foram submetidas à centrifugação resultando igualmente em discreta camada oleosa superior. Ambas as amostras do grupo infiltrado (LAt e FFt) formaram uma camada líquida após a centrifugação, que assim como a camada oleosa foram removidas do material a ser estudado, conforme descrito por Coleman15,16. A gordura fragmentada infiltrada apresentou uma camada visível e sedimentada inferiormente (pellet) que não se observou no Lipoaspirado infiltrado, e também não foi incluída no material para estudo. O material do grupo seco, tanto Lipoaspirado quanto Lipofragmentado não apresentaram camada líquida ou pellet inferior (Figuras 1B, C, D e E).
Avaliação Histológica e Imuno-histoquímica
A análise às cegas de ambos os grupos seco e infiltrado, tanto do material Lipoaspirado como do Lipofragmentado, mostrou características estruturais histológicas semelhantes no que se refere a arquitetura tecidual e integridade celular. A imunohistoquímica mostrou grande quantidade de células marcadas com CD34 amplamente distribuídas entre ambos os tecidos Lipoaspirado e Lipofragmentado. A histologia do material sedimentado obtido após a centrifugação do Lipofragmentado infiltrado (pellet), revelou adipócitos em meio a grande quantidade de matriz vascular e estromal, demonstrando alto índice de células marcadas pelo CD34 (Figura 4).
Contagem de Células Viáveis e Citometria de Fluxo
Embora tenha havido uma diferença significativa no número de células nucleadas entre as amostras, a viabilidade das mesmas não variou significativamente (Tabela 1). A análise do teste com Trypan Blue não mostrou diferença estatisticamente significativa na viabilidade das células entre as amostras do Lipoaspirado e Lipofragmentado em ambos os grupos, seco e infiltrado. A imunofenotipagem das amostras pela citometria de fluxo mostrou que em ambos os grupos seco e infiltrado, o Lipoaspirado e Lipofragmentado também mostraram comportamento semelhante com os marcadores utilizados no estudo (Figuras 5 e 6) . A distribuição analítica das células por cada marcador nas diferentes preparações não evidenciou diferença estatisticamente significativa (Tabela 1).
| Média de Intensidade de Fluorescência (%) | |||||||
|---|---|---|---|---|---|---|---|
| Ctle Auto | Ctke ISO | CD45-FITC | CD34-PE | CD90-FITC | CD105-FITC | ∑ nº Céls analisadas | |
| FFd | 6 | 11,91 | 52,98 | 51,81 | 92,22 | 69,09 | 11.095 |
| FFt | 5,07 | 6,64 | 84,12 | 57,67 | 55,98 | 65,42 | 20.000 |
| LAd | 2,61 | 3,4 | 61,39 | 63,78 | 51,52 | 37,23 | 20.000 |
| LAt | 6,09 | 4,21 | 56,14 | 78,33 | 70,67 | 68,68 | 20.000 |
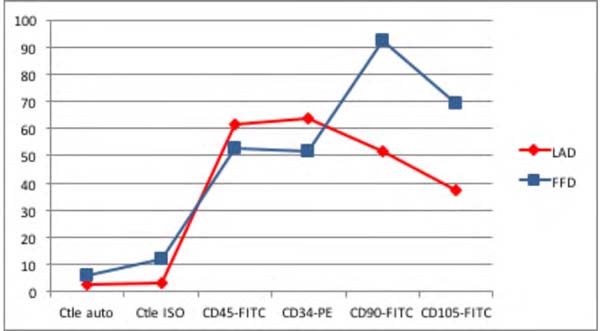
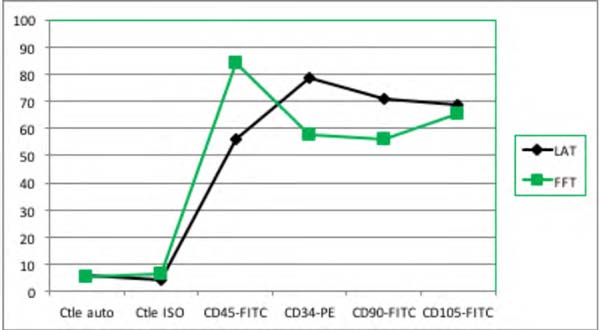
Dentre as amostras do grupo seco, o Lipofragmentado mostrou o melhor desempenho para os marcadores CD90 e CD105, obtendo uma maior quantificação de células tronco mesenquimais. Já no grupo infiltrado, o Lipofragmentado mostrou um melhor desempenho para marcadores CD45 enquanto o Lipoaspirado foi melhor para o CD34. A Figura 7 mostra a representação da análise imunofenotípica para marcadores de superfície AD-MSC nas diferentes amostras.
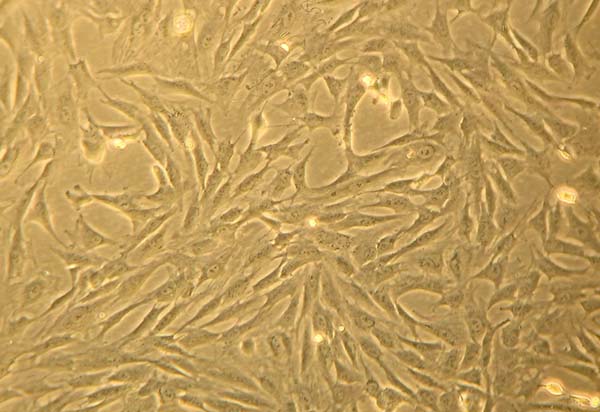
Cultura de Células Tronco derivadas da Gordura
As amostras de Lipoaspirado e Lipofragmentado em ambos os grupos seco e infiltrado, mostraram parâmetros semelhantes na cultura celular, com expansão regular padrão. A taxa de adesão em 72 horas foi de 25% para as amostras FFd, o que diferiu significativamente das outras amostras que chegaram aos 10%. Da mesma forma, a confluência celular em 100% também ocorreu mais cedo na amostra de FFd. Mesmo com esses achados, a aparência final das populações fibroblásticas não apresentou diferenças entre as amostras estudadas (Figura 8).
Integração do Lipoenxerto - Análise de Massa e Volume
Seis semanas após a lipoenxertia, todos os 10 ratos foram sacrificados e tiveram suas regiões dorsais abordadas para a remoção cirúrgica dos enxertos remanescentes (Figura 9). Testes T de Student para amostras independentes foram aplicados aos achados de massa e volume das peças obtidas, para comparar a retenção e comportamento do Lipofragmentado e Lipoaspirado em ambos os grupos seco (FFd X LAd) e infiltrado (FFt X LAt). Os números foram trabalhados por média e desvio padrão (SAS® for Windows v. 9,3) com a produção de ilustração gráfica (Statistica® for Windows v. 10) com nível de significância estabelecido em 5% (p<0.05).
SECO: Lipofragmentado X Lipoaspirado. No grupo onde a gordura foi colhida e processada sem infiltração prévia, o volume retido do Lipofragmentado apresentou média de 0.65 ± 0.13 enquanto do Lipoaspirado foi 0.73 ± 0.24, com o p=0.37. Já a massa retida do Lipofragmentado apresentou média de 0.63 ± 0.13, enquanto do Lipoaspirado foi 0.70 ± 0.24, com o p=0.41. Assim, no que se refere a massa e volume final dos enxertos provenientes de lipofragmentado e lipoaspirado secos, não houve diferença estatisticamente significativa (Figura 10).
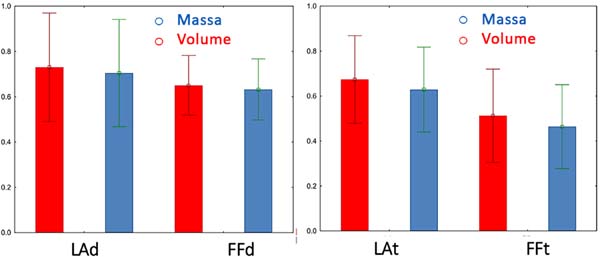
INFILTRADO: Lipofragmentado X Lipoaspirado. A análise do volume retido nos enxertos do grupo colhido pós-infiltração das peças revelou o Lipofragmentado com média de 0.51 ± 0.21 e o Lipoaspirado de 0,67 ± 0.20, com o p=0,09. Os achados de massa mostraram o Lipofragmentado com média de 0.46 ± 0.19, enquanto o Lipoaspirado foi de 0.63 ± 0.19, com o p=0.06. Novamente, os lipoenxertos obtidos por Lipofragmentação e Lipoaspiração infiltrada também não mostraram diferença estatisticamente significativa nas suas taxas de retenção de massa e volume (Figura 10).
Integração do Lipoenxerto - Análise Histológica
Um equipamento de scanner digital panorâmico (3DHistech®) e o software Pannoramic Viewer for Windows v. 1.15, foram utilizados para manusear as lâminas e ajudar na graduação das variáveis histológicas na coloração H&E, com exceção da fibrose que foi acessada pela coloração em Tricrômio de Masson. O tratamento estatístico dos dados obtidos pela avaliação microscópica dos enxertos retidos no grupo seco (FFd and LAd), não mostrou diferença em relação a inflamação fibrose e neovascularização. Entretanto, o Lipoaspirado seco apresentou maior grau de integridade celular e menor grau de cistos e vacúolos quando comparados ao Lipofragmentado seco. No grupo infiltrado (FFt and LAt), não houve diferença na integridade celular, inflamação e neovascularização, mas o Lipofragmentado apresentou menos cistos ou vacúolos e maior fibrose em comparação com o Lipoaspirado. Os resultados foram expressados pela média e desvio padrão (Teste T de Student) e o valor de p<0,05 foi considerado para significância estatística (Tabela 2).
| Lipofragmentado Seco | Lipoaspirado Seco | p | |||
| Média | Desvio | Média | Desvio | ||
| Integridade Celular | 1.8 | 0.63 | 3.0 | 0.94 | 0.0036 |
| Cistos/Vacúolos | 3.4 | 1.26 | 2.3 | 0.82 | 0.0333 |
| Inflamação | 2.7 | 0.67 | 2.3 | 0.82 | 0.2502 |
| Fibrose | 2.1 | 0.74 | 1.9 | 0.74 | 0.5520 |
| Neovasculação Celular | 2.1 | 0.88 | 2.2 | 1.03 | 0.8180 |
| Lipofragmentado infiltrado | Lipoaspirado Infiltrado | p | |||
| Média | Desvio | Média | Desvio | ||
| Integridade Celular | 2.3 | 1.16 | 3.4 | 1.26 | 0.0577 |
| Cistos/Vacúolos | 3.2 | 0.79 | 1.8 | 0.79 | 0.0009 |
| Inflamação | 2.3 | 0.67 | 2.3 | 0.95 | 1.000 |
| Fibrose | 1.9 | 1.2 | 3.1 | 0.88 | 0.0197 |
| Neovascularização | 2.0 | 0.47 | 2.4 | 0.97 | 0.2603 |
DISCUSSÃO
Uma vez que estamos propondo uma nova metodologia para a colheita e processamento do lipoenxerto, o escopo desse ensaio foi promover uma comparação estrutural e biológica entre o novo “Lipofragmentado” e o já reconhecido “Lipoaspirado”. Utilizamos a mesma área doadora de uma única pessoa a fim de eliminar a variabilidade interpessoal na qualidade da gordura quanto ao seu potencial regenerativo e subsequente retenção do lipoenxerto17. A ressecção da pele com bisturi e a divisão da peça gordurosa em pedaços menores, permitiu utilizar toda a espessura do subcutâneo, incluindo as camadas gordurosas e o tecido conectivo, este último geralmente pouco incorporado pela lipoaspiração convencional.
O dispositivo fragmentador pode utilizar diferentes tamanhos nos orifícios da placa multiperfurada distal (nós usamos orifícios com 2mm de diâmetro), a fim de possibilitar a injeção do material colhido através de diferentes tamanhos de cânulas, de acordo com as diferentes áreas a serem enxertadas como face, mamas e glúteos.
Embora este não tenha sido um alvo específico do nosso método, parece bastante claro que a Lipofragmentação dispende menos tempo e esforço físico por parte do cirurgião, obtendo quantidades superiores de material gorduroso do que a Lipoaspiração tradicional, especialmente se considerarmos o paciente pós-bariátrico, com camadas gordurosas esparsas e esvaziadas.
A infiltração tumescente foi inicialmente desenvolvida para aprimorar a técnica da lipoaspiração18, mas alguns estudos têm evidenciado seus potenciais efeitos adversos que podem impactar na melhor integração dos lipoenxertos19-23. Como essa é uma realidade na Lipoaspiração, optamos por incluir um grupo de infiltração tumescente até pelos relatos de que tal infiltração poderia impactar negativa ou positivamente a biologia e viabilidade dos enxertos3, o que não foi observado no presente estudo. Consideramos como um viés intrínseco do nosso método o fato de que, na demarcação inicial da peça cirúrgica a ser fonte para colheita de lipoenxerto, as regiões paraumbilicais (medianas) contém mais vasos perfurantes e uma fáscia de Scarpa mais densa do que os territórios laterais do abdome. As amostras das regiões mediais podem apresentar suspensões celulares mais densas do que a áreas laterais, o que poderia em tese justificar alguma diferença na composição e biologia dos enxertos extraídos.
Considerando que não dispomos dos chamados “nude mices” (ratos atímicos) em nossos laboratórios, utilizamos os ratos Wistar com a aplicação diária de ciclosporina para promover a desejável imunossupressão conforme previamente descrito por Ferreira et al., em 199524. Reconhecemos o rato atímico como o modelo mais apropriado para este tipo de pesquisa com xenoenxerto gorduroso e aguardamos a oportunidade de utilizá-los em ensaios futuros, reduzindo então a quantidade de gordura injetada, bem como estendendo o tempo de integração dos enxertos para 12 semanas25.
A observação dos nossos ensaios in vitro e in vivo demonstrou que o Lipofragmentado se apresentou com características estruturais e biológicas muito semelhantes às do Lipoaspirado. Recentemente, evidências da natureza dinâmica e regenerativa dos lipoenxertos têm emergido de diferentes áreas da cirurgia plástica, bem como da biologia celular e molecular, incluindo a possibilidade do transplante direto de células-tronco derivadas da gordura incluindo o seu nicho biológico, mesmo sem o seu isolamento formal em meio de cultura, não apenas para incrementar a retenção do enxerto, mas também como distintas fontes de terapias celulares26,27. A citometria de fluxo com painel de marcadores específicos de superfície, bem como o teste de viabilidade celular ajudaram a distinguir e confirmar possíveis populações da fração vascular estromal presentes no material lipofragmentado, sem diferença estatística em relação ao material lipoaspirado, mostrando que o novo método preservou e não causou danos significativos a essas importantes estruturas.
O mecanismo envolvido no processo de fragmentação provavelmente incorpora mais do que apenas conteúdo celular gorduroso, mas também a sua estrutura colagênica (scaffolds). Depois da centrifugação, o Lipofragmentado infiltrado formou um evidente pellet inferior, consistindo de adipócitos maduros circundados por uma rica trama estromal, com vasos sanguíneos e células nucleadas, inclusive células-tronco progenitoras. O fato de não termos incluído esse material sedimentado nas amostras do Lipofragmentado infiltrado poderia, em tese, justificar sua integração um pouco inferior depois de 6 semanas. Embora aquele tecido estromal não tenha sido separado e visualmente identificado nas amostras do Lipofragmentado seco, é bastante razoável se imaginar que ele deva ter sido incorporado às amostras do FFd, que apresentaram as melhores taxas de integração. Investigações subsequentes serão cruciais para determinar o real potencial do conteúdo estromal do Lipofragmentado no enriquecimento dos enxertos e prováveis aplicações clínicas. Futuros estudos com esse material poderão também explorar alguns conceitos modernos de aprimoramento da capacidade cicatricial dos tecidos, bem como da medicina regenerativa sítio específica, pela utilização do scaffold perivascular, provavelmente incorporado nessa nova forma de obtenção do lipoenxerto.
CONCLUSÃO
O método utilizado demonstrou que o dispositivo fragmentador foi capaz de transformar em lipoenxerto viável, as camadas do subcutâneo retiradas numa dermolipectomia convencional, e esse novo tipo de Enxerto de Gordura Fragmentada se comportou com características biológicas semelhantes àquelas exibidas pelo Lipoaspirado tradicional com seringa. Embora, preliminarmente, nossos resultados podem embasar a continuação de novos estudos em humanos, com o objetivo de estender a Lipofragmentação como alternativa na enxertia gordurosa bem como em possíveis aplicações clínicas para cicatrização de feridas e medicina regenerativa.
COLABORAÇÕES
|
FHM |
Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Coleta de Dados, Conceitualização, Concepção e desenho do estudo, Gerenciamento de Recursos, Gerenciamento do Projeto, Investigação, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão, Validação, Visualização |
|
FV |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização, Concepção e desenho do estudo, Gerenciamento do Projeto, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão, Visualização |
|
ED |
Análise e/ou interpretação dos dados, Análise estatística, Conceitualização, Concepção e desenho do estudo, Gerenciamento de Recursos, Gerenciamento do Projeto, Investigação, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão |
|
MACD |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização, Concepção e desenho do estudo, Gerenciamento do Projeto, Investigação, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Supervisão |
|
MAG |
Análise estatística, Coleta de Dados, Conceitualização, Concepção e desenho do estudo, Investigação, Metodologia, Realização das operações e/ou experimentos |
|
JMG |
Coleta de Dados, Investigação, Met odologia, Realização das operações e/ou experimentos |
|
RRR |
Coleta de Dados, Investigação, Metodologia, Realização das operações e/ou experimentos |
|
HCN |
Coleta de Dados, Investigação, Metodologia, Realização das operações e/ou experimentos Afiliação(ões) |
REFERÊNCIAS
1. Illouz YG. The fat cell “graft”: a new technique to fill depressions. Plast Reconstr Surg. 1986;78:122-123. DOI: https://doi.org/10.1097/00006534-198607000-00028
2. Bircoll M, Novack BH. Autologous fat transplantation employing liposuction techniques. Ann Plast Surg. 1987;18:327-329. DOI: https://doi.org/10.1097/00000637-198704000-00011
3. Strong AL, Cederna PS, Rubin JP, Coleman SR, Levi B. The current state of fat grafting: a review of harvesting, processing, and injection techniques. Plast Reconstr Surg. 2015 Oct;136(4):897-912. PMID: 26086386 DOI: https://doi.org/10.1097/PRS.0000000000001590
4. Sinno S, Wilson S, Brownstone N, Levine SM. Current thoughts on fat grafting: using the evidence to determine fact or fiction. Plast Reconstr Surg. 2016 Mar;137(3):818-824. DOI: https://doi.org/10.1097/01.prs.0000479966.52477.8b
5. Mendes FH, Viterbo F. Abdominoplasty after massive weight loss. In: Avelar JM, ed. New concepts on abdominoplasties and further aplications. New York: Springer; 2016. p. 356-388.
6. Mendes FH, Viterbo F, Deffunne E, et al. Fragmented fat: a new method for harvesting and processing of lipograft. J Plast Reconstr Aesthet Surg. 2019 Jun;72(6):1030-1048. PMID: 30824381 DOI: https://doi.org/10.1016/j.bjps.2019.02.001
7. Zuk PA, Zhu M, Muzuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001 Apr;7(2):211-28. DOI: https://doi.org/10.1089/107632701300062859
8. Carvalho AM, Alves AL, Golim MA, et al. Isolation and immunophenotypic characterization of mesenchymal stem cells derived from equine species adipose tissue. Vet Immunol Immunopathol. 2009 Dec;132(2-4):303-6. DOI: https://doi.org/10.1016/j.vetimm.2009.06.014
9. Strober W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. 2015 Nov;111(1):A3.B.1-3. DOI: 10.1002/0471142735.ima03bs111
10. Boschert MT, Beckert BW, Puckett CL, Concannon MJ. Analysis of lipocyte viability after liposuction. Plast Reconstr Surg. 2002 Feb;109(2):761-765;discussion:766-7. DOI: https://doi.org/10.1097/00006534-200202000-00055
11. Mushahary D, Spittler A, Kasper C, Weber V, Charwat V. Isolation, cultivation and characterization of human mesnchymal stem cells. Cytometry A. 2018 Jan;93(1):19-31. DOI: https://doi.org/10.1002/cyto.a.23242
12. Bourin P, Brunnell BA, Castella L, et al. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal stem cells: a joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the International Society for Cellular Therapy (ISCT). Cytotherapy. 2013 Jun;15(6):641-8. DOI: https://doi.org/10.1016/j.jcyt.2013.02.006
13. Fritz WD, Swartz WM, Rose S, et al. Limb allografts in rats immunosuppressed with cyclosporine A. Ann Surg. 1984;199(2):211-5.
14. Li K, Gao J, Zhang Z, et al. Selection of donor site for fat grafting and cell isolation. Aesthetic Plast Surg. 2013 Feb;37(1):153-8. PMID: 23232729 DOI: https://doi.org/10.1007/s00266-012-9991-1
15. Coleman SR. Long-term survival of fat transplants: Controlled demonstrations. PMID: 8526158 Aesthetic Plast Surg. 1995;19(5):421-425.
16. Coleman SR. Structural fat grafting: More than a permanent filler. Plast Reconstr Surg. 2006 Sep;118(3 Suppl):108S-120S. DOI: https://doi.org/10.1097/01.prs.0000234610.81672.e7
17. Fisher C, Grahovac TL, Schafer ME, Shippert RD, Marra KG, Rubin JP. Comparison of harvest and processing techniques for fat grafting and adipose stem cell isolation. Plast Reconstr Surg. 2013 Aug;132(2):351-61. PMID: 23584621 DOI: https://doi.org/10.1097/PRS.0b013e3182958796
18. Klein JA. Tumescent technique for local anesthesia improves safety in large- volume liposuction. Plast Reconstr Surg. 1993 Nov; 92(6):1085-1098. DOI: https://doi.org/10.1097/00006534-199311000-00014
19. Agostini T, Lazzeri D, Pini A, et al. Wet and dry techniques for structural fat graft harvesting. Plast Reconstr Surg. 2012 Aug;130(2):331e-339e. PMID: 22495217 DOI: https://doi.org/10.1097/PRS.0b013e3182589f76
20. Moore Junior JH, Kolaczynski JW, Morales LM, et al. Viability of fat obtained by syringe suction lipectomy: Effects of local anesthesia with lidocaine. Aesthetic Plast Surg. 1995;19:335-339. DOI: https://doi.org/10.1007/BF00451659
21. Livaoğlu M, Buruk CK, Uraloğlu M, et al. Effects of lidocaine plus epinephrine and PMID: 22777468 prilocaine on autologous fat graft survival. J Craniofac Surg. 2012 Jul;23(4):1015-8.
22. Shoshani O, Berger J, Fodor L, et al. The effect of lidocaine and adrenaline on the viability of injected adipose tissue: An experimental study in nude mice. J Drugs Dermatol. 2005 May/Jun;4(3):311-6. PMID: 15898286
23. Keck M, Zeyda M, Gollinger K, et al. Local anesthetics have a major impact on viability of preadipocytes and their differentiation into adipocytes. Plast Reconstr Surg. 2010 Nov;126(5):1500-5. PMID: 21042106 DOI: https://doi.org/10.1097/PRS.0b013e3181ef8beb
24. Ferreira LM, Borsanyi JP, Bemhain P, et al. Rat limb allotransplantation: Efficacy of subtherapeutic dose combination immunotherapy with cyclosporine and RS-61443. Rev Hosp São Paulo Esc Paul Med. 1995;6(1-2):15-9.
25. Kato H, Mineda K, Eto H, et al. Degeneration, regeneration, and cicatrization after fat grafting: dynamic total tissue remodeling during the first 3 months. Plast Reconstr Surg. 2014 Mar;133(3):303e-313e. PMID: 24572875
26. Galie M, Pignatti M, Scambi I, Sbarbati A, Rigotti G. Comparison of different centrifugation protocols for the best yield of adipose-derived stromal cells from lipoaspirates. Plast Reconstr Surg. 2008 Dec;122(6):233e-234e. PMID: 19050511 DOI: https://doi.org/10.1097/PRS.0b013e31818d2326
27. Rigotti G, Marchi A, Galie M, et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose- derived adult stem cells. Plast Reconstr Surg. 2007 Apr;119(5):1409-22;discussion:1423-4. DOI: https://doi.org/10.1097/01.prs.0000256047.47909.71
1. Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP,
Brasil.
Autor correspondente: Flavio Henrique Mendes Rua Claudio Manoel da Costa, Nº 65, Jardim Ariano, Lins, SP, Brasil. CEP: 16400-464. E-mail: mendesmd@fhmendes.com.br
Artigo submetido: 16/7/2019.
Artigo aceito: 2/8/2019.
Conflitos de interesse: não há.
Instituição: Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil.













 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter