INTRODUÇÃO
O linfedema é caracterizado pelo aumento do volume tecidual secundário ao acúmulo
de
líquido intersticial, devido à obstrução na drenagem pelo sistema linfático. Pode
estar associado a diversos sintomas como dor, desconforto, limitação da mobilidade
e
infecções recorrentes. Quanto as causas, é dividido em primário ou secundário1,2. Dentre as causas de linfedema secundário, uma das mais comuns é a
relacionada ao tratamento de neoplasias. Especificamente com relação ao câncer
de
mama, estudos de metanálise e revisão sistemática indicam que esta condição pode
ocorrer em até 5,6% dos pacientes submetidos à biopsia de linfonodo sentinela
e
19,9% daqueles submetidos à linfadenectomia3.
Tendo em vista que a incidência estimada de câncer de mama em mulheres brasileiras,
para o ano de 2018, é de 59.700 casos novos, e que a incidência geral estimada
de
linfedema em pacientes tratadas é aproximadamente 21,4%, pode-se esperar em torno
de
12.700 novos casos de linfedema2,4.
As modalidades de tratamento para o linfedema incluem intervenções cirúrgicas, como
lipoaspiração, transplante de linfonodos e anastomoses linfáticovenulares5,6. No entanto, a primeira linha de tratamento ainda é conservadora,
incluindo fisioterapia e drenagem linfática manual, que na maioria das vezes falha
em resolver os sintomas e melhorar a qualidade de vida do paciente7.
O transplante de linfonodos consiste na transferência de cadeias linfáticas
vascularizadas para locais afetados com o intuito de restaurar a drenagem linfática.
Seu mecanismo de ação exato ainda não foi definido, mas existem duas principais
teorias: os linfonodos transplantados produziriam fatores de crescimento locais,
estimulando a neolinfagiogênese; ou atuariam como “esponjas”, absorvendo o fluido
linfático intersticial e transferindo-o para a circulação sistêmica8.
OBJETIVO
O objetivo deste trabalho é demonstrar a técnica modificada de reconstrução mamária
tardia, utilizando os retalhos msTRAM e DIEP, com transplante de linfonodo da
região
inguinal e relatar a experiência do serviço de Cirurgia Plástica Reparadora do
Hospital Erasto Gaertner com o tratamento cirúrgico do linfedema de membro superior
através desta técnica.
MÉTODO
Foram incluídas no estudo pacientes do gênero feminino, com idade superior a 18 anos
e diagnóstico de linfedema de membro superior secundário ao tratamento do câncer
de
mama. O diagnóstico da dificuldade de drenagem linfática foi estabelecido como
uma
diferença maior que 2cm na circunferência dos membros superiores (medido 10cm
abaixo
da prega cubital), associado a sintomas como dor, sensação de peso ou fadiga
local.
Foram excluídos pacientes com infecção aguda, feridas abertas, trauma ou trombose
em
membro superior; neoplasia em atividade ou recorrente; em vigência de quimioterapia
ou radioterapia.
A funcionalidade dos vasos linfáticos foi avaliada por linfocintilografia antes da
cirurgia, injetando-se contraste entre o 1º e 2º dedos de ambas as mãos, e depois
foram tiradas imagens sequenciais do membro.
Os linfonodos responsáveis pela drenagem dos membros inferiores também foram
estudados através da linfocintilografia no dia anterior da cirurgia. A marcação
desses linfonodos permitiu, com auxílio GAMA PROBE (aparelho portátil composto
de
sonda de detecção e sistema de registro digital da radiação gama), sua identificação
e preservação durante a cirurgia evitando, assim, morbidade na área doadora.
Os linfonodos ilíacos superficiais, localizados em volta da veia ilíaca circunflexa
superficial, drenam principalmente a parede abdominal2 e, por isso, são a cadeia linfonodal de escolha para o
procedimento.
Técnica cirúrgica
O tipo de retalho (DIEP ou msTRAM) foi escolhido de acordo com a localização,
tamanho e número de perfurantes da parede abdominal, do lado contralateral da
reconstrução, tendo os vasos epigástricos inferiores como pedículo. A opção de
utilizar o hemiabdome contralateral se deve ao fato de que, ao girar o retalho
180º, o pedículo fica naturalmente orientado para porção medial do hemitórax
(próximo aos vasos receptores mamários internos) e a cadeia de linfonodos fica
na porção lateral superior, próximo à axila.
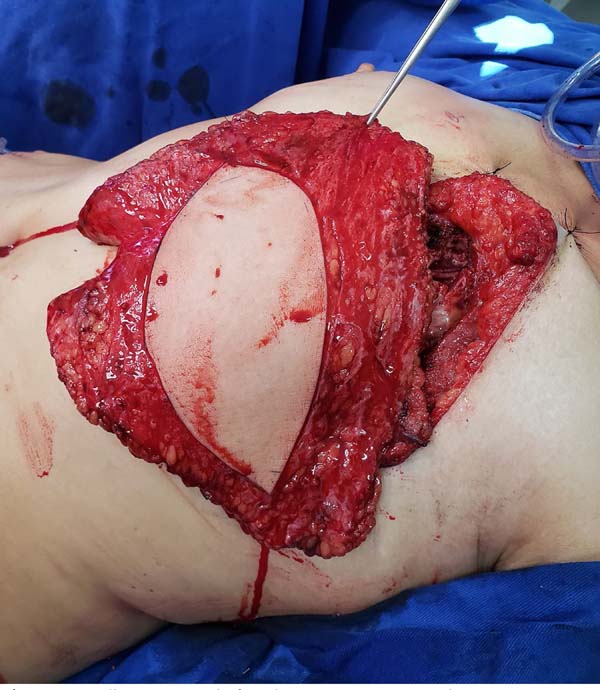
O retalho dermomuscular (DIEP ou msTRAM) foi dissecado e levantado em bloco
juntamente com a área doadora de linfonodos (região dos vasos ilíacos
circunflexos superficiais) (Figura 1). Para
a visualização dos linfonodos foi injetado o corante Azul Patente intradérmico
logo acima da crista ilíaca, e foram selecionados os linfonodos que absorviam
o
corante e não tinham ligações diretas com o membro inferior, ou seja, aqueles
que não captavam o radioisótopo pelo GAMA PROBE (dupla marcação) (Figura 2). Este procedimento tem como
objetivo principal evitar uma das mais temidas complicações dos transplantes
de
linfonodos: o linfedema da área doadora.
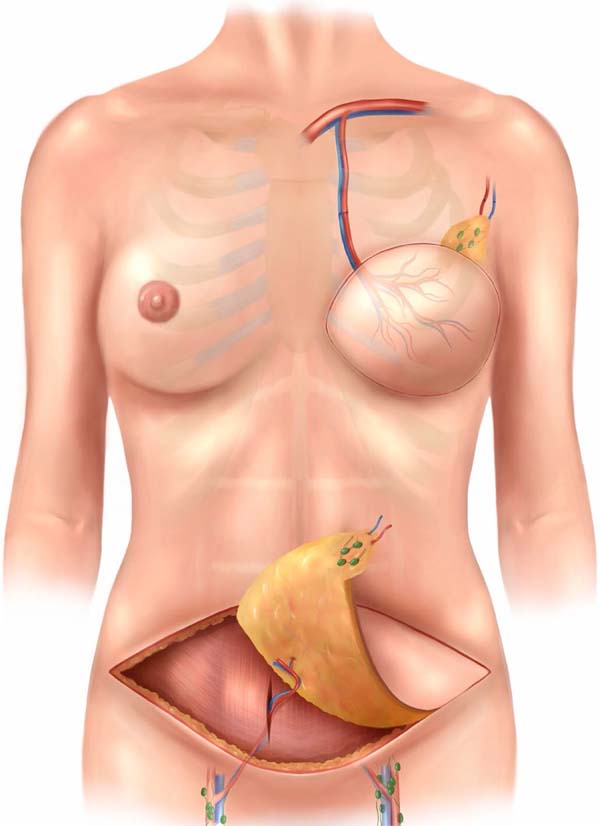
Figura 1 - Ilustração de retalho DIEP elevado junto aos linfonodos inguinais
do lado direito e seu posicionamento no área receptora após rotação
de 180o graus.
Figura 1 - Ilustração de retalho DIEP elevado junto aos linfonodos inguinais
do lado direito e seu posicionamento no área receptora após rotação
de 180o graus.
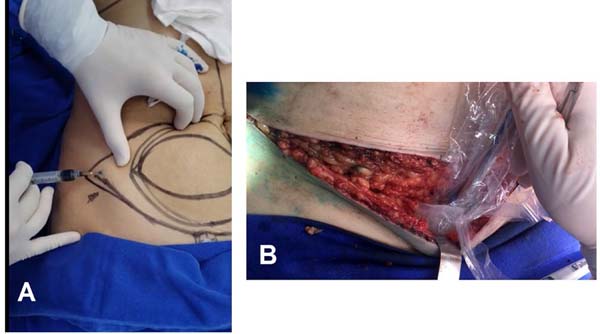
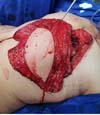
Figura 2 - A: Injeção intraoperatória de Azul Patente no retalho realizado
para identificar os linfonodos inguinais responsáveis pela drenagem
linfática local; B: Identificação intraoperatória dos linfonodos
inguinais profundos, responsáveis pela drenagem linfática do membro
inferior, utilizando GAMA PROBE. Este procedimento tem como objetivo
evitar o linfedema da área doadora.
Figura 2 - A: Injeção intraoperatória de Azul Patente no retalho realizado
para identificar os linfonodos inguinais responsáveis pela drenagem
linfática local; B: Identificação intraoperatória dos linfonodos
inguinais profundos, responsáveis pela drenagem linfática do membro
inferior, utilizando GAMA PROBE. Este procedimento tem como objetivo
evitar o linfedema da área doadora.
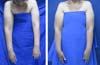
Na região receptora todo o tecido fibroso e avascular da cirurgia prévia foi
dissecado e ressecado, possibilitando a transferência do tecido sadio e com
capacidade de regeneração para a área. O vaso receptor do retalho livre foi a
artéria mamária interna (Figura 3). O uso
deste vaso tem várias vantagens, apresenta uma facilidade de manuseio, local
consistente, localização central, e adequada orientação do pedículo. Além disso,
sacrificar a artéria toracodorsal, que foi amplamente utilizada no surgimento
desta técnica, pode se tornar um problema se for necessária a realização do
retalho grande dorsal no futuro.
Figura 3 - Retalho DIEP com linfonodos inguinais posicionado na área
receptora. Em todos os casos os vasos receptores foram os vasos
mamários internos.
Figura 3 - Retalho DIEP com linfonodos inguinais posicionado na área
receptora. Em todos os casos os vasos receptores foram os vasos
mamários internos.
No pós-operatório as pacientes foram avaliadas através da aferição da
circunferência do membro superior afetado. A seguir os dados foram comparados
com as medidas no pré-operatório.
RESULTADOS
No período de junho de 2016 a fevereiro de 2019, cinco pacientes foram submetidas
à
reconstrução tardia de mama com retalho abdominal livre, associado à transferência
de cadeira linfonodal inguinal para o tratamento do linfedema no membro
superior.
Os dados referentes a idade, IMC pré-operatório, histórico de esvaziamento axilar,
radioterapia e tempo de linfedema estão listados na Tabela 1.
Tabela 1 - Dados referentes as idades das pacientes, IMC no momento da cirurgia,
tipo de tratamento prévio realizado e lateralidade de linfedema.
| |
Idade |
IMC (kg/m2) |
Esvaziamento Axilar |
Radioterapia Adjuvante |
Tempo de Linfedema |
Membro Afetado |
| J.P.P.B. |
41 anos |
27,9 |
Níveis I, II e III |
Sim |
2 anos |
Direito |
| M.A.R. |
51 anos |
24.7 |
Níveis I, II e III |
Sim |
2 anos |
Esquerdo |
| A.P.B. |
61 anos |
34.8 |
Níveis I, II e III |
Não |
4 anos |
Esquerdo |
| M.R.R. |
60 anos |
23.43 |
Níveis I, II e III |
Não |
6 anos |
Direito |
| R.A.G. |
57 anos |
31.2 |
Níveis I, II e III |
Sim |
4 anos |
Esquerdo |
Tabela 1 - Dados referentes as idades das pacientes, IMC no momento da cirurgia,
tipo de tratamento prévio realizado e lateralidade de linfedema.
Todas as pacientes obtiveram sucesso na transferência do retalho e apresentaram
diminuição da circunferência do membro afetado, assim como melhora dos sintomas
relacionados ao linfedema (Tabela 2 e Figura 4).
Tabela 2 - Resultados
| |
Cirunferência braço pré-operatório |
Cirunferência braço pós-operatório |
Redução percentual (%) |
| J.P.P.B. |
37 cm |
35,5 cm |
- 4,05% |
| M.A.R. |
30,5 cm |
26,5 cm |
- 13,1% |
| A.P.B. |
43 cm |
41,5 cm |
- 3,48% |
| M.R.R. |
35 cm |
32 cm |
- 8,6% |
| R.A.G |
35,5 cm |
32 cm |
- 9,85% |
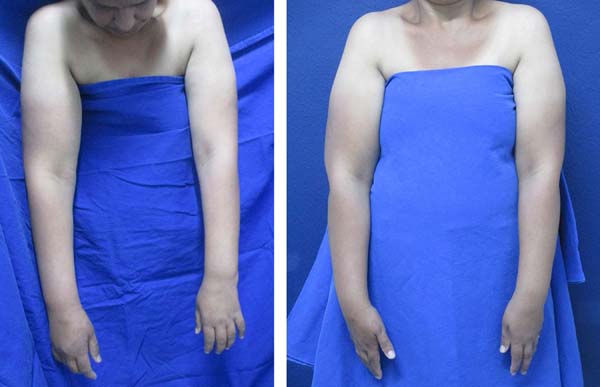
Figura 4 - Esquerda: Pré-operatório - Linfedema no membro superior direito;
Direita: Pós-operatório de 8 meses - Melhora dos sintomas e diminuição
da circunferência do membro superior direito.
Figura 4 - Esquerda: Pré-operatório - Linfedema no membro superior direito;
Direita: Pós-operatório de 8 meses - Melhora dos sintomas e diminuição
da circunferência do membro superior direito.
DISCUSSÃO
O mecanismo exato de ação do transplante de linfonodos ainda é obscuro. Algumas
evidências apontam para o aumento na produção local de fatores de crescimento
(principalmente o VEGF-C - fator de crescimento do endotélio vascular C) que
induziria a neolinfagiogênese, conectando os canais linfáticos obstruídos aos
linfonodos transplantados9. Este mecanismo
talvez explique o motivo deste tratamento parecer menos efetivo em pacientes com
linfedema de longa data, onde os vasos linfáticos do membro afetado não são
funcionais.
Outros autores encontraram evidências de que os próprios linfonodos podem absorver
o
fluido extracelular próximo e devolvê-lo para circulação sistêmica10. Tendo em mente este mecanismo, talvez
alguns pacientes com linfedema tenham maior benefício em receber o transplante
de
linfonodos nas extremidades dos membros afetados (como punho ou tornozelo), já
que é
nestes locais que ocorre maior acúmulo de líquido, pela ação da gravidade.
Outro ponto importante é como os linfonodos transplantados transferem o fluído
absorvido para a circulação sistêmica. Uma hipótese é que os linfáticos eferentes
do
retalho se conectem com o sistema linfático local. Outro possível mecanismo é
que o
líquido absorvido seja transferido diretamente para circulação sistêmica pelas
comunicações linfáticas venosas dentro do linfonodo11.
Mais estudos são necessários para compreender o mecanismo fisiológico para a melhora
do linfedema nestes pacientes. O mais provável é que todos estes mecanismos
propostos atuem simultaneamente, em maior ou menor grau, contribuindo para a melhora
dos sintomas.
Por se tratar de uma técnica relativamente recente, ainda existem poucos estudos
avaliando os resultados do transplante de linfonodos. Existem dois principais
indicadores avaliados: medidas de circunferência dos membros12 e medidas de qualidade de vida13. A vantagem de avaliar mudanças no volume dos membros é que
este é um dado objetivo e facilmente avaliado, mas nem sempre reflete uma melhora
nos sintomas. A avaliação da qualidade de vida é interessante, pois mesmo pacientes
sem uma grande redução nas medidas do membro, podem ter uma melhora significativa
nos sintomas.
Com relação a técnica descrita neste estudo, uma das principais vantagens é a
possibilidade de realizar a reconstrução da mama e o tratamento do linfedema em
um
único procedimento. Além disso, já está bem estabelecido na literatura que a
reconstrução de mama com retalho abdominal é o padrão ouro em termo de qualidade
de
vida14. Uma desvantagem é o risco de
linfedema da área receptora, e é por isso que a dupla marcação é importante, como
já
demonstrado em outros estudos15. Outra
desvantagem é o aumento do tempo cirúrgico, mas provavelmente esse aumento é pequeno
e não traz maiores consequências para os pacientes.
Um viés na avaliação destes pacientes pode ser devido à melhora dos sintomas do
linfedema apenas pela liberação das cicatrizes. Em um estudo avaliando a qualidade
de vida após transplante de linfonodos, foi descrito o caso de uma paciente que
sofreu a perda total do retalho, mas mesmo assim apresentou melhora nos sintomas
de
linfedema13. Outro viés importante é que
pode ser difícil separar a melhora da qualidade de vida pelo transplante de
linfonodos, da melhora causada pela reconstrução da mama.
Nesta casuística, não realizamos a anastomose dos vasos circunflexos ilíacos
superficiais ou epigástricos superficiais na axila, como descrito em outros estudos.
No intraoperatório, pudemos observar a viabilidade do retalho de linfonodos após
realizar apenas as anastomoses dos vasos epigástricos inferiores. Caso a viabilidade
seja duvidosa, seria prudente realizar estas anastomoses.
CONCLUSÃO
O transplante autólogo de linfonodos da região inguinal para a axila pode melhorar
a
drenagem linfática da área afetada, e é uma técnica segura para ser realizada
juntamente com a reconstrução microvascular de mama, utilizando retalhos
abdominais.
REFERÊNCIAS
1. Keeley V. Advances in understanding and management of lymphedema.
Curr Opin Support Palliat Care. 2017 Dec;11(4):355-360. DOI:
10.1097/SPC.0000000000000311 DOI:
https://doi.org/10.1097/SPC.0000000000000311
2. Warren AG, Brorson H, Borud LJ, Slavin SA. Lymphedema: a
comprehensive review. Ann Plast Surg. 2007 Oct;59(4):464-72. PMID: 17901744 DOI:
https://doi.org/10.1097/01.sap.0000257149.42922.7e
3. Disipio T, Rye S, Newman B, Hayes S. Incidence of unilateral arm
lymphedema after breast cancer: a systematic review and meta-analysis. Lancet
Oncol. 2013 May;14(6):500-15.
4. Ministério da Saúde (BR). Instituto Nacional de Câncer José Alencar
Gomes da Silva (INCA). Estimativa 2018 - Incidência de Câncer no Brasil. Rio
de
Janeiro (RJ): INCA; 2018; [acesso em 27 jul 2018]. Disponível em:
http://www.inca.gov.br/estimativa/2018/estimativa-2018.pdf
5. Leung N, Furniss D, Giele H. Modern surgical management of breast
cancer therapyrelated upper limb and breast lymphoedema. Maturitas. 2015
Apr;80(4):384-90. DOI:
https://doi.org/10.1016/j.maturitas.2015.01.012
6. Suami H, Chang DW. Overview of surgical treatments for breast
cancer-related lymphedema. Plast Reconstr Surg. 2010 Dec;126(6):1853-63. PMID:
21124127 DOI: https://doi.org/10.1097/PRS.0b013e3181f44658
7. Harris SR, Hugi MR, Olivotto IA, et al. Clinical practice guidelines
for the care and treatment of breast cancer: 11. Lymphedema. CMAJ. 2001
Jan;164(2):191-9. PMID: 11332311
8. Pappalardo M, Patel K, Cheng MH. Vascularized lymph node transfer
for treatment of extremity lymphedema: An overview of current controversies
regarding donor sites, recipient sites and outcomes. J Surg Oncol. 2018
Jun;117(7):1420-31. DOI: https://doi.org/10.1002/jso.25034
9. Saaristo AM, Niemi TS, Viitanen TP, Tervala TV, Hartiala P, Suominen
EA. Microvascular breast reconstruction and lymph node transfer for
postmastectomy lymphedema patients. Ann Surg. 2012 Mar;255(3):468-73. PMID:
22233832 DOI: https://doi.org/10.1097/SLA.0b013e3182426757
10. Cheng MH, Huang JJ, Wu CW, et al. The mechanism of vascularized
lymph node transfer for lymphedema: natural lymphaticovenous drainage. Plast
Reconstr Surg. 2014 Feb;133(2):192e-8e. PMID: 24469190 DOI:
https://doi.org/10.1097/01.prs.0000437257.78327.5b
11. Ito R, Suami H. Overview of lymph node transfer for lymphedema
treatment. Plast Reconstr Surg. 2014 Sep;134(3):548-56. PMID: 25158711 DOI:
https://doi.org/10.1097/PRS.0000000000000383
12. Tzou CH, Meng S, Ines T, et al. Surgical anatomy of the vascularized
submental lymph node flap: anatomic study of correlation of submental artery
perforators and quantity of submental lymph node. J Surg Oncol. 2017
Jan;115(1):54-9. DOI: https://doi.org/10.1002/jso.24336
13. Brucker B, Zeltzer A, Seidenstuecker K, et al. Breast cancer-related
lymphedema: quality of life after lymph node transfer. Plast Reconstr Surg. 2016
Jun;137(6):1673-80. PMID: 27219223
14. Atisha D, Alderman AK, Lowery JC, Kuhn LE, Davis J, Wilkins EG.
Prospective analysis of long-term psychosocial outcomes in breast
reconstruction: two-year postoperative results from the Michigan Breast
Reconstruction Outcomes Study. Ann Surg. 2008 Jun;247(6):1019-28. PMID: 18520230
DOI: https://doi.org/10.1097/SLA.0b013e3181728a5c
15. Dayan JH, Dayan E, Smith ML. Reverse lymphatic mapping: A new
technique for maximizing safety in vascularized lymph node transfer. Plast
Reconstr Surg. 2015 Jan;135(1):277-85. PMID: 25285683 DOI:
https://doi.org/10.1097/PRS.0000000000000822
1. Sociedade Brasileira de Cirurgia Plástica,
Brasil.
2. Hospital Erasto Gaertner, Jardim das Américas,
Curitiba, PR, Brasil.
3. Universidade Positivo, Industrial, Curitiba,
PR, Brasil.
4. Hospital Universitário Evangélico Mackenzie,
Bigorrilho, Curitiba, PR, Brasil.
Endereço Autor: Anne Karoline Groth, Rua Dr. Ovando
do Amaral, 201, Jardim das Américas, Curitiba, PR, Brasil. CEP
81520-060. E-mail: annegroth@gmail.com