

Original Article - Year 2019 - Volume 34 -
Reconstruções mamárias: estudo retrospectivo de 16 anos
Breast reconstructions: a 16-year retrospective study
RESUMO
Introdução: Câncer de mama é o segundo tipo mais comum de câncer entre mulheres no
Brasil. Estimam-se 59.700 casos novos de câncer de mama para o biênio
2018-2019. Reconstrução mamária é um procedimento seguro e vários
procedimentos cirúrgicos são descritos para sua realização: técnicas
conservadoras, retalhos de vizinhança, materiais aloplásticos, retalhos
miocutâneos pediculados e microcirúrgicos. O objetivo deste estudo foi
analisar os casos de reconstrução mamária pós-mastectomia por câncer de
mama, realizados em um período de 16 anos.
Métodos: Foi realizada revisão de prontuários de pacientes submetidas à reconstrução
mamária pós-mastectomia por câncer de mama, no período de janeiro de 2002 a
dezembro de 2017.
Resultados: No período analisado, 586 pacientes foram submetidas à reconstrução mamária.
Em 160 pacientes a reconstrução mamária foi realizada com retalho miocutâneo
do músculo retoabdominal (TRAM), 107 com técnicas conservadoras, 156 com
retalho miocutâneo do músculo grande dorsal (RGD), 113 com próteses e 50
secundárias. Previamente a outubro de 2007, a porcentagem de pacientes
submetidas a cirurgias bilaterais, somando-se TRAM e RGD, era de 30%, e a
partir desse período a porcentagem passou para 83,3%. Houve algum tipo de
complicação ou intercorrência em 203 (34,64%) pacientes operadas,
totalizando de 335 complicações. Grande maioria apresentou intercorrências
tratadas ambulatorialmente sem necessidade de reabordagem cirúrgica.
Conclusão: Houve aumento da incidência de cirurgias bilaterais, fato atribuído ao
aumento das mastectomias profiláticas na mama contralateral e aumento do
número de reconstruções utilizando RGD em comparação com o TRAM, bem como o
aumento significativo das reconstruções com implante de silicone.
Palavras-chave: Neoplasias da mama; Mama; Retalhos cirúrgicos; Implante mamário; Procedimentos cirúrgicos reconstrutivos
ABSTRACT
Introduction: Breast cancer is the second most common type of cancer among women in Brazil. An estimated 59,700 new cases of breast cancer were reported in the 2018-2019 biennium. Breast reconstruction is a safe procedure, and various surgical procedures have been described, including conservative techniques and use of neighborhood flaps, alloplastic materials, and pedicled and microsurgical myocutaneous flaps. The objective of this study was to analyze cases of breast reconstruction after mastectomy for breast cancer performed over a period of 16 years.
Methods: We reviewed the medical records of patients who underwent breast reconstruction after mastectomy for breast cancer between January 2002 and December 2017.
Results: Within the study period, 586 patients underwent breast reconstruction. Breast reconstruction was performed with a transverse rectus abdominis myocutaneous muscle (TRAM) flap in 160 patients, with conservative techniques in 107 patients, with a latissimus dorsi myocutaneous flap (LDMF) in 156 patients, with prostheses in 113 patients, and secondarily in 50 patients. Before October 2007, the proportion of patients who underwent bilateral surgeries with a TRAM flap and LDMF was 30%, and since then, the percentage has increased to 83.3%. One or more types of complications occurred in 203 patients (34.64%) who underwent surgery, with a total of 335 complications . Most outpatient complications did not require surgical reassessment.
Conclusion: The incidence of bilateral surgery increased, which is attributed to the increase in the number of prophylactic mastectomies in the contralateral breast and in the number of reconstructions using a LDMF compared with that using a TRAM flap. A significant increase in the number of reconstructions with silicone implants was also observed.
Keywords: Breast cancer; Breast; Surgical flap; Breast implant; Reconstructive surgical procedure
INTRODUÇÃO
De acordo com o Instituto Nacional do Câncer, o câncer de mama é o segundo tipo mais comum de câncer registrado entre mulheres no Brasil e no mundo - atrás apenas do câncer de pele não melanoma. Para o Brasil, estimam-se 59.700 casos novos de câncer de mama, para cada ano do biênio 2018-2019, com um risco estimado de 56,33 casos a cada 100 mil mulheres. A doença responde por cerca de 25,2% dos novos casos de câncer registrados no mundo1.
Múltiplos fatores estão envolvidos na etiologia do câncer de mama: idade da primeira menstruação menor do que 12 anos; menopausa após os 55 anos; mulheres que nunca engravidaram ou nunca tiveram filhos (nuliparidade); primeira gravidez após os 30 anos; uso de alguns anticoncepcionais e terapia de reposição hormonal (TRH) na menopausa, especialmente se por tempo prolongado; exposição à radiação ionizante; consumo de bebidas alcoólicas; dietas hipercalóricas; sedentarismo; e predisposição genética (pelas mutações em determinados genes transmitidos na herança genética familiar - principalmente por dois genes de alto risco, BRCA1 e BRCA2)1.
Em razão da sua elevada incidência, tal neoplasia torna-se uma das grandes preocupações, sobretudo pelos impactos psicológicos e sociais que acarretam para a saúde da mulher. Na tentativa de reduzir os sentimentos negativos desencadeados pela doença e pela mastectomia, melhorar a autoestima e suprir a falta da mama, muitas mulheres optam pela reconstrução cirúrgica. Trata-se de um procedimento seguro, que não aumenta o risco de recorrência nem interfere na detecção da doença, além de não levar ao atraso para terapias adjuvantes. Existem vários procedimentos cirúrgicos descritos para sua realização, com técnicas conservadoras, retalhos de vizinhança, materiais aloplásticos, retalhos miocutâneos pediculados e microcirúrgicos2,3.
Com o surgimento dos testes genéticos para BRCA1 e BRCA2 para estratificação de risco, a frequência de mastectomia profilática contralateral está aumentando consideravelmente em pacientes submetidas a mastectomia por câncer unilateral. Além dos testes genéticos, outros fatores podem contribuir para a realização da mastectomia profilática: alterações mamográficas múltiplas, lesões precursoras multicêntricas, dificuldade no rastreamento por apresentarem mamas densas, e a grande ansiedade das pacientes4.
OBJETIVO
O objetivo deste estudo foi analisar os casos de reconstrução mamária pós-mastectomia por câncer de mama, realizados em um período de 16 anos, na clínica privada do autor principal, identificando idade das pacientes, tipos de cirurgia realizados (técnica utilizada e bilateralidade), complicações, presença de fatores de risco para complicações, e evolução dos procedimentos ao longo do tempo.
MÉTODOS
Trata-se de um estudo observacional longitudinal retrospectivo por meio da revisão de prontuários das pacientes submetidas à reconstrução mamária pós-mastectomia por câncer de mama, no período de janeiro de 2002 a dezembro de 2017. Foram coletados os seguintes dados: idade, tipo de reconstrução mamária realizada (técnica utilizada e se unilateral ou bilateral) e complicações pós-operatórias. Nos prontuários das pacientes operadas a partir de outubro de 2007, também foram coletados dados referentes à presença de fatores de risco para complicações (comorbidades, tabagismo, obesidade e radioterapia).
Todas as cirurgias foram realizadas pelo mesmo cirurgião plástico em 5 hospitais localizados na cidade de Brasília (DF).
Este projeto de pesquisa seguiu os trâmites legais determinados pela Resolução 196/96 do Conselho Nacional de Saúde no que se refere à pesquisa envolvendo seres humanos e de acordo com os princípios da Declaração de Helsinque.
RESULTADOS
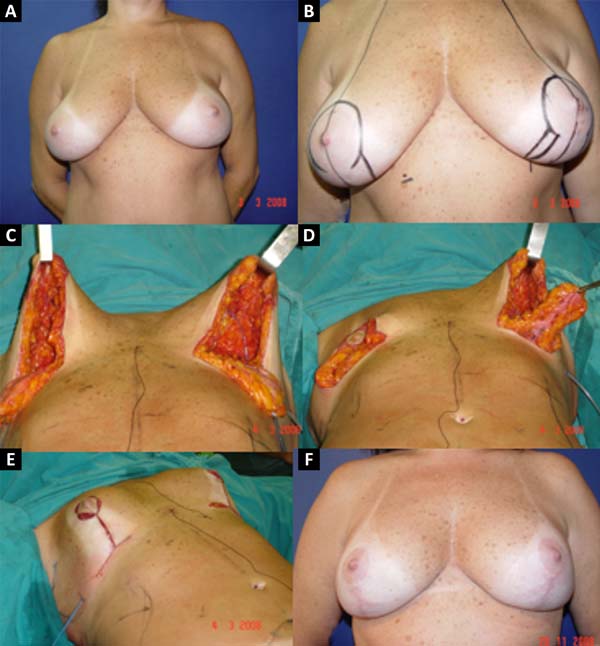
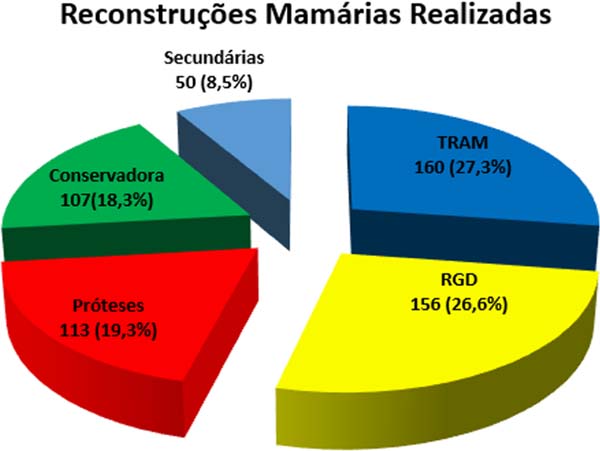
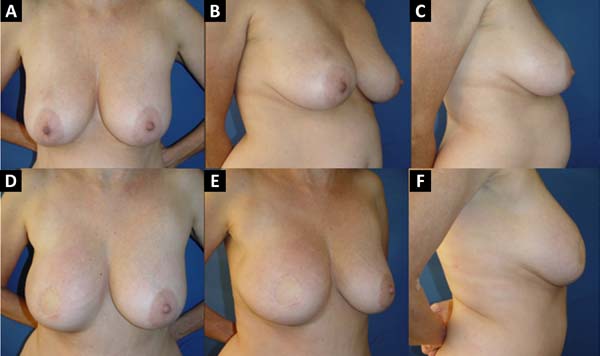
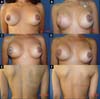
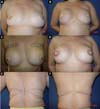
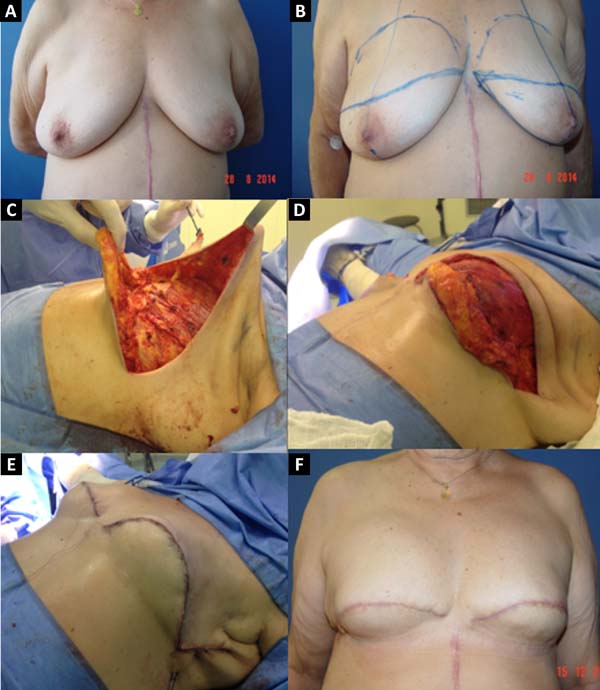
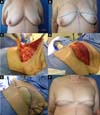
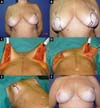
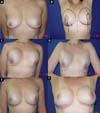
No período de janeiro de 2002 a dezembro de 2017, 586 pacientes mastectomizadas por câncer de mama foram submetidas à reconstrução mamária. A média de idade das pacientes foi de 54,37 anos, variando de 27 anos a 80 anos. Quanto ao tipo de reconstrução, em 160 pacientes a reconstrução mamária foi realizada com retalho miocutâneo do músculo reto abdominal (TRAM), 107 com técnicas conservadoras (retalhos locais e de vizinhança), 156 com retalho miocutâneo do músculo grande dorsal (RGD), 113 com próteses (sendo 16 com retalho de músculo peitoral maior estendido com retalho dermogorduroso de pedículo inferior e 41 com retalho retropeitoral superior e subcutâneo misto inferior cobrindo o implante) e 50 secundárias (aquelas que necessitaram de nova reconstrução em decorrência de falha do primeiro procedimento) (Figuras 1 a 8).
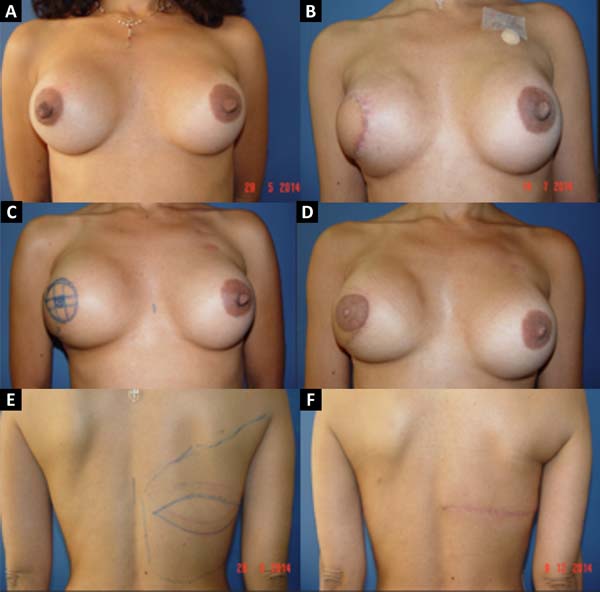
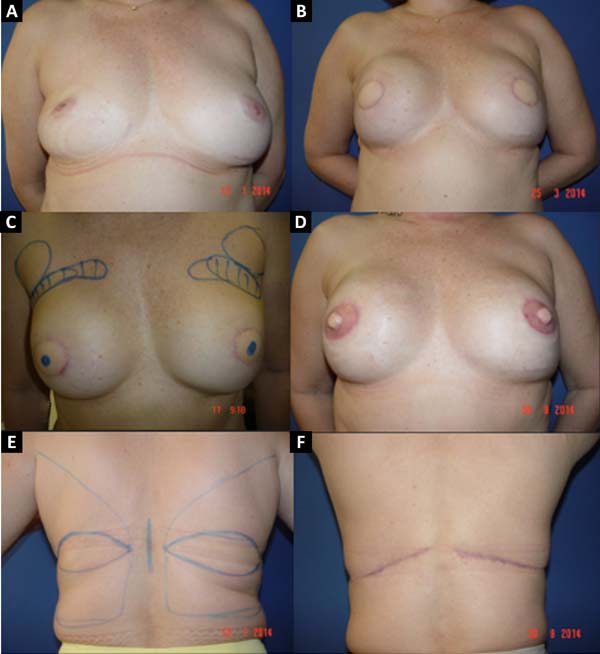
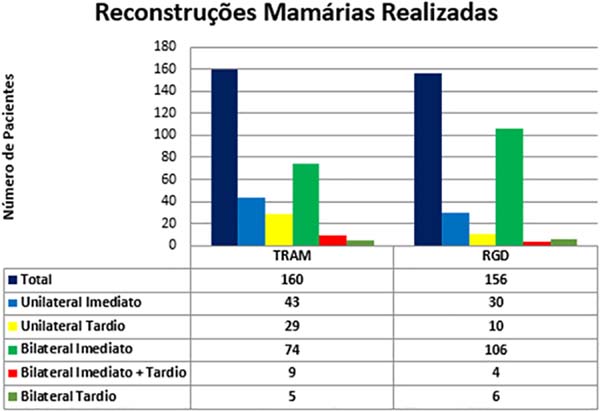
Dentre os procedimentos de TRAM realizados, em 72 pacientes foram unilaterais (43 imediatos e 29 tardios) e em 88 pacientes foram bilaterais (74 imediatos, 5 tardios, 9 imediatos de um lado e tardios de outro). Dentre os procedimentos de RGD realizados, em 40 pacientes foram unilaterais (30 imediatos e 10 tardios) e em 116 pacientes foram bilaterais (106 imediatos, 6 tardios, 4 imediatos de um lado e tardios de outro) (Figura 9).
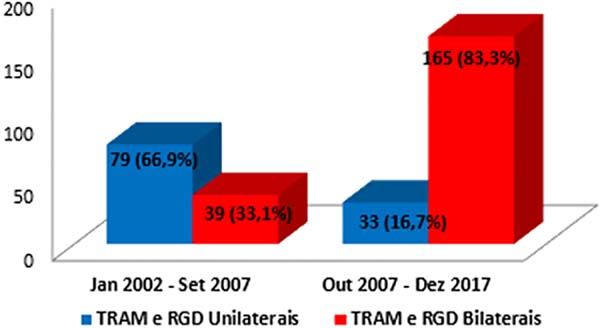
Previamente a outubro de 2007, a porcentagem de pacientes submetidos a cirurgias bilaterais, somando-se TRAM e RGD, era de 30%, e a partir desse período a porcentagem passou para 83,3% (Figura 10). De 2002 a 2006, em 32% dos pacientes, as reconstruções foram realizadas com TRAM e 12% com RGD; de 2007 a 2011, 25,73% com TRAM e 25,14% com RGD; e de 2012 a 2017, 16,45% com TRAM e 43,67% com RGD. No período total desse estudo, 64,55% dos pacientes submetidos à reconstrução com TRAM e com RGD foram bilaterais e 35,44%, unilaterais.
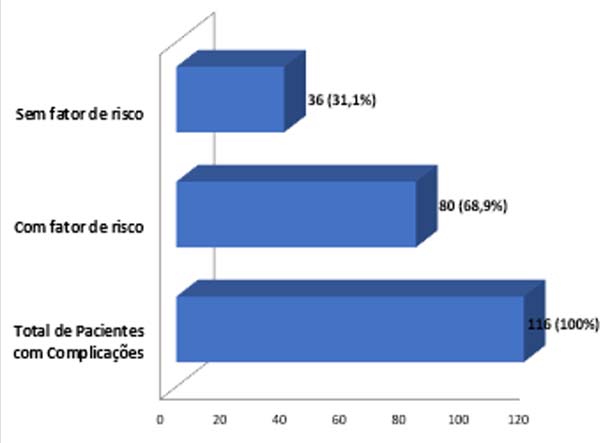
Houve algum tipo de complicação ou intercorrência em 203 (34,64%) pacientes operadas, totalizando de 335 complicações (Tabela 1), com uma paciente podendo apresentar mais de um tipo de intercorrência. A grande maioria apresentou intercorrências que tratadas ambulatorialmente sem necessidade de reabordagem cirúrgica. Analisando-se os fatores de risco nas últimas 293 pacientes operadas (a partir de outubro de 2007 até dezembro de 2017), 35 eram obesas (índice de massa corporal - IMC > 30kg/m2), 29 eram tabagistas, 32 haviam sido submetidas à radioterapia e 111 apresentavam comorbidades (diabetes, hipertensão arterial e hipotireoidismo). Nesse grupo, 116 (39,59%) pacientes apresentaram alguma complicação, das quais 80 (68,9%) possuíam pelo menos um fator de risco (Figura 11). Das 29 pacientes tabagistas, 58,62% apresentaram complicações.
| Complicações | n | % |
|---|---|---|
| Seroma | 84 | 25,07 |
| Necrose de pele remanescente da mama | 47 | 14,0 |
| Liponecrose | 37 | 11,0 |
| Deiscência | 33 | 9,85 |
| Necrose parcial do retalho | 31 | 9,25 |
| Hematoma | 20 | 5,97 |
| Infecção | 19 | 5,67 |
| Contratura capsular (incluindo radioterapia pós-operatória) | 18 | 5,40 |
| Necrose parcial do complexo areolopapilar (CAP) | 9 | 2,70 |
| Necrose de umbigo | 8 | 2,40 |
| Abaulamento abdominal | 8 | 2,40 |
| Síndrome de Mondor | 7 | 2,09 |
| Atelectasia | 5 | 1,50 |
| Tromboembolismo pulmonar | 3 | 0,90 |
| Assimetria | 2 | 0,60 |
| Trombose venosa profunda | 1 | 0,30 |
| Insuficiência renal aguda | 1 | 0,30 |
| Abdome agudo obstrutivo | 1 | 0,30 |
| Pneumonite | 1 | 0,30 |
| Total | 335 | 100 |
DISCUSSÃO
A reconstrução mamária é parte integral do tratamento do câncer de mama. Inúmeras técnicas estão disponíveis para reconstrução mamária e a seleção da melhor técnica é influenciada por diversos fatores relacionados ao tratamento oncológico como: o estadiamento, a necessidade de radioterapia, o tipo de mastectomia, a lateralidade (se unilateral ou bilateral); relacionados à paciente: IMC, comorbidades, presença de áreas doadoras para reconstrução autóloga, preferência, expectativa em relação ao resultado e estilo de vida5. A seleção da técnica a ser utilizada deve ser específica para a paciente em questão e de acordo com a experiência do cirurgião plástico.
Nos últimos 10 anos do período analisado, observou-se aumento da incidência de cirurgias bilaterais, apesar de a doença ser unilateral, em decorrência do interesse das pacientes em realizar cirurgia profilática contralateral. Com o surgimento dos testes genéticos para estratificação de risco, a frequência de mastectomia profilática contralateral vem aumentando de forma exponencial.
Além dos testes genéticos, outros fatores podem contribuir para a realização da mastectomia profilática: alterações mamográficas múltiplas, lesões precursoras multicêntricas, dificuldade no rastreamento por apresentarem mamas densas e a grande ansiedade das pacientes6.
No presente estudo, no período de 2002 a setembro de 2007, 30% dos TRAM e RGD foram bilaterais, e de outubro de 2007 até dezembro de 2017 essa taxa atingiu 83,33%. Estima-se que, a partir do momento do tratamento do câncer primário, mais de 10% das mulheres tratadas desenvolverão, subsequentemente, neoplasia na mama contralateral, podendo surgir até 30 anos após o tratamento inicial7.
A eficácia da mastectomia profilática depende da habilidade em remover a maior parte do tecido mamário, deixando o retalho com a espessura mínima viável. O desenvolvimento de câncer no tecido residual é relatado na literatura com incidência variando de 1% a 9%8. A eficácia da mastectomia profilática contralateral em pacientes tratadas de câncer de mama é estimada em 96%9. No estudo de Hartmann et al.6, a redução do risco de desenvolver câncer de mama, em pacientes submetidas à mastectomia profilática, foi próxima a 90%.
A reconstrução secundária, ou de resgate, definida como uma revisão completa de uma reconstrução prévia em caso de resultado insatisfatório ou falha da primeira cirurgia10, foi realizada em 50 pacientes. Chama atenção o fato de que em 88% desses casos foram utilizados os retalhos miocutâneos, TRAM e RGD, o que demonstra que esses retalhos são bem indicados nesses casos, por fornecerem tecido sadio e bem vascularizado a uma área manipulada previamente. Além disso, de acordo com números mostrados, com o passar dos anos, o RGD vem aumentando seu uso nas reconstruções em comparação ao TRAM.
O tratamento do câncer de mama era mutilante, com cirurgias amplas que retiravam grande quantidade de pele e até músculos, com isso, vem a importância da utilização do TRAM nas reconstruções que necessitam de um volume de tecido considerável para cobrir o defeito da mastectomia; desde que tenha tecido adiposo abdominal suficiente9.
Com o surgimento da mastectomia poupadora de pele, com o aumento de reconstruções imediatas, além da melhoria da qualidade dos implantes de silicone, vem diminuindo a incidência de reconstrução mamária com TRAM, que é uma cirurgia de maior morbidade e com desvantagens como hérnias e abaulamentos abdominais, e vêm aumentando as reconstruções com o GD e implantes diretos9.
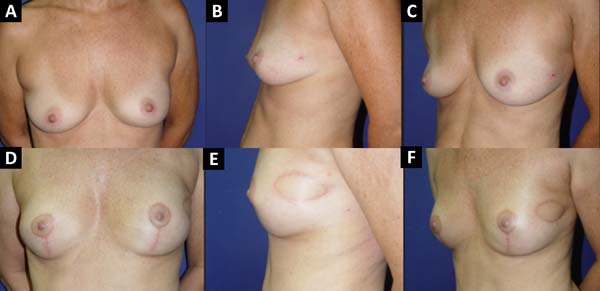
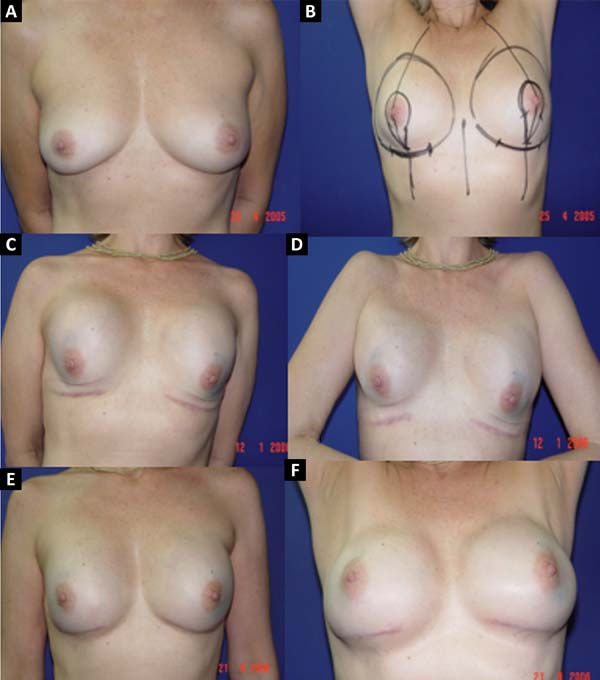
Das 586 pacientes submetidas à reconstrução mamária, em 16 (2,73%) delas foi utilizado o retalho de músculo peitoral maior estendido com retalho dermogorduroso de pedículo inferior cobrindo o implante de silicone. Este retalho é utilizado com o objetivo de alongar a loja submuscular. Este retalho só pode ser usado após análise conjunta com o mastologista, pois mantém uma pequena quantidade de tecido mamário dos quadrantes inferiores, e, tendo-se a concordância dele quanto à manutenção desse tecido, deve-se analisar a localização do tumor, a existência de microcalcificações ou outras afecções nessa região, bem como a viabilidade nutricional desse retalho.
A técnica descrita por Cosac et al.4 oferece uma adequada loja para a colocação do implante, sem tensão excessiva, com amenização da projeção nos polos superior e inferior, e menor tendência à migração cefálica do implante. Além disso, apresenta mínimo risco de extrusão da prótese, em casos de necrose ou deiscência, devido à interposição de tecido entre o implante e a pele. Além de excelente resultado estético, o retalho proposto não acarreta morbidade ao sítio doador, recuperação prolongada, fraqueza muscular nem o uso de enxertos, sendo uma alternativa em pacientes selecionadas4.
Em 41 (6,99%) pacientes submetidas à reconstrução mamária foi realizada uma loja para prótese com retalho retropeitoral superior e subcutâneo misto inferior. Esta técnica, descrita por Cosac et al.9, consiste na realização de uma incisão arqueada na mama, estendendo da extremidade lateral até a parte medial do sulco submamário. Toda a base inferior da pele da mama é mantida íntegra e o retalho dermogorduroso deve ter uma espessura mínima de 1,5 a 2cm. Após mastectomia, o cirurgião plástico confecciona o retalho do músculo peitoral maior, sendo que o implante, após sua inclusão, fica coberto por esse músculo em seus 2/3 superiores, e pelo retalho dermogorduroso em seu 1/3 inferior.
Esta técnica resulta em uma única cicatriz arqueada, levando a um aspecto menos estigmatizante. A recuperação das pacientes é rápida, com menor percepção de dor pós-operatória. Uma das grandes vantagens desta técnica é a presença de um retalho mais fino, sem tecido glandular, o que favorece uma maior segurança oncológica9.
A taxa de complicações verificada no presente estudo (34,64%) encontra-se de acordo com o reportado na literatura11. As complicações variam de 15% a 45%, de acordo com o tipo de cirurgia realizado, e aumentam com os fatores de risco (obesidade, tabagismo, comorbidades e radioterapia)4, fato observado neste estudo. Importante salientar que nem todas as complicações comprometem o resultado final ou exigem novas intervenções, como o seroma, responsável por 25,07% das complicações, que tem tratamento ambulatorial ou expectante, raramente implicando alguma complicação permanente.
A presença de tabagismo está associada ao aumento significativo das taxas de necrose dos retalhos, além de outras complicações11. No grupo das últimas 293 reconstruções estudadas, a taxa de complicações nas pacientes tabagistas foi de 58,62%, bem acima da taxa global de complicações de 33,41%.
CONCLUSÃO
A individualização do paciente é a chave para o sucesso da reconstrução mamária. Cada técnica reconstrutora tem suas indicações, vantagens e limitações, que devem ser amplamente discutidas como paciente visando o melhor resultado possível. A escolha da técnica também depende da experiência do cirurgião e de seu relacionamento com a equipe de mastologia. Ressaltamos a necessidade de uma equipe cirúrgica multidisciplinar, sintonizada, bem treinada e capacitada, cada qual em sua área de atuação, mas trabalhando de forma sinérgica para conseguir o melhor resultado cirúrgico possível.
Neste estudo, foi observada elevação da incidência de cirurgias bilaterais nos últimos anos, fato atribuído ao aumento das mastectomias profiláticas na mama contralateral, o que pode reduzir o risco da neoplasia e facilitar a simetrização mamária, implicando resultados mais harmônicos. Além disso, observamos nos últimos anos aumento do número de reconstruções utilizando o retalho miocutâneo do músculo grande dorsal em comparação com o retalho miocutâneo do músculo reto abdominal, bem como o aumento significativo das reconstruções com implante de silicone.
As técnicas empregadas na reconstrução mamária se mostram eficazes, são alternativas seguras, com taxas de complicação aceitáveis. A presença de fatores de risco, como obesidade, tabagismo, comorbidades e radioterapia, resultou em maior taxa de complicações, devendo o cirurgião estar atento a todos os detalhes, incluindo pré-operatório bem feito, indicação cirúrgica correta e acompanhamento pós-operatório rigoroso.
COLABORAÇÕES
|
OMC |
Análise e/ou interpretação dos dados, aprovação final do manuscrito, realização das operações e/ou experimentos. |
|
ACC |
Análise e/ou interpretação dos dados, coleta de dados, concepção e desenho do estudo, redação - revisão e edição. |
|
RCSD |
Análise e/ou interpretação dos dados. |
|
RSCC |
Análise e/ou interpretação dos dados. |
|
SVS |
Análise e/ou interpretação dos dados. |
|
AAD |
Análise e/ou interpretação dos dados. |
|
JPPCF |
Análise e/ou interpretação dos dados. |
|
JCD |
Aprovação final do manuscrito. |
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estimativa 2018: incidência de câncer no Brasil / Instituto Nacional de Câncer José Alencar Gomes da Silva. Coordenação de Prevenção e Vigilância. Rio de Janeiro: INCA; 2017.
2. Malata CM, McIntosh SA, Purushotham AD. Immediate breast reconstruction after mastectomy for cancer. Br J Surg. 2000;87(11):1455-72. DOI: https://doi.org/10.1046/j.1365-2168.2000.01593.x
3. Hu E, Alderman AK. Breast reconstruction. Surg Clin North Am. 2007;87(2):453-67. DOI: https://doi.org/10.1016/j.suc.2007.01.004
4. Cosac OM, Costa LA, Barros APGSH. Reconstrução mamária bilateral com retalhos pediculados. In: Melega JM, Viterbo F, Mendes FH, eds. Cirurgia plástica: os princípios e a atualidade. Rio de Janeiro: Guanabara Koogan; 2011. p. 732-42.
5. Nahabedian MY. Factors to consider in breast reconstruction. Womens Health (Lond). 2015;11(3):325-42. DOI: https://doi.org/10.2217/WHE.14.85
6. Hartmann LC, Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, et al. Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer. N Engl J Med. 1999;340(2):77-84. PMID: 9887158 DOI: https://doi.org/10.1056/NEJM199901143400201
7. Broët P, de la Rochefordière A, Scholl SM, Fourquet A, Mosseri V, Durand JC, et al. Contralateral breast cancer: annual incidence and risk parameters. J Clin Oncol. 1995;13(7):1578-83. PMID: 7602346 DOI: https://doi.org/10.1200/JCO.1995.13.7.1578
8. van Geel AN. Prophylactic mastectomy: the Rotterdam experience. Breast. 2003;12(6):357-61. DOI: https://doi.org/10.1016/S0960-9776(03)00136-X
9. Cosac OM, Ribeiro I, Moura LG, Soares DAS, Daher LMC, Galdino MCA, et al. Reconstrução mamária com loja de retalho retropeitoral superior e subcutâneo misto inferior. Rev Bras Cir Plást. 2018;33(2):166-73.
10. Tuttle TM, Jarosek S, Habermann EB, Arrington A, Abraham A, Morris TJ, et al. Increasing rates of contralateral prophylactic mastectomy among patients with ductal carcinoma in situ. J Clin Oncol. 2009;27(9):1362-7. DOI: https://doi.org/10.1200/JCO.2008.20.1681
11. Stucky CC, Gray RJ, Wasif N, Dueck AC, Pockaj BA. Increase in contralateral prophylactic mastectomy: echoes of a bygone era? Surgical trends for unilateral breast cancer. Ann Surg Oncol. 2010;17(Suppl 3):330-7. DOI: https://doi.org/10.1245/s10434-010-1259-x
1. Hospital das Forças Armadas, Brasília, DF,
Brasil.
2. Hospital Daher Lago Sul, Brasília, DF,
Brasil.
Autor correspondente: Ognev Meireles Cosac, SMDB Conjunto, 32, Lote 02, Casa A. Lago Sul, Brasilia, DF, Brasil. CEP 71680-320. E-mail: ognev@terra.com.br
Artigo submetido: 21/01/2019.
Artigo aceito: 10/02/2019.
Conflitos de interesse: não há.







 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter