

Articles - Year 2000 - Volume 15 -
Enxerto Autólogo de Epiderme Cultivada
Autologous Graft of Cultivated Epidermis
RESUMO
As técnicas atuais de cultura de tecidos permitem obter, a partir de um pequeno fragmento de pele, lâminas de queratinócitos cultivados para serem utilizados na cobertura de áreas cruentas. Essa população celular pode ser rapidamente expandida, atingindo, ao final de 30 dias, dimensão centenas de vezes maior do que a da biópsia inicial. Os autores analisam o método utilizado para a cultura de queratinócitos, as dificuldades encontradas, as aplicações atuais e as possibilidades futuras.
Palavras-chave: Cultura de pele; queratinócitos; cobertura de áreas cruentas
ABSTRACT
With the modern techniques of tissue culture, it is possible to obtain from a small fragment of skin, laminae of cultivated keratinocytes to be used for covering raw areas. This cellular population can be rapidly expanded, reachinq, at the end of 30 days, a dimension hundreds of times bigger than the original biopsy. The authors analyze the method used for the keratinocytes culture, the difficulties found, the present applications and future possibilities.
Keywords: Skin culture; keratinocytes; coverage of raw areas
A perda de substância cutânea é um problema que atormenta o cotidiano da Cirurgia Plástica. Estamos, constantemente, planejando e executando procedimentos com a finalidade de cobrir áreas cruentas, não só as de origem traumática, como as que nós mesmos produzimos após a retirada de lesões, mas também as áreas doadoras de enxertos e retalhos. O substituto ideal de pele, bom, barato e de grande disponibilidade, ainda não foi encontrado. Caminho promissor parece ser a cultura de células, pois o desenvolvimento tecnológico nessa área a evidencia como um procedimento eficaz, relativamente rápido e economicamente viável.
A obtenção de queratinócitos humanos, sob a forma de uma camada confluente, passível de ser usada como enxerto, foi descrita, inicialmente, por Green(1), em 1979. A partir desse trabalho pioneiro, têm sido introduzidos melhoramentos na técnica, bem como várias aplicações(2,3 e 4).
Em conjunto com o Banco de Células do Rio de Janeiro - PABCAM, situado no Hospital Universitário Clementino Fraga Filho, foi iniciado, em setembro de 1997, estudo clínico-laboratorial para sistematizar o cultivo, in vitro, de epiderme humana e possibilitar suas aplicações práticas. Essa técnica é utilizada em importantes centros médicos no mundo, mas ainda não é comum no Brasil.
A partir de biópsia cutânea, conseguem-se fragmentos de epiderme cultivada autóloga, que possibilitam a cobertura de áreas cruentas de extensão e etiologia diversas, como: queimaduras, úlceras crônicas, epidermólise bolhosa, áreas doadoras de enxertos cutâneos ou resultantes da ressecção de nevos gigantes, etc. Outra possível indicação é o tratamento de alguns casos de vitiligo, visto estarem os melanócitos presentes na cultura.
MATERIAL E MÉTODO
Fase clínica
No período de abril de 1998 a outubro de 1999, foram selecionados 19 pacientes portadores de nevos gigantes (4), tatuagens (5), vitiligo (5), ou que seriam submetidos à retirada de enxertos de pele parcial para cobertura de feridas complexas (5). Dez pacientes eram do sexo feminino e 9, do sexo masculino. A faixa etária variou de 8 meses a 72 anos.
Na primeira consulta avaliou-se a necessidade de cobertura cutânea imediata ou em seguida ao tratamento da lesão de base. De acordo com as Normas para Pesquisa em Seres Humanos, os pacientes foram esclarecidos sobre o procedimento e questionados quanto à sua aceitação. Estando eles de acordo, abriu-se prontuário na Instituição e procedeu-se à anamnese e ao exame físico, para o início do tratamento.
A biópsia foi feita sob anestesia local, em regime ambulatorial (15 pacientes), ou durante ato cirúrgico de outro procedimento, sob anestesia geral (4 pacientes), obtendo-se fragmentos com cerca de 2 cm2.
Esse material foi levado ao Banco de Células para ser cultivado, pelo período médio de 30 dias, durante o qual foram realizados os exames complementares e o preparo clínico do paciente.
Fase laboratorial
Empregou-se a técnica descrita, em 1981, por O'Connor(16), com algumas modificações. Os fragmentos cutâneos eram transportados para o laboratório em meio de cultura de Eagle, modificado por Dulbecco (DMEM) (Sigma Chemical Co., St. Louis, MO, USA), com 10% de soro fetal bovino (FBS) (Cultilab, Campinas, SP, Brasil) e 1µg/mL de anfotericina B (Eurofarma Laboratórios Ltda., São Paulo, SP, Brasil), sob refrigeração. Removia-se o máximo possível de derme, e os fragmentos contendo a epiderme eram fragmentados com uso de bisturi. Essa última porção era, a seguir, submetida a dissociação enzimática, com 0,3% de tripsima (Sigma) em solução salina balanceada sem sais de cálcio e magnésio (BSS-CMF), durante 18 a 20 horas, a 4º C, seguida de incubação em nova solução, durante 30 a 60 minutos a 37ºC, com agitação orbital. As células epidérmicas, agora separadas umas das outras, eram plaqueadas em garrafas de cultura (Nunc, Roskilde, Denmark), 6x106 células/ 75 cm2, contendo 3T3 (células embrionárias de camundongo) como camada alimentadora. A 3T3, obtida no Banco de Células do Rio de Janeiro, era previamente cultivada até atingir confluência, quando era tratada com 10µg/mL de Mitomicina C (Sigma), de forma a não mais proliferar (Figs. 1 e 2).
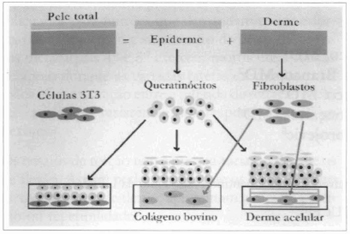
Fig. 1 - Esquema dos 3 tipos de procedimento empregados: utilizando a enzima dispase, a epiderme e a derme são dissociadas, obtendo-se queratinócitos, da primeira, e fibroblastos, da segunda. À esquerda, o esquema mostra queratinócitos semeados sobre uma camada alimentadora de células 3T3, evoluindo para multiplicação e discreta diferenciação. No centro, fibroblastos são semeados sobre gel de colágeno, formando nova matriz sobre a qual são semeados queratinócitos. À direita, derme acelular é povoada de fibroblastos e suporta o cultivo de queratinócitos.

Fig. 2 - As células epidérmicas são plaqueadas em garrafas contendo células embrionárias de camundongo (3T3) como camada alimentadora. O controle da evolução da cultura é feito, diariamente, pelo microscópio, até se observar confluência dos queratinócitos, o que ocorre após 20 a 40 dias.
As culturas eram mantidas por 20 a 40 dias em meio para queratinócitos: meio mínimo essencial, modificação D-valine, suplementado com 5 mg/L de insulina, 4mM de L-glutamina, 0,4 mg/mL de hidrocortisona, 10-10 M de toxina colérica, 5 mg/L de transferrina, 2x10-9M de T3, 10ng/mL de fator de crescimento epidérmico (todos da Sigma) e 20% de soro fetal bovino (Cultilab), a 37ºC e 5% de CO2. O crescimento celular era monitorado ao microscópio invertido com contraste de fase. O meio de cultura era trocado a cada 2 ou 3 dias. A confluência celular era atingida em período de 10 a 20 dias, dependendo da idade do paciente (Figs. 3 e 4). Após 4 a 7 dias em confluência, a camada epidérmica era descolada da garrafa, com o uso de 1,2U/mL de dispase em DMEM (Sigma), por 60 minutos a 37ºC. Tal camada era então lavada com solução salina balanceada (BSS), fixada sobre gaze embebida em petrolatum (Adapatic®), utilizando clipes cirúrgicos (Ligaclip - ambos da Johnson & Johnson Medical INC., São Paulo, Brasil), transportada ao centro cirúrgico em placas de Petri refrigeradas e utilizadas para enxertia (Figs. 5 e 6). O período entre o descolamento celular e a enxertia era de 4 horas (Fig. 7).
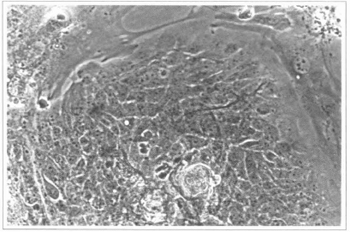
Fig. 3 - Cultura epidérmica (9º dia) - observam-se colônias de células epidérmicas tendo, ao redor, fibroblastos da camada alimentadora. Microscópio invertido 200x.
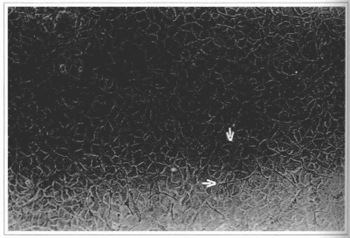
Fig. 4 - Cultura epidérmica (21º dia) - observa-se confluência celular e presença de melanócitos. Cultura pronta para descolamento. Microscópio invertido 100x.
Fig. 5 - Após 4 a 7 dias em confluência, a epiderme cultivada é descolada, enzimaticamente, da garrafa, com o uso de dispase.

Fig. 6 - A lâmina de epiderme cultivada é fixada sobre gaze embebida em petrolatum, utilizando-se clipes cirúrgicos.
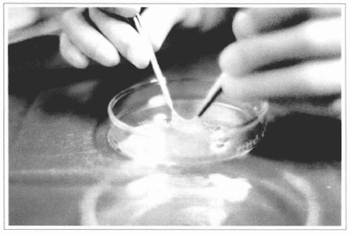
Fig. 7 - 0s conjuntos de gaze + epiderme são levados ao centro cirúrgico sob cuidados de assepsia e refrigeração. Nesta figura, a epiderme foi elevada de seu leito de gaze, para mostrar sua espessura.
Fase cirúrgica
Os enxertos foram aplicados diretamente sobre a área cruenta principal em 11 casos, ou como complemento ao método de cobertura dessa área em 6 casos (Figs. 8 e 9). O leito receptor foi preparado de acordo com a doença de base: com bisturi (4 casos), desepitelização com laser de CO2 (2 casos), abrasão com lixa d'água (3 casos), desepitelização com dermátomo elétrico (8 casos).
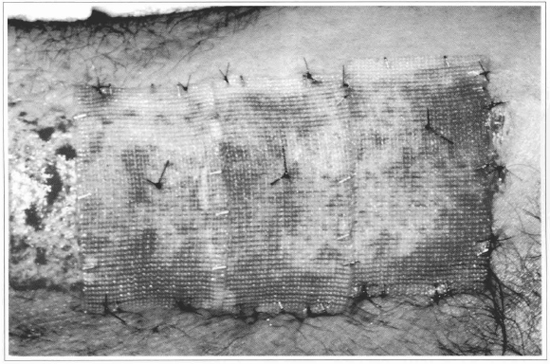
Fig. 8 - Os conjuntos gaze + epiderme são fixados sobre a área cruenta, sendo a gaze utilizada como apoio dos pontos de fixação. Neste caso, foi deixada uma faixa sem enxertia, para permitir a comparação com a integração da epiderme cultivada.

Fig. 9 - Após 10 dias, observa-se epitelização completa da área tratada, percebendo-se que a parte enxertada com a epiderme cultivada apresenta cobertura mais espessa do que a faixa que epitelizou sem enxertia. 0 limite entre as duas partes esta assinalado por dois pontos.
Por sua espessura muito delgada, os segmentos de pele cultivada eram enxertados presos à gaze com petrolatum, a qual servia como âncora dos pontos de fixação, de mononylon 5-0. Todo o conjunto era coberto com gaze vaselinada e curativo oclusivo-compressivo tipo Brown. O curativo era aberto após 5 a 7 dias, para avaliação, mantendo-se a área coberta com gazes fofas, durante pelo menos 14 dias.
RESULTADOS
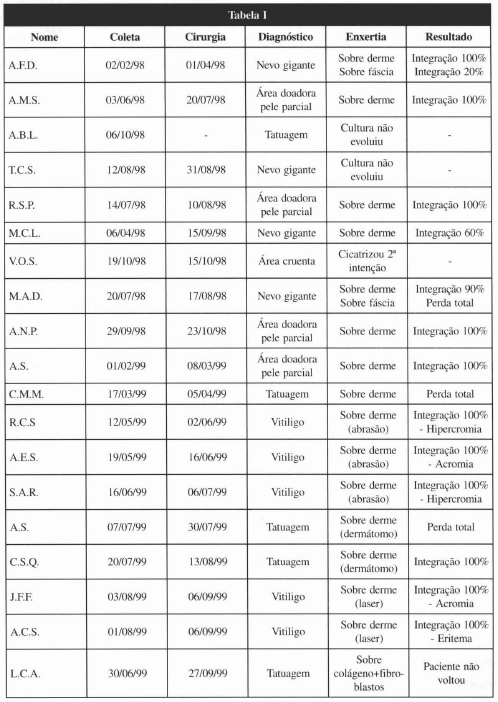
Dos 19 pacientes selecionados inicialmente, 1 abandonou o tratamento, 1 apresentou cicatrização por segunda intenção na área a ser tratada e, em 2, a cultura não evoluiu, ainda na fase laboratorial, aplicando-se outra técnica de reparação. Sendo assim, chegou-se ao total de 15 pacientes, com 16 áreas tratadas.
No pós-operatório, observou-se que 9 pacientes apresentaram integração total dos enxertos, 3 tiveram 60 a 90 % de integração e, em 2, não houve integração (Tabela I).
DISCUSSÃO
A cultura de células esbarra, de início, com os elevados custos da aparelhagem envolvida e do treinamento de pessoal. Esbarra ainda com segredos técnicos e problemas de patentes, pois grandes laboratórios têm atuado na produção industrial de substitutos cutâneos.
Sendo assim, embora as técnicas básicas possam ser encontradas em numerosas publicações, os pequenos detalhes de execução, fundamentais para a realização integral dos procedimentos, necessitam ser redescobertos, individualmente, pelos diferentes pesquisadores.
A essas dificuldades some-se, em nosso país, a constante falta de verbas, a dificuldade de contratar técnicos especializados e, eventualmente, até as tentativas, de outras instituições, de levarem, mediante propostas financeiras sedutoras, nossos poucos profissionais gabaritados, e teremos o panorama em que se desenvolvem as pesquisas universitárias.
Por outro lado, embora sofisticadas, as pesquisas sobre cultura de células são perfeitamente exeqüíveis e de interesse atual. Guardam, também, uma aura meio mágica, pois a capacidade de multiplicar, em laboratório, os seres vivos, em parte ou no todo, continua a ser vista como novidade, mesmo já tendo algumas décadas de observação. E, sobretudo, não são ainda procedimentos rotineiros, estando justificadas novas e variadas pesquisas.
Como não tínhamos experiência com a técnica, escolhemos casos em que o eventual insucesso do enxerto não trouxesse nenhum inconveniente além da pequena cicatriz na área de biópsia, ou seja:
1) Áreas doadoras de enxertos de pele parcial, onde a epitelização ocorreria normalmente, mesmo sem o enxerto de pele cultivada.
2) Nevos gigantes, cujo tratamento usual consistiria em ressecções múltiplas. Se o enxerto não integrasse, procederíamos à ressecção anteriormente planejada.
3) Vitiligo - as áreas receptoras eram preparadas mediante dermabrasão a lixa ou a laser. Se não houvesse integração da pele cultivada, haveria epitelização espontânea.
4) Tatuagens - a área tatuada poderia ser abrasada ou desepitelizada com dermátomo ou bisturi. A camada de células cultivadas aceleraria a epitelização e, também, contribuiria para disfarçar pigmentos residuais. Se não houvesse integração, a epitelização se faria espontaneamente.
A consulta inicial a diversos trabalhos publicados nos deu uma falsa idéia das possíveis aplicações da epiderme cultivada. O'Connor e cols.(6) (1981) publicaram a primeira aplicação clínica de queratinócitos cultivados, utilizados em 2 pacientes com queimaduras de 3º grau extensas. Testaram a enxertia sobre três tipos de leito receptor: granulação recente, granulação crônica e fáscia recém-desbridada. Referem integração satisfatória da epiderme cultivada nos 2 pacientes e nos 3 tipos de área cruenta. No entanto, relatam também que "os 2 pacientes foram extensamente enxertados com enxertos autólogos expandidos" e que, "após 3 a 4 semanas, a epiderme cultivada alcançou a pele expandida circundante", o que leva a crer que os enxertos foram colocados sobre os orifícios da pele expandida ou muito próximos a eles. Não há como garantir que a epiderme resultante era a cultivada ou provinha do crescimento das bordas da pele expandida.
Outros autores apresentaram sua experiência com epiderme cultivada em queimados, porém com resultados heterogêneos (7,8 e 9).
Gallico e cols.(10)(1989) utilizaram epiderme cultivada para cobrir áreas cruentas resultantes da retirada de nevos gigantes, em 8 crianças. As ressecções se estendiam até a fáscia, sobre a qual os enxertos eram colocados. Referem integração de 68%, em média, chegando a 84% em um caso.
Nossa experiência não corrobora esses resultados. Tentamos colocar segmentos de epiderme cultivada diretamente sobre áreas cruentas de vários tipos, porém concluímos que a epiderme não se integra a superfícies irregulares e onde não há derme. Consideramos igualmente duvidosa a possibilidade de auferir algum benefício na colocação de epiderme cultivada sobre áreas queimadas. Tivemos a comprovação desse fato nas tentativas de enxertar a epiderme sobre fáscias musculares, nos pacientes de nevos gigantes, após a ressecção dos tecidos comprometidos. Não houve integração e, seguramente, a superfície da fáscia é melhor área receptora do que superfícies queimadas (Figs. 10,11,12 e 13).
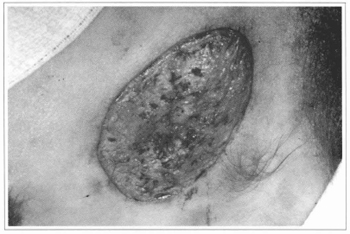
Fig. 10 - Ressecção de nevo preservando o leito dérmico, sobre o qual será enxertada a epiderme cultivada.
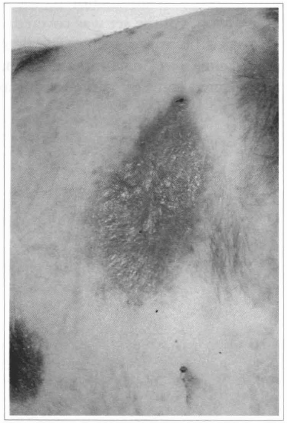
Fig. 11 - Dez dias após a enxertia da epiderme cultivada, observa-se epitelização completa.
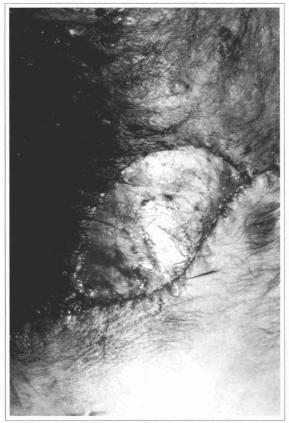
Fig. 12 - Ressecção de nevo com exposição da fáscia profunda sobre a qual será enxertada a epiderme.
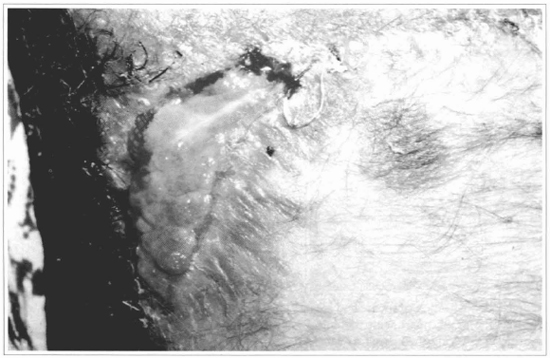
Fig. 13 - Após 15 dias, observa-se perda total do enxerto.
Acreditamos que a utilização da epiderme isolada deve se restringir a áreas cruentas que tenham derme na profundidade.
A questão sobre qual a vantagem em cobrir com epiderme cultivada áreas que epitelizarão espontaneamente, como as áreas doadoras de enxertos, pode ser respondida pelos próprios pacientes. Todo cirurgião plástico sabe que as áreas cruentas resultantes da retirada de enxertos de meia espessura são muito dolorosas e aderem aos curativos, dificultando sua retirada, além de produzirem secreção seroemática que determina mau odor local e constitui meio de cultura para bactérias. O desconforto da área doadora é sempre maior do que o da área da doença principal que motivou a retirada do enxerto. Isso dura pelo menos duas semanas, quando não há complicações.
A utilização da pele cultivada eliminou completamente a dor e as secreções, produzindo a epitelização completa das feridas em menos de 7 dias. Em todos os pacientes deixamos uma faixa de área cruenta, onde o enxerto não foi colocado. A inspeção externa do curativo evidenciava, sempre, umedecimento naquele local e o paciente especificava que a dor se restringia a ele.
Outra tentativa de utilização foi feita em pacientes portadores de vitiligo. Diversos trabalhos recomendam essa conduta, tendo em vista que, em meio aos queratinócitos, são cultivados alguns melanócitos(11,12)(Fig. 14). Em nossos 5 pacientes, preparamos as áreas receptoras com dermabrasão(3) ou com laser(2). A integração dos enxertos foi completa em todos os casos, em torno de 7 dias, e os pacientes foram orientados para as terapias dermatológicas usuais para essa doença. Entretanto, após 6 meses de observação, concluímos que os resultados são precários ou insuficientes, pois, ou a pigmentação não ocorre, ou é irregular, tanto em tonalidade quanto em distribuição. Consideramos, portanto, que para tais pacientes as técnicas utilizadas ainda devem ser aprimoradas (Figs. 15,16 e 17).
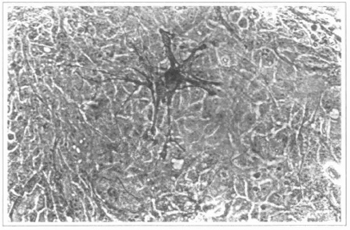
Fig. 14 - Cultura epidérmica (9º dia). Observa-se destaque de melanócito presente. Microscópio invertido 200x .
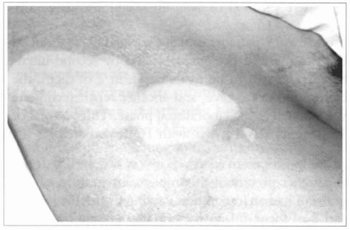
Fig. 15 - Área acrômica em paciente de vitiligo. Sobre esta área foi feita abrasão com lixa d'água e enxertada epiderme cultivada.
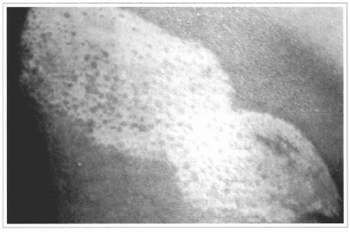
Fig. 16 - Aspecto do local, 4 meses após a enxertia, observando-se pigmentação esparsa e tênue.
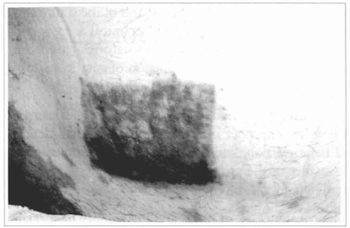
Fig. 17- Outra paciente de vitiligo na qual foi feita enxertia de epiderme cultivada, próximo aos pêlos pubianos, sobre área abrasada. Aspecto após 5 meses, observando-se hipercromia e distribuição irregular do pigmento.
A experiência adquirida com a cultura de queratinócitos indica que há necessidade de desenvolver suportes artificiais ou biógenos, substituindo a derme. Pesquisamos, no momento, duas formas de substituição dérmica: colágeno bovino e derme acelular humana, ambas contendo fibroblastos humanos (Figs. 18 e 19). Tais substitutos se prestariam tanto para cobertura provisória quanto para permanente. No primeiro caso, preparariam a área cruenta para posterior enxertia, minimizando a dor e as perdas hidroeletrolíticas. Poderiam, também, em associação com células epidérmicas, cultivadas em sua superfície ou aplicadas posteriormente, proporcionar cobertura definitiva da área cruenta. As duas possibilidades parecem promissoras e serão motivo de outros trabalhos.
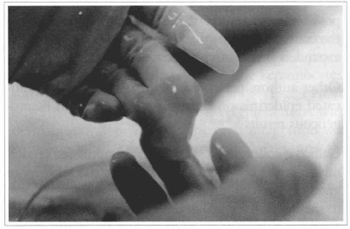
Fig. 18 - Preparado de colágeno bovino com fibroblastos, para ser utilizado como substituto dérmico.
Fig. 19 - Preparado de derme acelular.
CONCLUSÕES
a) O cultivo de queratinócitos é uma técnica viável, capaz de produzir grandes segmentos de tecido a partir de pequenas biópsias, em curtos espaços de tempo.
b) A integração das lâminas epiteliais cultivadas se faz muito bem sobre superfícies dérmicas, promovendo epitelização mais rápida e eliminando a dor e as secreções da ferida.
c) A epiderme cultivada não se integra sobre áreas cruentas desprovidas de derme.
d) O emprego de epiderme cultivada sobre áreas de vitiligo não resultou em pigmentação homogênea.
BIBLIOGRAFIA
1. GREEN H et al. Growth of cultured human epidermal cells into multiple ephitelia suitable for grafting. Proc. Natl. Acad. Sci. USA. 1979;76:5665-5668.
2. TSAI C et al. Clinical results of cultured epithelial cell grafting in the oral and maxillofacial region. J. Cranio-Maxillofacial Surg. 1997;25:4-8.
3. FAHMY FS et al. Skin graft storage and keratinocyte viability. British Journal of Plastic Surgery. 1993;46:292-295.
4. FALABELLA R, ESCOBAR C, BORRERO I. Treatment of refractory and stable vitiligo by transplantation of in vitro cultured epidermal autografts bearing melanocytes. J. Am. Acad. Dermatol. 1992;26:230-236.
5. GOBET R et al. Efficacy of cultured epithelial autografts in pediatric burns and reconstructive surgery. Surgery. 1997;121:655-661.
6. O'CONNOR NE, MULLIKEN JB, BANKS-SCHLEGEL S, KEHINDE O, GREEN H. Grafting of burns with cultured epithelium prepared from autologous epidermal cells. Lancet, 1981;1:75-78.
7. COLEMAN JIII, SIWY B.Cultured epidermal autografts: a life saving and skin saving technique in children. J. Pediatr. Surg. 1992;2:210-215.
8. McAREE K, KLEIN R, BOECKMAN C. The use of cultured ephitelial autografts in the wound care of severely burned patients. J. Pediatr. Surg. 1993;28:166-168.
9. BLIGHT A, MOUNTFORD E, CHESHIRE I, CLANCY J, LEVICK P. Treatment of full skin thickness burn injury using cultured ephitelial grafts. Burns. 1991;17:495-498.
10. GALLICO GGIII, O'CONNOR NE, COMPTON CC. Cultured epidermal autografts for giant congenital naevi. Plast. Reconstr. Surg. 1989;84:1-9.
11. OLSSON MJ, JUHLIN L. Transplantation of melanocytes in vitiligo. Br. J. Dermatol. 1995;132:587-591.
12. KAUFMANN R, GREINER D, KIPPENBERGER S, BERND A. Grafting of in vitro cultured melanocytes onto Laser-ablated lesions in vitiligo. Acta Derm. Venereol. 1998;78:136-138.
I. Chefe do Serviço de Cirurgia Plástica do Hospital Universitário Clementino Fraga Filho da UFRJ.
II. Biotecnóloga do Banco de Células do Rio de Janeiro (HUCFF).
III. Doutorando - HUCFF-UFRJ.
IV. Doutorando - HUCFF-UFRJ.
V. Diretor do Banco de Células do Rio de Janeiro - HUCFF.
Endereço para correspondência:
Talita Franco
Praia de Botafogo, 528 apto 1402-B
Rio de Janeiro - RJ - 22250-040
Fax: (21) 542-7119
e-mail: talita@openlink.com.br


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter