

35ª Jornada Sul Brasileira de Cirurgia Plástica - Year 2019 - Volume 34 - (Suppl.1)
Management of squamous cell carcinoma in a renal transplant patient with a fascial-cutaneous flap based on posterior tibial artery and use of total skin graft: case report
Manejo do carcinoma de células escamosas em paciente transplantado renal com retalho fáscio-cutâneo baseado na artéria tibial posterior e uso de enxerto de pele total: relato de caso
ABSTRACT
Introduction: The squamous cell carcinoma (SCC) is a common malignant cutaneous neoplasia that frequently appears as a hardened and elevated lesion with varying degrees of ulceration and crust. These types of lesions present as characteristic an unpleasant odor caused by the macerated keratin and by necrotic tissues with bacterial infection. The general recommendation is surgical management, but there are also protocols that use radiotherapy.
Method: This is a case report based on review of medical and photographic records, besides bibliographic review.
Conclusions: A fasciocutaneuos flap based on tibial posterior artery associated with skin graft is a good option for reconstruction of the upper leg after tumor resections.
Keywords: Carcinoma; Surgical flaps; Tibial arteries
RESUMO
Introdução: O carcinoma de células escamosas (CEC) é uma neoplasia cutânea maligna comum que frequentemente se apresenta como uma lesão endurecida, elevada, com graus variados de ulceração e crosta. Esses tipos de lesões apresentam como caraterística um odor desagradável causado pela queratina macerada e por tecidos necróticos com infecção bacteriana. A recomendação geral é o manejo cirúrgico, mas também existem protocolos de manejo que utilizam radioterapia, de acordo com o caso.
Método: Relato de caso baseado na revisão do prontuário e registros fotográficos, além de revisão bibliográfica.
Conclusão: retalho fáscio-cutâneo baseado na artéria tibial posterior associado com enxerto de pele total é uma boa opção para reconstrução da região superior da perna após ressecções tumorais.
Palavras-chave: Carcinoma; Retalhos cirúrgicos; Artérias da tíbia
INTRODUÇÃO
O carcinoma de células escamosas (CEC) é uma neoplasia cutânea maligna comum que frequentemente se apresenta como uma lesão endurecida, elevada com graus variados de ulceração e crosta. O CEC pode surgir em qualquer local, mas é mais comum em pele danificada, como nas lesões actínicas de pele, em cicatrizes pós-queimaduras (úlcera de Marjolin), cicatrizes traumáticas, úlceras de estase, dermatite crônica por radiação, lesões por lúpus eritematoso, líquen plano na mucosa oral e lesões infectadas pelo papilomavírus humano (HPV), ceratose seborreica, queratoacantoma e imunossupressão1.
Esses tipos de lesões apresentam como característica um odor desagradável causado pela queratina macerada e por tecidos necróticos com infecção bacteriana1.
O CEC é o segundo tumor de pele mais comum ao nível mundial, após o carcinoma basocelular (CBC).
Ao momento do diagnóstico, a maioria das lesões estão circunscritas à pele, no entanto algumas podem apresentar metástase regional ou à distância3.
Tumores que surgem em áreas não expostas ao sol e com diâmetro < 2 cm têm risco limitado de progressão. Pelo contrário, lesões acima de 2 cm diâmetro com espessura ≥ 4 mm com formas pobremente diferenciadas têm pior prognóstico e risco de metástase3-7. A recomendação geral é o manejo cirúrgico, mas também existem protocolos de manejo que utilizam radioterapia. Na raça negra, os cânceres de pele são, em sua maioria, CECs dos membros inferiores (70-85%). Pacientes imunossuprimidos por qualquer causa têm maior incidência de CEC, CBC, sarcoma de Kaposi, e o risco aumenta com a duração de imunossupressão2. Dentro dos cânceres de pele, 20% são CEC e, destes, 1-2% têm probabilidade de disseminação ganglionar2. O diagnóstico é clínico (tipo de pele, tempo de aparecimento, antecedentes pessoais e familiares, características das lesões) e por meio de biópsia2. A radioterapia deve ser considerada como tratamento nos casos de margens comprometidas, em situações de carcinomas localizados em áreas de difícil reparação estética ou em pacientes com limitações ao tratamento cirúrgico2. Nos casos que for diagnosticado o CEC, é importante a avaliação dos linfonodos regionais, em especial aqueles com maior risco de disseminação2. O tratamento cirúrgico deve ter margens de segurança de 3-4 mm em todas as suas margens e, se essas estiverem confirmadas como livres de neoplasia ao exame anatomopatológico, nenhum tratamento adicional será necessário2.
OBJETIVO
Apresentar um caso clínico de um paciente com lesão tumoral tipo CEC em perna direita com antecedente de transplante renal, imunossupressão e hepatite C, submetido à ressecção e reconstrução com emprego de retalho fáscio-cutâneo mais enxerto de pele total. A cirurgia foi realizada no serviço de cirurgia plástica do Hospital Universitário da Universidade Federal de Santa Catarina.
MÉTODO
Relato de caso baseado na revisão do prontuário e registros fotográficos, além de revisão bibliográfica.
Relato de caso
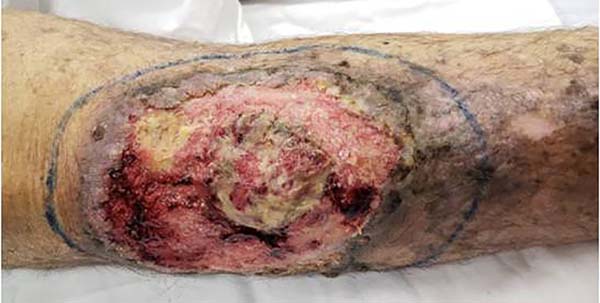
Paciente masculino, 67 anos de idade, natural de Florianópolis, Santa Catarina, com antecedente de transplante renal há 31 anos, terapia inmunossupresora com prednisona e azatioprina, hepatite C tratada com daclatasvir e sofosbuvir durante 2 anos, apresenta lesão tumoral há 9 meses com crescimento acelerado, de bordas irregulares, odor fétido, localizada no terço superior da perna direita. Diâmetro de lesão de 15 cm × 10 cm, com centro ulcerado e necrótico, com sangramento ocasional (Figura 1). Dor intensa associada, sem evidência clínica de linfonodos inguinais, pulsos normais, deambulação normal. Resultado anatomopatológico prévio à cirurgia reporta carcinoma de células escamosas invasivo, moderadamente diferenciado. O paciente foi submetido a ressecção total da lesão com margens de segurança de 1 cm e reconstrução com retalho fáscio-cutâneo e enxerto de pele total.
Técnica cirúrgica
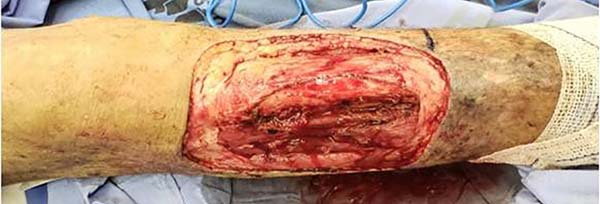
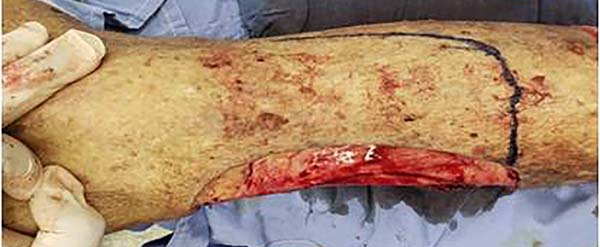
O paciente foi posicionado em decúbito dorsal, submetido à raquianestesia, antissepsia, assepsia e infiltração local com solução contendo adrenalina e soro fisiológico em relação 1:500.000. Foi realizada ressecção do CEC com margens de segurança, ampliação das margens cirúrgicas profundas da ressecção incluindo músculo e periósteo (Figura 2), e posteriormente foi feita marcação do retalho com base na descrição do retalho fáscio-cutâneo (Figura 3).
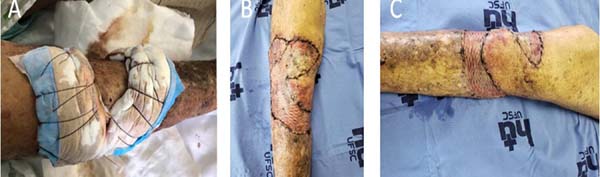
Procedeu-se à incisão e à dissecção do retalho fáscio-cutâneo na panturrilha direita para cobertura do defeito ósseo. Realizou-se cuidadosa hemostasia com bisturi elétrico e procedeu-se à fixação do retalho com pontos simples com PDS 3-0. Após, captou-se enxerto de pele no abdome inferior, que então recebeu preparo com aparelho skin graft mesher (Figura 4), e foi fixado à zona receptora com sutura com PDS 3-0 em pontos contínuos. Posteriormente, realizou-se curativo compressivo de Brown.
No pós-operatório imediato, o paciente apresentou piora da anemia crônica em função da perda sanguínea no procedimento cirúrgico, manejada com transfusão de uma unidade de concentrado de hemácias. Paciente recebeu tratamento antibiótico profilático com cefazolina 1 g e analgesia com dipirona, de forma pré-emptiva, e morfina, quando necessário. Exames séricos para avaliação da função renal e eletrólitos não sofreram mudanças significativas.
O procedimento ocorreu sem intercorrências, sem complicações e bem tolerado pelo paciente durante o pós-operatório. Não foram observados sofrimentos do retalho nem hematomas; retirou-se o curativo de Brown em 5 dias após cirurgia, com boa integração do enxerto (Figura 5). O paciente, durante as duas primeiras semanas de pós-operatório, passou a deambular com auxílio de muletas. O anatomopatológico evidenciou CEC invasivo com comprometimento profundo e com margens livres periféricas na mostra.
O paciente mantém acompanhamento no ambulatório de cirurgia plástica sem queixas, e é orientado a fazer hidratação da pele com AGE (óleo de girassol) três vezes ao dia e evitar exposição solar. Devido ao resultado anatomopatológico, o paciente foi encaminhado para radioterapia.
RESULTADO
Após reconstrução, paciente manteve os movimentos oculares e palpebrais, apresentando leve retração palpebral, mas sem presença de lagoftalmo. O aspecto estético ficou agradável e o paciente satisfeito com o resultado.
DISCUSSÃO
Os pacientes transplantados necessitam de terapia imunossupressora cronicamente, o que lhes acarreta uma maior incidência de manifestações oncológicas. Semelhantemente à população geral, a grande maioria dos tumores são de tipo CEC ou CBC, porém em risco aumentado em 100 vezes para CEC e 10 vezes para CBC4.
Precursores ou simuladores do CEC são, em particular, induzidos por diferentes causas, tais como lesões actínicas de pele, em cicatrizes pós-queimaduras (úlcera de Marjolin), cicatrizes traumáticas, úlceras de estase, dermatite crônica por radiação, lesões por lúpus eritematoso, líquen plano na mucosa oral e lesões infectadas por HPV, ceratose seborreica, queratoacantoma e imunossupressão1.
No CEC, se o exame revelar margens exíguas, deve-se realizar uma ampliação ou discutir o tratamento complementar com radioterapia, tanto em situações de carcinomas localizados em áreas de difícil reparação estética como em paciente com limitações ao tratamento cirúrgico2.
Como conceito geral, os retalhos fáscio-cutâneos são compostos por porções variadas de pele e seus anexos, além de tecido subcutâneo acompanhado de segmentos da fáscia muscular adjacente. Seu importante papel na reparação de grades feridas deve-se ao fato de incorporar tecido profundo e possibilidade de utilização de vasos fáscio-musculares como pedículos (aumentando a irrigação e vitalidade do retalho), como, nesse caso, o uso da artéria tibial posterior para nutrição do retalho.
Outra grande vantagem desse tipo de retalho foi a utilização de uma estrutura vascularizada e extremadamente resistente como é a fáscia muscular, incrementando segurança e resistência à cobertura de estruturas nobres.
CONCLUSÃO
A técnica proposta pelos autores, por ser de fácil e rápida execução e possuir baixo risco de complicações intraoperatórias, é uma boa alternativa para esse tipo de caso de pacientes com exposição óssea após ressecção tumoral em região superior da perna, além de oferecer resultado estético aceitável e manter margens oncológicas seguras.
REFERÊNCIAS
1. Rei Ogawa, Tumores não melanocíticos benignos e malignos da pele e de partes moles, Peter C. Neligan. Principios de Cirurgia plástica. 3 ed, Nova Iorque: Elsevier. 2017; p. 1903-6.
2. Machado DP, Dunshee I. Neoplasias da Pele, Capítulo 25, Mélega, Cirurgia Plástica Os Principios e Actualidade. 1 ed. Rio de Janeiro, Guanabara Koogan; 2011. p. 169-72.
3. Ribero S, Osella Abate S. Squamocellular Carcinoma of the Skin: Clinicopathological Features Predicting the Involvement of the Surgical Margins and Review of the Literature. Dermatology. 2016; 232:279-84. PMID: 27028227 DOI: https://doi.org/10.1159/000444051
4. Mendez BM, Thornton JF. Current Basal and Squamous Cell Skin Cancer Management. Am Soc Plast Surg. 2018; 142:373.
5. Piérard GE, Piérard-FranChimont C. La Cancérogenèse Dans La Peau De Patients Transplantés Rénaux. Rev Med Liege. 2017; 72(3):146-50.
6. Maloney F, Comber H, O'Lorcain P, et al. A population based study of skin cancers in renal transplant recipients. Br J Dermatol. 2006; 154:498-504.
7. Dharnidharka VR, Naik AS, Axelrod D, et al. Clinical and economic consequences of early cancer after kidney transplantation in contemporary practice. Transplantation; 2016.
1. Universidade Federal de Santa Catarina,
Florianópolis, SC, Brasil.;
Endereço Autor: Guilherme Luiz Pacher Schmitz Rua José Joao Martendal, nº 385 - Carvoeira, Florianopolis, SC, Brasil CEP 88040-420 E-mail: guilhermelpschmitz@icloud.com








 Read in Portuguese
Read in Portuguese
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter