

Ideas and Innovation - Year 2018 - Volume 33 -
Avaliação histológica do músculo grande dorsal submetido à expansão tecidual pós-infiltração com toxina botulínica: estudo experimental em ratas
Histological evaluation of latissimus dorsi muscle subjected to tissue expansion after infiltration with botulinum toxin: an experimental study in rats
RESUMO
Os autores descrevem as alterações histológicas no músculo grande dorsal submetido à expansão após relaxamento com toxina botulínica e as possíveis correlações dos achados com os benefícios práticos como, por exemplo, aumento da complacência muscular e melhor acomodação da prótese. Foi empregado o modelo experimental, com dez ratas com peso médio de 300 g, mesma faixa etária, da cepa Wistar (Rattus norvegicus) e o músculo grande dorsal. Biópsias musculares foram feitas antes e após as expansões, no músculo normal, no grupo controle (apenas com expansores) e no grupo com expansores e toxina botulínica. Expansores de 3 centímetros cúbicos eram posicionados abaixo do músculo e expandidos com 0,3 mililitros de soro fisiológico semanalmente, por 10 semanas. Os cortes histológicos foram corados segundo as técnicas de Hematoxilina-eosina, para avaliação geral, e tricrômio de Masson para avaliação do tecido conjuntivo. As fibras musculares submetidas à expansão sob a ação da toxina botulínica apresentaram focos de fibrose e proliferação de vasos sanguíneos menos intensos que no grupo sem toxina botulínica e a diminuição do número de fibras musculares e a atrofia eram menores que no grupo que não utilizou a toxina. Os achados nos permitem presumir que a expansão muscular associada ao relaxamento com toxina botulínica preserva as características da musculatura esquelética, oferecendo melhor acomodação e proteção da prótese e facilitando a dinâmica da expansão, além de diminuir a dor.
Palavras-chave: Dispositivos para expansão de tecidos; Toxinas botulínicas; Histologia
ABSTRACT
The authors describe histological changes in the latissimus dorsi muscle submitted to expansion after relaxation with botulinum toxin. The possible practical benefits include increased muscle compliance and better accommodation of a prosthesis. The experimental model involved 10 Wistar rats (Rattus norvegicus) of the same age, with average weight of 300 g. Muscle biopsies before and after expansion were performed in normal muscle, in a control group (with expanders alone), and in a group with expanders and botulinum toxin. Expanders measuring 3 cm3 were positioned below the muscle and expanded with 0.3 ml of saline weekly, for 10 weeks. Histological sections were stained using hematoxylin-eosin for general evaluation and Masson's trichrome for evaluation of connective tissue. The muscle fibers submitted to expansion under the action of botulinum toxin showed less fibrosis and less intense proliferation of blood vessels than in the group without botulinum toxin, and the atrophy and reduction in the number of muscle fibers were less prominent than in the group that did not receive botulinum toxin. The findings suggest that muscle expansion associated with botulinum toxin relaxation preserves skeletal muscle characteristics by providing better accommodation and protection for a prosthesis and facilitating expansion dynamics; this method may also reduce pain.
Keywords: Tissue expansion devices; Botulinum toxin; Histology
INTRODUÇÃO
A expansão tecidual é muito usada em cirurgia plástica e utiliza as propriedades biomecânicas dos tecidos submetidos à tensão progressiva1.
A expansão natural ocorre durante a fase de crescimento físico, no aumento das mamas na puberdade e na gestação, demonstrando adaptação rápida à expansão fisiológica2.
O processo de expansão pode ser utilizado em lesões maiores ou em áreas com distensibilidade pequena, permitindo reparar grandes perdas teciduais de origem congênita ou adquirida por traumas ou tumores, por exemplo3-5.
Uma das principais queixas da expansão muscular progressiva é a dor, provavelmente secundária ao espasmo muscular induzido pela hipóxia. Atenuação ou ausência da dor em casos em que há uma denervação cirúrgica eletiva ou traumática de um determinado músculo que será expandido é descrita, por exemplo, em casos de reconstrução mamária com próteses expansíveis6,7. Além disso, no músculo expandido para reconstrução mamária com prótese, há redução da dor após o relaxamento com toxina botulínica7,8.
Após a expansão, há um ganho na complacência muscular, contribuindo para a diminuição da tensão na sutura. As alterações histológicas descritas são hipertrofia muscular, alteração no formato da fibra e na posição nuclear, aumento e alterações nos vasos sanguíneos. Essas alterações não são vistas na expansão muscular aguda realizada no intraoperatório por causa do tempo excessivamente curto para estimular crescimento muscular permanente4.
OBJETIVO
Descrever as alterações histológicas no músculo grande dorsal submetido à expansão após relaxamento com toxina botulínica.
MÉTODO
Trata-se de estudo piloto de projeto de pesquisa aprovado pelo Comitê de Ética no Uso de Animais (CEUA) da Instituição. Seguimos as recomendações do CEUA buscando atender aos princípios dos 3R (reduction, refinement and replacement), sendo utilizada amostragem de conveniência.
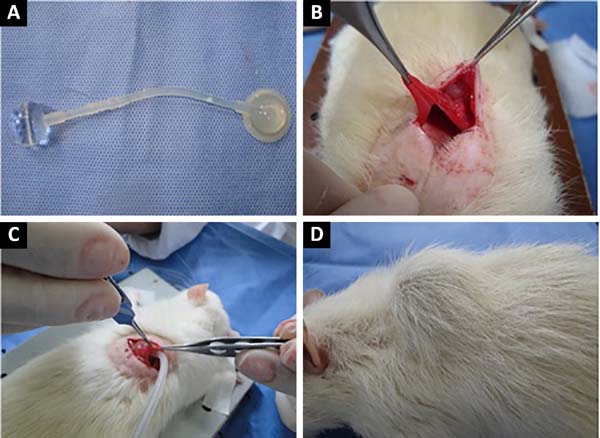
Foram utilizadas dez ratas com peso médio de 300 g, com cerca de 6 meses da cepa Wistar (Rattus norvegicus). O músculo utilizado para a expansão foi o grande dorsal, por ser de fácil abordagem, delgado, com evidente plano de clivagem e base óssea subjacente. Para a expansão muscular, foram utilizados expansores de órbita de seres humanos com 1,7 cm de diâmetro, 3 ml de volume, lisos, com duas válvulas, esterilizados com óxido de etileno, registrados na Agência Nacional de Vigilância Sanitária (ANVISA) (Figura 1A).
Foi aplicada a toxina botulínica tipo A, na forma liofilizada em frasco com 100UI, diluída em 4 ml de solução fisiológica a 0,9%, de forma a obter 25UI/ml, na dose de 1UI por cm2 de músculo, em única dose, antes de iniciar a expansão. Para a aplicação, foram utilizadas seringas e agulhas de insulina de 1 ml/cc e infiltrados dois traços de referência da seringa.
Cinco animais foram submetidos à expansão do músculo grande dorsal sem aplicação da toxina botulínica e cinco com aplicação prévia de toxina botulínica.
Após a incisão e identificação do músculo grande dorsal, foi realizada dissecção romba submuscular para confeccionar uma loja na qual se colocava o expansor (Figura 1B). A válvula conectada ao expansor foi posicionada no subcutâneo, para facilitar a identificação nas futuras punções. Amostras do músculo foram coletadas para avaliação histológica antes da expansão e ao final da mesma. Foram feitas dez expansões, com intervalo de sete dias e injetado o equivalente a 0,3 ml em cada aplicação.
Para a introdução do expansor, os animais eram anestesiados com cloridrato de xilazina 2% na dosagem de 5mg/kg, em uma concentração de 9,1mg/ml (peso x dosagem x 1/concentração), associada a ketamina na dosagem de 50mg/kg, intraperitoneal (Figura 1C).
Imediatamente após o posicionamento do expansor, foi injetado 10% de sua capacidade com soro fisiológico tingido com azul de metileno para acompanhamento de possíveis extravasamentos. Após a expansão completa (Figura 1D), foram coletadas amostras do músculo para a análise histológica e estas imediatamente fixadas em formol tamponado a 4%. Posteriormente, o material foi processado, incluído em parafina e submetido à microtomia (cortes histológicos com cerca de 4µm de espessura). Os cortes histológicos foram corados segundo as técnicas de Hematoxilina-eosina (HE), para avaliação geral, e tricrômio de Masson (TM) para avaliação do tecido conjuntivo.
As lâminas foram analisadas em microscópio de luz comum por dois observadores simultaneamente. Nas lâminas coradas pelo HE, avaliou-se a presença de atrofia muscular, mudança na posição e no tamanho do núcleo das células musculares, presença de inflamação, alteração na quantidade de vasos sanguíneos e presença de depósitos, comparando-se com a biópsia pré-expansão nos grupos com e sem relaxamento prévio com a toxina botulínica.
Nas lâminas coradas pelo TM, avaliou-se a quantidade de tecido conjuntivo, corado em azul, entre as fibras musculares, coradas em vermelho. O estudo foi analisado considerando-se apenas variáveis categóricas, visto que, devido ao tamanho da amostra, não é possível identificar diferença estatística entre os grupos.
RESULTADOS
As fibras musculares biopsiadas antes da expansão nos animais dos grupos com e sem relaxamento com a toxina botulínica foram consideradas como músculo normal e utilizadas como controle.
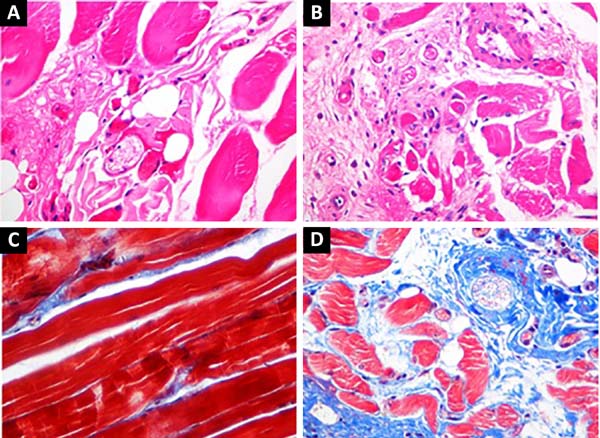
Ao avaliar os animais submetidos à expansão sem a toxina botulínica, observou-se focos de fibrose, com aumento do tecido conjuntivo entre as fibras musculares e entre os fascículos musculares, mais intensa que no grupo com relaxamento com a toxina botulínica em todos os casos.
Além disso, havia maior aumento no número de vasos sanguíneos, atrofia do músculo esquelético e consequente centralização dos núcleos destas células e maior escassez de músculo. O grupo sem aplicação da toxina botulínica exibia ainda focos de hemorragia antiga e leve infiltrado inflamatório inespecífico de linfócitos e plasmócitos em todos os casos, não vistos no grupo com toxina botulínica (Figura 2).
DISCUSSÃO
Acredita-se que a maior fibrose nos animais submetidos à expansão muscular esquelética decorra provavelmente da isquemia do tecido pela expansão e consequente distensão e compressão dos vasos sanguíneos. Posteriormente, seriam liberadas citocinas que induziriam a proliferação vascular encontrada9.
Quando se avaliou o grupo que recebeu a toxina botulínica, a fibrose e a proliferação vascular foram menos intensas. Provavelmente, o relaxamento da musculatura induzido pela toxina diminua a isquemia local8,10-12, justificando a diferença encontrada. Além disso, também se encontrou menos atrofia, bem como não foi encontrada inflamação, o que poderia decorrer de menor liberação de citocinas pró-inflamatórias9. A expansão mais fácil após o relaxamento muscular justificaria a ausência de hemorragia nesse grupo6,7.
Apesar de não termos avaliado a dor neste estudo, revisando a literatura, observamos que uma das principais queixas da expansão tecidual progressiva é a dor, que pode levar inclusive à interrupção do tratamento8,13. Existem trabalhos que demonstram a redução da dor no músculo expandido para reconstrução mamária com prótese pós-relaxamento com toxina botulínica8,9,13.
Além do relaxamento muscular, acredita-se que a menor hipóxia sofrida pelas fibras musculares seja um fator associado à diminuição da dor, talvez pela diminuição de liberação de substâncias álgicas6,13.
CONCLUSÃO
A toxina botulínica é uma substância usada na prática médica há vários anos, relativamente segura e de fácil aplicação, que causa relaxamento muscular, permitindo distensão muscular menos abrupta e dolorosa.
Apesar do tamanho reduzido da amostra, indicando a necessidade de estudos posteriores, esses achados correlacionados com dados da literatura, nos permitem presumir que sua aplicação no músculo esquelético expandido associa-se com maior preservação do músculo, havendo consequentemente maior distensibilidade e melhor acomodação da prótese.
COLABORAÇÕES
|
MPSN |
Concepção e desenho do estudo; realização das operações e/ou experimentos. |
|
LCR |
Concepção e desenho do estudo; realização das operações e/ou experimentos. |
|
ECSA |
Análise e/ou interpretação dos dados; aprovação final do manuscrito; redação do manuscrito ou revisão crítica de seu conteúdo. |
|
ACRD |
Realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo. |
|
ACPB |
Análise e/ou interpretação dos dados; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo. |
|
RME |
Análise e/ou interpretação dos dados; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo. |
REFERÊNCIAS
1. Argenta LC, Marks MW. Principles of tissues expansion. In: Mathes SJ, ed. Plastic surgery: general principles. Philadelphia: Saunders Elsevier; 2006. p. 539-67.
2. Neumanm CG. The expansion of an area of skin by progressive distention of a subcutaneous balloon: use of the method for securing skin for subtotal reconstruction of the ear. Plast Reconstr Surg (1946). 1957;19(2):124-30. DOI: http://dx.doi.org/10.1097/00006534-195702000-00004
3. Chun JT, Rohrich RJ. Versatility of tissue expansion in head and neck burn reconstruction. Ann Plast Surg. 1998;41(1):11-6. PMID: 9678462 DOI: http://dx.doi.org/10.1097/00000637-199807000-00003
4. De Filippo RE, Atala A. Stretch and growth: the molecular and physiologic influences of tissue expansion. Plast Reconstr Surg. 2002;109(7):2450-62. DOI: http://dx.doi.org/10.1097/00006534-200206000-00043
5. Gemperli R, Brechtbühl ER. Expansores teciduais. In: Mélega JM, ed. Cirurgia plástica: fundamentos e arte: princípios gerais. Rio de Janeiro: Medsi; 2002. p. 177-83.
6. Layeeque R, Hochberg J, Tillman R, Westbrook K, Yuen JC, Kunkel KM, et al. Botulinum toxin infiltration for pain control after mastectomy and subpectoral tissue expansion. Ann Surg 2004;240(4):608-14.
7. Lu L, Atchabahian A, Mackinnon SE, Hunter DA. Nerve injection injury with botulinum toxin. Plast Reconstr Surg. 1998;101(7):1875-80. PMID: 9623830 DOI: http://dx.doi.org/10.1097/00006534-199806000-00015
8. LoGiudice J, Gosain AK. Pediatric tissue expansion: indications and complications. J Craniofac Surg. 2003;14(6):866-72. DOI: http://dx.doi.org/10.1097/00001665-200311000-00008
9. Mitchell RN, Kumar V, Abbas AK. Fundamentos de Patologia: Robbins e Cotran. 8a ed. Rio de Janeiro: Elsevier; 2012.
10. Mathes SJ. Plastic Surgery: general principles. Philadelphia: Saunders Elsevier; 2006.
11. Pitanguy I. Utilização de expansores cutâneos nas sequelas de queimaduras. Bol Acad Nac Med. 1991;151(6/9):29-38.
12. Gur E, Hanna W, Andrighetti L, Semple JL. Light and electron microscopic evaluation of the pectoralis major muscle following tissue expansion for breast reconstruction. Plast Reconstr Surg. 1998;102(4):1046-51. PMID: 9734422 DOI: http://dx.doi.org/10.1097/00006534-199809020-00019
13. Jankovic J, Brin MF. Therapeutic uses of botulinum toxin. N Engl J Med. 1991;324(17):1186-94. PMID: 2011163 DOI: http://dx.doi.org/10.1056/NEJM199104253241707
1. Universidade Federal do Triângulo Mineiro,
Uberaba, MG, Brasil.
*Autor correspondente: Renata Margarida Etchebehere, Avenida Getúlio Guaritá, 130 - Uberaba, MG, Brasil. CEP 38025-440. E-mail: renataetch@hotmail.com
Artigo submetido: 28/9/2017.
Artigo aceito: 5/9/2018.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter