INTRODUÇÃO
O câncer de mama é atualmente um dos principais problemas de saúde do mundo e, no
Brasil, sua incidência vem aumentando gradativamente. É o tipo de câncer que mais
acomete as mulheres em todo o mundo1.
A mastectomia está entre os tratamentos mais empregados para o câncer de mama. Essa
cirurgia e as terapias adjuvantes contribuem para o desenvolvimento de complicações
físicas2 e transtornos psicológicos3, que podem influenciar negativamente a
qualidade de vida4. Após a mastectomia, a
ausência da mama altera a imagem corporal da mulher, produz sensação de mutilação
e
perda da feminilidade e sensualidade5.
Na tentativa de reduzir os sentimentos negativos desencadeados pela doença e seu
tratamento, melhorar a autoestima e suprir a falta da mama, muitas mulheres optam
pela reconstrução cirúrgica6. Trata-se de um
procedimento seguro, que não aumenta o risco de recorrência nem interfere na
detecção da doença, além de não levar ao atraso para terapias adjuvantes.
Existem vários procedimentos cirúrgicos descritos para sua realização, com técnicas
conservadoras, retalhos de vizinhança, materiais aloplásticos, retalhos miocutâneos
pediculados e microcirúrgicos7,8.
O retalho de músculo grande dorsal (MGD) é uma das opções cirúrgicas mais usadas nas
reconstruções mamárias. A cicatriz da área doadora no dorso, embora por vezes
situada sob a alça do sutiã, frequentemente é extensa (15 cm a 25 cm) e pode ser
de
qualidade ruim, apresentando-se alargada ou hipertrófica.
Com evolução histórica semelhante, o retalho do músculo grande dorsal foi
primeiramente descrito por Tansini, em 19069.
Contudo, apenas em 1976 Olivari10 descreveu
seu uso para cobertura de lesões radioterápicas da parede torácica. No ano seguinte,
Schneider et al.11
introduziram o retalho miocutâneo em ilha do músculo grande dorsal (RMGD) para
a
reconstrução mamária e, em 1978, Bostwick et al.12 descreveram uma modificação do procedimento
com utilização associada do músculo peitoral maior para cobertura do implante
mamário.
OBJETIVO
O objetivo deste trabalho foi analisar as complicações da reconstrução tardia da mama
com o retalho de músculo grande dorsal no Serviço de Cirurgia Plástica e
Microcirurgia Reconstrutiva do Hospital Universitário Walter Cantídio da
Universidade Federal do Ceará, em Fortaleza, CE, no período de 2015 a 2017.
MÉTODO
Trata-se de um estudo clínico retrospectivo observacional realizado por meio de
revisão de prontuários médicos de pacientes operadas e acompanhadas
ambulatorialmente. Foram coletados dados de 12 pacientes submetidas à reconstrução
mamária tardia com retalho do músculo grande dorsal no Serviço de Cirurgia Plástica
e Microcirurgia Reconstrutiva do Hospital Universitário Walter Cantídio da
Universidade Federal do Ceará durante o período de 2015 a 2017.
A idade das pacientes variou entre 35 e 65 anos. Foram analisadas complicações
imediatas, aquelas que ocorreram em até 30 dias de pós-operatório. Dentre estas,
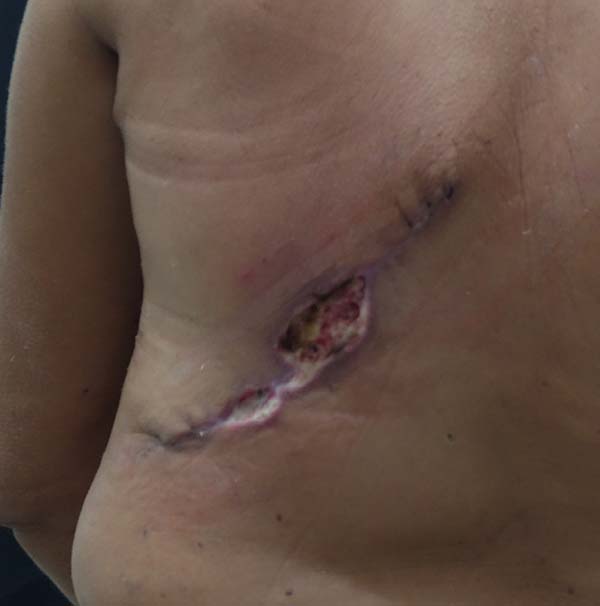
foram observados casos de seroma em região dorsal, casos de deiscência parcial
da
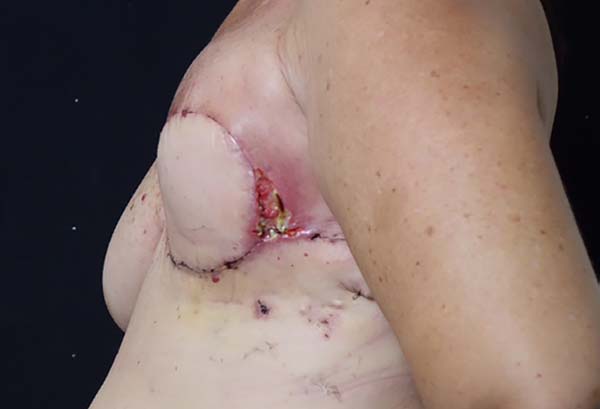
ferida operatória e casos de necrose do retalho de grande dorsal. Não se observaram
fatores de risco - hipertensão arterial sistêmica (HAS), diabetes mellitus (DM),
tabagismo, índice de massa corporal (IMC), idade - com significância estatística
para as complicações precoces.
Complicações tardias foram consideradas aquelas que ocorreram após 30 dias da
cirurgia. Foram observados casos de alterações de cobertura do implante, com atrofia
muscular e cutânea, predominantemente em polo superior da mama, casos de contratura
capsular.
RESULTADOS
As 12 pacientes foram submetidas à reconstrução tardia mamária pós-mastectomia com
retalho de músculo grande dorsal no Serviço de Cirurgia Plástica e Microcirurgia
Reconstrutiva do Hospital Universitário Walter Cantídio da Universidade Federal
do
Ceará durante o período de 2015 a 2017 com mesma equipe cirúrgica. A idade das
pacientes variou entre 35 e 65 anos.
Analisando o tempo de internação, observou-se que o período variou de 1 a 5 dias,
sendo que 82% delas passaram 4 dias ou menos.
As complicações foram divididas em complicações imediatas e tardias. Complicações
imediatas foram aquelas que ocorreram em até 30 dias de pós-operatório. Dentre
estas, foram observados casos de seroma em região dorsal (25%), casos de deiscência
parcial da ferida operatória (16,7%) e casos de necrose do retalho de grande dorsal
(8,4%) (Figuras 1, 2, 3 e 4). Não se observaram fatores de risco (HAS, DM, tabagismo, IMC,
idade) com significância estatística para as complicações imediatas.
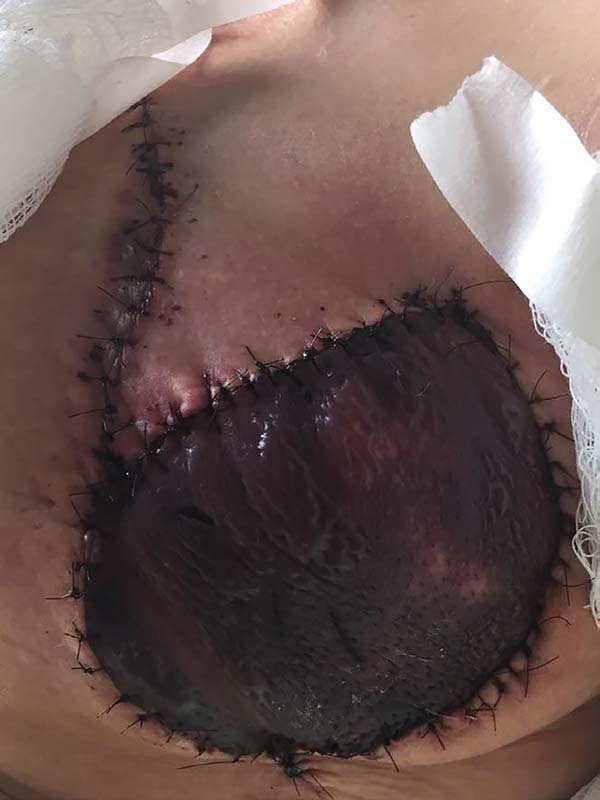
Figura 1 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
Figura 1 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
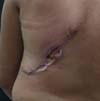
Figura 2 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
Figura 2 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
Figura 3 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
Figura 3 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
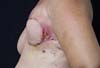
Figura 4 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
Figura 4 - Complicação imediata da reconstrução tardia mamária pós-mastectomia
com retalho de músculo grande dorsal.
Complicações tardias foram consideradas aquelas que ocorreram após 30 dias da
cirurgia. Foram observados casos de alterações de cobertura do implante, com atrofia
muscular e cutânea, predominantemente em polo superior da mama, e casos de
contratura capsular.
Nas 12 pacientes estudadas nesta série, não se observaram casos de complicações
tardias (alterações de cobertura do implante, atrofia muscular e cutânea).
DISCUSSÃO
A reconstrução mamária vem, cada vez mais, assumindo importante papel no tratamento
do câncer de mama, em decorrência dos comprovados benefícios psicológicos e físicos
para as pacientes. Esse procedimento favorece o retorno mais rápido dessas pacientes
ao convívio social, com melhora da imunidade e, consequentemente, oferece melhor
prognóstico no tratamento dessa doença13,14.
Dentro deste panorama, observou-se aumento das indicações de reconstruções mamárias
com retalhos locais, materiais aloplásticos e com o RMGD, em detrimento do retalho
transverso do músculo retoabdominal (TRAM), que apresenta maior morbidade local
e
sistêmica15.
No cenário do tratamento do câncer de mama, a radioterapia adjuvante à mastectomia
é
frequentemente realizada em mulheres com diagnóstico de câncer de mama em estádio
II
e III. Isto aumenta o controle local, a sobrevida livre de doença e a sobrevida
global16-19.
Apesar da melhora dos resultados oncológicos, a radioterapia adjuvante em mulheres
com câncer de mama pode piorar os resultados estéticos, com atrofias teciduais
e
contraturas capsulares e aumentar o risco de perda da reconstrução mamária20.
Em uma série de 100 casos, Perdikis et al.21 observaram uma taxa de contratura capsular em pacientes
submetidas a RMDG e implante de silicone de 6%. Em outra série com 53 casos, Venus
& Prinsloo observaram 7,4% de contratura capsular que necessitou capsulotomia
e
33% de contratura capsular que não necessitou a cirurgia.
Nas 12 pacientes estudadas nesta série, não se observaram casos de alterações de
cobertura do implante, com atrofia muscular e cutânea. Seroma na área doadora
do
músculo grande dorsal é a complicação mais comum do procedimento. As taxas desta
complicação publicadas na literatura variam de 16% a 79%22-25.
No entanto, a significância do seroma como uma complicação maior, que necessite de
nova intervenção cirúrgica, é baixa. No presente estudo, foi observada uma taxa
de
25% de seroma. Gart et al.15, em artigo que incluiu 1079 pacientes submetidas à RMGD da base de dados
American College of Surgeons National Surgical Improvement
Program (ACS-NSQIP), observaram em relação às complicações imediatas,
5,7% de reoperações, 3,3% de infecções cutâneas, 1,3% de necrose do retalho, 0,6%
de
deiscência da ferida operatória e 3,2% de complicações clínicas.
As complicações imediatas observadas nesse estudo eram 2 casos (16,7%) de deiscência
parcial da ferida operatória. Estas intercorrências provavelmente ocorreram devido
à
necessidade de eficácia oncológica local, acarretando retalhos de mastectomia
delgados e hipoperfundidos. Se observou 1 caso de necrose do retalho de grande
dorsal, mas nenhum caso com infecções, complicações clínicas.
Além de ser um retalho de grandes dimensões, com um território de pele conhecido e
confiável e apresentar menos complicações do que todos os outros retalhos autólogos,
o RMGD oferece várias vantagens adicionais, incluindo o tempo de recuperação rápido,
as altas taxas de satisfação do paciente, e mínima morbidade da área doadora26-29.
CONCLUSÃO
A cirurgia plástica tem papel importantíssimo no tratamento das pacientes portadoras
de câncer de mama. A reconstrução mamária com RGD tem enorme aplicabilidade,
contemplando a correção de quase todos os defeitos pós-mastectomia. Neste trabalho,
foi verificado alto grau de satisfação por parte das pacientes operadas e bons
resultados obtidos, com poucas repercussões funcionais.
REFERÊNCIAS
1. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes
da Silva (INCA). Estimativa 2012: Incidência de Câncer no Brasil. Rio de
Janeiro: INCA; 2011. 118 p.
2. Cheville AL, Tchou J. Barriers to rehabilitation following surgery
for primary breast cancer. J Surg Oncol. 2007;95(5):409-18. DOI: http://dx.doi.org/10.1002/jso.20782
3. Parker PA, Youssef A, Walker S, Basen-Engquist K, Cohen L, Gritz ER,
et al. Short-term and long-term psychosocial adjustment and quality of life in
women undergoing different surgical procedures for breast cancer. Ann Surg
Oncol. 2007;14(11):3078-89. DOI: http://dx.doi.org/10.1245/s10434-007-9413-9
4. Rietman JS, Dijkstra PU, Debreczeni R, Geertzen JH, Robinson DP, De
Vries J. Impairments, disabilities and health related quality of life after
treatment for breast cancer: a follow-up study 2.7 years after surgery. Disabil
Rehabil. 2004;26(2):78-84. DOI: http://dx.doi.org/10.1080/09638280310001629642
5. Sheppard LA, Ely S. Breast cancer and sexuality. Breast J.
2008;14(2):176-81. DOI: http://dx.doi.org/10.1111/j.1524-4741.2007.00550.x
6. Keith DJ, Walker MB, Walker LG, Heys SD, Sarkar TK, Hutcheon AW, et
al. Women who wish breast reconstruction: characteristics, fears, and hopes.
Plast Reconstr Surg. 2003;111(3):1051-6. DOI: http://dx.doi.org/10.1097/01.PRS.0000046247.56810.40
7. Malata CM, McIntosh SA, Purushotham AD. Immediate breast
reconstruction after mastectomy for cancer. Br J Surg. 2000;87(11):1455-72. DOI:
http://dx.doi.org/10.1046/j.1365-2168.2000.01593.x
8. Hu E, Alderman AK. Breast reconstruction. Surg Clin North Am.
2007;87(2):453-67. DOI: http://dx.doi.org/10.1016/j.suc.2007.01.004
9. Tansini I. Sopra il mio nuovo processor di amputazione della
mammella. Gazz Mal Ital. 1906;57:141.
10. Olivari N. The latissimus flap. Br J Plast Surg. 1976;29(2):126-8.
DOI: http://dx.doi.org/10.1016/0007-1226(76)90036-9
11. Schneider WJ, Hill HL Jr, Brown RG. Latissimus dorsi myocutaneous
flap for breast reconstruction. Br J Plast Surg. 1977;30(4):277-81. DOI:
http://dx.doi.org/10.1016/0007-1226(77)90117-5
12. Bostwick J 3rd, Vasconez LO, Jurkiewicz MJ. Breast reconstruction
after a radical mastectomy. Plast Reconstr Surg. 1978;61(5):682-93. DOI:
http://dx.doi.org/10.1097/00006534-197805000-00004
13. Veiga DF, Veiga-Filho J, Ribeiro LM, Archangelo I Jr, Balbino PF,
Caetano LV, et al. Quality-of-life and self-esteem outcomes after oncoplastic
breast-conserving surgery. Plast Reconstr Surg. 2010;125(3):811-7. DOI:
http://dx.doi.org/10.1097/PRS.0b013e3181ccdac5
14. Bellino S, Fenocchio M, Zizza M, Rocca G, Bogetti P, Bogetto F.
Quality of life of patients who undergo breast reconstruction after mastectomy:
effects of personality characteristics. Plast Reconstr Surg. 2011;127(1):10-7.
DOI: http://dx.doi.org/10.1097/PRS.0b013e3181f956c0
15. Gart MS, Smetona JT, Hanwright PJ, Fine NA, Bethke KP, Khan SA, et
al. Autologous options for postmastectomy breast reconstruction: a comparison
of
outcomes based on the American College of Surgeons National Surgical Quality
Improvement Program. J Am Coll Surg. 2013;216(2):229-38. DOI: http://dx.doi.org/10.1016/j.jamcollsurg.2013.04.022
16. Overgaard M, Hansen PS, Overgaard J, Rose C, Andersson M, Bach F, et
al. Postoperative radiotherapy in high-risk premenopausal women with breast
cancer who receive adjuvant chemotherapy. Danish Breast Cancer Cooperative Group
82b Trial. N Engl J Med. 1997;337(14):949-55. DOI: http://dx.doi.org/10.1056/NEJM199710023371401
17. Overgaard M, Jensen MB, Overgaard J, Hansen PS, Rose C, Andersson M,
et al. Postoperative radiotherapy in high-risk postmenopausal breast-cancer
patients given adjuvant tamoxifen: Danish Breast Cancer Cooperative Group DBCG
82c randomized trial. Lancet. 1999;353(9165):1641-8.
18. Ragaz J, Jackson SM, Le N, Plenderleith IH, Spinelli JJ, Basco VE,
et al. Adjuvant radiotherapy and chemotherapy in node-positive premenopausal
women with breast cancer. N Engl J Med. 1997;337(14):956-62. DOI: http://dx.doi.org/10.1056/NEJM199710023371402
19. Clarke M, Collins R, Darby S, Davies C, Elphinstone P, Evans E, et
al.; Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of
radiotherapy and of differences in the extent of surgery for early breast cancer
on local recurrence and 15-year survival: an overview of the randomised trials.
Lancet. 2005;366(9503):2087-106. DOI: http://dx.doi.org/10.1016/S0140-6736(05)67887-7
20. Shah C, Kundu N, Arthur D, Vicini F. Radiation therapy following
postmastectomy reconstruction: a systematic review. Ann Surg Oncol.
2013;20(4):1313-22. DOI: http://dx.doi.org/10.1245/s10434-012-2689-4
21. Perdikis G, Koonce S, Collis G, Eck D. Latissimus dorsi myocutaneous
flap for breast reconstruction: bad rap or good flap? Eplasty.
2011;11:e39.
22. Losken A, Nicholas CS, Pineel XA, Carlson GW. Outcomes evaluation
following bilateral breast reconstruction using latissimus dorsi myocutaneous
flaps. Ann Plast Surg. 2010;65(1):17-22. DOI: http://dx.doi.org/10.1097/SAP.0b013e3181bda349
23. Delay E, Gounot N, Bouillot A, Zlatoff P, Rivoire M. Autologous
latissimus breast reconstruction: a 3-year clinical experience with 100
patients. Plast Reconstr Surg. 1998;102(5):1461-78. DOI: http://dx.doi.org/10.1097/00006534-199810000-00020
24. Bonomi S, Settembrini F, Salval A, Gregorelli C, Musumarra G,
Rapisarda V. Current indications for and comparative analysis of three different
types of latissimus dorsi flaps. Aesth Surg J. 2012;32(3):294-302. DOI:
http://dx.doi.org/10.1177/1090820X12437783
25. Chang DW, Youssef A, Cha S, Reece GP. Autologous breast
reconstruction with the extended latissimus dorsi flap. Plast Reconstr Surg.
2002;110(3):751-9. DOI: http://dx.doi.org/10.1097/01.PRS.0000019711.36017.5B
26. Munhoz AM, Montag E, Fels KW, Arruda EG, Sturtz GP, Aldrighi C, et
al. Outcome analysis of breast-conservation surgery and immediate latissimus
dorsi flap reconstruction in patients with T1 to T2 breast cancer. Plast
Reconstr Surg. 2005;116(3):741-52. DOI: http://dx.doi.org/10.1097/01.prs.0000176251.15140.36
27. Brumback RJ, McBride MS, Ortolani NC. Functional evaluation of the
shoulder after transfer of the vascularized latissimus dorsi muscle. J Bone
Joint Surg. 1992;74(3):377-82. DOI: http://dx.doi.org/10.1097/00005131-199212000-00068
28. Russell RC, Pribaz J, Zook EG, Leighton WD, Eriksson E, Smith CJ.
Functional evaluation of latissimus dorsi donor site. Plast Reconstr Surg.
1986;78(3):336-44. DOI: http://dx.doi.org/10.1097/00006534-198609000-00009
29. Dutra AK, Neto MS, Garcia EB, Veiga DF, Netto MM, Curado JH, et al.
Patients' satisfaction with immediate breast reconstruction with a latissimus
dorsi musculocutaneous flap. J Plast Surg Hand Surg. 2012;46(5):349-53. DOI:
http://dx.doi.org/10.3109/200065 6X.2012.704726
1. University of Belgrade, Serbia.
2. Hospital Universitário Walter Cantídio,
Fortaleza, CE, Brasil.
3. Universidade Federal do Ceará, Fortaleza, CE,
Brasil.
4. Sociedade Brasileira de Cirurgia Plástica, São
Paulo, SP, Brasil.
Endereço Autor: Aleksandra Markovic
Av. Beira Mar, nº 4260, Praia de Mucuripe
Fortaleza, CE, Brasil CEP 60165-121
E-mail: 19quepasa19@gmail.com