

Original Article - Year 2017 - Volume 32 -
Estabelecimento de protocolo para armazenamento de pele autógena refrigerada
Establishment of a protocol for storage of refrigerated autologous skin
RESUMO
INTRODUÇÃO: Enxertos de pele autólogos são utilizados em tratamento de pacientes queimados. Esses enxertos podem ser armazenados e preservados, desde que o processo de armazenamento seja realizado com rígido controle de qualidade, para garantir a redução dos riscos de infecção.
MÉTODOS: Foi realizado um estudo de coorte retrospectivo na Unidade de Queimados do Hospital das Clínicas de São Paulo no período de fevereiro de 2015 a julho de 2016, em que foi estabelecido um protocolo para armazenamento de pele refrigerada com controle de coleta, preservação, embalagem e registro de todos os processos. Para garantia de qualidade, foram coletadas biópsias dos enxertos para microbiologia pré e pós-armazenamento e realizado um estudo transversal de prevalência de contaminação pré e pós-estocagem.
RESULTADOS: Os pontos críticos encontrados foram inadequação de embalagem, ausência de registros de processos, falta de coleta de biópsias para microbiologia e falhas no descarte. A maior parte das amostras estava contaminada tanto pré como pós-estocagem (84,2%). Apenas dois pacientes apresentaram microbiologia estéril no pré e contaminada no pós, porém foram encontrados germes da pele do tipo gram+.
CONCLUSÃO: Foi estabelecido um método promissor de armazenamento de pele refrigerada que necessita alguns pequenos ajustes para adequação ao controle de qualidade.
Palavras-chave: Transplante autólogo; Transplante de pele; Preservação de tecido; Controle de qualidade; Refrigeração.
ABSTRACT
INTRODUCTION: Autologous skin grafts are used for treatment of burn patients. These grafts can be stored and preserved, as long as the storage process is performed with strict quality control to reduce the risk of infection.
METHODS: A retrospective cohort study was conducted in the Burn Unit of the Hospital das Clínicas de São Paulo from February 2015 to July 2016. During this period, a protocol was established to store refrigerated skin, with control of collection, preservation, and packaging, and recording of all processes. To ensure quality, graft biopsies were collected for pre- and post-storage microbiology testing and a cross-sectional study for contamination was performed.
RESULTS: Critical deficiencies included inadequate packaging, lack of processing records, lack of biopsies for microbiology testing, and failure to discard specimens. Most of the samples were contaminated before and after storage (84.2%). Only two samples were sterile before storage but became contaminated after storage, with growth of Gram-positive skin bacteria.
CONCLUSION: A promising method for the storage of refrigerated skin was established, but requires minor adjustments in quality control.
Keywords: Autologous transplantation; Skin grafting; Tissue preservation; Quality control; Refrigeration.
O tratamento dos pacientes queimados baseia-se no uso dos enxertos de pele autólogos. Em geral, o cirurgião retira a pele de uma área doadora do próprio indivíduo e no mesmo tempo cirúrgico faz a cobertura de suas feridas. Entretanto, algumas vezes o leito das lesões não se encontra preparado para receber o enxerto; ou o cirurgião retira uma quantidade excessiva de pele, a qual poderia ser utilizada para tratamento de outras feridas com leito ainda impróprio ou que poderiam tratar eventuais áreas de falha de integração de enxertos. Nestas situações, o ideal seria que este material fosse armazenado e preservado com segurança até que fosse possível a realização de um novo procedimento cirúrgico1.
O armazenamento de enxertos de pele autólogo refrigerados começou a ser avaliado em 1903, por Wentscher, que testou o armazenamento durante 14 dias em temperaturas próximas a 8ºC2. Outros estudos experimentais foram realizados em 1912, por Carrel, que analisou a preservação da pele em temperaturas normotérmicas e hipotérmicas, e verificou que o material poderia ser mantido em hipotermia por até duas semanas3.
Os primeiros relatos de uso clínico de pele refrigerada ocorreram no período da Segunda Guerra Mundial. Os soldados queimados eram expostos a várias cirurgias sob anestesia geral e, com o intuito de reduzir este tempo cirúrgico, os cirurgiões retiravam vários enxertos de pele autóloga de uma só vez, e os mantinham refrigerados até que as áreas cruentas estivessem preparadas para receber o tecido4.
Durante esse mesmo período, Mattews descreveu o método de armazenamento de pele refrigerada enrolada em tule ou gaze e embebida em solução salina para evitar a sua desidratação. Depois disso, eram colocadas em frascos hermeticamente fechados e armazenadas em refrigeradores com temperatura entre 3º a 6ºC. Foi verificado que o melhor tempo de armazenamento foi entre 2 a 8 semanas e que algumas amostras apresentaram contaminação por bactérias da flora normal da pele4.
Após a definição sobre a viabilidade tecidual da pele refrigerada por até duas ou três semanas4,5, a principal preocupação atual refere-se ao risco de contaminação. Titley et al.5 realizaram um estudo bacteriológico qualitativo e quantitativo em 102 enxertos de pele autóloga refrigerada. A cultura microbiológica foi realizada no momento da retirada, durante a sua utilização e após 21 dias de armazenamento.
Eles verificaram que as condições de armazenamento influenciam na proliferação de microrganismos e que o número de organismos por grama de enxerto de pele (organismos/g) pode interferir na integração desses enxertos. A associação entre a pega do enxerto e número de organismos/g no momento da sua retirada foi relativamente fraca (r = -24), no entanto, a maioria desses enxertos (96,4%) estava com a taxa de contaminação menor que 105 organismos/g. Após três semanas de armazenamento, cerca de 40% dos enxertos apresentaram contaminação superior a 105 organismo/g. Os autores atribuíram este achado ao armazenamento em refrigerador com temperatura oscilante e não padronizada5.
Desta maneira, é fundamental que todo o processo de armazenamento de pele refrigerada seja realizado com um rígido controle de qualidade para garantir a redução dos riscos de infecção. Os processos de retirada, embalagem e armazenamento devem seguir os preceitos de boas práticas com técnicas assépticas, materiais adequadamente padronizados, refrigerador de uso exclusivo com temperatura padronizada e monitorada e com controle de todos os procedimentos efetuados pela equipe multidisciplinar5,6.
Desde a década de 50, a Unidade de Queimados do Hospital das Clínicas da Universidade de São Paulo realiza o armazenamento de tecido refrigerado para transplante autólogo. Porém, este procedimento era feito com pouco controle, sem preocupação com a embalagem, ausência de padronização dos processos de armazenamento, registros de dados e sem qualquer estudo sobre a contaminação do material7.
Com o início dos sistemas de acreditação hospitalar e controle de qualidade, a equipe de enfermagem da Unidade de Queimados e do Banco de Tecidos, assessorada por biomédicos e médicos, sentiu a necessidade de estabelecer novos protocolos padronizados e controlados para preservação e armazenamento de pele autóloga refrigerada.
OBJETIVO
O objetivo deste estudo foi avaliar um modelo de armazenamento de pele autógena refrigerada utilizando o resultado de culturas microbiológicas como fator de controle de qualidade do processo.
MÉTODOS
Trata-se de um estudo de coorte retrospectivo realizado na Unidade de Queimados do Hospital das Clínicas de São Paulo (São Paulo, SP) no período de fevereiro de 2015 a julho de 2016.
Neste estudo foram seguidos os princípios da Declaração de Helsinque, e considerado isento de avaliação do Comitê de Ética em Pesquisa por tratar-se de um estudo de gestão de melhorias de processos, em que o foco foi voltado para melhorar um processo já existente no setor e validar técnica a ser desenvolvida no armazenamento de pele autógena.
Local de estudo: Unidade de Queimados do Instituto Central Hospital das Clínicas de São Paulo (ICHC) e Banco de Tecidos do ICHC.
Fase 1 - Descrição de modelo padronizado de armazenamento de pele de espessura parcial refrigerada para uso autólogo
1A - Fase de retirada da pele
Pacientes com queimaduras de segundo e terceiro graus internados na Unidade de Queimados do Hospital das Clínicas foram submetidos a procedimentos cirúrgicos de enxertia de pele segundo critérios médicos sem nenhum tipo de envolvimento do grupo de pesquisa na indicação do tratamento. A retirada dos enxertos de pele ocorreu em centro cirúrgico sob anestesia geral ou raquianestesia, sendo realizada sempre por algum cirurgião plástico do serviço devidamente paramentado com técnica estéril.
As áreas doadoras foram submetidas a um processo de degermação com clorexidina degermante 2% por 5 minutos e, posteriormente, realizada antissepsia com clorexidina alcoólica 0,5%. A extração da pele parcial foi realizada com um dermátomo da marca Integra® com espessura variável entre 12 a 18 µ. Durante o procedimento, quando o cirurgião plástico percebeu que havia retirado mais enxerto que o necessário, imediatamente informava o enfermeiro, que dava início ao processo de armazenamento.
1B - Fase de processamento
Ao saber da necessidade de armazenamento, o enfermeiro providenciou o kit de embalagem (preparo descrito abaixo no item embalagens), Ringer Lactato (100 ml) e o frasco de tioglicolato de sódio para cultura microbiológica.
Inicialmente, o médico separou uma pequena biópsia de tecido e, com o auxílio do enfermeiro, posicionou por técnica estéril o material em frasco de tioglicolato de sódio para realização da cultura microbiológica de controle pré-armazenamento.
Em seguida, o enfermeiro forneceu as embalagens estéreis ao cirurgião. No frasco primário depositou-se a pele, que deve ser completamente recoberta por solução de Ringer Lactato e o frasco lacrado. Posteriormente, introduziu-se a embalagem primária no plástico secundário de tal forma que não se tem mais acesso ao elemento primário. Neste momento, o enfermeiro realizou a primeira selagem do plástico secundário com uma seladora modelo Ron Micromecânica RSR - 2000.
Foram então preparadas etiquetas com identificação do paciente, tipo de tecido refrigerado, data de processamento e prazo de validade. Esta etiqueta foi colocada no plástico e realizada uma nova selagem; desta forma, a embalagem final apresentava dupla selagem com identificação adequada e estava pronta para o armazenamento.
1C - Fase de armazenamento
Depois de embalado, o enxerto foi armazenado no refrigerador Consul Compacto 120 com temperatura de 4ºC+/-2ºC, localizado no centro cirúrgico da Unidade de Queimados. A pele foi mantida em refrigerador até o seu uso clínico ou pelo prazo máximo de 14 dias. No momento de uso clínico ou descarte, coletou-se uma nova amostra de biópsia de tecido para análise microbiológica pós-armazenamento.
1D - Preparo de embalagens
Uma etapa importante do estabelecimento do protocolo foi realizada quando se determinaram as embalagens para acondicionamento da pele. Para esta escolha, seguiram-se as normas definidas na resolução vigente que determina as especificações necessárias das embalagens, quanto as suas propriedades físico-químicas, citotóxicas e pirogênicas8. Antes do seu uso, as embalagens primárias e as secundárias foram esterilizadas em óxido de etileno (Figura 1).

Figura 1. Embalagem para armazenamento de enxerto de pele autólogo.
A embalagem selecionada para o armazenamento de enxerto de pele autólogo foi a da Maxvac®, que apresentava certificação quanto aos seguintes ensaios: termossoldagem, resistência à perfuração, resistência à tração, permeabilidade a oxigênio e vapor de água e migração. Os ensaios de citotoxicidade e pirogenicidade dessas embalagens foram realizados nos laboratórios do Instituto Adolfo Lutz® e Medlab®, respectivamente. Os resultados encontrados foram ausência de pirogênio e sem efeito tóxico para linhagem celular. Desta forma, foi possível definir embalagens com adequada qualidade para armazenamento tecidual.
1E - Registros de procedimentos
A garantia do controle de qualidade depende de um bom sistema de registros de todos os procedimentos realizados. Nesta etapa foram criados instrumentos de registro das informações referentes aos pacientes com os seguintes dados: nome, sexo, número de registro, data de nascimento, de retirada do tecido, de envio de biópsias para laboratório de microbiologia e de utilização e descarte dos enxertos.
Para garantir a rastreabilidade, foi criado um sistema de contrarreferências em que o nome do paciente, seu registro e o tipo de tecido armazenado eram identificados na etiqueta anexada na embalagem, no formulário SAEP (Protocolo de Assistência de Enfermagem Pré-operatório) localizado no prontuário do paciente e no livro de controle geral de enxertos de pele autóloga refrigerados.
O refrigerador de armazenamento era monitorado quanto à temperatura com o auxílio de um termômetro digital calibrado para máxima e mínima da Incoterm®, sendo realizada a checagem três vezes ao dia e registrado os dados em Folha de Registro de Controle de Temperatura. A limpeza da geladeira foi realizada quinzenalmente com água e detergente neutro, e durante este período o material ficava armazenado em outro refrigerador específico para amostras de exames por 2 a 3 horas até a estabilização da temperatura do refrigerador limpo. Vale salientar que durante este armazenamento provisório, o tecido era mantido em dupla embalagem intacta e não existiam amostras de exames no refrigerador.
Fase 2 - Estudo das análises microbiológicas para avaliação de eficácia do protocolo de armazenamento de pele autóloga refrigerada
O objetivo desta fase foi realizar um estudo microbiológico para avaliar a contaminação do material armazenado. No período ente fevereiro de 2015 até julho de 2016, foram coletados os dados referentes aos pacientes que tiveram enxertos de pele armazenados por refrigeração na Unidade de Queimados do ICHC.
As informações obtidas foram registradas em um instrumento de coleta com os seguintes dados: nome, número de registro, data de nascimento, sexo, data da captação, transplante ou descarte, resultados das culturas pré-armazenamento e pré-transplante ou pós-armazenamento (até 14 dias de preservação). Foram realizadas análises microbiológicas para anaeróbios, aeróbios e fungos e os resultados das análises foram verificados através do sistema informatizado de exames.
2A - Critérios de inclusão e exclusão para estudo microbiológico
Os critérios de inclusão na amostra foram: enxertos autólogos armazenados com todos os campos preenchidos na folha de registro de "Controle de enxerto de pele autóloga do setor de queimados" e cujo controle microbiológico tenha sido realizado por meio de biópsias de pele tanto no pré como no pós-armazenamento; enxertos com análises microbiológicas (bactérias aeróbias, anaeróbias e fungos) no pré e pós-armazenamento com resultado final conclusivo, ou seja, sem crescimento bacteriano ou com a identificação do micro-organismo contaminante.
Critérios de exclusão: enxertos autólogos em que a biópsia somente foi realizada em um único momento (pré ou pós-armazenamento); resultados de culturas que tiveram resultados inconclusivos em qualquer momento.
2B - Análises de resultados
A partir dos dados coletados foi possível determinar por estatística simples as características da amostra, as taxas de transplante e descarte de material e as taxas de contaminação pré e pós-armazenamento identificando se houve alguma contaminação durante o processo de estocagem.
RESULTADOS
Dentre 88 amostras de enxerto de pele autólogo coletadas, 50 (57%) foram descartadas, sendo 54% (n = 27) pelo motivo da coleta de biópsia realizada somente no pós-armazenamento, 34% (n = 17) realizada apenas no pré-armazenamento e em 12% (n = 6) não foram coletas as biópsias.
Das 38 (43%) amostras estudadas, 34 (89,5%) estavam contaminadas; dessas ,71,1% (n = 27) tinham contaminação inicial no pré-armazenamento e continuaram assim na cultura final no pós-armazenamento. 13,1% (n = 5) tinham contaminação somente no pré e 5,3% (n = 2) amostras apenas na pós-armazenamento. O período médio de armazenamento dessas amostras foi de até 14 dias.
Em 4 (10,5%) amostras não houve contaminação no pré e continuaram com cultura negativa no pós-armazenamento. No entanto, 84,2% (n = 32) apresentaram contaminação no pré e no pós-armazenamento, e os principais micro-organismos encontrados foram Staphylococcus aureus, Pseudomonas aeruginosa, Enterococcus faecalis, Klebsiella pneumoniae e Staphylococcus coagulase negativo.
Em relação à padronização do método de armazenamento de pele autóloga, as principais dificuldades encontradas foram:
a) selagem da embalagem secundária - a falta de uma seladora portátil dificultou a mobilidade do equipamento até outros centros cirúrgicos que não o exclusivo da unidade de queimados;
b) registro das informações - a falta da definição inicial do enfermeiro como responsável pelo "Controle de enxerto de pele autólogo armazenado" incidiu em falta de registros, registros incompletos e dificuldade no rastreamento das informações;
c) amostras armazenadas fora do período - a falta da definição inicial dos enfermeiros responsáveis pelo controle do refrigerador de armazenamento de enxerto de pele autólogo causou o armazenamento e descarte das amostras com período superior a 14 dias.
d) análise microbiológica - a falta de coleta da biópsia no pré e/ou pós-armazenamento pela equipe médica resultou em resultados microbiológicos ausentes ou incompletos.
Na figura abaixo (Figura 2) podemos perceber as principais falhas encontradas na coleta de biópsias para exame microbiológico.
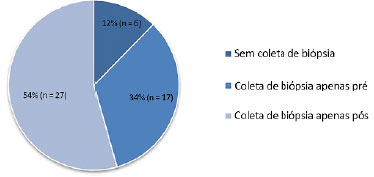
Figura 2. Causas de exclusão de enxertos do estudo sobre a prevalência de infecção.
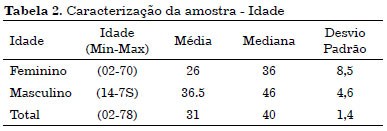
Desta maneira, o estudo de controle de infecção dos 38 enxertos de pele refrigerados, representou 43% do número total de pacientes com tecido armazenado. A maior parte dos pacientes era do sexo masculino com uma idade média de 36,5 anos (Tabelas 1 e 2).

Em relação à prevalência de contaminação foram encontradas quatro situações possíveis de cada enxerto: contaminação nas culturas de pré e pós-armazenamento, contaminação apenas no momento pré, contaminação apenas no pós e ausência de contaminação tanto no pré como no pós. A Figura 3 apresenta esta distribuição.
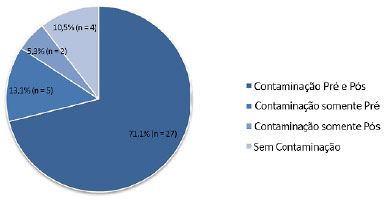
Figura 3. Prevalência de contaminação nos enxertos de pele autólogo armazenados.
Nas situações com contaminação tanto no pré como no pós, apenas no pré ou sem contaminação podemos afirmar que não foi o armazenamento o causador da presença de bactérias, entretanto, a contaminação apenas no pós (5,3% - dois pacientes) provoca maior preocupação, exigindo uma melhor análise do tipo de germes encontrados (Tabela 3).
Nas Figuras 4 e 5 podemos observar os principais micro-organismos encontrados no pré e pós armazenamento, respectivamente.
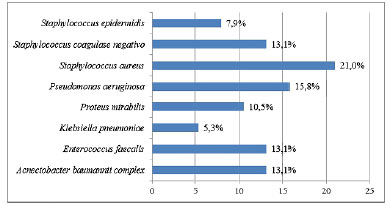
Figura 4. Bactérias isoladas no pré-armazenamento de 38 enxertos de pele autóloga.
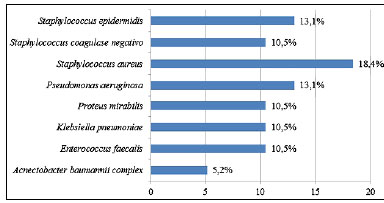
Figura 5. Bactérias isoladas no pós-armazenamento de 38 enxertos de pele autóloga.
Quanto ao destino final dos tecidos, dos 38 enxertos da amostra apenas três foram utilizados para transplante (7,9% da amostra), com uma média de armazenamento de 6,5 dias. Todo o restante do material foi descartado.
DISCUSSÃO
O desenvolvimento de um método padronizado de armazenamento de pele autóloga refrigerada é fundamental para garantir controle de qualidade em todo o processo envolvendo a retirada, armazenamento, utilização e descarte dos enxertos autólogos. O objetivo primordial deste estudo foi estabelecer uma prática que envolvesse toda a equipe multidisciplinar do setor de queimados do ICHC com papel fundamental dos enfermeiros que zelariam por garantir a realização dos processos com o máximo rigor de boas práticas.
Durante o estabelecimento do protocolo, foi fundamental a identificação de pontos críticos que poderiam causar riscos aos tecidos e aos pacientes receptores. Os principais pontos críticos foram relacionados à embalagem do material, registro de processos, descarte de materiais e coleta das amostras microbiológicas.
A determinação das embalagens exigiu estudos complementares quanto às questões mecânicas e de toxicidade dos materiais, porém, o mais difícil foi conscientizar a equipe quanto à necessidade de utilização dos materiais previamente padronizados. Muitas vezes, alguns profissionais embalavam o tecido em embalagem imprópria e insistiam que o mesmo fosse conservado na geladeira de armazenamento de pele. Entretanto, esta atitude não pode ser tolerada, porque o risco de contaminação cruzada dentro do refrigerador aumenta muito com embalagens sem as devidas certificações12.
Os outros pontos críticos (falha em registros, descarte de material e falha na coleta de culturas) foram identificados durante o estudo de prevalência microbiológica de contaminação. Os processos não estavam adequadamente anotados, muitos tecidos passavam do prazo de armazenamento e não eram descartados, e algumas das culturas microbiológicas no pré e pós-armazenamento não eram coletadas.
A fim de solucionar estes problemas, definiu-se o enfermeiro como o profissional responsável pelo controle de todas estas atividades. Apenas a partir desta decisão foi possível garantir uma melhora na coleta e armazenamento das informações, permitindo garantir que todo o processo fosse realizado com segurança.
A preocupação com o risco de contaminação na padronização de nosso modelo foi tão importante que exigiu a realização de um estudo complementar sobre sua prevalência no material armazenado. A amostra final do estudo foi composta de um total de 38 enxertos refrigerados, com predomínio de pacientes do sexo masculino (60,5% x 39,5%) e com idade média de 31 anos, indicando o predomínio de indivíduos economicamente ativos.
Em nossos resultados, apenas 10,5% (n = 4) dos enxertos não apresentavam contaminação no pré-armazenamento e continuaram assim na cultura final. Por outro lado, 84,2% (n = 32, contaminação pré-armazenamento e/ou pré e pós-armazenamento) já estavam contaminadas previamente à refrigeração. Desta forma, podemos inferir que a antissepsia e assepsia das áreas doadoras eram realizadas de forma inadequada ou que os pacientes apresentavam excessiva contaminação cutânea, não sendo possível a redução da carga bacteriana no momento de extração da pele.
Os principais micro-organismos encontrados foram Staphylococcus aureus, Pseudomonas aeruginosa, Enterococcus faecalis, Klebsiella pneumoniae e Staphylococcus coagulase negativo, sendo esses os agentes mais comuns em grandes queimados. Li et al.13 encontraram em 30 amostras de enxertos de pele conservados em refrigeração um crescimento polimicrobiano em 43% das culturas, com perfil de microrganismos semelhantes aos encontrados em nosso estudo.
Entretanto, o achado mais relevante refere-se àqueles que não possuíam contaminação no pré e passaram a tê-lo após o armazenamento (5,3%- n = 2). Para o estabelecimento do modelo, este fato não deveria ocorrer e, por isso, estes casos foram analisados individualmente, para tentar compreender se poderiam inviabilizar a metodologia padronizada. Em ambas as situações, os microrganismos encontrados eram bactérias do tipo gram positivos, sendo germes que costumam estar presentes na flora normal do tecido cutâneo.
Titley et al.5 também estudaram o armazenamento de pele por refrigeração realizando estudos qualitativos e quantitativos das bactérias contaminantes e relacionando com a taxa de integração dos enxertos. Eles demonstraram que as espécies de pele contaminadas apenas com bactérias do tipo gram positivo, mesmo com mais de 105 colônias, apresentavam altas taxas de integração e nenhum tipo de infecção do receptor, enquanto aqueles com crescimento de gram negativos apresentavam perda completa dos enxertos transplantados. Também demonstraram que as contaminações de enxertos previamente estéreis provavelmente ocorriam em razão do uso de refrigeradores domésticos para armazenamento.
Estes aparelhos sofrem grandes oscilações de temperatura e podem propiciar condições para o crescimento bacteriano. Provavelmente, foi o motivo dos dois casos de crescimento bacteriano encontrados exclusivamente no pós-armazenamento. O refrigerador utilizado em nossa unidade de queimados é do tipo doméstico, não sendo capaz de manter a temperatura estável. Desta forma, para adequação do protocolo solicitamos a aquisição de um equipamento de refrigeração científica.
A principal limitação deste estudo foi a não realização de culturas quantitativas para melhor identificação da carga bacteriana existente no material armazenado. Novos estudos já estão sendo planejados por este grupo de trabalho para aprimorar o modelo de armazenamento de tecidos implantado em nosso serviço.
CONCLUSÃO
Diante dos resultados obtidos, foi possível desenvolver um método promissor de armazenamento de pele autóloga refrigerada que ainda necessita de alguns estudos e ajustes para ser padronizado e estar completamente adequado aos padrões de qualidade necessários.
COLABORAÇÕES
ROC Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
AOP Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
EFP Aprovação final do manuscrito; realização das operações e/ou experimentos.
KM Realização das operações e/ou experimentos.
CI Aprovação final do manuscrito.
VFC Análise estatística; concepção e desenho do estudo; redação do manuscrito ou revisão crítica de seu conteúdo.
DSG Aprovação final do manuscrito.
RG Aprovação final do manuscrito.
REFERÊNCIAS
1. Blakey CM, Alexander KS, Galea G, Stewart KJ. The implications of a new Code of Practice on the storage of human skin for a regional plastic surgery unit. Burns. 2007;33(3):399-400. DOI: http://dx.doi.org/10.1016/j.burns.2006.08.005
2. Wentscher J. A further contribution about the survivability of human epidermal cells. Dtsch Z Chir. 1903;70:21-44. DOI: http://dx.doi.org/10.1007/BF02790822
3. Carrel A. The preservation of tissues and its applications in surgery. 1912. Clin Orthop Relat Res. 1992;(278):2-8. DOI: http://dx.doi.org/10.1001/jama.1912.04270080205010
4. Matthews DN. Storage of skin for autogenous grafts. The Lancet. 1945;245(6356):775-8. DOI: http://dx.doi.org/10.1016/S0140-6736(45)90544-7
5. Titley OG, Cooper M, Thomas A, Hancock K. Stored skin--stored trouble? Br J Plast Surg. 1994;47(1):24-9. PMID: 8124562
6. Bashaw MA. Guideline Implementation: Autologous Tissue Management. AORN J. 2015;102(3):270-80. DOI: http://dx.doi.org/10.1016/j.aorn.2015.07.003
7. Schiozer W. Banco de pele no Brasil. Rev Bras Queimaduras. 2012;11(2):53-5.
8. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada - RDC Nº 32, de 11 de junho de 2012. Dispõe sobre as diretrizes para embalagens primárias utilizadas no acondicionamento de tecidos humanos para fins terapêuticos e dá outras providências. Brasília: Ministério da Saúde; 2012.
9. Neves JR, Francesconi F, Costa A, Ribeiro BM, Follador I, Almeida LMC. Propionibacterium acnes e a resistência bacteriana. Surg Cosmet Dermatol. 2015;7(3 Supl 1):S27-38. DOI: http://dx.doi.org/10.5935/scd1984-8773.2015731683
10. Santos AL, Santos DO, Freitas CC, Ferreira BLA, Afonso IF, Rodrigues CR, Castro HC. Staphylococcus aureus: visitando uma cepa de importância hospitalar. J Bras Patol Med Lab. 2007;43(6):413-23. DOI: http://dx.doi.org/10.1590/S1676-24442007000600005
11. Becker K, Heilmann C, Peters G. Coagulase-negative staphylococci. Clin Microbiol Rev. 2014;27(4):870-926. DOI: http://dx.doi.org/10.1128/CMR.00109-13
12. Van Wicklin SA, Brubaker SA, Conner R. Guideline for Autologous Tissue Management. In: 2015 Guidelines for Perioperative Practice. Denver: Association of peri Operative Registered Nurses (AORN); 2014. p. 187-238.
13. Li Z, Overend C, Maitz P, Kennedy P. Quality evaluation of meshed split-thickness skin grafts stored at 4ºC in isotonic solutions and nutrient media by cell cultures. Burns. 2012;38(6):899-907. DOI: http://dx.doi.org/10.1016/j.burns.2012.02.002
1. Instituto Israelita de Ensino e Pesquisa Albert Einstein, São Paulo, SP, Brasil
2. Universidade de São Paulo, São Paulo, SP, Brasil
Instituição: Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.
Autor correspondente:
Renata Oliveira da Conceição
Avenida Dr. Arnaldo, 455
São Paulo, SP, Brasil - CEP 01246-903
E-mail: renata.oliveira@hc.fm.usp.br
Artigo submetido: 6/3/2017.
Artigo aceito: 23/9/2017.
Conflitos de interesse: não há.



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter