

Original Article - Year 2017 - Volume 32 -
Mastectomia redutora de pele com retalho dermogorduroso de pedículo inferior na reconstrução imediata de mamas com médias e grandes hipertrofias
Skin-reducing mastectomy using inferior pedicle dermal fat flaps in immediate reconstruction of medium and large hypertrophic breasts
RESUMO
INTRODUÇÃO: O câncer de mama é o tipo mais comum entre as mulheres (excetuando-se os de pele não melanoma) e nos últimos anos seu tratamento evoluiu muito com as mastectomias preservadoras de pele. As mamas com ptose grau II e III são de difícil abordagem e necessitam da redução estética do envelope cutâneo após o procedimento de adenomastectomia.
MÉTODOS: Foi realizado um estudo retrospectivo de janeiro de 2013 a janeiro de 2016 em que foram incluídas todas as pacientes submetidas à adenomastectomia e reconstruídas imediatamente através de redução do envelope cutâneo com a técnica de marcação de Pitanguy associada ao emprego de prótese ou expansor no plano submuscular superiormente e abaixo do retalho dermicogorduroso inferiormente.
RESULTADOS: Um total de 15 pacientes foram operadas pela técnica proposta, contabilizando um total de 25 mamas (10 casos foram bilaterais). Doze pacientes apresentavam câncer, duas realizaram cirurgia profilática e uma apresentava fibroadenoma gigante juvenil. Em dois casos foi utilizado expansor e em 23 mamas foi colocada a prótese definitiva em um único tempo cirúrgico. Em três mamas o complexo aerolopapilar (CAP) foi ressecado por motivos oncológicos; dos 22 preservados, em 15 foi realizado enxerto e em 7 ascensão através de retalho de pedículo superior. Houve 5 casos de complicação (20%), sendo 3 seromas (12%), 1 necrose na junção do 'T' (4%), e 1 necrose total do CAP (4%).
CONCLUSÃO: A técnica descrita fornece um método eficaz e reproduzível de reconstrução mamária imediata com prótese em um tempo único em pacientes com mamas volumosas. Contudo, deve-se selecionar bem os pacientes, pois não se pode negligenciar os riscos de complicações.
Palavras-chave: Neoplasias da mama; Mastectomia subcutânea; Mamoplastia; Retalhos cirúrgicos; Implantes de mama.
ABSTRACT
INTRODUCTION: Breast cancer is the most common type of neoplasm among women (except for non-melanoma skin cancers), and in the past few years, its treatment greatly evolved with skin-sparing mastectomies. Breasts with grades II and III ptosis are difficult to approach and require an aesthetic reduction of the cutaneous envelope after adenomastectomy.
METHODS: A retrospective study was conducted from January 2013 to January 2016. This included all patients undergoing adenomastectomy and immediate reconstruction via reduction of the cutaneous envelope using Pitanguy's marking technique associated with the use of a prosthesis or expander above the submuscular plane and below the dermal fat flap.
RESULTS: A total of 15 patients were operated on based on the proposed technique, accounting for a total of 25 breasts (10 cases were bilateral). Twelve patients had cancer; two underwent prophylactic surgery; and one developed juvenile giant fibroadenoma. In two cases, an expander was used, and in 23 breasts, a definitive prosthesis was placed in a single surgical period. In three breasts, the nipple-areolar complex (NAC) was resected for oncological reasons; of the 22 preserved, 15 underwent grafting, and seven underwent elevation through the superior pedicle flap. There were five complications (20%): three seromas (12%), one necrosis at the "T" junction (4%), and one total NAC necrosis (4%).
CONCLUSION: The technique described is an effective and reproducible method of immediate breast reconstruction using implants in a single period in patients with large breasts. However, the right patients should be selected because the risks of complications cannot be neglected.
Keywords: Breast neoplasms; Subcutaneous mastectomy; Mammoplasty; Surgical flaps; Breast Implants.
O câncer de mama é o tipo de câncer mais comum entre as mulheres no Brasil e no mundo, depois do de pele não melanoma, respondendo por cerca de 25% dos casos novos a cada ano. A estimativa de novos casos para este ano de 2016 no Brasil, segundo o INCA, é de 57.9601.
O tratamento do câncer de mama evoluiu muito nos últimos anos. O diagnóstico e o início precoce do tratamento são essenciais. Para os casos em que a mastectomia se faz necessária, as opções de reconstrução já são bem estabelecidas. As mastectomias com preservação de pele facilitaram muito os métodos de reconstrução e os resultados estéticos nos casos em estágios iniciais2,3. Poupando-se o envelope cutâneo e o sulco inframamário consegue-se um resultado muito mais satisfatório na reconstrução4. O complexo areolopapilar (CAP) também pode ser preservado, quando sua manutenção não comprometer os protocolos da terapia oncológica.
As possibilidades de reconstrução tipicamente incluem expansores ou implantes; retalhos pediculados, usualmente o retalho miocutâneo do músculo reto abdominal (TRAM) ou o retalho miocutâneo do músculo grande dorsal; ou retalhos livres como o TRAM livre e o retalho perfurante da artéria epigástrica inferior profunda (DIEP). Embora a reconstrução com tecidos autólogos tenha um resultado a longo prazo mais satisfatório, as reconstruções com implante ou expansor são muito utilizadas por serem um procedimento mais simples e rápido, trazendo menor morbidade operatória para a paciente4,5.
As mamas volumosas são de difícil abordagem ao se propor uma adenomastectomia, uma vez que o envelope cutâneo é extenso, sendo difícil o resultado final estético e harmonioso. Dentro deste contexto, foi descrita, primeiramente por Bostwick6, uma técnica de mastectomia com redução de pele, que é realizada através de uma incisão de mamoplastia redutora clássica "wise pattern" associada ao emprego de implante ou expansor no plano submuscular superiormente e abaixo do retalho dermogorduroso inferiormente, resultando numa cicatriz externa em T-invertido.
OBJETIVO
O objetivo deste artigo é relatar a aplicabilidade da técnica de mastectomia com redução de pele, que é realizada através de uma incisão de mamoplastia redutora clássica de Pitanguy associada ao emprego de implante ou expansor no plano submuscular superiormente e abaixo do retalho dermogorduroso inferiormente, resultando numa cicatriz externa em T-invertido em mamas com médias e grandes hipertrofias.
MÉTODOS
Foi realizado um estudo retrospectivo em que foram incluídas todas as pacientes submetidas à adenomastectomia e reconstruídas imediatamente por meio de redução do envelope cutâneo com a técnica de marcação de Pitanguy e uso do retalho dermogorduroso de pedículo inferior. O estudo foi realizado no período de janeiro de 2013 a janeiro de 2016 em pacientes selecionadas no Centro de Mama do Hospital São Lucas da Pontifícia Universidade Católica do Rio Grande do Sul e na clínica privada do autor. O estudo seguiu os princípios de Helsinque, tendo todos os pacientes recebido e concordado com o Termo de Consentimento Livre e Esclarecido.
Foram revisados os dados das pacientes, como: idade, tabagismo e comorbidades; assim como a indicação para cirurgia, incluindo o tipo de tumor, e a realização de quimioterapia e radioterapia.
As características das reconstruções, assim como as complicações, também foram revisadas. Foram consideradas complicações maiores as que evoluíram para a perda da reconstrução (retirada do implante), sendo as demais consideradas menores.
Para ser possível realizar a técnica descrita, é necessário que as pacientes possuam mamas de médio a grande volume com ao menos grau II de ptose mamária, mas idealmente com Grau III de Reignault. Utilizamos os critérios de Nava et al.4, que incluem mamas pendulares com a distância da aréola ao sulco infra mamário maior que 8 cm e a distância da fúrcula esternal à papila maior que 25 cm.
O CAP foi preservado apenas nos casos em que não havia acometimento macroscópico do mesmo ou em que as margens retroareolares foram negativas na congelação intraoperatória.
Técnica cirúrgica
A marcação pré-operatória é realizada com a paciente em pé, através da marcação clássica de mamoplastia de Pitanguy7 com algumas particularidades. Inicialmente, são marcadas a linha média, o meridiano mamário, o sulco inframamário e a linha axilar anterior. O ponto A é marcado ao nível do sulco inframamário e os pontos B e C são marcados o mais próximo possível das aréolas, mantendo-se as distâncias AB e AC entre 8 e 10 cm. Uma linha une o ponto B ao sulco inframamário medialmente, e outra, o ponto C ao sulco inframamário lateralmente (Figura 1).
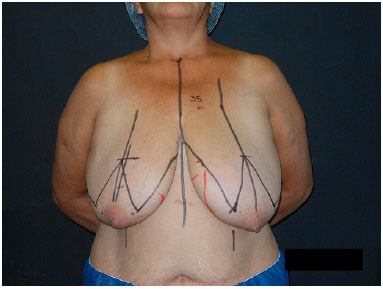
Figura 1. Marcação pré-operatória conforme Pitanguy.
A cirurgia inicia com a desepidermização de todo o polo inferior da mama (Figura 2) e, posteriormente, quando planejado enxerto do CAP, o mesmo é removido e colocado em solução salina. Após esta etapa, a equipe de mastologia realiza a adenomastectomia, mantendo todo o retalho do polo inferior como um retalho dermogorduroso (RDG) que irá cobrir toda porção inferior da prótese (Figura 3).
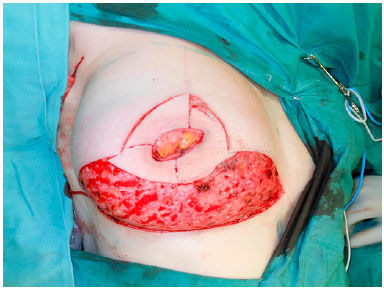
Figura 2. Desepidermização de todo polo inferior da mama.
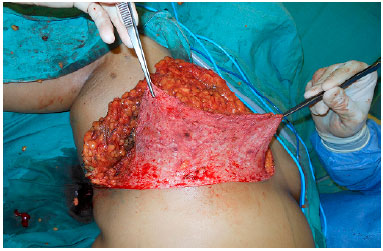
Figura 3. Retalho de pedículo inferior dermogorduroso.
Depois de concluído o procedimento oncológico, a borda lateral do músculo grande peitoral é identificada e o plano submuscular é criado, desinserindo-se o músculo totalmente da sua inserção costal inferior e até o quarto espaço intercostal na sua inserção esternal. O RDG é então suturado no músculo grande peitoral garantindo a cobertura de toda porção inferior da prótese (Figura 4). O músculo serrátil, na maioria das vezes e quando necessário, é dissecado do gradil costal o suficiente para a cobertura da porção lateral do implante, sendo suturado à borda lateral do músculo grande peitoral e do RDG (Figura 5).
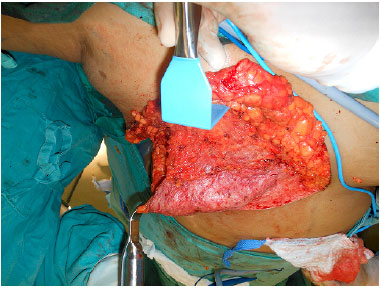
Figura 4. Retalho de pedículo inferior dermogorduroso suturado ao músculo grande peitoral.
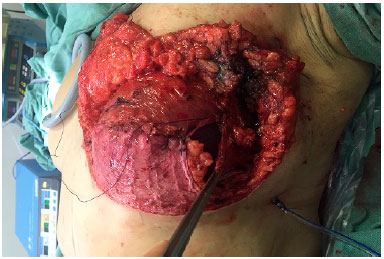
Figura 5. Músculo serrátil anterior auxiliando na cobertura da porção lateral do implante.
Inicia-se o fechamento da pele suturando-se os pontos B e C no meridiano mamário, reposicionando-se assim o envelope cutâneo (Figura 6). O CAP, quando preservado, é nutrido por um pedículo superior e mantido a 4 cm do sulco infra mamário na linha hemiclavicular. Quando realizado enxerto do CAP, a área receptora, localizada também a 4 cm do sulco inframamário, é desepidermizada e o CAP é suturado no local (Figura 7) e o curativo de Brown é então realizado. A sutura das demais incisões é realizada e a cicatriz resultante é em "T" invertido. Rotineiramente é utilizado um dreno de sucção (porto-vac) dentro da loja com o implante.
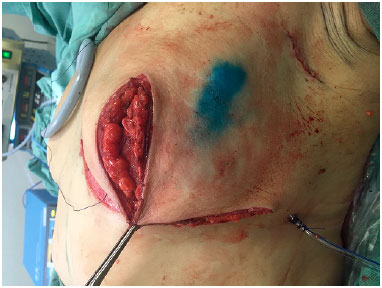
Figura 6. Reposicionamento do envelope cutâneo suturando-se os pontos B e C no meridiano mamário.
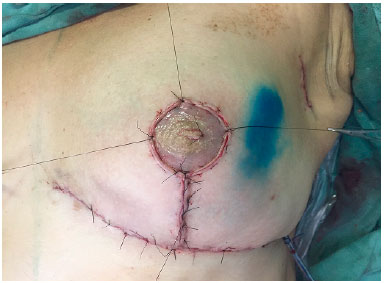
Figura 7. Enxerto do complexo areolopapilar: área receptora localizada a 4 cm do sulco inframamário
Em todas as pacientes é utilizado o sutiã cirúrgico desde a saída da sala cirúrgica até completar-se um mês de pós-operatório. O curativo de Brown é retirado após cinco dias e o dreno é mantido até o débito estar menor que 30 ml em 24 horas com conteúdo seroso.
RESULTADOS
Um total de 15 pacientes foram operadas pela técnica proposta, contabilizando um total de 25 mamas (10 casos foram bilaterais). Doze pacientes apresentavam câncer, duas realizaram cirurgia profilática e uma apresentava fibroadenoma gigante juvenil.
A idade média foi de 49,25 anos (25-69), sendo oito pacientes hígidas e sete com comorbidades. Duas pacientes eram hipertensas controladas e cinco eram obesas (Tabela 1).

Nos dois primeiros casos, os quais foram unilaterais, foram colocados expansores que foram substituídos, em um segundo tempo cirúrgico, por implantes mamários. Em todas as outras mamas foi colocado o implante definitivo em um único tempo cirúrgico, contabilizando um total de 23 implantes mamárias. Todos os implantes eram redondos, texturizados e de perfil alto, sendo o volume médio de 293 ml (200-400 ml) (Tabela 2).

Em três mamas o CAP foi ressecado por motivos oncológicos. Dos 22 preservados, em 15 foi realizado enxerto e em 7 ascensão através de retalho de pedículo superior (Tabela 2).
Em relação ao tratamento complementar, três pacientes realizaram quimioterapia neoadjuvantes, quatro realizaram quimioterapia adjuvante e três realizaram radioterapia adjuvante (Tabela 3).

Quanto ao diagnóstico patológico, houve 10 carcinomas ductal invasor, 3 carcinomas lobular invasor, 2 fibroadenomas juvenil gigante e em 10 casos foi realizada mastectomia profilática (Tabela 4).

As cinco pacientes que realizaram procedimento unilateral apresentavam carcinoma ductal invasor. Das dez que realizaram procedimento bilateral, uma apresentava fibroadenoma gigantes juvenil, duas realizaram cirurgia profilática bilateral, quatro apresentavam carcinoma ductal invasor numa mama e realizaram a cirurgia contralateral profilática, duas apresentavam carcinoma lobular invasor numa mama e realizaram a cirurgia contralateral profilática, e uma paciente apresentava carcinoma lobular invasor numa mama e carcinoma ductal invasor contralateral.
Houve cinco casos de complicação (20%), sendo 3 seromas (12%), 1 necrose na junção do 'T' (4%) e 1 necrose total do CAP (4%). Destes casos, um foi considerado uma complicação maior, já que evoluiu para perda da reconstrução (caso citado abaixo) e quatro foram considerados complicações menores (Tabela 5).

Referente aos casos de seroma, a primeira paciente evoluiu para infecção, exigindo a retirada do implante por um período de seis meses e posterior reconstrução com retalho do músculo grande dorsal associado a implante (complicação maior). A segunda paciente evoluiu para deiscência da ferida operatória com extrusão da prótese, sendo levada ao bloco cirúrgico para lavagem da loja, retirada do implante extruso e troca por um novo implante. A terceira paciente exigiu intervenção devido à cronicidade do quadro de seroma, que persistiu após múltiplas punções guiadas por ecografia, sendo levada à sala operatória para lavagem da loja e troca do implante com inserção de dreno de sucção de porto-vac. Todos estes casos evoluíram bem após as intervenções citadas acima.
A paciente que apresentou necrose na junção do "T" foi tratada com desbridamento e sutura a nível ambulatorial; assim como a paciente que apresentou necrose total do CAP que foi desbridado e realizado enxerto de pele total (Figura 8). Todos os enxertos de CAP integraram 100%, às custas de algum achatamento da papila e algum grau de despigmentação (Figura 9).
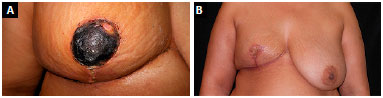
Figura 8. A: Necrose total do complexo areolopapilar; B: Aspecto final após o desbridamento e enxerto de pele total.
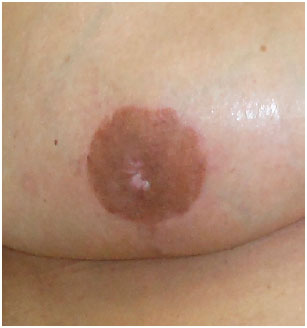
Figura 9. Aspecto final do enxerto de complexo areolopapilar (notar o achatamento de papila e algum grau de despigmentação).
DISCUSSÃO
O termo "mastectomia poupadora de pele" foi introduzido por Toth e Lappert, apud Hammond et al.8, em 1991, que sugeriram a realização de mastectomia com preservação do envelope cutâneo para um melhor resultado estético da mama operada. A segurança oncológica em termos de recorrência local já foi documentada por vários autores3,9-15.
Carlson et al.3 descreveram quatro tipos de mastectomia poupadora de pele, os quais são baseados no tipo de incisão e quantidade de pele excisada. Os tipos de I a III são utilizados em mamas pequenas com ptose leve através de incisões periareolares. O tipo IV é utilizado em mamas volumosas com ptose importante que exigem a ressecção estética do envelope cutâneo.
Regnault16 classificou o grau de ptose das mamas, definindo como grau II as mamas em que a papila está pouco abaixo do sulco inframamário, mas com polo inferior ainda visível, e como grau III as mamas em que a papila está bem abaixo do sulco inframamário, não apresentando polo inferior visível. Estas pacientes com mamas volumosas em que se pensaria em realizar mastectomia poupadora de pele beneficiam-se muito da reconstrução com a ressecção estética da pele e cobertura do implante com retalho dermogorduroso de pedículo inferior e músculo grande peitoral.
A técnica anteriormente descrita, nomeada de "Mastectomia Redutora de Pele" por Nava et al.13 em 2006, oferece uma loja adequada para colocação do implante, sem tensão excessiva e com diminuição do risco de extrusão da prótese de mama em caso de necrose dos retalhos de pele, já que a mesma está coberta com tecidos autólogos. A colocação do implante numa loja coberta com tecidos bem vascularizados traz mais segurança e, consequentemente, conforto ao cirurgião plástico5. Em caso de necrose de pele, tão frequente quanto 27% na área de junção do "T", o tratamento consiste apenas em curativos15. Em nossa casuística tivemos um caso de necrose na junção do "T", a qual foi tratada com ressutura em nível ambulatorial com anestesia local.
Hammond et al.8, em seu trabalho, relatam a realização desta cirurgia por meio da reconstrução em dois tempos com o uso de expansores. Em nossa casuística utilizamos expansor nos primeiros dois casos, devido à falta de experiência e credibilidade da perfusão dos retalhos. Porém, notou-se que a loja era extremamente adequada e segura para reconstrução em um tempo com uso de implante mamário definitivo.
A colocação do implante mamário numa loja apenas com o músculo grande peitoral acarreta uma cobertura inadequada da porção inferior do mesmo, uma vez que nesta área muitas vezes temos a cobertura apenas com tecido celular subcutâneo. Com a técnica utilizada, conseguimos uma cobertura total do implante com tecido autógeno, sem a necessidade de materiais como telas ou matriz dérmica acelular (ADM) para cobertura da porção inferolateral do implante. O uso destas matérias alógenas aumenta os custos da cirurgia, além de terem suas próprias complicações. Além disso, no Brasil ainda não é permitido o uso da ADM.
Com a técnica descrita, o implante não tem a tendência de migrar para o polo superior, uma vez que temos espaço suficiente no polo inferior para sua acomodação. Assim, com o tempo, o implante acaba sofrendo uma ptose natural e desejável8. Além disso, quanto maior a mama da paciente no pré-operatório, maior o retalho inferior que conseguimos, conseguindo-se fazer uma loja adequada para inserção direta de um implante volumoso sem restringir sua projeção, fato que descarta a necessidade de um expansor tecidual. Em nossa experiência, conseguimos utilizar implantes até de 400 ml em uma loja com volume adequado sem causar tensão nos tecidos adjacentes.
O número de complicações relacionadas a esta cirurgia é aceitável frente à relativa complexidade do ato operatório. Hudson e Skoll5 relataram 15,7% de complicações em 19 mamas operadas. Hammond et al.8 relataram 16,6% de complicações em 12 mamas operadas com o uso de expansor. Nava et al.13 relataram 33,3% de complicações em 30 mamas operadas. Ladizinsky et al.17 relataram 24% de complicações em 170 mamas operadas. De Vita et al.18 relataram 25% de complicações em 88 mamas operadas.
Em nossa casuística, tivemos 20% de complicações em 25 mamas operadas, sendo o seroma a complicação mais comum, apesar do uso de drenos de sucção a vácuo de rotina que eram mantidos de forma conservadora até o débito estar menor que 30 ml em 24 hs com conteúdo seroso. Todos estes casos de seroma evoluíram para tratamento cirúrgico, porém somente um evoluiu com perda da reconstrução, sendo necessária uma cirurgia de reconstrução com retalho do músculo grande dorsal associado a implante 11 meses após a retirada do implante inicial. Nos demais casos de seroma foi realizada cirurgia para lavagem da cavidade, troca do implante e colocação de dreno de sucção, tendo os dois casos evoluído bem.
Nos primeiros casos realizamos a ascensão do CAP com retalhos de pedículo superior, porém devido à dúvida da adequada vascularização do mesmo no transoperatório e após o primeiro caso de necrose total do CAP, passamos a enxertar todos os CAP quando os mesmos podem ser preservados do ponto de vista oncológico. Assim como King et al.19, retiramos todo tecido retroareolar até a derme e enviamos o material para congelação e anatomopatológico definitivo, configurando uma maior segurança oncológica. Com esta técnica, conseguimos resultados adequados sem nenhuma perda de CAP, porém às custas de um achatamento de papila e possibilidade de descoloração do CAP.
A marcação clássica de Pitanguy para mamoplastia redutora traz segurança e confiabilidade nos casos em que é necessária a simetrização da mama oposta, uma vez que a marcação cutânea de uma mama pode ser facilmente transposta para a outra, acarretando simetria adequada na reconstrução. Em todos os casos unilaterais, foi realizada a simetrização na mama oposta através da técnica clássica de Pitanguy7, resultando em mamas relativamente simétricas (Figuras 10 e 11).
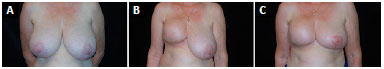
Figura 10. A: Pré-operatório de paciente com mamas volumosas, apresentando ptose grau III; B: Pós-operatório de um ano e nove meses da mastectomia redutora de pele à direita com implante de 325 ml redondo e perfil alto; C: Dois anos após a mastectomia redutora de pele e já tendo realizada a simetrização da mama oposta pela técnica de Pitanguy.
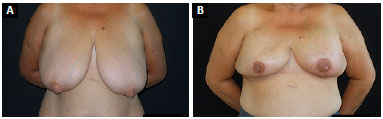
Figura 11. A: Pré-operatório de paciente com mamas muito pendulares, apresentando ptose grau III; B: Seis meses de pós-operatório de mastectomia redutora de pele bilateral com enxerto de CAP e inserção de implante de 400 ml redondo e perfil alto.
CONCLUSÃO
Hoje em dia, o tratamento cirúrgico do câncer de mama deve ser bem planejado, buscando-se também um resultado adequado do ponto de vista estético. A técnica descrita de mastectomia com redução de pele, que é realizada através de uma incisão de mamoplastia redutora clássica de Pitanguy associada ao emprego de implante ou expansor no plano submuscular superiormente e abaixo do retalho dermogorduroso inferiormente, resultando numa cicatriz externa em T-invertido, fornece um método eficaz e reproduzível de reconstrução mamária imediata em pacientes com mamas com médias e grandes hipertrofias. Consegue-se uma cobertura total do implante com tecido autógeno, fornecendo proteção na ferida operatória no seu polo inferior pelo RDG, além de permitir o uso de implantes volumosos sem restringir sua projeção.
COLABORAÇÕES
FFL Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva. Rio de Janeiro: Inca; 2016. [acesso 2016 Abr 16]. Disponível em: www2.inca.gov.br
2. Toth BA, Lappert P. Modified skin incisions for mastectomy: the need for plastic surgical input in preoperative planning. Plast Reconstr Surg. 1991;87(6):1048-53. PMID: 1852020 DOI: http://dx.doi.org/10.1097/00006534-199106000-00006
3. Carlson GW, Bostwick J 3rd, Styblo TM, Moore B, Bried JT, Murray DR, et al. Skin-sparing mastectomy. Oncologic and reconstructive considerations. Ann Surg. 1997;225(5):570-5. DOI: http://dx.doi.org/10.1097/00000658-199705000-00013
4. Nava MB, Ottolenghi J, Pennati A, Spano A, Bruno N, Catanuto G, et al. Skin/nipple sparing mastectomies and implant-based breast reconstruction in patients with large and ptotic breast: oncological and reconstructive results. Breast. 2012;21(3):267-71. DOI: http://dx.doi.org/10.1016/j.breast.2011.01.004
5. Hudson DA, Skoll PJ. Complete one-stage, immediate breast reconstruction with prosthetic material in patients with large or ptotic breasts. Plast Reconstr Surg. 2002;110(2):487-93. DOI: http://dx.doi.org/10.1097/00006534-200208000-00018
6. Bostwick J. Prophylatic (risk reducing) mastectomy and reconstruction. In: Bostwick J, ed. Plastic and Reconstructive Breast Surgery. St. Louis: Quality Medical Publishing; 1990. p. 1369-73.
7. Pitanguy I. Surgical treatment of breast hypertrophy. Br J Plast Surg. 1967;20(1):78-85. PMID: 5339723 DOI: http://dx.doi.org/10.1016/S0007-1226(67)80009-2
8. Hammond DC, Capraro PA, Ozolins EB, Arnold JF. Use of a skin-sparing reduction pattern to create a combination skin-muscle flap pocket in immediate breast reconstruction. Plast Reconstr Surg. 2002;110(1):206-11. PMID: 12087255 DOI: http://dx.doi.org/10.1097/00006534-200207000-00035
9. Kroll SS, Ames F, Singletary SE, Schusterman MA. The oncologic risks of skin preservation at mastectomy when combined with immediate reconstruction of the breast. Surg Gynecol Obstet. 1991;172(1):17-20. PMID: 1985335
10. Carlson GW, Styblo TM, Lyles RH, Jones G, Murray DR, Staley CA, et al. The use of skin sparing mastectomy in the treatment of breast cancer: The Emory experience. Surg Oncol. 2003;12(4):265-9. DOI: http://dx.doi.org/10.1016/j.suronc.2003.09.002
11. Carlson GW, Styblo TM, Lyles RH, Bostwick J, Murray DR, Staley CA, et al. Local recurrence after skin-sparing mastectomy: tumor biology or surgical conservatism? Ann Surg Oncol. 2003;10(2):108-12. PMID: 12620903
12. Gerber B, Krause A, Reimer T, Müller H, Küchenmeister I, Makovitzky J, et al. Skin-sparing mastectomy with conservation of the nipple-areola complex and autologous reconstruction is an oncologically safe procedure. Ann Surg. 2003;238(1):120-7. PMID: 12832974 DOI: http://dx.doi.org/10.1097/01.SLA.0000077922.38307.cd
13. Nava MB, Cortinovis U, Ottolenghi J, Riggio E, Pennati A, Catanuto G, et al. Skin-reducing mastectomy. Plast Reconstr Surg. 2006;118(3):603-10. DOI: http://dx.doi.org/10.1097/01.prs.0000233024.08392.14
14. Veronesi U, Cascinelli N, Mariani L, Greco M, Saccozzi R, Luini A, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med. 2002;347(16):1227-32. PMID: 12393819 DOI: http://dx.doi.org/10.1056/NEJMoa020989
15. Derderian CA, Karp NS, Choi M. Wise-pattern breast reconstruction: modification using AlloDerm and a vascularized dermal-subcutaneous pedicle. Ann Plast Surg. 2009;62(5):528-32. DOI: http://dx.doi.org/10.1097/SAP.0b013e3181a0cfee
16. Regnault P. Breast ptosis. Definition and treatment. Clin Plast Surg. 1976;3(2):193-203.
17. Ladizinsky DA, Sandholm PH, Jewett ST, Shahzad F, Andrews K. Breast reconstruction with the Bostwick autoderm technique. Plast Reconstr Surg. 2013;132(2):261-70. PMID: 23897325 DOI: http://dx.doi.org/10.1097/pRS.0b013e3182958774
18. De Vita R, Pozzi M, Zoccali G, Costantini M, Gullo P, Buccheri EM, et al. Skin-reducing mastectomy and immediate breast reconstruction in patients with macromastia. J Exp Clin Cancer Res 2015;34:120. DOI: http://dx.doi.org/10.1186/s13046-015-0227-5
19. King IC, Harvey JR, Bhaskar P. One-stage breast reconstruction using the inferior dermal flap, implant, and free nipple graft. Aesthetic Plast Surg. 2014;38(2):358-64. PMID: 24477522 DOI: http://dx.doi.org/10.1007/s00266-014-0276-8
1. Sociedade Brasileira de Cirurgia Plástica, Porto Alegre, RS, Brasil
2. Centro de Mama, Hospital São Lucas, Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre, RS, Brasil
Instituição: Hospital São Lucas, Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre, RS, Brasil.
Autor correspondente:
Francisco Felipe Laitano
Avenida Ipiranga, Conjunto 520 - Jardim Botânico
Porto Alegre, RS, Brasil - CEP 26599-000
E-mail: fflpoa@hotmail.com
Artigo submetido: 31/7/2016.
Artigo aceito: 10/7/2017.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter