

Special Article - Year 2017 - Volume 32 -
Critérios práticos para uma lipoaspiração mais segura: uma visão multidisciplinar
Practical criteria for a safer liposuction: a multidisciplinary approach
RESUMO
O Capítulo de Cirurgia do Contorno Corporal da Sociedade Brasileira de Cirurgia Plástica realizou em 2012 um amplo estudo dos parâmetros de segurança para a realização de uma lipoaspiração, antecedendo ao curso do Capítulo, realizado em 2013, no Rio de Janeiro, durante o 50º Congresso Brasileiro de Cirurgia Plástica, com a presença do ilustre Dr. Yves Gérard Illouz e grande número de participantes. Os autores realizaram uma revisão e atualização destes parâmetros, incorporando recentes avanços e sistematizando de forma prática as informações relevantes para a realização de uma lipoaspiração mais segura. Com a colaboração de anestesiologista, intensivista e cirurgião vascular, experientes no suporte ao procedimento, são apresentadas novas orientações práticas para o pré-operatório, trans e pós-operatório de uma lipoaspiração mais segura.
Palavras-chave: Lipectomia; Segurança do paciente; Complicações intraoperatórias; Complicações pós-operatórias.
ABSTRACT
In 2012, the Research Group on Body Contouring Surgery of the Brazilian Society of Plastic Surgery conducted an extensive study on the safety of liposuction before the initiation of the course of the Group, held in 2013 in Rio de Janeiro during the 50th Brazilian Congress of Plastic Surgery, with the presence of the illustrious Dr. Yves Gérard Illouz and a large number of participants. The authors performed a review and update of the safety parameters, incorporating recent advances and systematizing relevant information for the execution of a safer liposuction. With the collaboration of anesthesiologist, intensive care physician, and vascular surgeon, all with extensive experience in supporting the procedure, new practical guidelines were presented for a safer liposuction on the preoperative, transoperative, and postoperative periods.
Keywords: Lipectomy; Patient safety; Intraoperative complications; Postoperative complications
A lipoaspiração é o segundo procedimento mais realizado no Brasil, de acordo com o levantamento realizado pelo Datafolha publicado em 20091. Pesquisa mais recente aponta que em 2011 a lipoaspiração foi a cirurgia plástica mais realizada em nosso território, perfazendo um total de 211.108 procedimentos2. Em um levantamento mundial promovido pela ISAPS, entre 11.599.336 procedimentos cirúrgicos estéticos realizados no mundo em 2013, 1.614.031 foram lipoaspirações, sendo o Brasil o primeiro colocado em número total de procedimentos cirúrgicos estéticos3.
A mortalidade na lipoaspiração varia de 1 para 5000 pacientes (American Society of Plastic Surgeons, 1998) até 1 a cada 47.425 lipoaspirações realizadas por cirurgiões plásticos com reconhecido background em procedimentos estéticos (American Society for Aesthetic Plastic Surgery - ASAPS, 2001)4. A ASAPS, no ano de 2000, publicou uma pesquisa5 na qual foi relatada uma mortalidade de 19,1 para cada 100.000 lipoaspirações, sendo o tromboembolismo pulmonar a causa mortis mais frequente.
A grandiosa contribuição da lipoaspiração para a Cirurgia Plástica foi rapidamente assimilada por inúmeros cirurgiões plásticos em todo o mundo. Apesar de muitas inovações, desde a já abandonada dry tecnique até a lipoaspiração a laser, o princípio de retração da pele sobre um leito formado de túneis ocos tem-se mantido através dos anos. No entanto, as indicações, normas de segurança e refinamentos técnicos têm sofrido inúmeras variações por conta da criatividade, estudo e experiência de conceituados cirurgiões, e particularmente por imposições de ordem legal e normativa, variando consideravelmente de um país para outro.
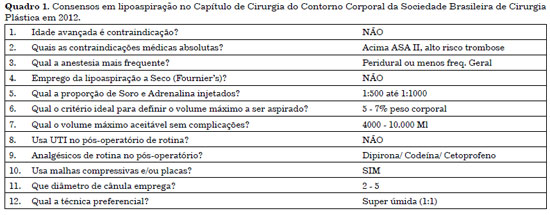
Em 2012, o Capitulo de Cirurgia do Contorno Corporal da Sociedade Brasileira de Cirurgia Plástica (SBCP) enviou um questionário com 34 perguntas para o Conselho Científico do Capítulo. As respostas obtidas em consenso estão sintetizadas no Quadro 1.
O problema do excesso de peso e obesidade tem alcançado proporções epidêmicas no mundo todo. As projeções da Organização Mundial de Saúde apontam que em 2025 cerca de 2,3 bilhões de pessoas no mundo estarão com sobrepeso, e mais de 700 milhões, serão considerados obesos6. No Brasil, segundo pesquisa realizada pelo Ministério da Saúde em 2014, 52,5% da população encontra-se acima do peso ideal (esse índice era de 43% em 2006) e 17,9% da população está obesa (Índice de Massa Corporal - IMC - maior ou igual a 30 kg/m2)7.
O aumento no número de obesos no mundo e no Brasil, a grande dificuldade no seu tratamento dietético e as morbidades inerentes à cirurgia bariátrica têm contribuído para que muitos destes pacientes procurem a lipoaspiração como tratamento, sendo rejeitados para tal pela maioria dos cirurgiões plásticos, com a premissa clássica da lipoaspiração como uma forma de tratamento exclusiva para as gorduras localizadas. Os autores cirurgiões plásticos reavaliaram essa indicação a partir de relatos pessoais de pacientes obesos, em que a lipoaspiração foi usada como coadjuvante na abordagem nutricional e no estímulo à prática de exercícios físicos.
O uso da técnica super úmida ("Superwet" ou 1:1) tem sido recomendado pela maioria dos autores como a mais adequada para uma lipoaspiração segura8. No entanto, na prática diária, o cirurgião plástico não vai limitar a quantidade de gordura aspirada pelo valor numérico infiltrado, ou seja, só vai ter inequívoca certeza de que realizou uma lipoaspiração super úmida (1:1) ao final do procedimento, quando contabilizar o conteúdo do frasco da lipoaspiração, comparando-o ao total transoperatoriamente infiltrado no subcutâneo. Este paradoxo requer uma atenção específica no pós-operatório, evitando que a reposição hídrica em excesso predisponha ao edema agudo de pulmão, ou pela sua insuficiência contribua para um choque hipovolêmico no outro extremo.
O volume máximo a ser aspirado com segurança em uma lipoaspiração tem sido motivo de muitas controvérsias9. De acordo com seu idealizador, Yves Gerard Illouz, o volume lipoaspirado não deveria ultrapassar 6 a 8% do peso corporal ou, ainda, não ser mais extenso que 30% da superfície corporal do paciente10.
A pertinente resolução do Conselho Federal de Medicina do Brasil determinou que os volumes aspirados não devem ultrapassar 7% do peso corporal quando se usar a técnica infiltrativa; ou 5% quando se usar a técnica não infiltrativa. A mesma normativa determinou ainda que a área total lipoaspirada não deve ultrapassar 40% da área corporal, seja qual for a técnica usada11.
Um levantamento da SBCP - Regional São Paulo, divulgado em 2014, verificou que 47,65% dos cirurgiões utilizam o limite de 7% do peso corporal, 39,60% o limite de 5% e 8,05% dos cirurgiões limitam a 3% o volume total lipoaspirado em um paciente12. Os Estados Unidos, por sua vez, não possuem uma regra bem estabelecida: Alguns estados instituíram limites máximos para uma lipoaspiração variando de 1000 a 5000 cc (por exemplo: Califórnia, Florida, Kentucky, Nova York, Ohio e Tennessee). Quando realizada simultaneamente a outras cirurgias, o estado da Florida restringe o volume de gordura aspirada a 1000 cc e o Tennessee a 2000 cc8.O IMC tem sido correlacionado ao volume máximo seguro a ser lipoaspirado, chegando a 100cc para cada unidade de IMC9.
O emprego de sangue e derivados, ainda que do próprio paciente, implicam sempre em potenciais riscos ao paciente. Estes riscos precisam ser claramente revistos no universo de cirurgias meramente estéticas, como também a conveniência ou não de indicarem-se outras cirurgias eletivas, concomitantemente a uma lipoaspiração.
A prevenção de tromboses e da embolia gordurosa requer, pela sua gravidade, protocolos eficientes, normativos e, se possível, específicos para a lipoaspiração.
Os autores estabeleceram de forma prática e objetiva preceitos atuais para indicação e execução de uma lipoaspiração mais segura, baseados em revisão das recomendações de 2012 do Capítulo de Cirurgia do Contorno Corporal da SBCP, atual revisão bibliográfica orientada pela fisiopatologia conhecida, e na experiência profissional dos autores: cirurgiões plásticos, anestesiologistas, cirurgião vascular e intensivista, todos com ampla experiência no suporte ao procedimento e suas complicações.
DISCUSSÃO
Uma extensa e abrangente revisão sobre a Segurança Cirúrgica nos procedimentos de lipoaspiração, morbidade e mortalidade, foi realizada por Gomes4 em 2003 no Brasil. Em 2009, nos EUA, O Evidence-Based Patient Safety Advisory for Ambulatory Surgery por Haeck et al.8 dedicou 17 páginas aos aspectos relevantes para a segurança do paciente durante e após uma lipoaspiração, sob a ótica da Medicina Baseada em Evidências.
Indicações da lipoaspiração
Duas situações, às vezes simultâneas, podem levar o cirurgião plástico a contraindicar uma lipoaspiração em um paciente saudável: obesidade e flacidez.
Apesar de estudos preliminares apontarem uma melhora nos riscos cardiovasculares, redução da pressão arterial e níveis menores de insulina após a lipoaspiração, esta não tem sido considerada um procedimento padrão para o tratamento da obesidade13. Alguns autores têm considerado a obesidade responsável pela manutenção de um estado inflamatório subclínico, associado a uma leucocitose.
No entanto, não existem até o presente provas inequívocas que a lipoaspiração possa melhorar o perfil lipídico, ou ainda alterar favoravelmente os níveis de leptina, adiponectina, resistina, interleucinas e proteína C-reativa, ou mesmo, reduzir os níveis do fator de necrose tumoral alfa em obesos14. Pacientes com IMC acima de 30 kg/m2 devem ser cuidadosamente avaliados para uma lipoaspiração, visto que possuem maior dificuldade de cicatrização e índices aumentados de infecção, trombose venosa profunda e apneia do sono15.
Vale lembrar que esses pacientes apresentam benefícios de ordem psicológica com a lipoaspiração. Pacientes obesos muitas vezes procuram o cirurgião plástico após o frequente insucesso de dietas, programas físicos e uso de anorexígenos. O primeiro autor, seguindo os ditames clássicos preconizados por Illouz, sempre contraindicou a lipoaspiração nestes casos, questionando atualmente essa contraindicação, após tratar um jovem paciente obeso de 118 kg (Figuras 1A-1D) com uma lipoaspiração de 4500 ml (Figuras 1E-1G). Este paciente tem mantido o resultado obtido por mais de 3 anos, e apresentou uma dramática mudança nos hábitos de vida, iniciando a pratica de esportes, com notável melhora no seu perfil psicossocial.

Figura 1. A: Paciente com 118 Kg, indicado para uma lipoaspiração adjuvante, como tratamento paliativo para a obesidade. Aspecto pré-operatório; B: Aspecto pré-operatório; C: Aspecto pré-operatório; D: Aspecto pré-operatório; E: Paciente com 118 kg, após lipoaspiração adjuvante de 4500 mL, como tratamento paliativo para a obesidade. Aspecto pós-operatório; F: Aspecto pós-operatório; G: Aspecto pós-operatório.
Outros casos do mesmo cirurgião em pacientes obesos, com aspirados entre 5 e 6 litros, têm mostrado recidivas parciais da obesidade em alguns e sucesso em outros. Embora a lipoaspiração não seja um tratamento usual para obesidade8, esta experiência, ainda que subjetiva, sugere que para pacientes que entendam plenamente o caráter adjuvante do tratamento e principalmente a severa limitação estética no resultado (por exemplo, o resultado não pode ser comparado ao obtido em um paciente magro com gordura localizada), a lipoaspiração pode e deve ser indicada nesses casos de obesidade. Deve, no entanto, o cirurgião envolver familiares no esclarecimento destes aspectos, além de proteger-se através de um consentimento informado específico, explicitando o caráter coadjuvante desta indicação.
Outra situação é a da paciente que, apesar de flacidez acentuada no abdômen, requerendo uma dermolipectomia abdominal/lipoabdominoplastia, não aceita estes procedimentos pela cicatriz resultante, possível gravidez futura ou falta de tempo para um pós-operatório adequado (Figuras 2A-2C).
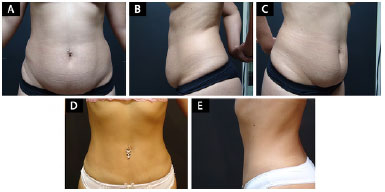
Figura 2. A: Paciente com 27 anos, apresentando lipodistrofia abdominal associada à flacidez, indicada para uma lipoaspiração alternativa, por não aceitar as cicatrizes de uma dermolipectomia. Aspecto pré-operatório; B: Aspecto pré-operatório; C: Aspecto pré-operatório; D: Paciente com 27 anos, apresentando lipodistrofia abdominal associada à flacidez, indicada para uma lipoaspiração alternativa, por não aceitar as cicatrizes de uma dermolipectomia. Aspecto pós-operatório; E: Aspecto pós-operatório.
Os mesmos aspectos mencionados para a paciente obesa valem para estes pacientes: Não podemos prever o nível de retração cutânea e a conveniência do procedimento frente às expectativas estéticas do paciente, mas podemos indicar a lipoaspiração em casos selecionados, pelo nível de entendimento do paciente e pelo aceite das limitações, com resultados gratificantes para o paciente e para o cirurgião (Figuras 2D-2E).
Pré-operatório: avaliação, alertas, jejum e medicações de uso contínuo
A avaliação pré-anestésica deverá ser realizada por médico anestesiologista, conforme dispõe a Resolução nº 1363/93 do Conselho Federal de Medicina (CFM). Esta avaliação é na verdade, o início da anestesia: reduz a morbidade e mortalidade perioperatórias, permite ao anestesiologista planejar a anestesia mais adequada para o caso, e estabelece uma relação pessoal com o paciente, contribuindo para a tranquilidade deste, frente a cirurgia e anestesia programadas.
Na anamnese pré-anestésica o paciente deve ser interrogado sobre alergias (por exemplo: látex, iodo e outras), sobre o abuso de drogas lícitas (benzodiazepínicos, cigarro, álcool) e ilícitas, sem moralismos. O ideal em um paciente tabagista é que ele pare de fumar de seis a oito semanas antes da cirurgia. Caso isso não seja possível, recomenda-se a interrupção pelo menos 24 horas antes da cirurgia, a fim de reduzir os níveis de carboxihemoglobina, aumentando a quantidade de oxigênio liberada para os tecidos. Devemos indagar sobre a data da última menstruação, afinal, várias pacientes que são submetidas a esse procedimento, estão em idade fértil.
Deve-se ter muita cautela com os frequentes usuários de inibidores do apetite entre pacientes candidatos a uma lipoaspiração: estas drogas atuam no sistema nervoso central, liberando noradrenalina na fenda sináptica, ou inibindo a recaptação da noradrenalina na terminação pré-sináptica. Esse aumento de neurotransmissores simpáticos na fenda sináptica leva a uma hiperestimulação simpática, acarretando hipertensão, taquicardia, arritmias e levando a complicações.
A suspensão de tais medicações (anfepramona, femproporex, sibutramina) se faz necessária com pelo menos 14 dias de antecedência. Recomendamos, ainda, a suspensão 15 dias antes da cirurgia, dos antidepressivos inibidores da MAO (monoaminoxidase).
Embora antiagregantes plaquetários sejam geralmente suspensos de 7 - 10 dias antes de cirurgias com alto risco de sangramentos, existem controvérsias quanto à conveniência da suspensão do AAS em pacientes que o utilizam profilaticamente: a suspensão abrupta do seu uso pode contribuir ao ambiente pró-trombótico comum a todos os pós-operatórios. A suspensão do AAS em pacientes que o utilizam profilaticamente não tem encontrado evidências de benefício em cirurgias com baixo risco de sangramento16 como a lipoaspiração.
O uso de fitoterápicos como o ginseng, gingko biloba e gengibre deve ser suspenso 7 dias antes da cirurgia, pelo potencial risco de elevação do sangramento na cirurgia e no procedimento anestésico. Diabéticos usuários de hipoglicemiantes orais devem suspendê-los para evitar hipoglicemia no período de jejum. Caso necessário, pode-se utilizar insulina regular. Diabéticos insulinodependentes devem ajustar a dose no pré-operatório, e não interromper, levando-se em conta o número de refeições que irão perder.
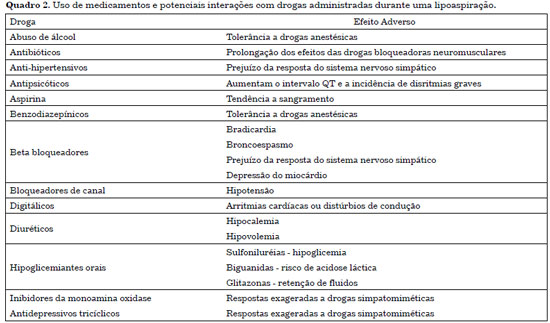
Medicamentos de uso crônico como anti-hipertensivos, hipolipemiantes, broncodilatadores (inclusive os beta agonistas inalatórios e os inibidores de leucotrienos), antidepressivos não inibidores da MAO, anticonvulsivantes, remédios para doenças tireoidianas, devem ser mantidos, mesmo no dia da cirurgia. Usuários crônicos de corticosteroides devem receber reposição dos mesmos no intraoperatório, podendo fazer uso da hidrocortisona, assim, evitando insuficiência suprarrenal. No Quadro 2 podemos visualizar o uso de alguns medicamentos e potenciais interações com drogas administradas no período perioperatório17-21.
Devemos pesquisar doenças pré-existentes e experiências anestésicas anteriores (náuseas, vômito, cefaleia pós bloqueio espinhal, dor pós-operatória e outras complicações). A possibilidade de hipertermia maligna anestésica (incidência de 1/50.000 pacientes adultos) também deve ser pesquisada na anamnese, e em caso de suspeita, o diagnóstico padrão é por biópsia muscular, com teste de contração a exposição ao halotano e cafeína (TCHC), pois a dosagem de CPK está elevada em apenas 50% dos parentes de acometidos, e não é específica da hipertermia maligna22.
Após minucioso exame físico e definição do risco cirúrgico (ASA), o anestesiologista pode prescrever medicação pré-anestésica, e recomendações sobre o jejum: após várias alterações, atualmente recomenda-se um jejum de pelo menos 8 horas antes da cirurgia23-26. É mais prudente, segura e prática a generalização do jejum do que a particularização do produto ingerido.
Transoperatório: técnicas, infiltrações (lidocaína e adrenalina), volume máximo e mudança de decúbito
A lipoaspiração seca, que foi preconizada por Pierre Fournier e posteriormente por ele abandonada em favor da técnica tumescente, apresentava uma perda sanguínea de 20 - 45% do aspirado. A técnica super úmida8 (1980), por definição aquela na qual 1 - 2 ml de solução é infiltrada para cada 1 ml de aspirado apresenta uma perda sanguínea de 1 - 2% do aspirado, e é a técnica mais frequentemente empregada em nosso meio.
A técnica tumescente, preconizada por Klein em 1985, infiltra 3 - 4 ml de solução por cada ml infiltrado, usando uma solução contendo 0,025% a 0,1% de lidocaína e 1: 1.000.000 de adrenalina8. Esta técnica tem como principal crítica a consistência rígida da pele a ser aspirada inviabilizando ao cirurgião "abraçar a cânula" com a mão não dominante. A não observância deste cânone técnico pode levar à inadvertida perfuração da parede abdominal, pleura ou ainda do triângulo de Petit, podendo provocar gravíssimos danos a órgãos internos. Outro aspecto importante é que possivelmente 70% do infiltrado vai para o intravascular, num período de 2 a 10 horas, podendo, quando excessivo, levar a um edema agudo de pulmão8.
A lidocaína é relativamente lipossolúvel e metabolizada pelo sistema microssomal hepático. Esta ligação com a gordura do subcutâneo, e a vascularização relativamente pobre sob a pele, retardam sua absorção sistêmica, mas há risco de sintomas tóxicos 6 a 14 horas, ou mesmo 20 horas após o seu uso, caso não se respeitem as doses máximas recomendadas.
No entanto, mesmo em doses adequadas, é importante lembrarmos que a lidocaína tem sua excreção diminuída nas hepatopatias, na redução do fluxo hepático pela adrenalina associada, nas hipoproteinemias, e no uso de alguns medicamentos como o propranolol e a cimetidina. A lidocaína, anexada à adrenalina para anestesia da pele, tem como dose máxima segura 7 mg/kg. Considerando o efeito da adrenalina, a baixa absorção no tecido gorduroso e a aspiração realizada, esta dose foi polemicamente elevada para 35 mg/kg de lidocaína por alguns autores8.
O Quadro 3 mostra os efeitos dos picos plasmáticos da lidocaína. A lidocaína, associada à infiltração tumescente, aumenta consideravelmente a ocorrência de anemia no pós-operatório, segundo Llanos et al.27. Considerando todos estes aspectos e a existência de inúmeros analgésicos eficientes que podem ser utilizados no pós-operatório, não vemos justificativa para o uso da lidocaína nas lipoaspirações sob anestesia peridural ou geral.
Embora adrenalina possa ser empregada seguramente até 10 mg no total8, é prudente não se ultrapassar 0,07 mg/kg, e sempre ter em mente suas contraindicações: hipertensão arterial grave, feocromocitoma, hipertireoidismo, cardiopatias, doenças vasculares periféricas8 e durante o uso de anestésicos halogenados. No caso do uso de halogenados durante a anestesia, recomenda-se reduzir a dose de adrenalina de 0,07 mg/kg para 0,05mg/kg, devido ao risco de arritmias com esta associação.
Um aspecto vital na realização das lipoaspirações é o pleno entendimento das consequências fisiológicas e dos potenciais graves riscos relacionados ao posicionamento do paciente, particularmente durante um bloqueio espinhal. Na posição supina horizontal, a influência da gravidade sobre o sistema vascular é mínima. As pressões intravasculares desde a cabeça até os pés variam pouco em comparação com as pressões médias próximo ao coração.
Em posição prona, se as pernas permanecerem essencialmente horizontais, os gradientes de pressão nos vasos sanguíneos são mínimos, associados à vasodilatação periférica promovida pelo bloqueio espinhal. A possibilidade de uma hipotensão grave ou mesmo uma parada cardíaca na mudança de decúbito deve ser sempre considerada.
A autora anestesiologista recomenda manusear o paciente com movimentos firmes, lentos e por etapas: primeiramente, deslocando o paciente mais lateralmente na mesa cirúrgica, para então promover sua cuidadosa rotação, levando-o ao decúbito ventral. Apesar da escassa literatura sobre o assunto, logo antes da mudança de decúbito, recomendamos ainda a administração de pequena dose de efedrina (5 mg EV) ou etilefrina (1mg EV), contribuindo assim, para evitar uma queda na pressão arterial.
O Conselho Federal de Medicina e a SBCP, por meio da Resolução 1.711 de 10 de dezembro de 200311, limitaram o volume aspirado ao máximo de 7% do peso e 40% da área corporal, com a técnica infiltrativa e sem a coincidência destes parâmetros. A referida resolução considerou para este critério apenas o sobrenadante gorduroso do frasco.
Embora estes critérios sejam normativos, os autores usualmente consideram o volume total aspirado presente no frasco, pela falta de estudos que evidenciem inequivocamente a conveniência de se considerar apenas a fração gordurosa aspirada frente a espoliação hidroeletrolítica provocada, apesar da infiltração realizada. O próprio índice de 7% do peso corporal, embora consensual, é empírico, destarte, não foi obtido por critérios de Medicina Baseada em Evidências.
Pós-operatório: alta no mesmo dia relacionada ao volume aspirado, reposição hidroeletrolítica, emprego de sangue e hemoderivados, tromboses e embolia gordurosa, associações cirúrgicas
A Resolução CFM 1.886/200828 elencou os critérios genéricos para uma alta hospitalar: nível de consciência adequado, estabilidade de sinais vitais (pressão arterial, pulso e temperatura) há pelo menos 1 hora (além de apresentar uma PA compatível com os níveis pré-operatórios e com a idade do paciente), ausência de náuseas e vômitos, ausência de dispneia, capacidade de deglutição (e tosse), capacidade de locomoção, sangramento mínimo e ausência de dor severa ou retenção urinária.
Em termos de lipoaspiração, além desses critérios, cada caso deve ser individualizado29, tendo em mente o uso da lidocaína a ser evitado na infiltração, seus picos tardios quando empregada (Quadro 3), e outros fatores específicos do procedimento. O primeiro autor tem eventualmente realizado lipoaspirações de até 5 litros com alta hospitalar no mesmo dia. Estes pacientes foram submetidos a lipoaspirações de no máximo 5% do seu peso corporal, sem uso de lidocaína, realizada com anestesia peridural e técnica super úmida, no início da manhã, e receberam alta da clínica 8 horas após o procedimento, com todos os critérios elencados satisfatórios, em plenas condições, e sem qualquer intercorrência.
Reposição hidroeletrolítica
Atualmente, por analogia com a reposição em queimados, temos empregado a reposição oral com isotônicos esportivos paralela à hidratação EV quando indicada. Tem sido consenso a manutenção de um debito urinário de 1 ml/kg/hora30 ou ainda um volume residual entre 90 - 140 ml /kg8,30 (volume residual é calculado subtraindo-se do total recebido durante o procedimento em infiltração e soro, a soma de 30% do aspirado com a diurese transoperatória).
Para os pacientes que tiveram uma relação de 1:1 entre infiltração e aspirado, tem sido suficiente a reposição de apenas 1 ml/kg/hora para o período de jejum (usual 3 horas). Para pacientes que tiveram um aspirado maior que o infiltrado se agrega este volume excedente a reposição no pós-operatório em soro fisiológico ou Ringer EV (na verdade apenas 70% do excedente seriam necessários para atender o modelo teórico de 1:1, pois na infiltração apenas 70% do infiltrado retorna para o intravascular).
Um pós-operatório adequado é aquele hemodinamicamente estável e eficiente: a pressão arterial é apenas um dos parâmetros, uma vez que uma hipotensão pós-operatória pode ser um sinal tardio da instalação de um choque ou ainda uma transitória consequência da vasodilatação periférica, frequente durante e após anestesias peridurais.
Empregos de sangue e hemoderivados
Com uma perda de sangue menor que 20% da volemia (cálculo: volemia é 65 ml/kg mulher, 70 ml/kg homem e a perda de sangue na lipoaspiração "super úmida 1:1" é de 1-2% do aspirado), uma hemoglobina não inferior a 9 g/dl e um VG não inferior a 30 (pouco válido, uma vez que só tardiamente reflete a espoliação), é extremamente improvável a necessidade de emprego de sangue no pós-operatório de uma lipoaspiração.
A decisão para transfusão sanguínea ainda é polêmica, pois a indicação embasada em patamares de hematócrito e hemoglobina abaixo de 30% e 10 g/dl, respectivamente, vem caindo cada vez mais em desuso, devido aos riscos de transmissibilidade de doenças e à contenção de custos31. O equilíbrio entre os riscos potenciais e a necessidade da transfusão delineiam suas indicações e requerem astúcia médica, tendo em vista que não se limitam a nenhum critério único, mas sim, pela avaliação do estado clínico em relação ao déficit de fornecimento celular de oxigênio32.
Em pacientes saudáveis o aumento da frequência cardíaca ou do volume sistólico podem ser suficientes para equilibrar a oferta de oxigênio, todavia, em circunstâncias mais avançadas pode haver uma maior dependência da concentração arterial de oxigênio arterial devido ao aumento do consumo de oxigênio (VO2) para manter o metabolismo celular aeróbio e consequente hiperlactatemia33.
Um volume intravascular adequado promove melhorias nos resultados perioperatórios, porém a quantidade e a composição de fluidos ainda permanecem variáveis. Tanto a hipovolemia quanto a hipervolemia podem comprometer a perfusão tecidual, portanto, a reposição equilibrada é fundamental. O volume intravascular pode se alterar durante a anestesia neuraxial pelo bloqueio simpático, aumentando a capacitância venosa ou pela utilização de drogas anestésicas que causam vasodilatação, assim como, durante a cirurgia quando ocorre hemorragia, coagulopatia dilucional ou hipotermia34.
A determinação do volume ideal, quando ocorrem mudanças hemodinâmicas bruscas, é sempre um desafio. A monitorização hemodinâmica, parâmetros laboratoriais e avaliação clínica devem ser os pilares para a recuperação e manutenção de uma hemodinâmica adequada. Podem ser utilizados como parâmetros estáticos para guiar a terapia com fluidos os seguintes critérios: frequência cardíaca, pressão arterial, pressão venosa central, saturação periférica de oxigênio e o fluxo urinário.
No entanto, estes parâmetros não denunciam a presença subclínica de hipovolemia ou hipervolemia. Também podem ser utilizados os parâmetros dinâmicos, como a variação da pressão sistólica, a variação da pressão do pulso, a forma da onda pletismográfica da oximetria de pulso, a análise de ondas arteriais por monitores, assim como o cálculo do volume sistólico por ecocardiografia transesofágica.
A variação respiratória também pode trazer informações úteis para a reposição intravascular, tendo em vista que durante a inspiração na ventilação mecânica há um aumento da pressão torácica, com redução do enchimento do ventrículo direito e esquerdo. Desta forma, as variações no volume sistólico em decorrência das alterações do volume podem ser mensuradas e quando superiores a 10-15% são responsivas à fluidoterapia34.
Entre os benefícios da hemotransfusão, podemos descrever a melhora da hemostasia, o aumento da capacidade do transporte de oxigênio e a melhora do débito cardíaco pelo aumento do volume sanguíneo. Uma unidade de sangue aumentará o hematócrito em 3%. Segundo a American Society of Anesthesiologists (ASA), como já mencionado, a transfusão de concentrado de hemácias não deve ser indicada unicamente pelo valor da hemoglobina, e sim, na percepção do risco de o paciente desenvolver complicações relacionadas à oxigenação inadequada. Segundo a ASA, no entanto, existem algumas considerações sobre a transfusão de concentrado de hemácias:
• Concentração de Hg menor do que 6 g/dL, mesmo em um paciente saudável e jovem, em caso de anemia aguda requer transfusão;
• Se a concentração de Hg for maior do que 10 g/dL, geralmente não há necessidade de transfusão;
• Quando as concentrações de Hg forem entre 6 g/dL e 10 g/dL, deve-se considerar a transfusão de concentrado de hemácias, se houver isquemia de algum órgão, sangramento potencial ou atual, ou fatores de risco que desencadeiem complicações por inadequada oxigenação e hipovolemia.
Em adultos saudáveis, o volume intravascular adequado promovido pela reposição volêmica durante um sangramento com decréscimo de 10% no hematócrito pode não descompensar a DO2 em consequência do aumento do débito cardíaco, da taxa de extração de oxigênio e do desvio da curva de dissociação oxigênio-hemoglobina para a direita.
O alvo da hemoglobina para transfusão em pós-operatório não está bem estabelecido, mas sabe-se que valores entre 7,1 e 8 g/dl determinam uma mortalidade de 0,9%, enquanto que a hemoglobina entre 5,1 e 7 g/dl determina uma mortalidade de 9,2% em até 30 dias32.
O emprego do monitoramento não invasivo da Hg em tempo real, embora prático, deixa a desejar pela falta de uma documentação e responsabilidade legal pelo exame, sendo, portanto, fundamental a sua realização por bioquímico, no suporte à indicação de uma transfusão e a assimilação de seus potenciais riscos e benefícios.
A própria hemotransfusão pode causar isquemia, pois ocorrem efeitos pró-inflamatórios (citocinas pró-inflamatórias se acumulam) e alterações no sangue estocado31. Hemácias estocadas são pobres em 2,3 difosfoglicerato (2,3 DPG) e têm menor capacidade de transportar oxigênio. O sangue armazenado tem perda da atividade do óxido nítrico, prejudicando a resposta vasodilatadora à hipóxia. Pode ainda ocorrer agregação e oclusão capilar porque hemácias estocadas são menos deformáveis. Por tais motivos, a hemotransfusão poderá aumentar a saturação do sangue venoso misto enquanto diminui a oferta tecidual de oxigênio.
Podemos considerar a transfusão autóloga (coleta e reinfusão do sangue do próprio paciente) como uma opção de menor risco, no caso de uma cirurgia eletiva de grande porte, associada a uma extensa lipoaspiração. Neste caso, os pacientes fazem uma pré-doação, e recebem suplementação com ferro até o dia da cirurgia.
Outra possibilidade é a hemodiluição normovolêmica intraoperatória: imediatamente antes da cirurgia o sangue do paciente é retirado em bolsa especial com anticoagulante e mantido sob resfriamento adequado. Durante a cirurgia, o paciente é hemodiluído com Ringer ou soro fisiológico, para no final da cirurgia, até 5 horas após a coleta, receber seu próprio sangue, que vai apresentar acentuada capacidade de transporte de oxigênio, em virtude do alto hematócrito, e uma grande capacidade de coagulação pelas plaquetas e outros fatores de coagulação presentes.
Na experiência da autora anestesiologista, essa prática tem sido muito bem tolerada pelos pacientes, levando a uma melhora na diurese, menor índice de tonturas no pós-operatório, melhor estado geral, e uma rápida recuperação. A hemodiluição normovolêmica é realizada pela autora anestesiologista nas lipoaspirações médias e grandes, em que o limite de 7% do peso corporal possa ser incidente. O autor cirurgião vascular complementa que a probabilidade de ocorrer hipercoagulabilidade e trombose venosa profunda, costuma ser menor com o uso da hemodiluição normovolêmica35,36.
Considerando a citada perda de apenas 1 - 2% de sangue no rigoroso emprego da técnica super úmida, transfusões de sangue e derivados de rotina deveriam ser consideradas apenas nas grandes lipoaspirações concomitantes a outras cirurgias, ou em lipoaspirações muito extensas, em pacientes com resposta hemodinâmica clinicamente insatisfatória.
Prevenção e diagnóstico inicial de tromboses
I. Protocolo Geral para todos os pacientes hígidos submetidos à lipoaspiração e sem história pessoal ou familiar de trombose. Pacientes com sobrepeso, fumantes, usuários de pílulas anticoncepcionais e ainda que suspenderam a reposição hormonal há pelo menos 15 dias estão também aqui enquadrados.
a) Heparina - uma entre as duas opções abaixo deve ser empregada:
Heparina não fracionada (HNF) - Nos Estados Unidos da América, tornou-se hábito seu início 6 a 12 horas após a cirurgia, sendo este esquema terapêutico padronizado em ensaios clínicos e aprovado pelo FDA37. A dose a ser utilizada na profilaxia da TVP é de 5000 U de HNF administradas por via subcutânea. Deve ser iniciada 6 horas após o início da operação, e continuar sendo administrada a cada 8 ou 12 horas, até que o paciente tenha condições de deambular.
Heparina de baixo peso molecular (HBPM) - no Brasil, a HBPM mais utilizada é a enoxaparina sódica. Uma única dose de 40 mg de enoxaparina sódica deve ser administrada 6 horas após o bloqueio espinhal ou 8 horas após a retirada do cateter espinhal (se este foi empregado). Enoxaparina não deve ser empregada antes desses prazos, pelo risco de provocar um hematoma intraespinhal com suas nefastas consequências neurológicas. Em caso de anestesia geral, a enoxaparina pode ser empregada logo após o término da lipoaspiração. A HBPM é tão eficaz quanto a HNF na profilaxia da TVP, apresentando menor incidência de trombocitopenia induzida pela heparina37.
Tempo de manutenção da profilaxia medicamentosa: a necessidade de se manter a profilaxia após a alta hospitalar é motivo de controvérsia. Em pacientes ortopédicos, há estudos que indicam a manutenção da profilaxia por, pelo menos, 25 a 30 dias após a alta hospitalar38; porém, outros estudos não encontraram justificativa clínica para tal uso39. O bom senso nos leva a crer que, se o paciente permanecer acamado ou imobilizado em casa, ou se apresentar fatores de risco como neoplasias ou tratamentos antitumorais, a profilaxia deverá ser mantida.
b) Botas de compressão pneumática externa intermitente: são tão efetivas quanto o uso da HBPM e da HNF na profilaxia das tromboses venosas profundas, tendo a vantagem de não aumentar o risco de sangramento. Devem ser instaladas logo após a indução anestésica, e utilizadas até que o paciente possa deambular normalmente. Nos pacientes muito obesos, nos quais as botas de compressão pneumática intermitente podem não servir devido ao grande diâmetro das panturrilhas, deve-se utilizar aparelhos de compressão pneumática intermitente instalados nos pés: eles também aumentam o fluxo sanguíneo venoso nos membros inferiores e fazem profilaxia efetiva das tromboses venosas profundas40. O uso de botas de compressão pneumática intermitente tem efeito sinérgico com o emprego de HBPM ou HNF, diminuindo ainda mais a incidência de trombose venosa profunda37.
c) Meias elásticas: são efetivas na prevenção das tromboses venosas profundas, principalmente quando usadas em conjunto com outros métodos (HNF ou HBPM)41.
d) Outros Cuidados: enfatizamos a proibição de repouso adicional no pós-operatório, e que os pacientes devem deambular normalmente na manhã do dia seguinte à lipoaspiração, restringindo o repouso ao usual noturno. Indicamos também que o paciente faça dez inspirações profundas de hora em hora no pós-operatório imediato, como profilaxia empírica da atelectasia pulmonar.
II. Protocolo para os pacientes considerados de alto risco para desenvolver tromboembolismo venoso: são considerados pacientes de alto risco os com história pessoal de TVP/TEP, obesidade mórbida (IMC>59), portadores de doenças inflamatórias intestinais, e ainda os portadores de trombofilias adquiridas ou hereditárias (deficiência de proteína C ou proteína S, fator V de Leiden, deficiência de antitrombina III). Nestes pacientes, além dos métodos citados acima, poder-se-á utilizar o implante de filtros de veia cava inferior temporários. Esses filtros devem ser implantados na veia cava infrarrenal no período pré-operatório, e retirados assim que o paciente tenha condições de deambular normalmente42.
III. Diagnóstico Básico de TVP/TEP43. Todo paciente que apresentar no pós-operatório de uma lipoaspiração sintomas de TVP ou TEP (por exemplo: empastamento de panturrilhas, tosse e dor torácica de início abrupto, hemoptise), deverá ser submetido aos seguintes exames:
a) EcoDoppler do sistema venoso profundo dos membros inferiores: nos últimos anos, o ecoDoppler firmou-se como o método de escolha para a confirmação diagnóstica da TVP.
b) Dímero D: a técnica ELISA (Enzyme-linked imunosorbant assay) para dímero D tem mostrado que este teste pode ser usado para excluir o diagnóstico de TVP e mesmo da embolia pulmonar quando os resultados forem normais, pois este exame tem alta sensibilidade, embora apresente baixa especificidade. Lensing et al.43 demonstraram que a associação do ecoDoppler e medida do dímero D é um meio eficiente de diagnóstico, com menos de 1% de falso negativos.
c) Angiotomografia de pulmão: atualmente é o método de escolha para se confirmar o diagnóstico de embolia pulmonar.
IV. Síndrome de Embolia Gordurosa: Complicação rara nas formas fulminante e subaguda (1 a cada 77000 lipoaspirações)44 e talvez frequente na forma subclínica. É a obstrução de pequenos vasos pulmonares com gordura que, sendo hidrolisada pela lipase, libera ácidos graxos, que por sua vez aumentam a adesividade dos neutrófilos às células endoteliais.
A ação de enzimas proteolíticas dos lisossomos desses neutrófilos ataca o endotélio, levando a sua ruptura e consequente hemorragia e edema cerebral, pulmonar ou de qualquer órgão45. O diagnóstico é somente clínico pela SARA, alterações no SNC, petéquias e critérios menores (febre, alterações retinianas e urinárias, queda no hematócrito, plaquetopenia, gordura positiva no escarro, aumento do VHS) e eventual RM cerebral relevante45,46. O tratamento é inespecífico: assistência ventilatória, sendo contraindicados os anticoagulantes. A mortalidade é de 100% na fulminante e 20% na subclínica (dados da Ortopedia)46. A prevenção é evitar hipóxia, choque e talvez emprego de corticoide (experiência da Ortopedia)45,46.
Associações com outras cirurgias
O risco de trombose venosa em pós-operatório se relaciona diretamente com tempo cirúrgico, com o trauma cirúrgico e com o padrão cirúrgico. Por exemplo, cirurgias ginecológicas e urológicas têm mais predisposição a desenvolver trombose venosa profunda, além das mencionadas características do paciente (obesidade, coagulopatias, trombose prévia e idade avançada)47.
Quando houver absoluta necessidade de cirurgias combinadas, devemos atentar para o tempo cirúrgico (quanto maior, maior o índice de morbidade), para o aumento da perda volêmica, para o maior risco de infecção (maior exposição dos tecidos) e para a hipotermia transoperatória nesses casos.
Devem, ainda, ser evitadas associações de lipoaspirações extensas com outros procedimentos em Cirurgia Plástica ou outras especialidades, pelo aumento dos riscos de TVP, TEP e embolia gordurosa.
CONCLUSÕES
1) Indicações de lipoaspiração
a) Lipodistrofias localizadas.
b) Coadjuvante no tratamento de obesidade, para pacientes que aceitem os limites estéticos do procedimento e sua eventual transitoriedade de resultados. Usar termo de consentimento específico nesse caso.
c) Lipodistrofia abdominal em pacientes selecionados, que, apesar da flacidez de pele, não aceitam a dermolipectomia /lipoabdominoplastia indicadas, e concordam com o caráter paliativo e relativamente imprevisível dos resultados obtidos com a lipoaspiração isolada. Usar termo de consentimento específico nesse caso.
2) Pré-Operatório
a) Manejo de Medicações e hábitos
Suspender 15 dias antes:
• Antidepressivos inibidores da MAO
• Anorexígenos
• Estrogênios (Reposição hormonal)
• Antiarrítmicos
Suspender pelo menos 7 dias antes:
• Fitoterápicos: Ginko biloba, Ginseng, Gengibre
• Vitamina E
• Antiagregantes plaquetários (AAS): Suspender somente na concomitância de outros procedimentos cirúrgicos com maior possibilidade de sangramentos.
Suspender no dia da cirurgia:
Hipoglicemiantes orais
Manter, inclusive no dia da cirurgia:
• Anti-hipertensivo
• Hipolipemiantes
• Broncodilatadores (beta agonistas inalatórios e inibidores de leucotrienos)
• Antidepressivos que não sejam inibidores da MAO
• Anticonvulsivante
• Medicamentos tireoidianos
Suspender se possível:
• Pílula anticoncepcional (15 dias)
• Tabagismo (2 meses ou pelo menos 24 horas)
b) Avaliações:
• Hemograma, glicemia de jejum, creatinina, coagulograma, eventual Beta HCG
• Avaliação Cardiológica
• Avaliação Anestesiológica
• Avaliação do Cirurgião Vascular, indispensável nos seguintes casos: pacientes com história pessoal de TVP/TEP, obesidade mórbida (IMC > 59), portadores de trombofilias adquiridas ou hereditárias (deficiência de proteína C ou proteína S, fator V de Leiden, deficiência de antitrombina III) e portadores de doenças inflamatórias intestinais.
3) Transoperatório
a) Anestesia: peridural ou geral. Anestesia local somente para áreas muito pequenas, empiricamente um volume de aproximadamente 200 - 500 ml de aspirado, com especial consideração a toxidade da lidocaína imediata e tardia até 14 horas após a infiltração.
b) Infiltração: Soro fisiológico a temperatura ambiente com 1 ampola de adrenalina para 500 ml de soro, respeitada a dose máxima de 0,07 mg de adrenalina /kg. e.g.: 5 ampolas de 1 mg para um paciente de 70 kg.
c) Mudança de decúbito: Realizar a mudança de posição de forma lenta e por etapas. O uso de agonista alfa-1 adrenérgico (e.g.: 1mg de etilefrina ou seja, 1ml EV de uma ampola de 10 mg diluída em 10 ml de soro fisiológico), antes de iniciar a mudança de decúbito, possivelmente promove maior segurança.
d) Volume Máximo: a ser aspirado: 5% até 7% do peso corporal, considerar a totalidade do frasco, proporciona uma margem adicional de segurança.
4) Pós-Operatório
a) Alta no mesmo dia: Embora subjetivos e carentes de estudos específicos, a experiência do primeiro autor indica que lipoaspirações até 4000 ml podem eventualmente receber alta no mesmo dia, se além das condições clínicas mencionadas na resolução CFM 1886/2008 (deambulação espontânea, micção sem dificuldade, sensibilidade normal na região perineal após o bloqueio espinhal, acompanhante esclarecido, etc), forem observados os seguintes parâmetros: 8 horas de observação pós-operatória na clínica ou hospital, alta somente nas lipoaspirações de até 5% do peso corporal e pela técnica super-úmida, máximo de 4 litros aspirados considerando todo o conteúdo do frasco, e sem uso de lidocaína na infiltração transoperatória.
b) Reposição: Para um aspirado igual ou menor que o infiltrado, 1 ml/kg/hora de soro fisiológico ou Ringer durante o jejum dos pacientes (usualmente de 3 horas). Pode ser substituído ou completado por isotônicos VO na ausência de náuseas.
Para um aspirado maior que o infiltrado, adicionar este excedente em Ringer ou solução fisiológica EV. Nas lipoaspirações maiores que 4000 ml é conveniente o uso de sonda vesical, pernoite na clínica, e manutenção da diurese em 1 ml/kg/hora.
c) Parâmetros para um pós-operatório mais seguro:
Concentração de Hemoglobina mínima de 9 g/dl
Diurese de 1ml/kg/hora
Alertar a equipe para sinais de choque hipovolêmico por anemia aguda:
Particularmente, pulso rápido e fraco (110 bpm ou mais); respiração rápida e curta (30 rpm ou mais); PA sistólica igual ou menor que 80 mmHg); palidez (especialmente mucosa ocular); cianose; pele úmida e fria (principalmente testa e palmas das mãos); sede excessiva; visão nublada; ansiedade, confusão ou inconsciência; expressão de ansiedade ou olhar indiferente profundo; perda total ou parcial de consciência.
d) Sangue e derivados: A indicação de transfusões é uma mescla de resultados laboratoriais com a clínica apresentada pelo paciente no pós-operatório. Indicada somente em condições excepcionais, não há indicação formal para seu uso profilático de rotina, mesmo como autotransfusão ou normodiluição volêmica, com um volume máximo aspirado de 5% do peso corporal, e uma lipoaspiração super úmida (rigorosamente 1:1) realizada, sem outras cirurgias concomitantes.
Considerar, no entanto, sua utilização nas lipoaspirações de 7% do peso corporal e/ou associações com outras cirurgias, ou sempre que a resposta clínica do paciente assim indicar, independente do volume aspirado ou técnica empregada (úmida, super-úmida, tumescente). No paciente sem sangramento ativo e hemodinamicamente compensado, considerar ainda os seguintes critérios (de Carson & Kleinman)32:
Hemoglobina menor que 6 g/dl- transfusão sempre recomendada
Hemoglobina entre 6 e 7 g/dl- transfusão geralmente indicada
Hemoglobina entre 7 e 8 g/dl- transfusão-recomendada em pacientes com doença cardiovascular ou se houver sintomatologia como hipotensão ortostática, taquicardia, isquemia miocárdica que não respondem a reposição de líquidos
Nos pacientes com sangramento ativo ou algumas comorbidades em que a anemia seja determinante na piora clínica poderá haver indicação de transfusão no paciente mesmo com níveis de hemoglobina entre 8 e 10 g/dl18.
Na probabilidade de extensa perda volêmica, programar autotransfusão ou uma diluição normovolêmica transoperatória: o sangue do paciente será estocado em bolsa especial antes da cirurgia (450 gramas), conservado em cooler com gelo, e reinfundido até 5 horas após seu armazenamento.
e) Prevenção de tromboses nos pacientes sem riscos adicionais de TVP: Enoxaparina sódica 40 mg subcutâneo 6 horas após a anestesia peridural ou 8 horas após a retirada do cateter espinhal (logo após a cirurgia, se empregada anestesia geral). Botas de compressão intermitente durante a cirurgia e após, até a alta da clínica. Meias de compressão durante e após a cirurgia, por 30 dias, podendo tirar para o repouso. Alertar para a correta colocação da meia elástica, para que não exerça função de garrote através de dobras inadvertidas ou propositais.
É muito importante o esclarecimento dos pacientes e seus familiares da contraindicação do repouso diurno a partir do dia seguinte a lipoaspiração, pois há em nossa cultura uma tendência ao repouso adicional após qualquer cirurgia. Evitando este inconveniente, e coibindo ainda o uso de sapatos de salto alto, podemos suspender o emprego de enoxaparina no dia seguinte a lipoaspiração, com o início da deambulação em todos pacientes sem riscos adicionais de TVP.
Para pacientes com alto risco de desenvolverem tromboembolismo venoso (história pregressa e/ou fatores mencionados na discussão), a prevenção deverá ser individualizada a partir da avaliação e condutas do cirurgião vascular, e da conveniência de ser ou não realizada uma lipoaspiração nestes pacientes.
f) Associações com outras cirurgias: Considerando o caráter estético e eletivo das lipoaspirações, é conveniente, sempre que possível, limitar as associações a 1 único procedimento "estético" concomitante, com duração máxima de 3 horas, e perda mínima de sangue. Devem ser evitadas cirurgias ginecológicas, urológicas e ortopédicas no mesmo ato.
AGRADECIMENTOS
Os autores agradecem ao acadêmico de medicina Lucas Santiago (Universidade Positivo-Curitiba) pela colaboração na organização das Referências Bibliográficas.
COLABORAÇÕES
JWF Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
AM Redação do manuscrito ou revisão crítica de seu conteúdo.
AASR Redação do manuscrito ou revisão crítica de seu conteúdo.
CTM Redação do manuscrito ou revisão crítica de seu conteúdo.
CLF Redação do manuscrito ou revisão crítica de seu conteúdo.
WMI Redação do manuscrito ou revisão crítica de seu conteúdo.
REFERÊNCIAS
1. Instituto de Pesquisas Datafolha. Cirurgia Plástica no Brasil-2009. [acesso 2016 Jan 27]. Disponível em: http://www2.cirurgiaplastica.org.br/wp-content/uploads/2012/11/pesquisa2009.pdf
2. Folha de São Paulo. Cirurgias Plásticas em 2011. [acesso 2016 Jan 27]. Disponível em: http://www2.cirurgiaplastica.org.br/materia-folha-de-sao-paulo/
3. ISAPS SURVEY. Highlights of the ISAPS 2013 Statistics on Cosmetic Surgery. [acesso 2016 Jan 27]. Disponível em: http://www2.cirurgiaplastica.org.br/wp-content/uploads/2014/08/ISAPS_quick_facts.pdf
4. Gomes RS. Critérios de Segurança em lipoaspiração. ACM Arq Catarin Med. 2003;32(4):35-46.
5. Grazer FM, de Jong RH. Fatal outcomes from liposuction: census survey of cosmetic surgeons. Plast Reconstr Surg. 2000;105(1):436-46. DOI: http://dx.doi.org/10.1097/00006534-200001000-00070
6. Associação Brasileira para o Estudo da Obesidade e da Síndrome Metabólica. Mapa da Obesidade. [acesso 2016 Jan 27]. Disponível em: http://www.abeso.org.br/atitude-saudavel/mapa-obesidade
7. Brasil. Ministério da Saúde. VIGITEL 2014. Excesso de Peso e Obesidade. [acesso 2016 Jan 27]. Disponível em: http://portalsaude.saude.gov.br/images/pdf/2015/abril/15/PPT-Vigitel-2014-.pdf
8. Haeck PC, Swanson JA, Gutowski KA, Basu CB, Wandel AG, Damitz LA, et al.; ASPS Patient Safety Committee. Evidence-based patient safety advisory: liposuction. Plast Reconstr Surg. 2009;124(4 Suppl):28S-44S. DOI: http://dx.doi.org/10.1097/PRS.0b013e3181b52fcd
9. Chow I, Alghoul MS, Khavanin N, Hanwright PJ, Mayer KE, Hume KM, et al. Is There a Safe Lipoaspirate Volume? A Risk Assessment Model of Liposuction Volume as a Function of Body Mass Index. Plast Reconstr Surg. 2015;136(3):474-83. DOI: http://dx.doi.org/10.1097/PRS.0000000000001498
10. Illouz YG. Complications of liposuction. Clin Plast Surg. 2006;33(1):129-63. DOI: http://dx.doi.org/10.1016/j.cps.2005.10.001
11. Brasil. Conselho Federal de Medicina. Resolução No 1.711, de 10 de dezembro de 2003. Estabelece parâmetros de segurança que devem ser observados nas cirurgias de lipoaspiração, visando garantir ao paciente o direito de decisão pós-informada e aos médicos, os limites e critérios de execução. [acesso 2016 Jan 27]. Disponível em: http://www.portalmedico.org.br/resolucoes/cfm/2003/1711_2003.htm
12. Sociedade Brasileira de Cirurgia Plástica. Levantamento sobre Lipoaspiração em 2014. [acesso 2016 Jan 27]. Disponível em: http://www2.cirurgiaplastica.org.br/lipoaspiracao-2
13. Giese SY, Bulan EJ, Commons GW, Spear SL, Yanovski JA. Improvements in cardiovascular risk profile with large-volume liposuction: a pilot study. Plast Reconstr Surg. 2001;108(2):510-9. DOI: http://dx.doi.org/10.1097/00006534-200108000-00035
14. Pintarelli G, Gomes RS, Rocha JD. Lipoaspiração: atualização dos fatores de riscos metabólicos e sua importância clínico-cirúrgica. Rev Bras Cir Plást. 2014:29(3):457-67.
15. de Jong RH. Body mass index: risk predictor for cosmetic day surgery. Plast Reconstr Surg. 2001;108(2):556-61. DOI: http://dx.doi.org/10.1097/00006534-200108000-00044
16. Magarão RVQ, Marques AC, Feitosa-Filho GS. Aspirina no perioperatório de cirurgias não cardíacas: o dilema entre manter ou suspender. Rev Bras Clin Med. 2011;9(3):218-24.
17. Duke J. Segredos em Anestesiologia. 3a ed. Rio de Janeiro: Di Livros; 2009.
18. Cavalcanti IL, Cantinho FA, Assad AR. Anestesia para Cirurgia Plástica. Rio de Janeiro: SAERJ; 2005.
19. White PF. Perioperative Drug Manual. 2nd ed. Philadelphia: Saunders; 2004.
20. Assad AR, Volquind D, Vianna PTG, Duarte NM, Pires OC. Educação Continuada em Anestesiologia. Volume I. Rio de Janeiro: Sociedade Brasileira de Anestesiologia; 2011.
21. Mansano AM. Avaliação pré-anestésica. Curso de Educação Continuada em Anestesiologia. Volume I. Rio de Janeiro: SAERJ; 2011. p. 25-42.
22. Correia ACC, Silva PCB, Silva BA. Hipertermia maligna: aspectos moleculares e clínicos. Rev Bras Anestesiol. 2012;62(6):828-37. DOI: http://dx.doi.org/10.1590/S0034-70942012000600007
23. Stoelting RK, Miller RD. Bases de Anestesia. 4ª ed. São Paulo: Roca; 2004.
24. Delfino J, Vale N. Anestesia Peridural, Atualização e Perspectiva. Rio de Janeiro: Atheneu; 2001. DOI: http://dx.doi.org/10.1590/S0034-70942001000600002
25. Manica J. Anestesiologia, Princípio e Técnicas. 2a ed. Porto Alegre: Artmed; 1997.
26. Barash PG, Cullen BF, Stoelting RK, Calahan MK, Stock MC, Ortega R. Manual de Anestesiologia Clínica. 4ª ed. Porto Alegre: Artmed; 2004.
27. Llanos S, Dagnino B, Ponce D, Bonacic S, Navarrete L, Navarrete S, et al. Effect of subcutaneous lidocaine infiltration on blood loss secondary to corporal lipoaspiration: a prospective, randomized, double-masked clinical trial. Aesthetic Plast Surg. 2009;33(5):738-42. PMID: 19484178 DOI: http://dx.doi.org/10.1007/s00266-009-9343-y
28. Brasil. Conselho Federal de Medicina. Resolução CFM No 1.886/2008 de 21 de novembro de 2008. Dispõe sobre as "Normas Mínimas para o Funcionamento de consultórios médicos e dos complexos cirúrgicos para procedimentos com internação de curta permanência". [acesso 2016 Jul 18]. Disponível em: http://www.portalmedico.org.br/resolucoes/CFM/2008/1886_2008.htm
29. Cangiani L. Anestesia Ambulatorial: Recuperação e Critérios de Alta. Curso de Educação à Distância em Anestesiologia. Volume VII. 2007. p. 63-77.
30. Fernandes JW. Lipoaspiração. In: Fernandes JW, ed. Cirurgia Plástica Bases e Refinamentos. Curitiba: Primax; 2012. p. 177-86.
31. Fernandes CR, Ortenzi AV, Mendes FF. Transfusão Sanguínea: Recomendações Atuais e Desfechos Em Longo Prazo Em Diferentes Cenários Clínicos. "Curso de Educação a Distância em Anestesiologia". Rio de Janeiro: SAERJ; 2009. p.103-13.
32. Carson JL, Kleinman S. Indications and hemoglobin thresholds for red blood cell transfusion in the adult. UpToDate. 2017. [acesso 2017 Mar 30]. Disponível em: https://www.uptodate.com/contents/indications-and-hemoglobin-thresholds-for-red-blood-cell-transfusion-in-the-adult
33. Manaker S, Rosen IM. Oxygen delivery and consumption. UpToDate. 2017. [acesso 2017 Mar 30]. Disponível em: https://www.uptodate.com/contents/oxygen-delivery-and-consumption
34. Joshi GP. Intraoperative fluid management. UpToDate. 2017. [acesso 2017 Mar 30]. Disponível em: https://www.uptodate.com/contents/intraoperative-fluid-management
35. Almeida MF. Preoperative normovolemic hemodilution in aesthetic plastic surgery. Aesthetic Plast Surg. 1999;23(6):445-9. DOI: http://dx.doi.org/10.1007/s002669900318
36. Murray D. Acute normovolemic hemodilution. Eur Spine J. 2004;Suppl 1:S72-5. DOI: http://dx.doi.org/10.1007/s00586-004-0755-8
37. Agnelli G, Sonaglia F. Prevention of venous thromboembolism. Thromb Res. 2000;97(1):V49-62. PMID: 10668808 DOI: http://dx.doi.org/10.1016/S0049-3848(99)00207-8
38. Pineo GF, Hull RD. Prophylaxis of venous thromboembolism following orthopedic surgery: mechanical and pharmacological approaches and the need for extended prophylaxis. Thromb Haemost. 1999;82(2):918-24. PMID: 10605804
39. Leclerc JR, Gent M, Hirsh J, Geerts WH, Ginsberg JS. The incidence of symptomatic venous thromboembolism during and after prophylaxis with enoxaparin: a multi-institutional cohort study of patients who underwent hip or knee arthroplasty. Canadian Collaborative Group. Arch Intern Med. 1998;158(8):873-8. PMID: 9570173
40. Morris RJ, Woodcock JP. Evidence-based compression: prevention of stasis and deep vein thrombosis. Ann Surg. 2004;239(2):162-71. PMID: 14745323 DOI: http://dx.doi.org/10.1097/01.sla.0000109149.77194.6c
41. Sachdeva A, Dalton M, Amaragiri SV, Lees T. Elastic compression stockings for prevention of deep vein thrombosis. Cochrane Database Syst Rev. 2010;(7):CD001484.
42. Kaufman JA, Kinney TB, Streiff MB, Sing RF, Proctor MC, Becker D, et al. Guidelines for the Use of Retrievable and Convertible Vena Cava Filters: Report from the Society of Interventional Radiology Multidisciplinary Consensus Conference. World J Surg. 2007;31(2):251-64. DOI: http://dx.doi.org/10.1007/s00268-006-0292-1
43. Lensing AW, Prandoni P, Prins MH, Büller HR. Deep-vein thrombosis. Lancet. 1999;353(9151):479-85. PMID: 9989735 DOI: http://dx.doi.org/10.1016/S0140-6736(98)04298-6
44. Rees TD, La Trenta GS. Suction-Assisted Lipectomy. In: Aesthetic Plastic Surgery. 2nd ed. Philadelphia: WB. Saunders; 1994.
45. Filomeno LTB, Carelli CR, Silva NCLF, Barros Filho TEP, Amatuzzi MM. Embolia gordurosa: uma revisão para a prática ortopédica atual. Acta Ortop Bras. 2005;13(4):196-208. DOI: http://dx.doi.org/10.1590/S1413-78522005000400010
46. Nogueira FVM, Coelho GVBF, Silveira Junior VF, Andrade CZN, Hetens CMC, Farina Junior JA. Lipoaspiração e embolia gordurosa: Revisão de Literatura. Rev Bras Cir Plást. 2015;30(2):291-4.
47. Pai M, Douketis JD. Prevention of venous thromboembolic disease in surgical patient. UpToDated. 2017. [acesso 2017 Mar 30]. Disponível em: https://www.uptodate.com/contents/prevention-of-venous-thromboembolic-disease-in-surgical-patients
1. Sociedade Brasileira de Cirurgia Plástica, Curitiba, PR, Brasil
2. Universidade Positivo, Curitiba, PR, Brasil
3. Sociedade Brasileira de Anestesiologia, Rio de Janeiro, RJ, Brasil
4. Sociedade Brasileira de Angiologia e Cirurgia Vascular, São Paulo, SP, Brasil
5. Faculdade Evangélica de Medicina do Paraná, Curitiba, PR, Brasil
6. Universidade Federal do Paraná, Curitiba, PR, Brasil
Instituição: Clínica Julio Wilson Fernandes, Curitiba, PR, Brasil.
Autor correspondente:
Julio Wilson Fernandes
Av. Getulio Vargas
Curitiba, PR, Brasil - CEP 80250-180
E-mail: cirurgiaplasticajwf@uol.com.br Artigo submetido: 24/7/2017.
Artigo aceito: 7/8/2017.
Conflitos de interesse: não há.



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter