

Case Report - Year 2017 - Volume 32 -
Relato de caso de linfoma anaplásico de células grandes associado a implante mamário em paciente brasileira
Report of a case of anaplastic large cell lymphoma associated with a breast implant in a Brazilian patient
RESUMO
O linfoma anaplásico de células grandes (ALCL) associado a implantes mamários é um distúrbio linfoproliferativo das células T que foi recentemente reconhecido como uma entidade independente na classificação de linfomas da Organização Mundial de Saúde (OMS). Apesar do pequeno número de descrições, o número de casos está crescendo rapidamente. Das poucas centenas de casos que foram publicados até agora, muito poucos vieram do Brasil e nenhum foi relatado às autoridades locais. Encontramos um caso recentemente, e acreditamos que seu relato à comunidade local de cirurgia plástica poderá chamar a sua atenção para essa patologia emergente. O prognóstico é muito bom na maior parte dos casos diagnosticados. Contudo, ainda se sabe pouco sobre como e por que os implantes de silicone poderiam desencadear uma resposta linfoide, culminando num ALCL.
Palavras-chave: Linfoma anaplásico de células grandes; Implantes de mama; Neoplasias da mama; Mamoplastia; Seroma.
ABSTRACT
Breast implant-associated anaplastic large cell lymphoma (BIA-ALCL) is a T-cell lymphoproliferative disorder that has recently been recognized as an independent entity in the World Health Organization (WHO) classification of lymphomas. Despite the small number of reports to date, the number of cases is rapidly increasing. Of the few hundred cases that have been reported so far, very few came from Brazil and none have been reported to the local authorities. We encountered a case of BIA-ALCL and believe that its report to the local plastic surgery community could raise awareness to this emerging pathology. The prognosis is very good in most of the diagnosed cases. However, little is known about how and why silicone implants could trigger a lymphoid response that results in ALCL.
Keywords: Lymphoma large-cell anaplastic; Breast implants; Breast neoplasms; Mammoplasty; Seroma.
Os cirurgiões plásticos em todo o mundo têm-se surpreendido com o número crescente de mulheres com relatos de um novo tipo de linfoma identificado na presença de implantes mamários, desde que o primeiro caso foi reportado em 19971. O Linfoma Anaplásico de Células Grandes (ALCL) Associado a Implantes Mamários foi recentemente incluído na classificação da Organização Mundial da Saúde de neoplasias linfoides2 e tem se tornado uma preocupação crescente para o exercício moderno da cirurgia plástica3. Os esforços recentes para melhorar a comunicação e análise dos dados foram realizados por agências reguladoras e sociedades médicas em todo o mundo4-6.
Apesar de o Brasil ser o segundo maior mercado mundial de implantes mamários, nenhum caso de ALCL foi oficialmente relatado à Agência Nacional de Vigilância Sanitária (ANVISA) até agora7. Encontramos um destes casos recentemente e acreditamos que seu relato aumentará a conscientização sobre ALCL na comunidade local de cirurgia plástica e da mama.
RELATO DE CASO
Uma paciente de 44 anos de idade, até então saudável, nos procurou com uma queixa de um leve desconforto durante quase um ano, com um recente aumento de sua mama direita. Ela havia sido submetida a uma mamoplastia de aumento primária por incisão periareolar com implantes de poliuretano de 195cc 11 anos antes.
Ao exame físico, notava-se acentuada assimetria de volume com discreta infiltração na pele na parte inferomedial da mama (Figura 1). Os exames físicos e de imagem revelaram uma massa heterogênea de 10cm posterior ao implante que infiltrava o músculo peitoral maior (Figura 2). Não havia seroma. A suspeita inicial de ALCL foi confirmada com uma biópsia guiada por ultrassonografia e estudos himunohistoquímicos adequados (CD30 + ALK; -) (Figura 3)4.
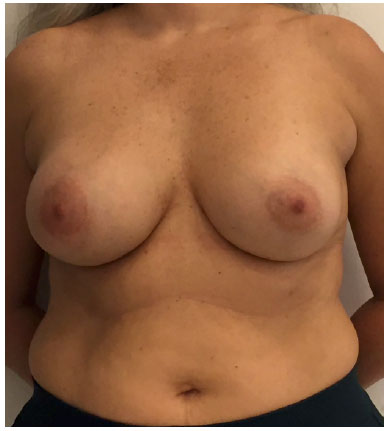
Figura 1. Pré-operatório, vista frontal.
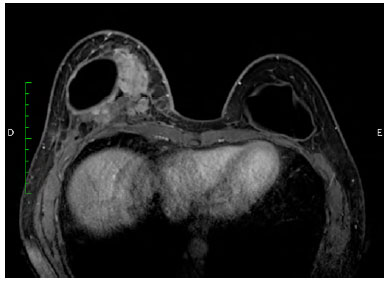
Figura 2. Imagem de ressonância magnética (plano transversal), mostrando uma massa heterogênea medialmente, posteriormente ao implante.
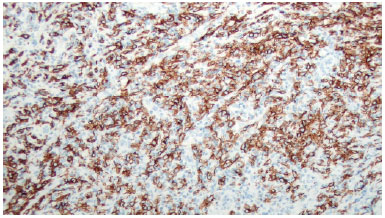
Figura 3. Imunohistoquímica com coloração com CD30.
No pré-operatório, a tomografia por emissão de pósitrons (PET scan) mostrou aumento no metabolismo da glicose na área mamária (SUV = 9.5) e em um linfonodo axilar que foi biopsiado algumas semanas antes, com um relatório patológico negativo para malignidade (SUV = 2.0) (Figura 4A). O planejamento cirúrgico e a terapêutica adjuvante foram discutidos por uma equipe multidisciplinar e com o paciente, com base nas melhores evidências disponíveis no momento.
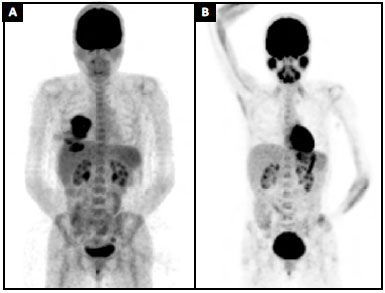
Figura 4. A: PETSCAN pré-operatório (MIP) mostrando aumento no metabolismo da glicose na área mamária (SUV = 9.5); B: 9 meses de seguimento PETSCAN (MIP).
O procedimento cirúrgico envolveu a retirada do implante, com capsulectomia total envolvendo a massa e remoção de todo o tecido macroscopicamente suspeito (Figura 5). Essa resseção incluiu o músculo peitoral maior, parte do tecido mamário e da pele do polo inferomedial, que tinha uma aparência anormal na inspeção (Figura 6). A reconstrução foi alcançada com uma mamoplastia oncoplástica (Figura 7).
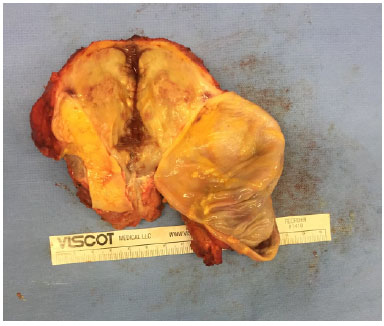
Figura 5. Espécime cirúrgico (mama direita).
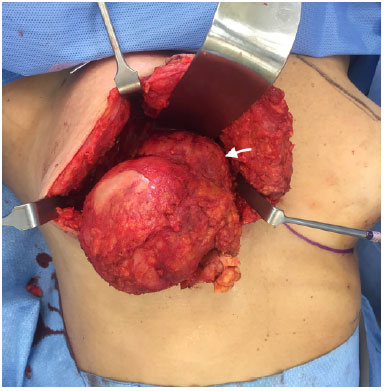
Figura 6. Aspecto macroscópico depois da capsulectomia e dissecção do tumor (seta). A massa infiltra-se no músculo peitoral maior.
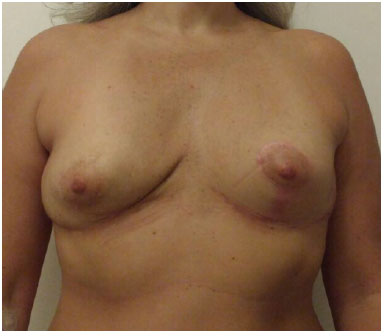
Figura 7. 9 meses de pós-operatório, vista frontal.
A concha do implante e o revestimento de poliuretano estavam intactos. A axila direita foi aberta e explorada manualmente para detecção de linfonodos endurecidos duros ou aumentados, porém nada foi encontrado. A remoção contralateral do implante e capsulectomia foram associadas a uma mastopexia convencional. O estudo patológico dos espécimes da mama direita revelou infiltração de células aberrantes, pleomórficas, na massa necrótica, músculo adjacente, tecido mamário e pele sem um claro limite e margens positivas. A pele adicional removida para a configuração final da mama estava livre de linfócitos aberrantes. Contudo, margens negativas não puderam ser garantidas.
A paciente optou por não ser submetida a qualquer tratamento adjuvante. Naquele momento, não sentíamos que havia evidências suficientes que sugerissem claramente qualquer benefício da quimioterapia, e o paciente recusou a radioterapia. Agora, com nove meses de pós-operatório, seu PET-SCAN mostra remissão completa da doença (Figura 4B). Esse caso foi registrado no PROFILE Registry (http://www.thepsf.org/research/clinical-impact/profile.htm).
DISCUSSÃO
O ALCL é uma rara complicação das próteses mamárias. No entanto, dado o número de mulheres brasileiras com implantes mamários atualmente, todos os cirurgiões plásticos e de mama estão sob o risco de terem de enfrentar este linfoma emergente. Ainda sabemos muito pouco sobre ALCL e a evidência atual é limitada a relatos de caso e estudos transversais das forças-tarefa americana, britânica e australiana. Até agora, algumas centenas de casos foram descritos.
Os americanos estimaram que a prevalência ao longo da vida de ALCL era de 1 para cada 30.000 mulheres com um implante mamário texturizado4. O ALCL já foi relatado em associação com todos os tipos de implantes texturizados. No entanto, a força-tarefa australiana sugeriu que alguns fabricantes apresentam um risco maior do que outros5.
Um seroma tardio tem sido a apresentação mais frequentemente relatada. No entanto, seromas tardios em pacientes com implantes mamários são muito mais propensos a serem benignos. O conhecimento sobre ALCL é importante, pois os diagnósticos só podem ser feitos por estudos imunohistoquímicos específicos do fluido em torno do implante (CD30 e ALK).
Os patologistas devem ser informados sobre a suspeita clínica, e dos testes específicos necessários, uma vez que estes não são rotineiramente realizados em espécimes da mama. No nosso caso, o linfoma apresentou-se como uma massa, uma outra apresentação da doença que tem sido relatada. Ainda não está claro se essas são formas diferentes da doença ou partes de um espectro de doenças, mas a forma da massa tem sido associada a prognósticos mais pobres3,5,6.
A remoção do implante com capsulectomia total parece ser suficiente para tratar o ALCL. A radioterapia adjuvante e a quimioterapia têm sido usadas em alguns destes doentes, sem um benefício claro. Uma recente orientação do National Comprehensive Cancer Network propôs tratamento adjuvante para o ALCL não confinado ao seroma e cápsula8.
No entanto, essas terapias adjuvantes têm morbidades aguda e crônica que devem ser consideradas e discutidas com a paciente. A maioria das recomendações atuais ainda são baseadas em impressões de dados preliminares e muito tempo será necessário antes de termos provas sólidas para orientar a tomada de decisão clínica em pacientes com ALCL.
Em nosso caso, a paciente era muito resistente ao cuidado oncológico tradicional e decidiu não se expor à radiação após discussões multidisciplinares. O acompanhamento certamente é curto; no entanto, por ora, a paciente está em remissão. Pouquíssimas mortes ocorreram em pacientes com ALCL. Acredita-se que a mortalidade é de somente 2.5%. Uma vez que a gravidade da apresentação e suspeita clínica prévia são notadamente fontes importantes de viés para o relato de novos casos, esta estimativa é provavelmente exagerada.
O impacto que essa nova entidade terá sobre a comunidade de cirurgia de mama ainda não está claro. Como o público e os meios de comunicação reagirão ao ALCL dependerá dos nossos esforços para gerar informações e nos comunicarmos adequadamente.
AGRADECIMENTOS
Agradecemos aos Drs. Edward I-Fei Chang e Mark W. Clemens pela disponibilidade e apoio durante a gestão do caso relatado aqui.
COLABORAÇÕES
BNB Análise e/ou interpretação dos dados; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
BG Aprovação final do manuscrito; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
VLNA Aprovação final do manuscrito; realização das operações e/ou experimentos.
FMC Aprovação final do manuscrito; realização das operações e/ou experimentos.
LSM Realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
MFPF Concepção e desenho do estudo; redação do manuscrito ou revisão crítica de seu conteúdo.
MMCS Aprovação final do manuscrito; concepção e desenho do estudo; redação do manuscrito ou revisão crítica de seu conteúdo.
ACSDB Aprovação final do manuscrito; concepção e desenho do estudo.
REFERÊNCIAS
1. Keech JA Jr., Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg. 1997;100(2):554-5. PMID: 9252643
2. Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127(20):2375-90. PMID: 26980727 DOI: http://dx.doi.org/10.1182/blood-2016-01-643569
3. Brody GS, Deapen D, Taylor CR, Pinter-Brown L, House-Lightner SR, Andersen JS, et al. Anaplastic large cell lymphoma occurring in women with breast implants: analysis of 173 cases. Plast Reconstr Surg. 2015;135(3):695-705. Erratum in: Plast Reconstr Surg. 2015;136(2):426.
4. Doren EL, Miranda RN, Selber JC, Garvey PB, Liu J, Medeiros LJ, et al. U.S. Epidemiology of Breast Implant-Associated Anaplastic Large Cell Lymphoma. Plast Reconstr Surg. 2017;139(5):1042-50. DOI: http://dx.doi.org/10.1097/PRS.0000000000003282
5. Loch-Wilkinson A, Beath K, Knight RJW, Wessels WLF, Magnusson M, Papadopoulos T, et al. Breast implant associated Anaplastic Large Cell Lymphoma in Australia and New Zealand - high surface area textured implants are associated with increased risk. Plast Reconstr Surg. 2017. DOI: 10.1097/PRS.0000000000003654. [Epub ahead of print] DOI: http://dx.doi.org/10.1097/PRS.0000000000003654
6. Johnson L, O'Donoghue JM, McLean N, Turton P, Khan AA, Turner SD, et al. Breast implant associated anaplastic large cell lymphoma: The UK experience. Recommendations on its management and implications for informed consent. Eur J Surg Oncol. 2017;43(8):1393-401. DOI: http://dx.doi.org/10.1016/j.ejso.2017.05.004
7. Srinivasa DR, Miranda RN, Kaura A, Francis AM, Campanale A, Boldrini R, et al. Global Adverse Event Reports of Breast Implant-Associated ALCL: An International Review of 40 Government Authority Databases. Plast Reconstr Surg. 2017;139(5):1029-39. DOI: http://dx.doi.org/10.1097/PRS.0000000000003233
8. Clemens MW, Horwitz SM. NCCN Consensus Guidelines for the Diagnosis and Management of Breast Implant-Associated Anaplastic Large Cell Lymphoma. Aesthet Surg J. 2017;37(3):285-9. DOI: http://dx.doi.org/10.1093/asj/sjw259
1. Hospital Sírio Libanês, São Paulo, SP, Brasil
2. Laboratório Fleury, São Paulo, SP, Brasil
3. Faculdade de Medicina, Universidade de São Paulo, SP, Brasil
4. Breast Academy, Gold Coast, Australia
Instituição: Hospital Sírio Libanês, São Paulo, Brasil.
Autor correspondente:
Bernardo Nogueira Batista
Praça Amadeu Amaral, 27 - 6º andar
São Paulo, SP, Brasil - CEP 01327-010
E-mail: bernardo.psnbatista@hsl.org.br
Artigo submetido: 21/7/2017.
Artigo aceito: 17/8/2017.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter