

Original Article - Year 2017 - Volume 32 -
Avaliação volumétrica das mamas em pacientes submetidas à lipoenxertia com uso de expansão pré-operatória (BRAVA®): experiência da Santa Casa de São Paulo
Volumetric assessment of breasts in patients undergoing fat grafting with pre-operative expansion (BRAVA®): experience of Santa Casa de São Paulo
RESUMO
INTRODUÇÃO: O enxerto autólogo de tecido adiposo exibe qualidades desejáveis para utilização como material de preenchimento. Contudo, a grande barreira para o seu maior desenvolvimento foram os resultados pouco previsíveis e o alto índice de absorção da gordura enxertada ao longo do tempo. O objetivo é realizar avaliação volumétrica das mamas de pacientes submetidas à lipoenxertia com uso de expansão pré-operatória (BRAVA®).
MÉTODOS: Foram operadas 19 pacientes no período entre março de 2012 e junho de 2015 na disciplina de Cirurgia Plástica da Santa Casa de São Paulo. Os parâmetros avaliados por ressonância nuclear magnética (pré e 6 meses pós-operatório) foram: Volume Aumentado=Volume Pós-operatório - Volume Pré operatório; Percentual de Aumento=Volume Aumentado/Volume Pré operatório x100; Percentual de Integração=Volume Aumentado/Volume Enxertado x 100.
RESULTADOS: O volume médio das mamas no pré-operatório foi de 294,73 ml e de 458,42 ml no pós-operatório. O volume médio de enxerto foi de 274,4 ml (150-350 ml). Em relação aos parâmetros avaliados, o volume médio de aumento foi de 168,42 ml (90-270 ml), o percentual médio de aumento foi de 58,98% (23-90%) e o percentual médio de integração foi de 62,36% (30-80%).
CONCLUSÃO: A utilização da expansão externa (BRAVA®) na mama mostrou-se um método efetivo nas taxas de integração do enxerto de gordura, bem como no aumento global do volume mamário.
Palavras-chave: Sobrevivência de enxerto; Dispositivos para expansão de tecidos; Mamoplastia; Autoenxertos.
ABSTRACT
INTRODUCTION: Autologous fat graft possesses the desired qualities of a filling material. However, the largest barriers to its further development are unpredictable results and high rate of absorption of the grafted fat over time. The objective is to perform a volumetric assessment of the breasts in patients undergoing fat grafting using pre-operative external expansion (BRAVA®).
METHODS: Nineteen patients were operated between March 2012 and June 2015 in the Service of Plastic Surgery, Santa Casa de São Paulo. The parameters evaluated using nuclear magnetic resonance (pre-operatively and 6 months post-operatively) were the following: augmented volume=post-operative volume - pre-operative volume; percentage of augmentation=augmented volume/pre-operative volume x 100; percentage of integration=augmented volume/volume grafted x 100.
RESULTS: The average volume of the breasts in the pre- and post-operative periods were 294.73 ml and 458.42 ml, respectively. The average graft volume was 274.4 ml (150-350 ml). The following parameters were assessed: average volume augmentation, 168.42 ml (90-270 ml); average percentage of augmentation, 58.98% (23-90%); and average percentage of integration, 62.36% (30-80%).
CONCLUSION: The use of external expansion (BRAVA®) in breasts was effective in increasing the rates of integration of the fat grafts and the overall augmentation in breast volumes.
Keywords: Graft Survival; Tissue expansion devices; Mammoplasty; Autografts.
O enxerto autólogo de tecido adiposo exibe qualidades desejáveis para utilização como material de preenchimento.
É autólogo, biocompatível, está presente em quantidades suficientes como tecido doador na maioria dos indivíduos, sendo de fácil obtenção, processamento e aplicação1,2. Contudo, uma análise da evolução histórica dessa técnica mostra que a grande barreira para o seu maior desenvolvimento foram os resultados pouco previsíveis e o alto índice de absorção da gordura enxertada ao longo do tempo3,4.
O primeiro relato do uso da gordura para preenchimento mamário foi feito em 1895, fato que representou um marco como a primeira tentativa de reconstrução mamária.
O grande impulso ao enxerto de gordura ocorreu na década de 80 com a introdução, por Illouz, da técnica conhecida como lipoaspiração5-7.
Em 1987, a ASPS (Associação Americana de Cirurgia Plástica) condenou o uso do enxerto de gordura nas mamas em virtude dos altos índices de complicações (cistos oleosos, esteatonecrose, infecção, risco de carcinogênese e dificuldade de avaliação radiológica das mamas)8.
Em 2007, a ASPS reviu o seu posicionamento e considerou a possibilidade do enxerto de gordura nas mamas, no entanto, recomendou a necessidade de novos estudos para avaliar a eficácia e segurança da técnica.
Apesar das incertezas, cirurgiões europeus e norte-americanos mostraram séries de casos com bons resultados e baixos índices de complicações.
O grande obstáculo que permanece é a taxa de reabsorção do enxerto e a falta de comprovação científica do melhor método de coleta, tratamento e transferência do tecido.
Inúmeros procedimentos têm sido utilizados para que o resultado a longo prazo seja mais previsível. Basicamente, três categorias de tratamentos podem corroborar nesse processo: 1 - Tratamento da área receptora (BRAVA®), 2 - Injeção de aditivos (hormônios, fatores de crescimento, plasma rico em plaquetas, etc.), 3 - Cultura e expansão celular.
O tratamento da área receptora com pressão negativa (Brava System®), desenvolvido pelo cirurgião norte-americano Roger Khouri, ganhou grande destaque nos últimos anos e vem sendo aplicado por diversos centros mundiais9,10.
Isto promove cinco grandes efeitos:
• Aumento do potencial de enxertia (área receptora expandida);
• Permite a expansão das áreas com fibrose e constrição;
• Reduz a demanda dos adipócitos para funcionar como expansor, uma vez que a expansão irá reduzir a tensão do tecido;
• Promove a angiogênese;
• Otimização do tempo cirúrgico.
Khouri et al.11, em 2014, apresentaram os resultados de um estudo multicêntrico com 476 pacientes que foram submetidas à expansão pré-operatória. Observaram uma taxa de integração de 76,9% no seguimento médio de 3,5 anos. Este fato contrasta com a taxa de integração de 58,3% apresentada por Coleman e Saboeiro12, em 2007, sem a utilização do expansor. Kosowski et al.13, em 2015, também reportaram em um estudo com 488 pacientes e seguimento de 7 anos, uma taxa de integração superior com a utilização do expansor externo (BRAVA®).
Os efeitos do enxerto de gordura não se restringem apenas ao aumento volumétrico, mas também ao poder regenerador tecidual, em virtude das células mesenquimais que são carreadas e transferidas.
É fato que o enxerto de gordura nas mamas está se popularizando em todo o mundo e é uma ferramenta extremamente útil tanto na reconstrução como na cirurgia estética. Novos trabalhos científicos devem comprovar a melhor forma de obtenção, processamento e injeção do tecido adiposo nas mamas, bem como a segurança radiológica e oncológica.
OBJETIVO
O objetivo deste trabalho é o de realizar uma avaliação volumétrica das mamas de pacientes submetidas à lipoenxertia com uso de expansão pré-operatória (BRAVA®).
MÉTODOS
Foram operadas 19 pacientes no período entre março de 2012 e junho de 2015 na disciplina de Cirurgia Plástica da Santa Casa de São Paulo, em São Paulo, SP, sendo observadas as diretrizes da Declaração de Helsinque.
As pacientes eram todas do sexo feminino, com idade média de 33,2 anos. O cálculo do índice de massa corporal (IMC) foi realizado no pré e pós-operatório.
As pacientes foram submetidas à ressonância nuclear magnética no pré-operatório e 6 meses após o procedimento.
Das 19 pacientes, 15 foram submetidas ao enxerto de gordura para reconstrução mamária e quatro para correção de deformidades estéticas.
Todas as pacientes utilizaram o dispositivo expansor externo (BRAVA®) no pré-operatório por 30 dias durante 10-12 horas/dia.
Ao final desse período, as pacientes foram operadas no hospital central da Santa Casa de São Paulo, sob anestesia geral. Foi realizada a captação da gordura através de incisões de 0,5 cm e cânulas de múltiplos orifícios com calibre de 3 mm. As áreas doadoras foram o abdome, flancos e face interna de coxas. A aspiração foi realizada com aparelho e com pressão de 300 mmHg.
A gordura foi centrifugada manualmente por 2 minutos para que houvesse a separação da fração de óleo, gordura e sangue (Figuras 1 e 2).
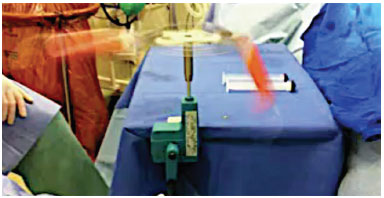
Figura 1. Centrífuga manual.
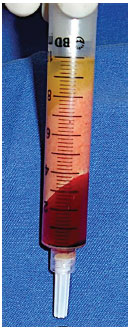
Figura 2. Separação dos componentes (óleo, gordura e sangue) após centrifugação.
O óleo e a fração líquida foram descartados, utilizando-se apenas a gordura. Esta foi transferida para uma pistola de enxertia que foi utilizada para realização do enxerto em múltiplos planos e em forma de leque. Foi feita a retroinjeção e enxertado 1 ml a cada disparo da pistola, evitando o enxerto em bolus. A cânula de enxertia apresentava 2,0 mm.
As áreas com fibrose ou submetidas à radioterapia foram liberadas através de um procedimento denominado Rigotomia que consiste na utilização de uma agulha 40x12 mm para criar uma malha multiperfurada que permitisse a expansão e enxertia sob a cicatriz ou área de fibrose.
O curativo era realizado com o uso de Zobecs e enfaixamento não compressivo por 1 semana.
Os parâmetros avaliados pela ressonância nuclear magnética foram:
• Volume Aumentado=Volume pós-operatório - Volume Pré-operatório;
• Percentual de Aumento=Volume Aumentado/Volume Pré-operatório x 100;
• Percentual de Integração=Volume Aumentado/Volume Enxertado x 100.
RESULTADOS
A análise dos dados evidenciou que não houve diferença estatisticamente significante do IMC no pré e no pós-operatório.
As pacientes eram todas do sexo feminino e com idade média de 33,2 anos.
O volume médio das mamas no pré-operatório foi de 294,73 ml e de 458,42 ml no pós-operatório.
O volume médio de enxerto foi de 274,4 ml (150-350 ml). Em relação aos parâmetros avaliados, o volume médio de aumento foi de 168,42 ml (90-270 ml), o percentual médio de aumento foi de 58,98% (23-90%) e o percentual médio de integração foi de 62,36% (30-80%) (Figuras 3 e 4).

Figura 3. Volumes mamários no pré e pós-operatórios e volume enxertado por paciente.

Figura 4. Porcentagem de aumento da mama e de integração do enxerto.
Das 19 pacientes, 15 foram submetidas ao enxerto de gordura para reconstrução mamária e quatro para correção de deformidades estéticas (Figuras 5 a 11).
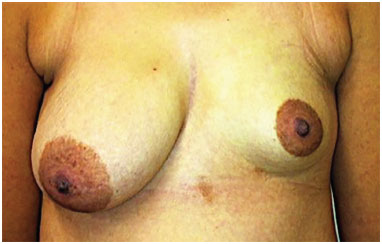
Figura 5. Pré-operatório.
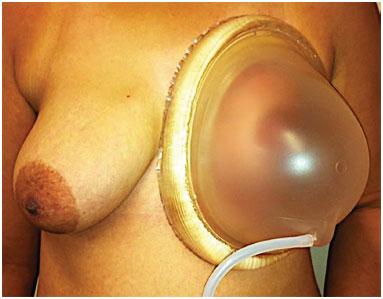
Figura 6. Uso de expansor externo (BRAVA®).
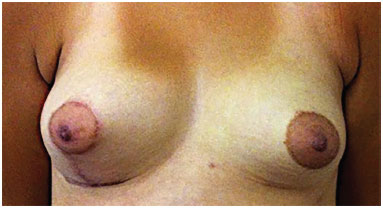
Figura 7. Pós-operatório de 6 meses de enxerto de gordura em mama esquerda (280 ml) e mastopexia à direita.
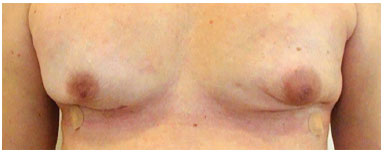
Figura 8. Pós-operatório de adenectomia bilateral.
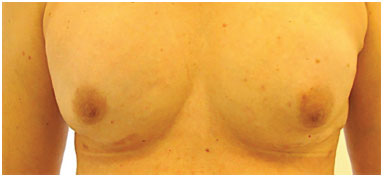
Figura 9. Pós-operatório de enxerto de gordura bilateral para correção de retrações cicatriciais (150 ml em cada mama). Utilizou o BRAVA® no pré-operatório.
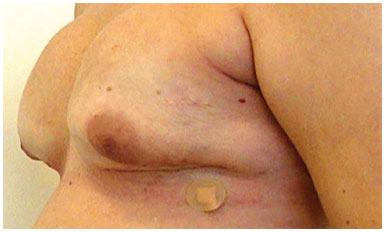
Figura 10. Pós-operatório de adenectomia bilateral.
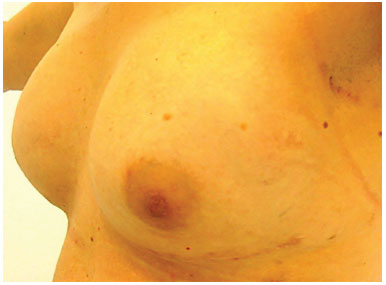
Figura 11. Pós-operatório de 1 ano de enxerto de gordura em mamas (150 ml em cada mama).
O tempo cirúrgico médio foi de 2 horas e 17 minutos. Todas as pacientes apresentaram algum grau de equimose nas mamas no pós-operatório e uma paciente evoluiu com reação alérgica ao silicone do dispositivo de expansão no período pré-operatório.
Todas as pacientes relataram melhora do aspecto estético da mama, apesar do índice de reabsorção ter ficado ao redor de 38%, e manifestaram o desejo de realizar novas sessões de enxerto.
Em relação aos achados dos exames de imagem no pós-operatório, observou-se a presença de pequenos cistos oleosos e áreas de esteatonecrose esparsas em sete das 19 pacientes. Nenhuma dessas imagens foi considerada suspeita pela equipe de radiologia, não tendo sido recomendada a biópsia.
DISCUSSÃO
Há uma grande variedade de fatores que interferem na permanência em longo prazo do tecido transplantado. Os principais são: método de coleta do tecido, preparo do tecido, método de enxertia e qualidade do leito receptor. Cada um desses fatores isoladamente contribuirá para o resultado final.
Infelizmente, não há na literatura um consenso sobre a melhor técnica a ser utilizada, porém algumas diretrizes são constantes.
No que diz respeito ao método de coleta do enxerto, utilizam-se cânulas de diâmetro de 2,5 - 3 mm. Isto cria lóbulos de gordura menores que são mais facilmente revascularizados, causam menor lesão da área doadora e menor trauma durante a enxertia.
Em relação ao número de orifícios para aspiração, recomenda-se cânulas com 6-12 orifícios laterais (2 x 1 mm). Com isso, é possível obter um alto fluxo de gordura pela cânula, inclusive, em baixas pressões.
Em relação ao método de enxertia, é preconizado que seja realizada com cânulas de ponta romba, calibre de 1,5 a 2 mm, orifício lateral com diâmetro equalizado em relação às cânulas de aspiração para haver um menor trauma.
Pode-se utilizar seringas de 1, 3, 5 cc ou dispositivos tipo 'pistola' que permitem o controle do montante de enxerto por acionamento (0,5 , 1 ,1,5 cc). Não se deve realizar o enxerto em bolus, nem em cavidades. O enxerto para integrar deve estar em contato com a área receptora.
A dispersão do enxerto deve ser realizada em túneis, múltiplas camadas e retroinjeção.
Evita-se o enxerto dentro do parênquima mamário. O mais indicado é realizá-lo no plano subdérmico, subcutâneo, supramuscular ou mesmo intramuscular.
Quando a paciente for portadora de implante ou expansor, é possível realizar o enxerto entre a cápsula e o tecido subjacente (musculatura).
Em relação ao método de aspiração, a pressão de sucção adequada é, em tese, a menor pressão possível capaz de desprender a gordura da área doadora, obtendo-se, dessa forma, um material altamente viável para enxertia e com baixos índices de lesão celular.
Portanto, seja com a seringa ou com o aparelho, o mais importante é que a pressão negativa se mantenha abaixo de 300 mmHg para que se obtenha adipócitos com alto grau de viabilidade.
Quando analisamos os fatores relacionados à área doadora, também não encontramos consenso. Padoin et al.14, em 2008, observaram em estudo experimental que as regiões inferiores do abdome e da face interna das coxas apresentavam um número maior de células mesenquimais no tecido adiposo quando comparadas com outras regiões. No entanto, do ponto de vista clínico, não se observa uma diferença de resultado quando comparamos as áreas doadoras.
O critério de escolha depende fundamentalmente da quantidade de tecido necessária bem como das áreas disponíveis para coleta. Estes são os fatores determinantes.
Apesar de não haver uma comprovação científica, é recomendado que não se exponha o tecido adiposo ao meio externo. É preferível utilizar um sistema fechado a fim de evitar a contaminação e perda da viabilidade.
Quando analisamos a forma de preparar o enxerto, encontramos resultados díspares.
Smith et al.15, em 2006, realizaram um trabalho clínico comparando seis diferentes modalidades de preparação do tecido adiposo antes de sua transferência (1- sem preparação, 2- centrifugação apenas, 3- lavagem com ringer lactato, 4- lavagem com soro fisiológico a 0,9%, 5- ringer lactato e centrifugação, 6- associação de soro fisiológico 0,9% com centrifugação) e não encontraram diferenças estatísticas entre as amostras.
As três principais formas de tratar o enxerto previamente à sua transferência são:
• Lavagem do enxerto com soro fisiológico a 0,9%;
• Decantação;
• Centrifugação.
Condé-Green et al.16, em 2010, compararam essas três modalidades de tratamento do enxerto e concluíram que a centrifugação a 3000 rpm (1286 g) era a que mais lesava os adipócitos. Em contrapartida, se considerarmos a concentração de células mesenquimais, a centrifugação é o método que determina o melhor resultado em relação aos demais quando analisa-se o Pellet (camada mais profunda resultante da separação dos componentes após a centrifugação).
Do ponto de vista de lesão do adipócito, a lavagem é a que determinou a maior viabilidade celular, com moderada quantidade de células mesenquimais.
O fato é que não existe um consenso em relação ao melhor método, uma vez que os trabalhos não são randomizados e, portanto, comparáveis.
Apesar disso, os métodos que vêm sendo mais utilizados atualmente são decantação e centrifugação manual, com o intuito de menor lesão do adipócito.
Existem outras formas de tratamento do tecido adiposo que irá ser transferido, sobretudo em trabalhos experimentais.
Yoshimura et al.17, em 2008, apresentaram altas taxas de integração do enxerto e baixos índices de complicações ao enriquecer o enxerto com células mesenquimais extraídas do próprio tecido adiposo.
Fraga et al.18, em 2008 compararam a integração e viabilidade do enxerto autólogo de tecido adiposo autonomizado e não autonomizado, observando maior número de adipócitos viáveis, menor índice de fibrose e necrose no enxerto previamente autonomizado.
A utilização de substâncias que são capazes de aumentar a integração do tecido enxertado também é área constante de estudo.
Pires Fraga et al.19, em 2010, observaram que a utilização do plasma rico em plaquetas em enxertos autólogos de tecido adiposo é capaz de promover menor taxa de absorção e maior integração do tecido transplantado.
Uma das áreas mais promissoras em relação à busca de melhores resultados está na manipulação da área receptora. O dispositivo de expansão externa (BRAVA®) tem sido utilizado com este propósito.
No início da década de 90, Ilizarov demonstrou que as células, quando colocadas sob tensão, respondem com proliferação e expansão da sua população, preenchendo o defeito com um novo tecido20,21. Os cientistas denominaram esse fenômeno como mecanotransdução22.
Lancerotto et al.23 demonstraram que, além da mecanotransdução, as forças de tensão promovem uma isquemia temporária que ativa neoangiogênese. Este fenômeno é a base do desenvolvimento do dispositivo de expansão externo Brava (Brava, LLC, Miami, Fl.).
Tom Baker, em 1999, apresentou os resultados preliminares no congresso da Sociedade Americana de Cirurgia Plástica. Inicialmente, o dispositivo foi utilizado de forma isolada, sem o enxerto de gordura. Acreditava-se que o aumento mamário era decorrente apenas do edema causado no tecido submetido à expansão. Os efeitos duravam algumas semanas porém eram dependentes do uso intensivo do dispositivo. O grande achado foi detectado após análise das imagens de ressonância pré e pós-utilização do BRAVA®.
Observou-se um intenso aumento do fluxo vascular para mama, além da expansão do tecido, que poderia funcionar como um scaffold para receber um volume maior de enxerto.
Esta é a base do método de preparo da área receptora que propicia os resultados obtidos.
Os dois fundamentos principais do enxerto de gordura na mama são: a interface enxerto-leito receptor e a pressão limite do fluido intersticial.
Existe um volume máximo de enxerto a partir do qual não há revascularização dos enxertos por falta de contato com o leito receptor, bem como pelo aumento significativo da pressão intersticial, que levará à isquemia e morte celular.
A expansão externa pré-operatória permite o incremento da área receptora, associada ao aumento do número de vasos sanguíneos, o que corrobora para que se possa realizar um volume maior de enxerto, sem que ocorra isquemia e perda do tecido adiposo transferido.
Khouri et al.24, em 2014, observaram que o tamanho ideal do enxerto não ultrapasse 2 mm de raio. Isto aumenta a chance de integração e o sucesso do procedimento.
Khouri et al.11, em 2014, apresentaram os resultados de um estudo multicêntrico com 476 pacientes que foram submetidas à expansão pré-operatória. Observaram uma taxa de integração de 76,9% no seguimento médio de 3,5 anos.
No nosso estudo, observamos uma taxa de integração de 62,36% e de aumento de 58,98%. Apesar de ser uma de integração um pouco abaixo do trabalho de Khouri, a porcentagem de aumento da mama foi bastante alta.
Este é o principal parâmetro a ser analisado (% de aumento da mama), como já mostraram Khouri e Khouri25, em 2015. A porcentagem de integração não é o parâmetro de maior relevância clínica. Não está relacionada à qualidade do enxerto, da área receptora, ou da técnica cirúrgica e sim à relação do volume de enxerto com a totalidade da área receptora. Por exemplo: se realizarmos um enxerto de 10 ml numa área receptora (mama) de 100 ml com a técnica adequada, provavelmente teremos uma integração de 90%. Clinicamente, isto representará um aumento de apenas 9% no volume final da mama.
Em contraste, se o mesmo cirurgião, com a mesma técnica, enxertar 100 ml na mesma mama (área receptora de 100 ml) e obtiver uma taxa de integração de 60%, isto representará um aumento final da mama de 60%. Ou seja, apesar de uma taxa de integração menor, o aumento mamário foi clinicamente relevante.
Com a expansão externa do tecido, conseguimos aumentar a área enxertável, alcançando uma porcentagem maior de aumento do volume final. Outro ponto importante é que com o aumento da complacência da área receptora é possível realizar uma transferência maior de gordura sem atingir uma pressão intersticial muito grande. Este é um dos principais preditores de um bom resultado.
Diversas táticas vêm sendo empregadas para que avancemos no tratamento dos distúrbios mamários por meio do enxerto de gordura.
A manipulação da área receptora pela expansão pré-operatória vem apresentando bons resultados, apesar de algum grau de desconforto para os pacientes que utilizam o dispositivo. Talvez esse seja um dos grandes obstáculos para o uso mais frequente em nosso meio. Existe uma diferença cultural e de clima (temperatura) em relação aos Estados Unidos e países europeus, que torna a utilização da expansão pré-operatória mais fácil nesses países.
Apesar de tudo, observamos bons resultados nesse grupo de 19 pacientes estudados, o que nos incentiva a continuar utilizando essa tática.
CONCLUSÃO
A utilização da expansão externa (BRAVA®) na mama mostrou-se um método auxiliar nas taxas de integração do enxerto de gordura, bem como no aumento global do volume mamário.
COLABORAÇÕES
MFPF Análise e/ou interpretação dos dados; aprovação final do manuscrito.
LFP Redação do manuscrito ou revisão crítica de seu conteúdo.
AHJ Aprovação final do manuscrito.
NCA Análise estatística.
REFERÊNCIAS
1. Billings E Jr, May JW Jr. Historical review and present status of free fat graft autotransplantation in plastic and reconstructive surgery. Plast Reconstr Surg. 1989;83(2):368-81. PMID: 2643129 DOI: http://dx.doi.org/10.1097/00006534-198902000-00033
2. Coleman SR. Structural fat grafting: more than a permanent filler. Plast Reconstr Surg. 2006;118(3 Suppl):108S-20S. DOI: http://dx.doi.org/10.1097/01.prs.0000234610.81672.e7
3. Schorcher F. Fettgewebsverpflanzung bei zu kleiner. Brust Munchen Med Wochenschr. 1957;99:489.
4. Fischer A, Fischer GM. Revised techniques for cellulitis fat: reduction in riding breeches deformity. Bull Int Acad Cosm Surg. 1977;2(4):40-3.
5. Illouz YG. Body contouring by lipolysis: a 5-year experience with over 3000 cases. Plast Reconstr Surg. 1983;72(5):591-7. PMID: 6622564 DOI: http://dx.doi.org/10.1097/00006534-198311000-00001
6. Illouz YG. De l'útilization de la graisse aspirée pour combler les defects cutanés. Rev Chir Esthet Lang Fr. 1985;10:13-20.
7. Illouz YG. The fat cell "graft": a new technique to fill depressions. Plast Reconstr Surg. 1986;78(1):122-3. DOI: http://dx.doi.org/10.1097/00006534-198607000-00028
8. American Society of Plastic and Reconstructive Surgeons. Report on autologous fat transplantation by the ASPRS ad hoc committee on new procedures. Chicago: American Society of Plastic and Reconstructive Surgeons; 1987. 174 p.
9. Khouri R, Del Vecchio D. Breast reconstruction and augmentation using pre-expansion and autologous fat transplantation. Clin Plast Surg. 2009;36(2):269-80. DOI: http://dx.doi.org/10.1016/j.cps.2008.11.009
10. Smith CJ, Khouri RK, Baker TJ. Initial experience with the Brava nonsurgical system of breast enhancement. Plast Reconstr Surg. 2002;110(6):1593-5. DOI: http://dx.doi.org/10.1097/00006534-200211000-00036
11. Khouri RK, Khouri RK Jr, Rigotti G, Marchi A, Cardoso E, Rotemberg SC, et al. Aesthetic applications of Brava-assisted megavolume fat grafting to the breasts: a 9-year, 476-patient, multicenter experience. Plast Reconstr Surg. 2014;133(4):796-807. DOI: http://dx.doi.org/10.1097/PRS.0000000000000053
12. Coleman SR, Saboeiro AP. Fat grafting to the breast revisited: safety and efficacy. Plast Reconstr Surg. 2007;119(3):775-85. DOI: http://dx.doi.org/10.1097/01.prs.0000252001.59162.c9
13. Kosowski TR, Rigotti G, Khouri RK. Tissue-Engineered Autologous Breast Regeneration with Brava®-Assisted Fat Grafting. Clin Plast Surg. 2015;42(3):325-37. DOI: http://dx.doi.org/10.1016/j.cps.2015.03.001
14. Padoin AV, Braga-Silva J, Martins P, Rezende K, Rezende AR, Grechi B, et al. Sources of processed lipoaspirate cells: influence of donor site on cell concentration. Plast Reconstr Surg. 2008;122(2):614-8. PMID: 18626381 DOI: http://dx.doi.org/10.1097/PRS.0b013e31817d5476
15. Smith P, Adams WP Jr, Lipschitz AH, Chau B, Sorokin E, Rohrich RJ, et al. Autologous human fat grafting: effect of harvesting and preparation techniques on adipocyte graft survival. Plast Reconstr Surg. 2006;117(6):1836-44. PMID: 16651956 DOI: http://dx.doi.org/10.1097/01.prs.0000218825.77014.78
16. Condé-Green A, Baptista LS, de Amorin NF, de Oliveira ED, da Silva KR, Pedrosa Cda S, et al. Effects of centrifugation on cell composition and viability of aspirated adipose tissue processed for transplantation. Aesthet Surg J. 2010;30(2):249-55. DOI: http://dx.doi.org/10.1177/1090820X10369512
17. Yoshimura K, Sato K, Aoi N, Kurita M, Hirohi T, Harii K. Cell-assisted lipotransfer for cosmetic breast augmentation: supportive use of adipose-derived stem/stromal cells. Aesthetic Plast Surg. 2008;32(1):48-55. DOI: http://dx.doi.org/10.1007/s00266-007-9019-4
18. Fraga MF, Helene A Jr, Nakamura F, Lellis RF, Kikuchi W, Esteban D. Comparative study of the integration and viability of autonomised and nonautonomised autologous fat tissue grafts--experimental model in rabbits. J Plast Reconstr Aesthet Surg. 2008;61(9):1044-8. DOI: http://dx.doi.org/10.1016/j.bjps.2007.06.034
19. Pires Fraga MF, Nishio RT, Ishikawa RS, Perin LF, Helene A Jr, Malheiros CA. Increased survival of free fat grafts with platelet-rich plasma in rabbits. J Plast Reconstr Aesthet Surg. 2010;63(12):e818-22. DOI: http://dx.doi.org/10.1016/j.bjps.2010.07.003
20. Ilizarov GA, Devyatov AA, Kamerin VK. Plastic reconstruction of longitudinal bone defects by means of compression and subsequent distraction. Acta Chir Plast. 1980;22(1):32-41.
21. Ilizarov GA, Deviatov AA. Clinical and experimental data on bloodless lengthening of lower extremities. Eksp Khir Anesteziol. 1969;14:27-32.
22. French AS. Mechanotransduction. Annu Rev Physiol. 1992;54:135-52. PMID: 1373277 DOI: http://dx.doi.org/10.1146/annurev.ph.54.030192.001031
23. Lancerotto L, Chin MS, Freniere B, Lujan-Hernandez JR, Li Q, Valderrama Vasquez A, et al. Mechanisms of action of external volume expansion devices. Plast Reconstr Surg. 2013;132(3):569-78. PMID: 23676966 DOI: http://dx.doi.org/10.1097/PRS.0b013e31829ace30
24. Khouri RK, Rigotti G, Cardoso E, Khouri RK Jr, Biggs TM. Megavolume autologous fat transfer: part I. Theory and principles. Plast Reconstr Surg. 2014;133(3):550-7. PMID: 24572848
25. Khouri RK Jr, Khouri RK. Percentage augmentation: the more meaningful index of success in fat grafting. Plast Reconstr Surg. 2015;135(5):933e-935e. PMID: 25700295 DOI: http://dx.doi.org/10.1097/PRS.0000000000001191
Faculdade de Ciências Médicas da Santa Casa de São Paulo, SP, Brasil
Instituição: Faculdade de Ciências Médicas da Santa Casa de São Paulo, SP, Brasil.
Autor correspondente:
Murillo Francisco Pires Fraga
Rua Cesário Motta Jr, s/n - Vila Buarque
São Paulo, SP, Brasil CEP 01221-0100
E-mail: murifraga@ig.com.br
Artigo submetido: 18/2/2016.
Artigo aceito: 21/2/2017.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter